
Insuline
Saviez-vous ...
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. SOS Enfants a regardé des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| Insuline | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
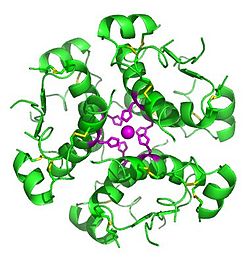 Générée par ordinateur image de six molécules d'insuline assemblés dans un hexamère, soulignant le triple symétrie , les zinc ions tenant ensemble, et le résidus histidine zinc impliquées dans la liaison. L'insuline est stockée dans le corps comme un hexamère, tandis que la forme active est le monomère. | |||||||||||||
| |||||||||||||
| Identificateurs | |||||||||||||
| Symboles | INS; IDDM2; ILPR; IRDN; MODY10 | ||||||||||||
| ID externes | OMIM: 176730 MGI: 96573 HomoloGene: 173 ChEMBL: 5881 GeneCards: INS Gene | ||||||||||||
| |||||||||||||
| motif d'expression d'ARN | |||||||||||||
 | |||||||||||||
| Plus les données d'expression de référence | |||||||||||||
| Orthologues | |||||||||||||
| Espèce | Humain | Souris | |||||||||||
| Entrez | 3630 | 16334 | |||||||||||
| Ensembl | ENSG00000254647 | ENSMUSG00000000215 | |||||||||||
| UniProt | P01308 | P01326 | |||||||||||
| RefSeq (ARNm) | NM_000207 | NM_001185083 | |||||||||||
| RefSeq (protéine) | NP_000198 | NP_001172012 | |||||||||||
| Lieu (UCSC) | Chr 11: 02.18 à 02.18 Mb | Chr 7: 142,68 à 142,7 Mb | |||||||||||
| Recherche dans PubMed | |||||||||||||
L'insuline est une hormone peptidique, produit par les cellules bêta du pancréas, et est au centre de régulation de glucides et le métabolisme des graisses dans le corps. L'insuline provoque les cellules de la foie, muscles squelettiques, et tissu adipeux à absorber du glucose à partir du sang . Dans le foie et les muscles squelettiques, le glucose est stocké sous la forme le glycogène, et dans les cellules adipeuses ( adipocytes) il est stocké en tant que triglycérides.
L'insuline se arrête l'utilisation des graisses comme source d'énergie en inhibant la libération de le glucagon. A l'exception du trouble métabolique du diabète sucré et le syndrome métabolique, l'insuline est prévu à l'intérieur du corps dans une proportion constante pour éliminer l'excès de glucose dans le sang, ce qui serait autrement toxique. Lorsque les niveaux de glycémie sont inférieurs à un certain niveau, le corps commence à utiliser le sucre stocké comme une source d'énergie grâce la glycogénolyse, ce qui décompose le glycogène dans le foie et les muscles en glucose, qui peut ensuite être utilisé comme source d'énergie. En tant que mécanisme de contrôle métabolique central, son état est aussi utilisé comme un signal de commande à d'autres systèmes de l'organisme (par exemple, acides aminés absorption par les cellules du corps). En outre, il a plusieurs autres les processus anaboliques dans le corps.
Lorsque le contrôle du taux d'insuline échoue, le diabète sucré peut entraîner. En conséquence, l'insuline est utilisé en médecine pour traiter certaines formes de diabète sucré. Les patients atteints de le diabète de type 1 dépendent de l'insuline externe (le plus souvent injection sous-cutanée) pour leur survie parce que l'hormone ne est plus produit en interne. Les patients atteints de le diabète de type 2 sont souvent et résistant, du fait de cette résistance à l'insuline, peut souffrir d'une déficience «relative» à l'insuline. Certains patients atteints de diabète de type 2 peuvent éventuellement avoir besoin d'insuline si d'autres médicaments ne parviennent pas à contrôler correctement les taux de glucose sanguin. Plus de 40% des personnes atteintes de diabète de type 2 ont besoin d'insuline dans le cadre de leur plan de gestion du diabète.
La protéine de l'insuline humaine est composée de 51 acides aminés et a un poids moléculaire de 5808 Da. C'est un dimère d'une chaîne A et une chaîne B, qui sont reliés entre eux par des liaisons disulfure.
Le nom de l'insuline est dérivé du latin insula pour "île". La structure de l'insuline varie légèrement entre les espèces d'animaux. L'insuline d'origine animale diffère quelque peu dans la "force" (en les effets de contrôle du métabolisme des glucides) chez l'homme en raison de ces variations. porcin insuline est particulièrement proche de l' humain la version.
Gène
Le préproinsuline précurseur de l'insuline est codée par l'INS gène.
Allèles
Une variété de mutants alleles avec des changements dans la région codante ont été identifiés. Un lire gène de passage, INS-IGF2, chevauche avec ce gène à «région et avec le gène IGF2 en 3 '5 la région.
Réglementation
Plusieurs séquences régulatrices dans le région de promoteur du gène de la liaison de l'insuline humaine à les facteurs de transcription. En général, la A-boîtes se lient à facteurs de Pdx1, E-boîtes se lient à NeuroD, C-boxes lient à MafA, et des éléments de réponse à l'AMPc CREB. Il y a aussi silencieux qui inhibent la transcription.
| Séquence régulatrice | obligatoire les facteurs de transcription |
|---|---|
| ILPR | Par1 |
| A5 | Pdx1 |
| élément régulateur négatif (NRE) | récepteur de glucocorticoïde, Oct1 |
| Z (chevauchement NRE et C2) | ISF |
| C2 | Pax4, MafA (?) |
| E2 | USF1 / USF2 |
| A3 | Pdx1 |
| CREB RE | - |
| CREB RE | CREB, CREM |
| A2 | - |
| CAAT liaison activateur (CEB) (chevauchent partiellement A2 et C1) | - |
| C1 | - |
| E1 | E2A, NeuroD1, HEB |
| A1 | Pdx1 |
| G1 | - |
La structure des protéines
Dans les vertébrés, la séquence d'acides aminés de l'insuline est fortement conservée. Bovine insuline humaine diffère de seulement trois acides aminés des résidus, et porcin dans une insuline. Même l'insuline à partir de certaines espèces de poissons est assez semblable à l'homme d'être cliniquement efficace chez l'homme. L'insuline dans certains invertébrés est assez similaire dans l'ordre à l'insuline humaine, et a des effets physiologiques similaires. La forte homologie vu dans la séquence de l'insuline de diverses espèces suggère qu'il a été conservée sur une grande partie de l'histoire évolutive animal. Le C-peptide de proinsuline (voir plus loin), cependant, diffère beaucoup plus parmi les espèces; ce est aussi une hormone, mais un secondaire.
La structure primaire de l'insuline bovine a été déterminée par Frederick Sanger en 1951. Après cela, ce polypeptide est synthétisé de manière indépendante par plusieurs groupes.
L'insuline est produite et stockée dans le corps comme un hexamère (une unité de six molécules d'insuline), tandis que la forme active est le monomère. Le hexamère est une forme inactive avec la stabilité à long terme, qui sert comme un moyen de maintenir l'insuline hautement réactive protégée, mais facilement disponibles. La conversion hexamère-monomère est l'un des aspects centraux de formulations d'insuline pour injection. L'hexamère est beaucoup plus stable que le monomère, ce qui est souhaitable pour des raisons pratiques; Cependant, le monomère est un médicament bien à réaction plus rapide parce que la vitesse de diffusion est inversement liée à la taille des particules. Un médicament à réaction rapide signifie des injections d'insuline ne ont pas à précéder les repas selon les heures, qui à son tour donne diabétiques plus de flexibilité dans leurs horaires quotidiens. L'insuline peut se agréger et former fibrillaire interdigitées bêta-feuilles. Cela peut provoquer l'injection l'amylose, et empêche le stockage de l'insuline pendant de longues périodes.
Synthèse, effets physiologiques, et la dégradation
Synthèse
L'insuline est produite dans le pancréas et libéré lorsque l'un quelconque de plusieurs stimuli sont détectés. Ces stimuli comprennent des protéines ingérées et de glucose dans le sang produite à partir de la digestion des aliments. Les hydrates de carbone peuvent être des polymères de sucres simples ou des sucres simples elles-mêmes. Si les hydrates de carbone comprennent le glucose, alors que le glucose sera absorbé dans le niveau de glucose dans le sang et le sang va commencer à augmenter. Dans les cellules cibles, l'insuline déclenche une la transduction de signal, ce qui a pour effet d'augmenter glucose absorption et le stockage. Enfin, l'insuline est dégradée, terminant la réponse.

Chez les mammifères, l'insuline est synthétisée dans le pancréas au sein de la β-cellules de la îlots de Langerhans. Un million à trois millions de îlots de Langerhans (des îlots pancréatiques) forment les endocrine du pancréas partie, qui est essentiellement un exocrine glande. La partie du système endocrinien ne représente que 2% de la masse totale du pancréas. Dans les îlots de Langerhans, les cellules bêta constituent 65 à 80% de toutes les cellules.
L'insuline est constitué de deux chaînes polypeptidiques, l'A- et B- chaînes, reliées entre elles par des liaisons disulfure. Il est toutefois d'abord synthétisé comme un seul polypeptide appelé préproinsuline dans pancréatique β-cellules. Préproinsuline contient un résidu 24 peptide signal qui dirige la chaîne de polypeptide naissant à l'état brut réticulum endoplasmique (RER). Le peptide signal est clivé du polypeptide comme subit une translocation dans la lumière du RER, formant proinsuline. Dans le RER de la pro-insuline se replie dans la bonne conformation et trois liaisons disulfures sont formés. Environ 5-10 minutes après son montage dans le réticulum endoplasmique, la proinsuline est transporté vers le réseau trans-Golgi (TGN) où sont formés des granulés immatures. Transport à l'TGN peut prendre environ 30 min.
La proinsuline subit une maturation en insuline active par l'action d'endopeptidases cellulaires appelées prohormone convertases ( PC1 et PC2), ainsi que la exoprotéase le clivage de carboxypeptidase E. Le à 2 positions, libérant un fragment appelé C-peptide, et en laissant deux chaînes peptidiques, les chaînes B et A-, reliées par deux ponts disulfures. Les sites de coupure sont situés après chacun d'une paire de résidus basiques (lysine-64 et arginine-65 et arginine-31 et -32), et après coupure de ces deux paires de résidus basiques sont éliminés par la carboxypeptidase. Le C-peptide est la partie centrale de la proinsuline, et la séquence primaire de la proinsuline va dans l'ordre "BCA" (le chaînes B et A ont été identifiés sur la base de la masse et le C-peptide a été découvert plus tard).
L'insuline mature résultant est emballé à l'intérieur des granulés matures d'attente pour les signaux métaboliques (tels que la leucine, l'arginine, le glucose et le mannose) et la stimulation du nerf vagal exocytosed à partir de la cellule dans la circulation.
La production endogène d'insuline est régulée en plusieurs étapes le long de la voie de synthèse:
- À transcription à partir du gène de l'insuline
- En stabilité de l'ARNm
- Au traduction de l'ARNm
- Dans le modifications post-traductionnelles
L'insuline et ses protéines associées ont été montrés être produite à l'intérieur du cerveau, et des niveaux réduits de ces protéines sont liées à la maladie d'Alzheimer.
Libération
Les cellules bêta dans le îlots de Langerhans libérer de l'insuline en deux phases. La première sortie de phase est déclenchée rapidement en réponse à l'augmentation des niveaux de glucose dans le sang. La deuxième phase est, une libération lente soutenue de vésicules nouvellement formés déclenchées indépendamment de sucre. La description de la première sortie de phase est la suivante:
- Le glucose pénètre dans les cellules β-à travers le transporteur de glucose, GLUT2.
- Le glucose entre dans la glycolyse et du cycle respiratoire, dans lequel plusieurs, de haute énergie ATP molécules sont produites par oxydation, conduisant à une augmentation de l'ATP: ADP dans la cellule.
- Un ATP intracellulaire augmenté: ADP ferme la SUR1 sensible à l'ATP / Kir6.2 canal potassique (voir récepteur sulfonylurée). Cela empêche les ions potassium (K +) de quitter la cellule par diffusion facilitée, ce qui conduit à une accumulation d'ions potassium. En conséquence, l'intérieur de la cellule devient plus positive par rapport à l'extérieur, menant à la dépolarisation de la membrane de la surface cellulaire.
- Sur dépolarisation, voltage-dépendants l'ion calcium (Ca2 +) des canaux ouverts qui permet aux ions calcium de se déplacer dans les cellules par diffusion facilitée.
- Une concentration en ion calcium intracellulaire accrue provoque l'activation de la phospholipase C, qui clive le phospholipide membranaire le phosphatidylinositol 4,5-bisphosphate en inositol 1,4,5-triphosphate et diacylglycérol.
- Inositol 1,4,5-triphosphate (IP3) se lie à des protéines de récepteurs dans la membrane plasmique de la réticulum endoplasmique (RE). Ceci permet la libération d'ions Ca 2+ à partir du RE par des voies de IP3-dépendants, et soulève en outre la concentration intracellulaire d'ions calcium.
- Des quantités d'ions calcium significativement augmenté dans les cellules provoque la libération d'insuline précédemment synthétisé, qui a été stockée dans sécréteur vésicules.
Ce est le principal mécanisme de libération d'insuline. D'autres substances connues pour stimuler la libération d'insuline comprennent les acides aminés arginine et leucine, la libération parasympathique l'acétylcholine (par l'intermédiaire de la phospholipase C), sulfonylurée, cholécystokinine (CCK, par l'intermédiaire de la phospholipase C), et le dérivé gastro-intestinale incrétines le glucagon-like peptide-1 (GLP-1) et insulinotrope dépendant du glucose peptide (GIP).
La libération de l'insuline est fortement inhibée par le hormone du stress la norépinéphrine (noradrénaline), ce qui conduit à une augmentation des niveaux de glucose dans le sang au cours du stress. Il semble que la libération de catécholamines par la système nerveux sympathique a des influences contradictoires sur la libération d'insuline par les cellules bêta, parce libération d'insuline est inhibée par α 2 adrénergiques et stimulée par β 2 adrénergiques. L'effet net de noradrénaline des nerfs sympathiques et adrénaline par les glandes surrénales sur la libération d'insuline est l'inhibition due à la domination des récepteurs α-adrénergiques.
Lorsque le niveau de glucose revient à la valeur physiologique d'habitude, la libération d'insuline par les cellules β-ralentit ou se arrête. Si les niveaux de glucose dans le sang chute inférieure à cela, surtout à des niveaux dangereusement bas, libération d'hormones hyperglycémiques (le plus en évidence glucagon des îlots de cellules alpha de Langerhans) oblige libération de glucose dans le sang de magasins cellulaires, principalement des magasins de cellules hépatiques de glycogène. En augmentant la glycémie, les hormones hyperglycémiques prévenir ou hypoglycémie menaçant la vie correct.
Signe d'altération de la libération d'insuline de première phase peut être vu dans le test de glucose de tolérance, démontré par un niveau de glucose dans le sang sensiblement élevé à 30 minutes, une baisse marquée de 60 minutes, et une montée régulière de retour aux niveaux de base sur les points de temps horaires suivants.
Oscillations

Même au cours de la digestion, en général, une ou deux heures après un repas, la libération d'insuline par le pancréas ne est pas continue, mais oscille avec une période de 3-6 minutes, en changeant de générer une concentration en insuline dans le sang supérieure à environ 800 p mol / l à moins de 100 pmol / l. On pense que pour éviter la régulation négative de récepteurs de l'insuline dans les cellules cibles, et d'aider à extraire le foie insuline dans le sang. Cette oscillation est important à considérer lors de l'administration de médicaments insulino-stimulante, car elle est la concentration sanguine d'oscillation de la libération d'insuline, ce qui devrait, idéalement, être atteinte, non pas une forte concentration constante. Ceci peut être réalisé en fournissant à l'insuline rythmiquement la veine porte ou en la transplantation d'îlots de cellules du foie. Pompes à insuline futurs espèrent remédier à cette caractéristique. (Voir aussi L'insuline pulsatile.)
teneur sanguine

La teneur en insuline de sang peut être mesurée en unités internationales, comme μIU / mL ou en concentration molaire, tel que pmol / L, où une μIU / ml est égal à 6,945 pmol / L. Un taux sanguin typique entre les repas est 8-11 μIU / mL (57 à 79 pmol / L).
Signal transduction
Protéines transporteuses spéciales les membranes cellulaires permettent le glucose du sang d'entrer dans une cellule. Ces transporteurs sont, indirectement, sous le contrôle de l'insuline de sang dans certains types de cellules du corps (par exemple, les cellules musculaires). Les faibles niveaux d'insuline en circulation, ou son absence, empêcheront le glucose de pénétrer dans ces cellules (par exemple, dans le diabète de type 1). Le plus souvent, cependant, il existe une diminution de la sensibilité des cellules à l'insuline (par exemple, la sensibilité à l'insuline réduit caractéristique du diabète de type 2), ce qui entraîne une diminution de l'absorption du glucose. Dans les deux cas, il ya «la famine cell» et de la perte de poids, parfois extrêmes. Dans quelques cas, il existe un défaut dans la libération d'insuline par le pancréas. Quoi qu'il en soit, l'effet est le même: des niveaux élevés de glucose dans le sang.
L'activation de récepteurs de l'insuline conduit à des mécanismes cellulaires internes qui affectent directement l'absorption du glucose par le contrôle de fonctionnement et le nombre de molécules de protéines dans la membrane cellulaire que le transport du glucose dans la cellule. Les gènes qui spécifient des protéines qui constituent le récepteur de l'insuline dans les membranes cellulaires ont été identifiés, et les structures de l'intérieur, l'article transmembranaire et la partie extra-membranaire du récepteur ont été résolus.
Deux types de tissus sont plus fortement influencées par l'insuline, en ce qui concerne la stimulation de l'absorption du glucose est concerné: les cellules musculaires ( myocytes) et les cellules adipeuses ( adipocytes). Les premiers sont importants en raison de leur rôle central dans le mouvement, la respiration, la circulation, etc., et les seconds parce qu'ils se accumulent en excès énergie alimentaire par rapport aux besoins futurs. Ensemble, ils représentent environ les deux tiers de toutes les cellules du corps humain typique.
L'insuline se lie à la portion extracellulaire des sous-unités alpha du récepteur de l'insuline. Ceci, à son tour, provoque un changement conformationnel dans le récepteur de l'insuline qui active le domaine de kinase résidant sur la partie intracellulaire des sous-unités bêta. Le domaine de kinase activée autophosphoryle résidus de tyrosine sur le C-terminale du récepteur, ainsi que des résidus de tyrosine dans le IRS-1 protéine.
- IRS-1 phosphorylé, à son tour, se lie à et active phosphoinositol 3-kinase ( PI3K)
- PI3K catalyse la réaction PIP2 + ATP → PIP3 + ADP
- PIP3 active la protéine kinase B ( PKB)
- PKB phosphoryle glycogène synthase kinase ( GSK) et inactive ainsi GSK
- GSK ne peut plus phosphoryler la glycogène synthase ( GS)
- phosphorylée GS est plus glycogène
- PKB facilite également la fusion des vésicules, ce qui entraîne une augmentation des transporteurs du GLUT4 à la membrane plasmique
Après le signal a été produite, la résiliation de la signalisation est alors nécessaire. Comme mentionné ci-dessous dans la section concernant la dégradation, l'endocytose et la dégradation du récepteur lié à l'insuline est un mécanisme principal pour mettre fin à la signalisation. De plus, la signalisation peut être résilié par déphosphorylation des résidus de tyrosine par tyrosine phosphatases. Sérine / thréonine kinases sont également connus pour réduire l'activité de l'insuline. Enfin, l'action de l'insuline est associée au nombre de récepteurs sur la membrane plasmique, une diminution de la quantité de récepteurs conduit également à la cessation de la signalisation de l'insuline.
La structure de l'insuline complexe de récepteur d'insuline a été déterminée en utilisant les techniques de Cristallographie aux rayons X.
Effets physiologiques

Les actions de l'insuline au niveau du métabolisme humain mondiale comprennent:
- Contrôle de la prise cellulaire de certaines substances, le glucose le plus en évidence dans le muscle et le tissu adipeux (environ les deux tiers des cellules de l'organisme)
- Augmentation de réplication de l'ADN et la synthèse des protéines par contrôle de l'absorption d'acides aminés
- Modification de l'activité de nombreux enzymes.
Les actions de l'insuline (directs et indirects) sur les cellules comprennent:
- Augmentation de la synthèse du glycogène - forces d'insuline de stockage du glucose dans le foie (et muscle) des cellules sous la forme de glycogène; niveaux abaissés de cellules hépatiques motif d'insuline pour convertir le glycogène en glucose et excréter dans le sang. Ce est l'action clinique de l'insuline, qui est directement utile pour réduire les niveaux élevés de glucose dans le sang comme dans le diabète.
- La synthèse des lipides accrue - forces de l'insuline des cellules graisseuses à prendre dans les lipides sanguins, qui sont convertis en des triglycérides; manque d'insuline provoque l'inverse.
- Augmentation estérification d'acides gras - forces tissu adipeux pour faire graisses (triglycérides), ce est à dire à partir d'esters d'acides gras; manque d'insuline provoque l'inverse.
- Diminution protéolyse - diminution de la dégradation des protéines
- Diminution la réduction des forces de la conversion des réserves de lipides des cellules adipeuses en acides gras dans le sang - la lipolyse; manque d'insuline provoque l'inverse.
- Diminution gluconéogenèse - diminue la production de glucose à partir de substrats non sucré, essentiellement dans le foie (la grande majorité de l'insuline endogène à destination du foie ne quitte le foie); manque d'insuline provoque la production de glucose à partir de substrats variés dans le foie et ailleurs.
- Diminution autophagie - niveau de dégradation des organites endommagés diminué. Niveaux postprandiale inhiber complètement l'autophagie.
- Utilisation accrue d'acides aminés - cellules à absorber des forces de circulation acides aminés; manque d'insuline inhibe l'absorption.
- Augmentation de l'absorption de potassium - cellules des forces pour absorber le potassium sérique; manque d'insuline inhibe l'absorption. L'augmentation de l'insuline dans l'absorption de potassium cellulaire abaisse le taux de potassium dans le sang. Cela se produit éventuellement via translocation induite par l'insuline de la Na + / K + -ATPase à la surface des cellules des muscles squelettiques.
- Arterial tonus musculaire - forces paroi artérielle musculaire pour se détendre, augmentant le flux sanguin, en particulier dans microarteries; manque d'insuline réduit le débit en permettant à ces muscles de se contracter.
- Augmentation de la sécrétion d'acide chlorhydrique par les cellules pariétales de l'estomac
- Diminution de l'excrétion rénale de sodium.
L'insuline influence également d'autres fonctions de l'organisme, tels que compliance vasculaire et cognition. Une fois l'insuline pénètre dans le cerveau humain, il améliore l'apprentissage et de la mémoire et de la mémoire verbale bénéficie en particulier. Améliorer cerveau signalisation de l'insuline par l'intermédiaire de l'administration intranasale d'insuline améliore également la thermorégulation aiguë et la réponse glucorégulateur à l'apport alimentaire, ce qui suggère que l'insuline nerveux central contribue à la maîtrise de l'énergie du corps entier homéostasie chez les humains.
Dégradation
Une fois qu'une molécule d'insuline a accosté sur le récepteur et son action effectuée, elle peut être libérée dans l'environnement extracellulaire, ou il peut être dégradé par la cellule. Les deux sites principaux de la clairance de l'insuline sont le foie et le rein. Le foie autorise plus l'insuline pendant le transport de premier passage, tandis que le rein autorise plus de l'insuline dans la circulation systémique. La dégradation implique normalement endocytose du complexe insuline-récepteur, suivi par l'action de insulino-enzyme dégradant. Une molécule d'insuline endogène produite par les cellules bêta du pancréas est estimé à se dégrader dans environ une heure après sa sortie initiale en circulation (à l'insuline demi-vie ~ 4-6 minutes).
Hypoglycémie
Bien que d'autres cellules peuvent utiliser d'autres combustibles plus en évidence (acides gras), neurones dépendent de glucose en tant que source d'énergie dans le nonstarving humain. Ils ne ont pas besoin d'insuline pour absorber le glucose, contrairement muscle et le tissu adipeux, et ils ont de très petits magasins internes du glycogène. Glycogène dans les cellules hépatiques (contrairement glycogène dans les cellules musculaires) peut être converti en glucose, et libérée dans le sang, lorsque le glucose à partir de la digestion est faible ou nulle, et la squelette glycérol des triglycérides peut également être utilisé pour produire du glucose dans le sang.
Absence suffisante de glucose et de la rareté de ces sources de glucose peut se faire de façon spectaculaire manifeste dans l'altération du fonctionnement de la système nerveux central: étourdissements, troubles de la parole, et même la perte de conscience. Faible niveau de glucose dans le sang est connu comme hypoglycémie ou, en cas de production d'inconscience, "coma hypoglycémique" (parfois appelé "choc insulinique" de l'agent causal le plus fréquent). Des causes endogènes de l'excès d'insuline (tels qu'un insulinome) sont très rares, et l'écrasante majorité des cas d'hypoglycémie induite excès d'insuline sont iatrogène et généralement accidentelle. Quelques cas de assassiner, tenté assassiner, ou de suicide à l'aide des surdoses d'insuline ont été signalés, mais la plupart des chocs d'insuline semblent être dues à des erreurs de dosage de l'insuline (par exemple, 20 unités au lieu de 2) ou d'autres facteurs imprévus (ne mangent pas que autant que prévu, ou exercés plus que prévu, ou cinétique imprévus de l'injection sous-cutanée de l'insuline elle-même).
Les causes possibles de l'hypoglycémie incluent:
- L'insuline externe (sous-cutanée habituellement injecté)
- Agents hypoglycémiants oraux (par exemple, l'un des sulfonylurées ou des médicaments similaires, ce qui augmente la libération d'insuline par les cellules β en réponse à un niveau de glucose sanguin particulier)
- L'ingestion de faibles en glucides substituts de sucre chez les personnes non diabétiques ou atteints de diabète de type 2. Les études animales montrent ceux-ci peuvent déclencher la libération d'insuline, mais en quantités beaucoup plus faibles que le sucre, selon un rapport publié dans le magazine Discover, Août 2004, p 18. (Ce ne peut jamais être une cause de l'hypoglycémie chez les patients diabétiques de type 1, car il est pas de production de l'insuline endogène à stimuler.)
Maladies et syndromes
Il ya plusieurs conditions dans lesquelles l'insuline perturbation est pathologique:
- Le diabète sucré - terme général désignant tous les Etats caractérisé par une hyperglycémie
- Type 1 - la destruction auto-immune des cellules β-productrices d'insuline dans le pancréas, entraînant une carence absolue en insuline
- Type 2 - syndrome multifactoriel avec l'influence combinée de la susceptibilité génétique et l'influence des facteurs environnementaux, l'être le plus connu l'obésité, l'âge et l'inactivité physique, résultant en résistance à l'insuline dans des cellules ayant besoin d'insuline pour l'absorption du glucose. Cette forme de diabète est fortement hérité.
- Autres types de tolérance au glucose (voir le diabète )
- Insulinome - une tumeur des cellules β-pancréatiques produisant de l'insuline en excès ou l'hypoglycémie réactive.
- Le syndrome métabolique - une condition mal comprise d'abord appelé syndrome X par Gerald Reaven, le syndrome de Reaven après Reaven, CHAOS en Australie (à partir des signes qui semblent voyager ensemble). Il ne est pas clair si ces signes ont une seule cause traitable ou sont le résultat de changements du corps menant au diabète de type 2. Elle est caractérisée par une pression artérielle élevée, la dyslipidémie (troubles sanguins dans les formes de cholestérol et d'autres lipides sanguins), et l'augmentation du tour de taille (au moins dans les populations dans la plupart des pays développés). La cause sous-jacente de base peut être la résistance à l'insuline qui précède le diabète de type 2, qui est une diminution de la capacité de réponse à l'insuline dans certains tissus (par exemple, muscle, graisse). Il est fréquent que les morbidités, comme essentielle l'hypertension , obésité, diabète de type 2, et maladies cardiovasculaires (MCV) développer.
- Syndrome des ovaires polykystiques - un syndrome complexe chez les femmes dans les années où la reproduction anovulation et excès d'androgènes sont généralement affiché comme hirsutisme. Dans de nombreux cas de syndrome des ovaires polykystiques, la résistance à l'insuline est présente.
En tant que médicament

Biosynthétique l'insuline "humaine" est maintenant fabriqué pour une utilisation clinique répandue aide technologie de l'ADN recombinant. Plus récemment, les chercheurs ont réussi à introduire le gène de l'insuline humaine dans les plantes et dans la production de l'insuline en eux, pour être précis carthame . Cette technique est prévue pour réduire les coûts de production.
Plusieurs de ces versions légèrement modifiées de l'insuline humaine, tout en ayant un effet clinique sur les niveaux de glucose dans le sang comme se ils étaient des copies exactes, ont été conçus pour avoir une absorption ou la durée d'action des caractéristiques quelque peu différente. Ils sont généralement désignés comme des «analogues de l'insuline». Par exemple, le premier disponible, Humalog (insuline lispro), ne présente pas un effet d'absorption retardée trouvé dans l'insuline ordinaire, et commence à avoir un effet en aussi peu que 15 minutes. D'autres analogues d'action rapide sont NovoRapid et Apidra, avec des profils similaires. Tous sont rapidement absorbés en raison d'une mutation dans la séquence qui empêche l'analogue de l'insuline de se former des dimères et des hexamères. Au lieu de cela, la molécule d'insuline est un monomère, qui est plus rapidement absorbé. Grâce à elle, par conséquent, ne nécessite pas la planification nécessaire pour d'autres insulines qui commencent à prendre effet beaucoup plus tard (jusqu'à plusieurs heures) après l'administration. Un autre type est à libération prolongée d'insuline; le premier d'entre eux était Lantus (insuline glargine). Celles-ci ont un effet stable pour tout le temps qu'ils sont actifs, sans le pic et tombent vigueur dans d'autres insulines; typiquement, ils continuent d'avoir un effet d'insuline pendant une période prolongée de 18 à 24 heures. De même, un autre analogue d'insuline prolongée ( Levemir) est basée sur une approche d'acylation d'acide gras. Une molécule d'acide myristyric est joint à la présente analogue, qui à son tour associe la molécule d'insuline pour la sérum-albumine abondante, qui à son tour se étend l'effet et réduit le risque d'hypoglycémie. Les deux analogues prolongées doivent être pris seulement une fois par jour, et sont très utilisés dans le marché diabète de type 1 comme insuline basale. Une combinaison d'une action rapide et une insuline prolongée est également disponible pour les patients, qui rend plus probable pour eux d'atteindre un profil de l'insuline qui imite celle des body's propre libération d'insuline.
L'insuline est généralement considéré commesous-cutanéespar injections à usage uniquedes seringues avecdes aiguilles, via unepompe à insuline, ou par l'utilisation répétéed'insuline stylos avec des aiguilles.
Contrairement à de nombreux médicaments, l'insuline ne peut actuellement pas être pris par voie orale parce que, comme presque tous les autres protéines introduites dans le tractus gastro-intestinal, elle est réduite à des fragments (même des composants uniques d'acides aminés), après quoi toute l'activité est perdue. Il n'y a eu des recherches sur les moyens de protéger l'insuline à partir du tube digestif, de sorte qu'il peut être administré par voie orale ou sublinguale. Bien expérimentale, plusieurs entreprises ont maintenant diverses formulations dans des essais cliniques humains.
Histoire
Découverte
En 1869, Paul Langerhans, un étudiant en médecine à Berlin , a été étudie la structure des pancréas sous un microscope quand il a identifié quelques touffes de tissus précédemment inaperçus éparpillés dans toute la masse du pancréas. La fonction des «petits tas de cellules", plus tard connu comme les îlots de Langerhans , était inconnu, mais Edouard Laguesse tard suggéré qu'ils pourraient produire des sécrétions qui jouent un rôle de régulation dans la digestion. Le fils de Paul Langerhans, Archibald, a également aidé à comprendre ce rôle de réglementation. Le terme «insuline» provient de l'insula , le mot latin pour l'îlot / île.
En 1889, la Pologne et l'Allemagne médecin Oscar Minkowski, en collaboration avec Joseph von Mering, enlevé le pancréas d'un chien en bonne santé pour tester son rôle supposé dans la digestion. Plusieurs jours après le pancréas du chien a été retiré, le gardien de l'animal de Minkowski remarqué un essaim de mouches se nourrissent de l' urine de chien. Sur tester l'urine, ils ont constaté qu'il y avait du sucre dans l'urine du chien, établissant pour la première fois une relation entre le pancréas et le diabète. En 1901, une autre étape importante a été prise par Eugene Opie, quand il a clairement établi le lien entre les îlots de Langerhans et le diabète: "Le diabète sucré est provoquée par la destruction des îlots de Langerhans et se produit uniquement lorsque ces corps sont en partie... ou totalement détruit. " Avant son travail, le lien entre le pancréas et le diabète était clair, mais pas le rôle spécifique des îlots.

Au cours des deux prochaines décennies, plusieurs tentatives ont été faites pour isoler ce qu'il était les îlots produites comme un traitement potentiel. En 1906, George Ludwig Zuelzer était chiens traitant partiellement fructueuses avec l'extrait pancréatique, mais était incapable de continuer son travail. Entre 1911 et 1912, EL Scott à l' Université de Chicago a utilisé des extraits pancréatiques aqueuses, et a noté "une légère diminution de la glycosurie", mais a été incapable de convaincre son directeur de la valeur de son travail; il a été arrêté. Israël Kleiner a démontré des effets similaires à l'Université Rockefeller en 1915, mais son travail a été interrompu par la Première Guerre mondiale , et il ne revient pas à elle.
En 1916, Nicolae Paulescu, un professeur roumain de physiologie à l' Université de Médecine et de Pharmacie à Bucarest, a développé une solution aqueuse extrait pancréatique qui, lorsqu'il est injecté dans un diabétique chien, eu un effet de normalisation sur les niveaux de sucre dans le sang. Il a dû interrompre ses expériences en raison de la Première Guerre mondiale et en 1921 il a écrit quatre articles sur son travail effectué dans Bucarest et ses tests sur un chien diabétique. Plus tard cette année, il a publié «La recherche sur le rôle du pancréas dans les aliments assimilation ".
Extraction et purification
En Octobre 1920, canadien Frederick Banting était la lecture de l'un des documents de Minkowski et a conclu que ce sont les sécrétions digestives qui très Minkowski avait initialement étudiés qui cassaient la sécrétion (s) de l'îlot, ce qui rend impossible d'extraire avec succès. Il nota une note à lui-même: ". Canaux pancréatiques Ligaturer du chien Tenir les chiens en vie jusqu'à ce acini dégénérée laissant îlots Essayez d'isoler la sécrétion interne de ceux-ci et soulager glycosurea.."
L'idée était de sécrétion interne du pancréas, qui, il était censé, régule le sucre dans le sang, pourrait détenir la clé du traitement du diabète. Un chirurgien de formation, Banting savait certaines artères pourraient être ligaturées qui conduirait à une atrophie de la plupart des pancréas, tout en laissant les îlots de Langerhans intacts. Il a théorisé un extrait relativement pur pourrait être faite à partir des îlots fois la plupart du reste du pancréas avait disparu.
Au printemps de 1921, Banting a voyagé à Toronto pour expliquer son idée de JJR Macleod, qui était professeur de physiologie à l' Université de Toronto, et a demandé Macleod si il pouvait utiliser son espace de laboratoire pour tester l'idée. Macleod était sceptique au début, mais finalement accepté de laisser Banting utiliser son espace de laboratoire, alors qu'il était en vacances pour l'été. Il a également fourni Banting avec dix chiens sur lesquels expérimenter, et deux étudiants en médecine, Charles Best et Clark Noble, à utiliser comme assistants de laboratoire, avant de partir pour l'Ecosse. Depuis Banting requis un seul assistant de laboratoire, Best et Noble retournées une pièce de monnaie pour voir ce qui aiderait Banting pour la première moitié de l'été. Meilleur gagné le tirage au sort, et a pris la première équipe comme assistant de Banting. Perte du tirage au sort aurait pu se révéler fâcheux pour Noble, étant donné que Banting a décidé de garder le meilleur pour tout l'été, et finalement partagé la moitié de son argent du prix Nobel et une grande partie du crédit pour la découverte de l'insuline avec le gagnant du tirage au sort . Noble avait gagné le toss, sa carrière aurait pu prendre un chemin différent. La méthode de Banting a été de lier une ligature autour du canal pancréatique; quand on l'examine plusieurs semaines plus tard, les cellules digestives pancréatiques étaient morts et ont été absorbés par le système immunitaire, laissant des milliers d'îlots. Ils ont ensuite isolé un extrait de ces îlots, la production de ce qu'ils appelaient «isletin" (ce que nous savons maintenant que l'insuline), et testés cet extrait sur les chiens à partir Juillet 27. Banting et Best ont ensuite été en mesure de garder un chien nommé pancréatectomisés Marjorie vie pour le reste de l'été par son injection avec l'extrait brut qu'ils avaient préparé. L'élimination du pancréas chez les animaux d'essai dans imite diabète essence, ce qui conduit à des niveaux de glucose dans le sang. Marjorie a réussi à rester en vie parce que les extraits, contenant isletin, étaient en mesure de réduire ses niveaux de glucose dans le sang.
Banting et Best ont présenté leurs résultats à Macleod à son retour à Toronto à l'automne de 1921, mais Macleod souligné défauts avec la conception expérimentale, et ont suggéré les expériences être répété avec plus de chiens et de meilleurs équipements. Il a ensuite fourni Banting et Best avec un meilleur laboratoire, et a commencé à payer Banting un salaire de ses subventions de recherche. Plusieurs semaines plus tard, la deuxième série d'expériences a également été un succès; et Macleod a aidé publier leurs résultats particuliers à Toronto que Novembre. Cependant, ils avaient besoin de six semaines pour extraire le isletin, qui a forcé des retards considérables. Banting a suggéré qu'ils essaient d'utiliser fœtale pancréas de veau, qui n'a pas encore développé glandes digestives; il a été soulagé de trouver cette méthode a bien fonctionné. Avec le problème de l'approvisionnement résolu, le prochain effort majeur était de purifier l'extrait. En Décembre 1921, Macleod a invité le biochimiste James Collip à aider dans cette tâche, et, dans un mois, l'équipe se sentait prêt pour un essai clinique.
Le 11 Janvier 1922, Leonard Thompson, un diabétique de 14 ans, qui était mourant à l' Hôpital général de Toronto, a reçu la première injection d'insuline. Cependant, l'extrait était si impur, Thompson a subi une grave réaction allergique, et d'autres injections ont été annulés. Au cours des 12 prochains jours, Collip travaillé jour et nuit pour améliorer l'extrait de bœuf pancréas, et une seconde dose a été injecté sur Janvier 23. Ce fut une réussite totale, non seulement en ayant aucun des effets secondaires évidentes, mais aussi à éliminer complètement la glycosurie signe de diabète. Le premier patient américain était Elizabeth Hughes Gossett, la fille du gouverneur de New York. Le premier patient traité aux États-Unis était avenir artiste de gravure sur bois James D. Havens, Dr. John Ralston Williams importé insuline de Toronto à Rochester, New York, pour traiter Havens.
Les enfants meurent de l'acidocétose diabétique ont été conservés dans de grandes salles, souvent avec 50 ou plus de patients dans une salle, la plupart du temps dans le coma. Membres de la famille en deuil étaient souvent présents, attendant la mort (jusque-là, inévitable).
Dans l'un des moments les plus dramatiques de la médecine, Banting, Best, et Collip allé de lit en lit, l'injection d'un quartier entier avec le nouveau extrait purifié. Avant ils avaient atteint le dernier enfant mourant, la première quelques-uns ont été réveillent de leur coma, les exclamations joyeuses de leurs familles.
Banting et Best jamais bien fonctionné avec Collip, le considérant comme quelque chose d'un intrus, et Collip quitté le projet peu de temps après.
Au cours du printemps de 1922, Meilleur réussi à améliorer ses techniques au point où de grandes quantités d'insuline pourraient être extraites à la demande, mais la préparation est resté impur. La firme de drogue Eli Lilly and Company a offert une assistance peu de temps après les premières publications en 1921, et ils ont pris Lilly sur l'offre en Avril. En Novembre, Lilly a fait une percée importante et était en mesure de produire de grandes quantités d'insuline très raffinée. L'insuline a été proposé à la vente peu de temps après.
Synthèse
L'insuline d'origine animale purifiée était le seul type d'insuline disponible pour diabétiques jusqu'à ce progrès de la génétique ont eu lieu plus tard avec la recherche médicale. La structure de l'acide aminé de l'insuline a été caractérisée dans le début des années 1950 par Frederick Sanger , et la première insuline synthétique a été produite simultanément dans les laboratoires de Panayotis Katsoyannis à l' Université de Pittsburgh et Helmut Zahn au RWTH Aachen University au début des années 1960.
La première génétiquement modifiée, l'insuline synthétique "humaine" a été produite dans un laboratoire en 1977 par Arthur Riggs, PhD, Keiichi Itakura, Ph.D., et Herbert Boyer utilisant E. coli. partenariat avec Genentech fondée par Swanson, Boyer et Eli Lilly and Company a continué en 1982 à vendre la première disponible dans le commerce de l'insuline humaine biosynthétique sous le nom de marque Humulin. La grande majorité de l'insuline actuellement utilisé dans le monde est maintenant insuline "humaine" recombinant biosynthétique ou ses analogues.
Insuline recombinante est produite soit dans la levure (généralement Saccharomyces cerevisiae ) ou E. coli . Chez la levure, l'insuline peut être conçu comme une protéine à chaîne unique avec une endoprotéase KexII (un homologue de levure de PCI / IIP) site qui sépare la chaîne A de l'insuline à partir d'une chaîne B de l'insuline c-terminale tronquée. Une queue C-terminale est ensuite synthétisé chimiquement greffé sur l'insuline par protéolyse inverse en utilisant la protease trypsine peu coûteux; typiquement la lysine sur la queue C-terminale est protégée par un groupe protecteur chimique pour empêcher une protéolyse. La facilité de synthèse modulaire et la sécurité relative des modifications à ce que les comptes de la région pour des analogues de l'insuline communs avec des modifications de C-terminal (par exemple lispro, aspart, glulisine). La synthèse et Genentech synthèse chimique comme complètement que par Bruce Merrifield ne sont pas préférés parce que l'efficacité de la recombinaison des deux chaînes de l'insuline est faible, principalement en raison de la concurrence avec la précipitation de la chaîne B de l'insuline.
Prix Nobel

Le Comité du prix Nobel en 1923 crédité l'extraction pratique de l'insuline à une équipe de l' Université de Toronto et reçu le prix Nobel à deux hommes: Frederick Banting et JJR Macleod. Ils ont reçu le prix Nobel de physiologie ou médecine en 1923 pour la découverte de l'insuline. Banting, insulté que Best n'a pas été mentionné, a partagé son prix avec lui, et Macleod immédiatement partagé son avec James Collip. Le brevet de l'insuline a été vendue à l' Université de Toronto pendant une demi-dollar.
Le structure primaire de l'insuline a été déterminée par le biologiste moléculaire britannique Frederick Sanger . Il était la première protéine d'avoir sa séquence déterminée. Il a reçu en 1958 le prix Nobel de chimie pour ce travail.
En 1969, après des décennies de travail, Dorothy Hodgkin déterminé la conformation spatiale de la molécule, la soi-disant structure tertiaire, au moyen d' études de diffraction des rayons X. Elle avait reçu un prix Nobel de chimie en 1964 pour le développement de la cristallographie.
Rosalyn Sussman Yalow a reçu le prix Nobel 1977 de médecine pour le développement de laradio-immunologique de l'insuline.
George Minot, co-lauréat du prix Nobel 1934 pour le développement du premier traitement efficace pourl'anémie pernicieuse, avaitle diabète sucré. Dr. William Castle observé que 1921 découverte de l'insuline, d'arriver à temps pour garder Minot vivant, était donc également responsable de la découverte d'un remède pourl'anémie pernicieuse.
Prix Nobel de la controverse

L'ouvrage publié par Banting, Best, Collip et Macleod représenté la préparation de l'extrait de l'insuline purifié approprié pour une utilisation sur des patients humains. Bien Paulescu découvert les principes du traitement de son extrait salin ne pouvait pas être utilisé sur les humains, et il n'a pas été mentionné dans le 1923 Prix Nobel. Professeur Ian Murray a été particulièrement active dans le travail pour corriger «l'injustice historique» contre Nicolae Paulescu. Murray était un professeur de physiologie à l'université de médecine Anderson à Glasgow , en Ecosse , le chef du département des maladies métaboliques conduisant à un hôpital de Glasgow, vice-président de l'Association britannique du diabète, et un membre fondateur de la Fédération Internationale du Diabète . Murray a écrit:
"la reconnaissance insuffisante a été accordée à Paulesco, le distinguéroumainscientifique, qui, au moment où l'équipe de Toronto entamaient leurs recherches avaient déjà réussi à extraire l'hormone antidiabétique du pancréas et de prouver son efficacité dans la réduction de l'hyperglycémie chez les chiens diabétiques."
Dans une communication récente professeur privéTiselius, directeur de l'Institut Nobel, a exprimé son opinion personnelle queNicolae Paulescu était également dignes de la récompense en 1923.

