Glucose
À propos de ce écoles sélection Wikipedia
Ce contenu de Wikipedia a été sélectionné par SOS Enfants d'aptitude dans les écoles à travers le monde. Voulez-vous savoir sur le parrainage? Voir www.sponsorachild.org.uk
| D -Glucose | |
|---|---|
 | |
 Glucose C6H12O6 | |
Nom à privilégier UICPA D-glucose | |
(2 R, 3 S, 4 R, 5 R) -2,3,4,5,6-Pentahydroxyhexanal | |
Autres noms Glycémie | |
| Identificateurs | |
| Abréviations | Glc |
| Numéro CAS | 50-99-7 |
| PubChem | 5793 |
| ChemSpider | 5589 |
| UNII | 5SL0G7R0OK |
| Numéro CE | 200-075-1 |
| KEGG | C00031 |
| MeSH | Glucose |
| ChEBI | CHEBI: 4167 |
| ChEMBL | CHEMBL1222250 |
| Numéro RTECS | LZ6600000 |
| Code ATC | B05 V04 CA02, V06 DC01 |
| Beilstein Référence | 1281604 |
| Gmelin Référence | 83256 |
| 3DMet | B04623 |
| images de Jmol-3D | Image 1 Image 2 |
SMILES
| |
InChI
| |
| Propriétés | |
| Formule moléculaire | C 6 H 12 O 6 |
| Masse molaire | 180,16 g mol -1 |
| Apparence | Poudre blanche |
| Densité | 1,54 g / cm 3 |
| Point de fusion | α- D-glucose: 146 ° C |
| Solubilité dans l'eau | 91 g / 100 ml |
| Thermochimie | |
| Std enthalpie de formation Δ f H | -1271 KJ / mol |
| Std enthalpie de combustion Δ c H | -2805 KJ / mol |
| Molaire standard entropie S | 209,2 J K -1 mol -1 |
| Capacité thermique spécifique, C | |
| Risques | |
| FS | CFPI 0865 |
| Indice de l'UE | non listé |
| NFPA 704 |  1
0 0 |
Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
Glucose ( / ɡ l U k oʊ s / Ou / - k oʊ z /; C 6 H 12 O 6, également connu sous le nom de D-glucose, le dextrose, ou sucre de raisin) est un simple, monosaccharide trouve dans les plantes. Ce est l'un des trois monosaccharides alimentaires, ainsi que fructose et galactose, qui sont absorbés directement dans la circulation sanguine pendant la digestion. Une importante hydrate de carbone dans la biologie , les cellules utilisent comme source d'énergie primaire et un intermédiaire métabolique. Le glucose est l'un des principaux produits de la photosynthèse et les carburants pour respiration cellulaire. Glucose existe dans plusieurs structures moléculaires différentes, mais toutes ces structures peut être divisé en deux familles de miroir-images ( stéréo). Un seul ensemble de ces isomères existe dans la nature, ceux qui dérivent de la " droitiers "de glucose, noté D-glucose. D-glucose est parfois appelé dextrose, bien que l'utilisation de ce nom est fortement déconseillée. Le terme est dérivé de dextrose glucose dextrogyre. Ce nom est donc confus lorsqu'il est appliqué à la énantiomère qui fait tourner la lumière dans la direction opposée. L'amidon et cellulose sont les polymères dérivés de la déshydratation du D-glucose. L'autre stéréoisomère, appelée L -glucose, ne est presque jamais trouvé dans la nature.
Le nom de "glucose" vient du grec mot glukus (γλυκύς), ce qui signifie «doux». Le suffixe " -ose "désigne un sucre .
Fonction
Pourquoi glucose et pas un autre monosaccharide tel que fructose est si largement utilisé dans les organismes ne est pas clairement compris. Une des raisons pourrait être que le glucose a une tendance plus faible, par rapport aux autres sucres hexose, de réagir de manière non spécifique avec les acides des groupes de protéines . Cette réaction ( glycation) réduit ou détruit la fonction d'un grand nombre enzymes. Le taux de faible glycation est due à la préférence de glucose pour le cyclique moins réactif isomère. Néanmoins, bon nombre de complications à long terme du diabète (par exemple, la cécité , l'insuffisance rénale, et neuropathie périphérique) sont probablement dus à la glycation des protéines ou des lipides. En revanche, addition d'enzyme régulée de glucose aux protéines par glycosylation est souvent indispensable à leur fonction. Une autre raison pour expliquer pourquoi glucose est le plus commun sucre , ce est que ce est la plus stable à conformation entre autres possibilités.
Analyte dans test sanguin médicale
Le glucose est un examen médical commune analyte mesurée dans des échantillons de sang. Manger ou à jeun avant de prendre un échantillon de sang a un effet sur le résultat. Une glycémie élevée à jeun niveau de sucre dans le sang peut être un signe de prédiabète ou un diabète sucré .
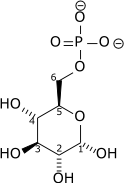
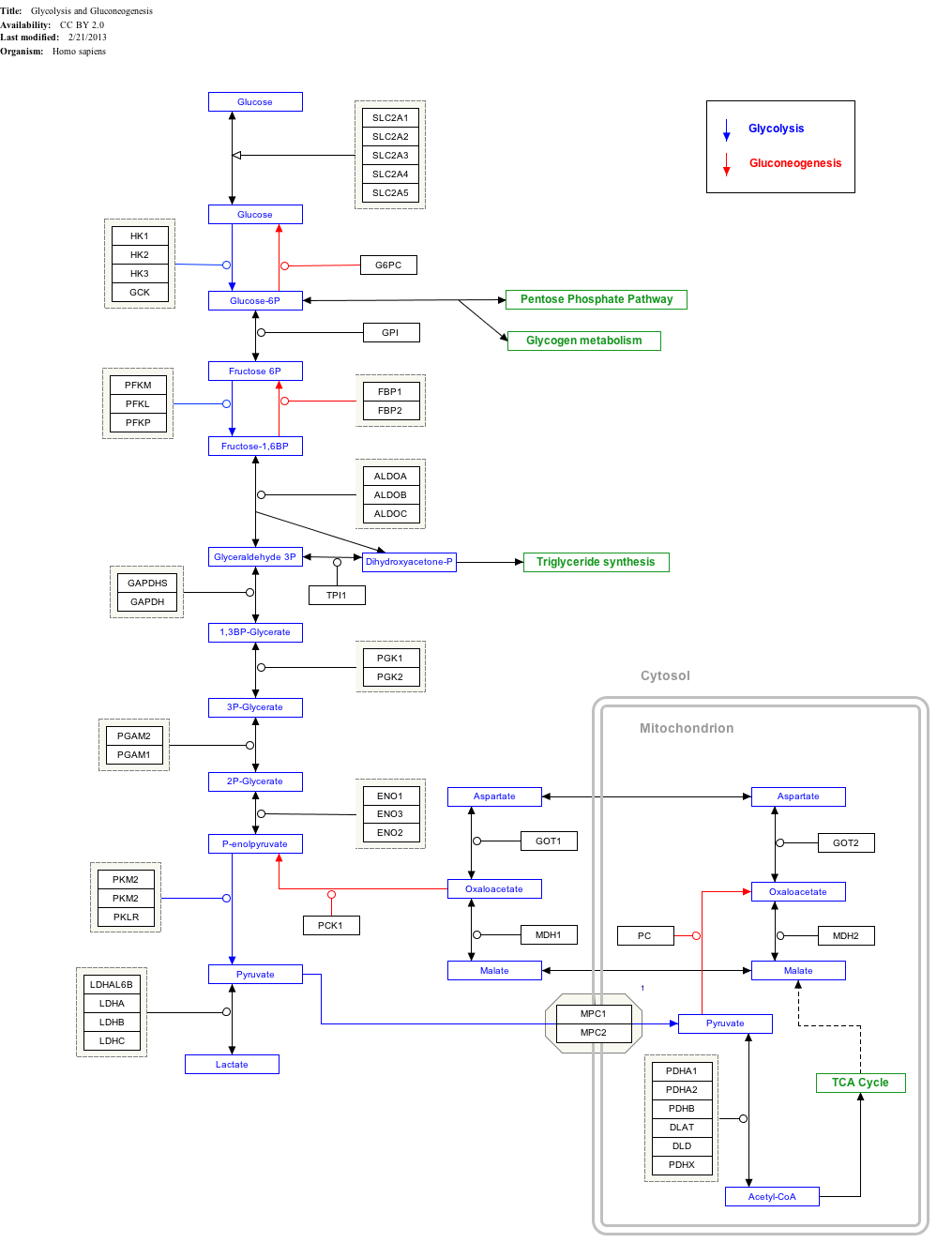
Glycolyse
| ||||||||||||||||||||
| Composé C00031 au KEGG Pathway base de données. Enzyme 2.7.1.1 au KEGG Pathway base de données. Composé C00668 au KEGG Pathway base de données. Réaction R01786 au Base de données KEGG Pathway. | ||||||||||||||||||||

-Glucose Composés contenant et formes isomères sont digérés et absorbés par le corps dans l'intestin, y compris amidon, le glycogène, et disaccharides monosaccharides.
Glucose est stocké principalement dans le foie et les muscles sous forme de glycogène.
-Il Est distribué et utilisés dans les tissus que le glucose libre.
L'utilisation de glucose comme source d'énergie dans les cellules est par la respiration aérobie ou anaérobie. Ces deux Commençons par les étapes précoces de la glycolyse voie métabolique. La première étape de ce est la la phosphorylation du glucose par hexokinase pour le préparer à répartition plus tard pour fournir de l'énergie. La principale raison de la phosphorylation immédiate de glucose par un hexokinase est d'empêcher la diffusion hors de la cellule. La phosphorylation ajoute une charge de sorte que le groupe phosphate glucose-6-phosphate ne peut pas traverser facilement la membrane cellulaire. Irréversibles premières étapes d'une voie métabolique sont communs à des fins réglementaires.
Dans la respiration anaérobie une molécule de glucose produit un gain net de deux molécules d'ATP (quatre molécules d'ATP sont produites pendant la glycolyse mais deux sont tenus par des enzymes utilisées au cours du processus). Dans la respiration aérobie une molécule de glucose est beaucoup plus rentable que dans une valeur nette de 32 molécules d'ATP est généré (34 brute avec deux étant nécessaire dans le processus).
Cliquez sur les gènes, les protéines et les métabolites ci-dessous pour créer un lien vers les articles respectifs.
- ^ La voie carte interactive peut être édité à WikiPathways: "GlycolysisGluconeogenesis_WP534".
Précurseur
Les organismes utilisent le glucose comme un précurseur pour la synthèse d'autres substances importantes. Amidon, la cellulose, et glycogène ("amidon animal") sont le glucose commune polymères ( polysaccharides). Certains de ces polymères comme l'amidon ou du glycogène servent de réserves d'énergie tandis que d'autres comme la cellulose et chitine (qui est fabriqué à partir d'un dérivé de glucose) ont des rôles structurels. Oligosaccharides de glucose combinées avec d'autres sucres servent réserves énergétiques importants. Il se agit notamment lactose, le sucre du lait prédominant dans laquelle un disaccharide et du glucose-galactose saccharose , une autre disaccharide et du glucose fructose. Le glucose est également ajouté sur certaines protéines et lipides dans un processus appelé glycosylation. Ce est souvent essentiels à leur fonctionnement. Les enzymes qui joignent d'autres molécules de glucose utilisent habituellement phosphorylée glucose pour alimenter la formation de la nouvelle obligation par rupture de la liaison glucose-phosphate.
Outre son utilisation directe en tant que monomère, le glucose peut être décomposé pour synthétiser une large variété d'autres biomolécules. Ceci est important car le glucose sert à la fois un réservoir de stockage d'énergie, mais aussi en tant que source de carbone organique. Le glucose peut être décomposée et transformée en lipides. Ce est aussi un précurseur pour la synthèse d'autres molécules importantes comme la vitamine C ( l'acide ascorbique). Bien que les plantes et certains microbes peuvent créer tous les composés dont ils ont besoin à partir du glucose étant donné les minéraux nécessaires, tous les animaux et de nombreux microbes ne peuvent pas synthétiser une partie ou
Structure et nomenclature
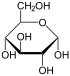
Le glucose est un monosaccharide de formule C 6 H 12 O 6 ou H (C = O) - (CHOH) 5 -H, dont cinq hydroxyle (OH) des groupes sont disposées d'une manière spécifique le long de son six carbone squelette.
Chaîne ouverte

Dans sa fugace forme à chaîne ouverte, la molécule de glucose a une ouverture (par opposition à cyclique) et non ramifiés squelette de six atomes de carbone, C-1 à C-6; où C-1 fait partie d'un groupe aldéhyde H (C = O) -, et chacun des cinq autres atomes de carbone porte un groupe -OH du groupe hydroxyle. Le reste obligations des carbones vertébrés sont satisfaites par hydrogène atomes -H. Par conséquent, le glucose est un et un hexose aldose, ou un aldohexose.
Chacun des quatre atomes de carbone C-2 à C-5 est un stéréocentre, ce qui signifie que ses quatre liaisons connectent à quatre substituants différents. (Carbone C-2, par exemple, se connecte à - (C = O) H, -OH, -H, et - (CHOH) 4 H.) En D-glucose, ces quatre pièces doivent être dans un tridimensionnelle spécifique arrangement. A savoir, lorsque la molécule est tracé en le Projection de Fischer, les groupes hydroxyle sur C-2, C-4 et C-5 doit être sur le côté droit, tandis que sur le C-3 doit être sur le côté gauche.
Les positions de ces quatre groupes hydroxyles sont exactement inversées dans le diagramme de Fischer . L -glucose D - et L-glucose sont deux des 16 aldohexoses possibles; les 14 autres sont allose, altrose, mannose, gulose, idose, galactose, et talose, chacune avec deux énantiomères, "D -" et "L -".
Formes cycliques
Dans les solutions, la forme à chaîne ouverte de glucose (soit "D -" ou "L -") existe en équilibre avec plusieurs isomères cycliques , contenant chacune un noyau d'atomes de carbone étant fermées par un atome d'oxygène. En solution aqueuse, cependant, plus de 99% des molécules de glucose, à un moment donné, exister en tant que pyranose. La chaîne ouverte est limitée à environ 0,25% et furanose existe en quantités négligeables. Les termes "glucose" et "D-glucose" sont généralement utilisés pour ces formes cycliques ainsi. L'anneau provient de la chaîne ouverte par un réaction d'addition nucléophile entre le groupe aldéhyde - (C = O) H en C-1 et le groupe -OH du groupe hydroxyle en C-4 ou C-5, pour donner un groupe hémiacétal -C (OH) HO-.
La réaction entre C-1 et C-5 crée une molécule avec un cycle à six chaînons, appelé pyranose, après l'éther cyclique pyrane, la molécule la plus simple avec le même anneau carbone-oxygène. Le (beaucoup plus rare) réaction entre C-1 et C-4 crée une molécule avec un cycle à cinq chaînons, appelé furanose, après l'éther cyclique furane. Dans les deux cas, chaque atome de carbone dans l'anneau présente un atome d'hydrogène et un groupe hydroxyle attaché à l'exception de la dernière carbone (C-4 ou C-5) dans laquelle le groupe hydroxyle est remplacé par le reste de la molécule ouverte (qui est - (C ( CH 2 OH) HOH) -H ou - (CHOH) -H, respectivement).
La réaction de cyclisation rend carbone chiral C-1, aussi, depuis ses quatre liaisons conduisent à -H, -OH, de carbone C-2, et à l'oxygène du cycle. Ces quatre parties de la molécule peuvent être disposés autour de C-1 (la carbone anomère) de deux manières distinctes, désignées par les préfixes "α-" et "β-". Quand une molécule de glucopyranose est tracé en le Haworth projection, la désignation "α-" signifie que le groupe hydroxyle fixé à C-1 et le groupe -CH 2 OH en C-5 est située sur des côtés opposés de l'avion de l'anneau (un Dispositif trans), tandis que "β-" signifie qu'ils sont sur le même côté du plan (a arrangement cis).
Par conséquent, l'isomère à chaîne ouverte D-glucose donne lieu à quatre isomères cycliques distinctes: D -glucopyranose α-, β- -glucopyranose D, D -glucofuranose α-, β- et D -glucofuranose; qui sont tous chiral.
 α- D - |  β- D - |  α- D - |  β- D - |

α- D -
Glucopyranose
β- D -
Glucopyranose
L'autre chaîne ouverte isomère L-glucose est similaire donne lieu à quatre formes cycliques distincts de L-glucose, chaque image du miroir du D-glucose correspondant.
Les bagues ne sont pas planes mais tordu en trois dimensions. L'anneau de glucopyranose (α ou β de) peut prendre plusieurs formes non planes, analogues à la «chaise» et conformations "en bateau" de cyclohexane. De même, la bague de glucofuranose peut prendre plusieurs formes, analogues aux conformations "enveloppe" de cyclopentane.
Les formes de glucopyranose de glucose prédominent en solution, et sont les seules formes observées à l'état solide. Ils sont des solides cristallins incolores, très solubles dans l'eau et l'acide acétique , peu soluble dans le methanol et l'éthanol . Ils fondent à 146 ° C (295 ° F) (α) et 150 ° C (302 ° F) (β), et se décomposent à des températures élevées en carbone et en eau.
Isomères de rotation
Chaque isomère de glucose est soumis à isomérie de rotation. Dans la forme cyclique du glucose, la rotation peut se produire autour de l'angle de torsion O6-C6-C5-O5, appelée ω -angle, pour former trois décalés conformations rotamères appelés Gauche - Gauche (gg), gauche - trans (gt) et trans - Gauche (tg). Pour méthyle α- D -glucopyranose à l'équilibre le rapport des molécules dans chaque rotamère conformation est signalé comme 57: 38: 5 gg: GT: tg. Cette tendance à l'-angle de ω à préfèrent adopter une conformation gauche est attribué au effet gauche.
Propriétés physiques
Solutions

Toutes les formes de glucose est transparente et facilement soluble dans l'eau, l'acide acétique , et dans plusieurs autres solvants. Ils sont peu solubles dans le methanol et l'éthanol .
La chaîne ouverte est thermodynamiquement instable, et ce spontanément isomérise les formes cycliques. (Bien que la réaction de fermeture de cycle pourrait en théorie créer quatre ou trois atomes anneaux, celles-ci seraient très tendues et ne sont pas respectées.) Dans les solutions à la température ambiante, les quatre isomères cycliques interconvertir sur une échelle de temps d'heures, dans un processus appelé mutarotation. A partir de ne importe quelles proportions, le mélange converge rapport stable de α: β 36:64. Le rapport serait α: β 11:89 si ce ne était l'influence de la effet anomérique. Mutarotation est considérablement plus lente à des températures proches de 0 ° C.
Mutarotation consiste en une inversion temporaire de la réaction de formation de noyau, d'où la forme à chaîne ouverte, suivie d'une re-formation de l'anneau. L'étape de cyclisation peut utiliser un groupe -OH différent de celui recréé par l'étape d'ouverture (commutation ainsi entre pyranose et formes furanose) et / ou le nouveau groupe hémiacétal créé sur C-1 peut avoir la même ou opposée chiralité que le un original (commutation ainsi entre l'α et β formes). Ainsi, même si la forme à chaîne ouverte est à peine détectable en solution, il est un élément essentiel de l'équilibre.
État solide
Selon les conditions, trois grandes formes solides de glucose peut être cristallisé à partir de solutions d'eau: α-glucopyranose, β-glucopyranose, et β-glucopyranose hydrate.
Activité optique
Que ce soit dans l'eau ou sous forme solide, D-glucose est dextrogyre, ce qui signifie qu'il va tourner la direction de polarisée dans le sens horaire de la lumière. L'effet est dû à la chiralité des molécules, et en fait la isomère symétrique, L-glucose, est lévogyre (rotation de la lumière polarisée dans le sens antihoraire) du même montant. La force de l'effet est différent pour chacun des cinq tautomères.
Notez que le D - préfixe ne se réfère pas directement sur les propriétés optiques du composé. Il indique que le centre chiral C-2 a la même chiralité que celle de glycéraldéhyde-D (qui a été de façon marquée, car il est dextrogyre). Le fait que le D-glucose est dextrogyre est un effet combiné de ses quatre centres chiraux, et pas seulement de C-2; et même quelques-unes des autres -aldohexoses D sont lévogyre.
Production
| Le métabolisme de la commune des monosaccharides et des réactions biochimiques de glucose |
|---|
 |

Biosynthèse
Dans les plantes et certaines les procaryotes, le glucose est un produit de la photosynthèse. Chez les animaux et les champignons, les résultats de glycémie de la répartition des le glycogène, un processus connu sous le nom glycogénolyse. Dans les usines du substrat de claquage est amidon.
Chez les animaux, le glucose est synthétisée dans le le foie et les reins de non glucidiques, tels que les produits intermédiaires pyruvate, lactate et glycérol, par un procédé connu sous le nom néoglucogenèse.
Dans certains hauturiers bactéries , le glucose est produit par chimiosynthèse.
Commercial
Le glucose est produit commercialement par l'intermédiaire du hydrolyse enzymatique de l'amidon. Beaucoup de cultures peuvent être utilisées comme source d'amidon. maïs , riz , blé , le manioc, feuilles de maïs et sagou sont tous utilisés dans diverses parties du monde. Au Etats-Unis , fécule de maïs (à partir de maïs) est utilisé presque exclusivement. La plupart glucose se produit commercial en tant que composant de sucre inverti, un environ 1: 1 mélange de glucose et fructose. En principe, la cellulose peut être hydrolysée en glucose, mais ce processus ne est pas encore commercialement pratique.
Histoire
Parce que le glucose est une nécessité de base de nombreux organismes, une compréhension correcte de sa composition chimique et la structure a grandement contribué à un progrès général dans la chimie organique. Cette compréhension se est produite en grande partie à la suite des enquêtes de Emil Fischer, un chimiste allemand qui a reçu le 1902 Prix Nobel de Chimie à la suite de ses conclusions. La synthèse de glucose a établi la structure de la matière organique et, par conséquent formé de la première validation définitive de Les théories de Jacobus Henricus van't Hoff de la cinétique chimique et les arrangements de liaisons chimiques dans les molécules contenant du carbone. Entre 1891 et 1894, Fischer a créé la configuration stéréochimique de tous les sucres connus et prédit correctement possible isomères, en appliquant la théorie de van't Hoff d'atomes de carbone asymétriques.