
L'adénosine triphosphate
À propos de ce écoles sélection Wikipedia
Cette sélection Wikipedia est déconnecté disponibles à partir enfants SOS pour la distribution dans le monde en développement. Avec enfants SOS vous pouvez choisir de parrainer des enfants dans plus de cent pays
| L'adénosine triphosphate | |
|---|---|
 | |
 | |
5- (6-aminopurin-9-yl) | |
| Identificateurs | |
| Numéro CAS | 56-65-5 |
| Propriétés | |
| Formule moléculaire | C 10 H 16 N 5 O 13 P 3 |
| Masse molaire | 507,181 g / mol |
| Acidité (p K a) | 6.5 |
| Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
L'adénosine 5'-triphosphate (ATP) est un multifonction nucléotidique qui est le plus important en tant que " moléculaire monnaie "intracellulaire énergie transfert. Dans ce rôle, ATP transporte l'énergie chimique dans les cellules pour métabolisme. Il est produit en tant que source d'énergie pendant le processus de photosynthèse et la respiration cellulaire et consommé par beaucoup enzymes et une multitude de processus cellulaires, y compris réactions biosynthétiques, la motilité et la division cellulaire. En voies de transduction de signaux, l'ATP est utilisé comme substrat par kinases phosphoryler des protéines et des lipides , ainsi que par l'adénylate cyclase, qui utilise de l'ATP pour produire le seconde molécule messagère AMP cyclique.
La structure de cette molécule est constituée d'une base purique ( adénine) fixé à la 1 'atome de carbone d'un sucre pentose ( ribose). Trois groupes phosphate sont fixés à l'extrémité 5 'atome de carbone du sucre pentose. ATP est également incorporé dans acides nucléiques par polymerases dans les processus de réplication de l'ADN et transcription. Lorsque l'ATP est utilisé dans la synthèse de l'ADN, le sucre ribose est d'abord converti en désoxyribose par la ribonucléotide réductase. ATP a été découvert en 1929 par Karl Lohmann, et a été proposé pour être la molécule principale de transfert d'énergie dans la cellule par Fritz Albert Lipmann en 1941.
PROPRIETES physiques et chimiques
ATP consiste en adénosine - lui-même composé d'un anneau de l'adénine et un ribose sucre - et trois des groupes phosphate (triphosphate). Les groupes phosphoryle, en commençant par le groupe le plus proche du ribose, sont désignés sous le nom de alpha (α), bêta (β) et gamma (γ) phosphates. L'ATP est hautement soluble dans l'eau et est très stable dans des solutions entre pH 6.8 à 7.4, mais est rapidement hydrolysé à pH extrême. Par conséquent, l'ATP est le meilleur stockée en tant que sel anhydre.
L'ATP est une molécule instable et tend à être hydrolysée dans l'eau. Si l'ATP et ADP sont en équilibre chimique , la quasi-totalité de l'ATP est converti en ADP. Tout système qui est loin de l'équilibre contient énergie potentielle, et est capable de faire le travail . Cellules biologiques maintenir le rapport de l'ATP en ADP à un point dix ordres de grandeur de l'équilibre, avec des concentrations plus élevées ATP mille fois que la concentration d'ADP. Ce déplacement de l'équilibre signifie que l'hydrolyse de l'ATP dans la cellule libère une grande quantité d'énergie. L'ATP est communément appelé une «molécule de haute énergie»; mais ce est incorrect, comme un mélange de l'ATP et de l'ADP à l'équilibre dans l'eau ne peut pas faire un travail utile à tous. ATP ne contient pas «obligations de haute énergie», et toute autre molécule instable servirait aussi bien comme un moyen de stocker l'énergie, si la cellule a maintenu sa concentration loin de l'équilibre.
La quantité d'énergie libérée peut être calculé à partir des variations de l'énergie dans des conditions non naturelles. La variation nette de l'énergie thermique ( enthalpie ) au la température et la pression de la décomposition de l'ATP étalon dans hydratée ADP et de phosphate inorganique hydraté est -20,5 kJ / mol, avec un changement de énergie libre de 3,4 kJ / mol. L'énergie libérée par clivage soit un phosphate (Pi) ou de pyrophosphate (PPi) unité de l'ATP, avec tous les réactifs et les produits lors de leur États standard de 1 M concentration, sont:
- ATP + H 2 O → ADP (hydraté) + Pi (hydraté) + H + (hydraté) AG = -30,54 kJ / mol (-7,3 kcal / mole)
- ATP + H 2 O → AMP (hydraté) + PPi (hydraté) + H + (hydraté) AG = -45,6 kJ / mol (-10,9 kcal / mole)
Ces valeurs peuvent être utilisées pour calculer la variation de l'énergie dans des conditions physiologiques et / ADP cellulaire ATP. Les valeurs indiquées pour l' énergie libre de Gibbs pour cette réaction dépendent d'un certain nombre de facteurs, y compris la force ionique globale et la présence de métaux alcalino-terreux tels que les ions Mg 2+ et Ca 2+. Dans des conditions cellulaires typiques, Ag est d'environ -57 kJ / mol (-14 kcal / mole).
Ionisation dans les systèmes biologiques
ATP a plusieurs groupes ionisables avec différents constantes de dissociation acide. Dans une solution neutre, de l'ATP est ionisé et existe principalement sous forme d'ATP à 4, avec une faible proportion de l'ATP 3-. Comme ATP a plusieurs groupes chargés négativement en solution neutre, il peut métaux chélate avec une très forte affinité. Le constante de liaison pour différents ions métalliques sont (donné comme par mole) que Mg 2+ (9 554), Na + (13), Ca 2+ (3 722), K + (8), Sr 2+ (1 381) et Li + (25). En raison de la force de ces interactions, ATP existe dans la cellule la plupart du temps dans un complexe avec Mg 2+.
Biosynthèse
L'ATP concentration à l'intérieur de la cellule est typiquement de 1 à 10 mM. ATP peut être produit par réactions d'oxydo-réduction à l'aide de simples et complexes sucres ( glucides ) ou les lipides comme source d'énergie. Pour l'ATP pour être synthétisé à partir de combustibles complexes, ils doivent d'abord être décomposés en leurs éléments de base. Les glucides sont hydrolysé en sucres simples, comme le glucose et fructose. Graisses ( triglycérides) sont métabolisés pour donner des acides gras et glycérol.
L'ensemble du processus d'oxyder le glucose en dioxyde de carbone est connu comme la respiration cellulaire et peut produire jusqu'à 36 molécules d'ATP à partir d'une seule molécule de glucose. ATP peut être produit par un certain nombre de processus cellulaires distinctes; les trois voies principales utilisés pour produire de l'énergie dans les eucaryotes sont les organismes et la glycolyse cycle de l'acide citrique / la phosphorylation oxydative, les deux composantes de respiration cellulaire; et bêta-oxydation. La majorité de cette production d'ATP par un non- photosynthétique eucaryote aérobie a lieu dans la mitochondrie , qui peut faire jusqu'à près de 25% du volume total d'une cellule typique.
Glycolyse
Dans la glycolyse, le glucose et le glycérol sont métabolisés en pyruvate via la voie glycolytique. Dans la plupart des organismes de ce processus se produit dans le cytosol, mais dans certains protozoaires comme le kinétoplastides, cela est effectué dans un spécialisé organite appelé le glycosome. Glycolyse génère un net deux molécules d'ATP par substrat phosphorylation catalysée par deux enzymes: PGK et la pyruvate kinase. Deux molécules de NADH sont également produits, qui peut être oxydé par le chaîne de transport d'électrons et en résultat la génération d'ATP supplémentaire par ATP synthase. Le pyruvate généré en tant que produit final de la glycolyse est un substrat pour la Cycle de Krebs.
Cycle de l'acide citrique
Dans la mitochondrie , le pyruvate est oxydé par le complexe pyruvate déshydrogénase pour l'acétyl-CoA, qui est entièrement oxydée en dioxyde de carbone par cycle de l'acide citrique (également connu sous le nom de cycle de Krebs). Chaque "tour" du cycle de l'acide citrique produit deux molécules de dioxyde de carbone , une molécule de l'équivalent ATP la guanosine triphosphate (GTP) à travers la phosphorylation au niveau du substrat, catalysée par succinyl CoA synthétase, trois molécules de la réduction coenzyme NADH, et une molécule de la coenzyme réduite FADH 2. Ces deux dernières molécules sont recyclés à leur état oxydé (NAD + et FAD, respectivement) par l'intermédiaire du chaîne de transport d'électrons, qui génère plus d'ATP par la phosphorylation oxydative. L'oxydation d'une molécule de NADH conduit à la synthèse de l'ordre de trois molécules d'ATP, et l'oxydation de l'une FADH 2 donne environ deux molécules d'ATP. La majorité de l'ATP cellulaire est généré par ce processus. Bien que le cycle de l'acide citrique ne implique pas elle-même moléculaire oxygène , ce est un obligatoirement processus aérobie parce O 2 est nécessaire pour recycler le NADH réduite et FADH 2 à leurs états d'oxydation. En l'absence d'oxygène du cycle de acide citrique cessera de fonctionner en raison de l'absence de disposition NAD + et FAD.
La production d'ATP par la mitochondrie de NADH cytosolique repose sur la navette malate-aspartate (et dans une moindre mesure, la navette glycérol-phosphate), car la membrane mitochondriale interne est imperméable aux NADH et NAD +. Au lieu de transférer le NADH généré, un malate convertis de l'enzyme de déshydrogénase oxaloacétate à malate, qui est transporté vers la matrice mitochondriale. Une autre réaction de déshydrogénase de malate catalysée se produit dans la direction opposée, produisant l'oxaloacétate et du NADH à partir du malate de nouveau transporté magasin et l'intérieur de la mitochondrie de NAD +. Un convertit l'oxaloacétate transaminase à aspartate pour le transport en arrière à travers la membrane et dans l'espace intermembranaire.
Dans la phosphorylation oxydative, le passage des électrons à partir de NADH et FADH 2 par les puissances de la chaîne de transport d'électrons le pompage de protons de la matrice mitochondriale et dans l'espace intermembranaire. Cela crée un force motrice de protons qui est l'effet net d'un gradient de pH et un gradient de potentiel électrique à travers la membrane mitochondriale interne. Flux de protons dans cette gradient de potentiel - ce est, de l'espace intermembranaire à la matrice - fournit la force motrice pour la synthèse d'ATP par ATP synthase. Cette enzyme contient une sous-unité de rotor qui tourne physiquement par rapport aux parties statiques de la protéine au cours de la synthèse d'ATP.
La plupart de l'ATP synthétisé dans les mitochondries sera utilisé pour les processus cellulaires dans le cytosol; il doit donc être exporté à partir de son site de synthèse dans la matrice mitochondriale. La membrane interne contient une antiporteur, la translocase ADP / ATP, qui est un protéine membranaire intégrale utilisé pour échanger nouvellement synthétisé ATP en ADP de la matrice dans l'espace intermembranaire. Cette translocase est entraîné par le potentiel de membrane, tel qu'il résulte du mouvement de l'ordre de 4 charges négatives de la membrane mitochondriale en échange de trois charges négatives déplacés à l'intérieur. Cependant, il est également nécessaire de transporter le phosphate dans la mitochondrie; le support de phosphate se déplace avec un proton dans chaque phosphate, partiellement dissiper le gradient de protons.
Le bêta-oxydation
Les acides gras peuvent également être décomposés l'acétyl-CoA par bêta-oxydation. Chaque tour de ce cycle réduit la longueur de la chaîne acyle par deux atomes de carbone et produit une NADH et FADH 2 une molécule, qui sont utilisés pour générer l'ATP par phosphorylation oxydative. Parce que NADH et FADH 2 sont des molécules riches en énergie, des dizaines de molécules d'ATP peuvent être générés par la bêta-oxydation d'une seule longue chaîne acyle. Le rendement énergétique élevé de ce processus et le stockage de la graisse compacte expliquent pourquoi il est la source la plus dense de l'alimentation calories.
La respiration anaérobie
La respiration anaérobie ou fermentation entraîne la production d'énergie par le procédé de oxydation en l'absence de O 2 en tant que accepteur d'électrons. Dans la plupart des eucaryotes, le glucose est utilisé à la fois comme un accumulateur d'énergie et d'un donneur d'électrons. L'équation de l'oxydation du glucose à l'acide lactique est:
- C 6 H 12 O 6
 2CH 3 CH (OH) COOH + 2 ATP
2CH 3 CH (OH) COOH + 2 ATP
Chez les procaryotes, des accepteurs d'électrons multiples peuvent être utilisés dans la respiration anaérobie. Ceux-ci comprennent le nitrate , le sulfate ou le dioxyde de carbone. Ces procédés conduisent à des processus écologiquement importants de dénitrification, la réduction du sulfate et acétogénèse, respectivement.
ATP par reconstitution nucléoside diphosphate kinases
ATP peut également être synthétisé par plusieurs réactions dites "reconstitution" catalysées par les familles d'enzymes de nucléosides kinases diphosphate (NDKs), qui utilisent d'autres nucléosides triphosphates comme un donneur de phosphate à haute énergie, et l'ATP: la famille guanido-phosphotransférase, qui utilise créatine.
- ADP + GTP
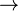 ATP + PIB
ATP + PIB
La production d'ATP lors de la photosynthèse
Chez les plantes, l'ATP est synthétisé par membrane des thylakoïdes de la pendant le chloroplaste réactions dépendant de la lumière de la photosynthèse dans un processus appelé photophosphorylation. Ici, l'énergie lumineuse est utilisée pour pomper des protons à travers la membrane des chloroplastes. Cela produit une force proton-motrice et cela entraîne l'ATP synthase, exactement comme dans la phosphorylation oxydative. Une partie de l'ATP produit dans les chloroplastes est consommée dans la Cycle de Calvin, qui produit trioses sucres.
ATP recyclage
La quantité totale d'ATP dans le corps humain est d'environ 0,1 taupe. La majorité de l'ATP ne est pas habituellement synthétisé de novo, mais est généré à partir d'ADP par les procédés mentionnés ci-dessus. Ainsi, à un moment donné, le montant total de l'ATP + ADP reste assez constante.
L'énergie utilisée par les cellules humaines nécessite la hydrolyse de 100 à 150 moles d'ATP par jour ce qui est autour de 50 à 75 kg. Typiquement, un humain va utiliser leur poids corporel de l'ATP au cours de la journée. Cela signifie que chaque molécule d'ATP est recyclé 1000 à 1500 fois au cours d'une seule journée (100 / 0,1 = 1,000). ATP ne peut pas être stockée, et donc sa consommation suit de près sa synthèse.
Régulation de la biosynthèse
La production d'ATP dans une cellule eucaryote aérobie est étroitement régulée par des mécanismes allostériques, par effets de rétroaction, et de la dépendance à la concentration de substrat d'enzymes individuels dans les glycolyse et d'oxydation voies de phosphorylation. Principaux points de contrôle se produisent dans les réactions enzymatiques qui sont si énergétiquement favorable qu'ils sont irréversibles dans des conditions physiologiques.
Dans la glycolyse, hexokinase est directement inhibée par son produit, la glucose-6-phosphate, et la pyruvate kinase est inhibée par l'ATP lui-même. Le point de contrôle principal de la glycolyse est phosphofructokinase (PFK), qui est allostérique inhibée par des concentrations élevées d'ATP et activé par des concentrations élevées d'AMP. L'inhibition de la PFK de l'ATP est inhabituelle, car l'ATP est également un substrat pour la réaction catalysée par la PFK; la forme biologiquement active de l'enzyme est une tétramère qui existe dans deux conformations possibles, dont un seul, qui se lie au second substrat fructose-6-phosphate (F6P). La protéine a deux sites de fixation à l'ATP - le site actif est accessible dans chaque conformation de la protéine, mais la liaison à l'ATP sur le site de l'inhibiteur stabilise la conformation qui se lie faiblement F6P. Un certain nombre d'autres petites molécules peut compenser le décalage induit par l'ATP en équilibre conformation et réactiver PFK, y compris AMP cyclique, des ions ammonium, phosphate inorganique, et le fructose biphosphate 1,6 et 2,6.
Le cycle de l'acide citrique est régulée principalement par la disponibilité des substrats clés, en particulier le rapport de NAD + en NADH et les concentrations de calcium , phosphate inorganique, ATP, ADP, AMP et. Citrate - la molécule qui donne son nom au cycle - est un inhibiteur de rétroaction citrate synthase et inhibe également PFK, fournissant un lien direct entre la régulation du cycle de l'acide citrique et la glycolyse.
Dans la phosphorylation oxydative, le point de contrôle clé est la réaction catalysée par cytochrome c oxydase, qui est réglementée par la disponibilité de son substrat-forme réduite de cytochrome c. Le montant de la réduction du cytochrome c disponibles est directement lié aux quantités d'autres substrats:
ce qui implique directement l'équation suivante:
Ainsi, un ratio élevé de [NADH] pour [NAD +] ou un faible ratio de [ADP] [P i] pour [ATP] impliquent une grande quantité de cytochrome c réduit et un niveau élevé de l'activité du cytochrome c oxydase. Un niveau supplémentaire de régulation est introduit par les tarifs de transport de l'ATP et NADH entre la matrice mitochondriale et le cytoplasme.
Fonctionne dans les cellules
ATP est généré dans la cellule par des procédés consommant de l'énergie et est décomposée par des processus de libération d'énergie. De cette façon ATP transfère l'énergie entre spatialement séparée réactions métaboliques. L'ATP est la principale source d'énergie pour la majorité des fonctions cellulaires. Cela comprend la synthèse de macromolécules, y compris ADN, ARN, et protéines. ATP joue également un rôle essentiel dans le transport des macromolécules à travers les membranes cellulaires, par exemple, exocytose et endocytose.
Dans la synthèse du acide nucléique L'ARN, l'ATP est l'un des quatre nucléotides incorporés directement dans des molécules d'ARN par ARN polymérases. L'énergie motrice cette polymérisation vient de cliver un pyrophosphate (deux groupes phosphate). Le processus est similaire à la biosynthèse de l'ADN, sauf que l'ATP est réduit à la désoxyribonucléotide dATP, avant l'incorporation dans l'ADN.
L'ATP est impliquée de manière critique dans le maintien de la structure cellulaire en facilitant le montage et le démontage des éléments de la cytosquelette. Dans un procédé apparenté, l'ATP est requis pour la raccourcissement des filaments d'actine et de myosine ponts transversaux nécessaires à la contraction musculaire. Ce dernier procédé est l'une des principales exigences énergétiques des animaux et est essentiel pour locomotion et la respiration.
Signalisation cellulaire
Signalisation extracellulaire
L'ATP est également un molécule de signalisation. ATP, ADP, ou adénosine sont reconnus par récepteurs purinergiques.
Chez l'homme, ce rôle de signalisation est important à la fois dans le système nerveux central et périphérique. Dépendant de l'activité libération de l'ATP à partir synapses, les axones et les cellules gliales active les récepteurs membranaires appelées purinergiques P2. Les récepteurs P2Y sont métabotropique, à savoir Couplés aux protéines G et modulent principalement taux d'AMP parfois cycliques calcium intracellulaire et. Quinze membres de la famille de P2Y ont été rapportés (P2Y1-P2Y15), même si certains ne sont liés par le biais faible homologie et plusieurs (P2Y5, P2Y7, P2Y9, P2Y10) ne fonctionnent pas comme des récepteurs qui soulèvent calcium cytosolique. Le récepteur P2X ionotropique sous-groupe composé de sept membres (P2X1-P2X7) qui sont Ca 2+ canaux ioniques -permeable ligand-dépendants qui se ouvrent lorsque lié à un nucléotide purine extracellulaire. Contrairement aux récepteurs P2 (ordre agoniste ATP> ADP> AMP> ADO), purinergique nucléotides comme ATP ne sont pas fortes agonistes des récepteurs P1 qui sont fortement activées par adénosine et d'autres nucléosides (ADO> AMP> ADP> ATP). Récepteurs P1 ont A1, A2a, A2b et A3 sous-types ("A" comme un vestige de l'ancienne nomenclature des récepteurs de l'adénosine), qui sont tous des G récepteurs couplés aux protéines, A1 et A3 étant couplé à Gi, et A2a et A2b être couplé à Gs.
Signalisation intracellulaire
L'ATP est critique dans processus de transduction du signal. Il est utilisé par kinases en tant que source de groupes phosphate dans les réactions de transfert de phosphate. L'activité de kinase sur des substrats tels que des protéines ou des lipides membranaires sont une forme courante de transduction du signal. La phosphorylation d'une protéine par une kinase peut activer cette cascade tel que le mitogen-activated protein kinase cascade.
ATP est également utilisé par l'adénylate cyclase et est transformé en le second messager de l'AMP cyclique molécule, qui est impliqué dans le déclenchement de signaux de calcium par la libération de calcium des réserves intracellulaires. Cette forme de la transduction du signal est particulièrement important dans le fonctionnement du cerveau, même si elle est impliquée dans la régulation d'une multitude d'autres processus cellulaires.
Synthèse désoxyribonucléotide
Dans tous les organismes connus, les désoxyribonucléotides qui forment ADN sont synthétisés par l'action de ribonucléotide réductase (RNR) enzymes sur leurs ribonucléotides correspondantes. Cette enzyme réduit la 2 ' un groupe hydroxyle sur le sucre ribose à désoxyribose, formant un désoxyribonucléotide (notée dATP). Toutes les enzymes de la ribonucleotide reductase utilisent une commune sulfhydryle mécanisme radicalaire tributaire réactive résidus de cysteine qui se oxydent pour former des liaisons disulfure dans le cours de la réaction. Enzymes RBR sont recyclés par réaction avec thiorédoxine ou glutarédoxine.
La régulation des enzymes apparentées RNR et maintient un équilibre de dNTP par rapport à l'autre et par rapport à la cellule dans PNT. Très bas le dNTP inhibe de concentration la synthèse d'ADN et réparation de l'ADN et est létale pour la cellule, tandis qu'un rapport de dNTP est anormal mutagène en raison de la probabilité accrue de la ADN polymérase incorporant le mauvais dNTP pendant la synthèse de l'ADN. Règlement ou différentielle spécificité de RNR a été proposée comme un mécanisme pour les modifications dans la taille relative des pools de dNTP intracellulaires sous stress cellulaire tels que hypoxie.
La liaison aux protéines

Certaines protéines qui se lient à l'ATP faire d'une caractéristique pliage de la protéine connue sous le nom Rossmann pliage, qui est un général nucléotide contraignant domaine structural qui peut également lier le cofacteur NAD. Les protéines de liaison ATP plus courantes, connues sous le nom kinases, part un petit nombre de plis communes; la protéines kinases, la plus grande superfamille de la kinase, les caractéristiques structurelles communes de part spécialisés pour la liaison de l'ATP et le transfert de phosphate.
ATP dans des complexes avec des protéines nécessite généralement la présence d'un divalent cation , presque toujours magnésium , qui se lie aux groupes phosphate de l'ATP. La présence de magnésium diminue fortement la constante de dissociation de l'ATP à partir de son partenaire de liaison de protéine sans affecter la capacité de l'enzyme à catalyser la réaction une fois que l'ATP est lié. La présence d'ions magnésium peut servir de mécanisme de régulation de la kinase.
Analogues de l'ATP
laboratoires de biochimie utilisent souvent des études in vitro pour explorer les processus moléculaires dépendant de l'ATP. Les inhibiteurs enzymatiques d'enzymes ATP-dépendants tels que kinases sont nécessaires pour examiner la des sites de liaison et états de transition impliqués dans les réactions dépendant de l'ATP. Analogues de l'ATP sont également utilisés dans Cristallographie aux rayons X pour déterminer une la structure des protéines dans un complexe avec l'ATP, souvent avec d'autres substrats. Analogues de l'ATP plus utiles ne peuvent pas être hydrolyse comme ATP serait; à la place ils emprisonnent l'enzyme dans une structure étroitement liée à l'état liée à l'ATP. L'adénosine 5 '- (gamma-thiotriphosphate) est un analogue de l'ATP extrêmement commun dans lequel l'un des atomes d'oxygène gamma-phosphate est remplacé par un soufre atome; cette molécule est hydrolysé à un taux considérablement plus lent que lui-même ATP et fonctionne comme un inhibiteur des processus dépendant de l'ATP. Dans les études cristallographiques, états de transition d'hydrolyse sont modélisés par la borne ions vanadate. Toutefois, la prudence se impose dans l'interprétation des résultats d'expériences utilisant analogues de l'ATP, puisque certaines enzymes peuvent les hydrolyser à des taux appréciables à forte concentration.


![\ Frac {~ cyt c_ {red}} {~ cyt c_ {}} boeuf = \ left (\ frac {[NADH]} {[NAD] ^ {+}} \ right) ^ {\ frac {1} {2 }} \ left (\ frac {[ADP] [P_ {i}]} {[ATP]} \ right) K_ {eq}](../../images/131/13158.png)
