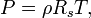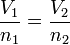Gás
Sobre este escolas selecção Wikipedia
Este conteúdo da Wikipedia foi escolhida pela SOS Children para adequação nas escolas ao redor do mundo. Clique aqui para saber mais sobre apadrinhamento de crianças.

| Mecânica do contínuo |
|---|
 |
Leis
|
Mecânica dos sólidos
|
|
Reologia
|
O gás é um dos os quatro estados fundamentais da matéria (sendo os outros sólidos , líquidos e de plasma ). Um gás puro pode ser feito de átomos individuais (por exemplo, um gás nobre ou gás atómico como néon ), elementais moléculas feitas a partir de um tipo de átomo (por exemplo, oxigénio ), ou compostos moléculas feitas a partir de uma variedade de átomos (por exemplo, dióxido de carbono ). Um gás mistura deverá conter uma variedade de gases puros tanto como o ar . O que distingue um gás a partir de líquidos e de sólidos é a grande separação das partículas de gás individuais. Esta separação faz normalmente um gás incolor invisível para o observador humano. A interacção de partículas de gás na presença de eléctrico e campos gravitacionais são consideradas insignificantes, como indicado pelos vectores de velocidade constante na imagem.
É encontrado o estado gasoso da matéria entre os estados líquido e de plasma, o último dos quais fornece o limite superior da temperatura para os gases. Delimita o extremo inferior dos temperatura escala mentira gases quânticos degenerativas que estão ganhando cada vez mais atenção. De alta densidade atômica gases super-arrefecido a incrivelmente baixas temperaturas são classificados por seu comportamento estatístico ou como um Gás de Bose ou um Gás de Fermi. Para uma lista detalhada desses estados exóticos da matéria ver lista de estados da matéria.
Etimologia
A palavra é um gás neologismo usado pela primeira vez no início do século 17 Flamengo químico JB Van Helmont. A palavra de Van Helmont parece ter sido simplesmente uma transcrição fonética do grego palavra χάος Caos - a g em holandês a ser pronunciado como o ch Inglês - caso em que Van Helmont estava simplesmente seguindo o estabelecido alquímico uso atestada pela primeira vez nas obras de Paracelsus. De acordo com a terminologia de Paracelso, o caos significava algo como "água ultra-rarefeito".
Características físicas

Como a maioria dos gases são difíceis de observar directamente, eles são descritos através da utilização de quatro propriedades físicas ou características macroscópicas: pressão, de volume, número de partículas (químicos agrupá-los por moles) e temperatura . Estas quatro características eram constantemente observados por cientistas como Robert Boyle , Jacques Charles, John Dalton , Joseph Gay-Lussac e Amedeo Avogadro para uma variedade de gases em várias configurações. Seus estudos detalhados em última análise, levou a uma relação matemática entre estas propriedades expressas pela lei do gás ideal (ver secção modelos simplificados abaixo).
Partículas de gás estão amplamente separados uns dos outros, e, consequentemente, têm ligações intermoleculares mais fracas do que os líquidos ou sólidos. Estes forças intermoleculares resultar de interacções electrostáticas entre as partículas do gás. Como carregada áreas de diferentes partículas de gás repelem, enquanto as regiões com cargas opostas de diferentes partículas de gás atrair um ao outro; gases que contêm carregadas permanentemente íons são conhecidos como plasmas . Compostos gasosos com ligações covalentes polares contêm desequilíbrios carga permanente e assim por experiência relativamente fortes forças intermoleculares, embora a molécula, enquanto carga líquida do composto permanece neutro. Transientes, cargas induzidas aleatoriamente existem em todo non-polar ligações covalentes das moléculas e as interacções electrostáticas causadas por eles são referidos como forças de Van der Waals . A interacção destas forças intermoleculares varia dentro de uma substância que determina muitas das propriedades físicas únicas para cada um dos gases. Uma comparação de pontos de ebulição para os compostos formados por ligações iônicas e covalentes nos leva a esta conclusão. As partículas de fumaça flutuando na imagem fornece alguns insights sobre o comportamento do gás de baixa pressão.
Em comparação com os outros estados da matéria, gases têm baixa densidade e viscosidade. Pressão e temperatura influenciam as partículas dentro de um certo volume. Esta variação na velocidade de separação das partículas e é referido como compressibilidade. Esta separação das partículas e do tamanho influencia as propriedades ópticas de gases como pode ser encontrado no seguinte lista de índices de refração. Finalmente, as partículas de gás ou afastados difusa, a fim de se distribuir de forma homogénea ao longo de qualquer recipiente.
Macroscópico
Ao observar um gás, que é típico para especificar um ponto de referência ou escala de comprimento. Uma escala de comprimento maior corresponde a um macroscópica ou ponto de vista global do gás. Esta região (referido como um volume) deve ser de tamanho suficiente para conter uma grande amostragem de partículas de gás. A análise estatística resultante deste tamanho da amostra produz o comportamento "média" (isto é, velocidade, temperatura ou pressão) de todas as partículas de gás dentro da região. Em contraste, numa escala menor comprimento corresponde a um ponto microscópico ou partícula de vista.
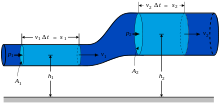
Macroscopicamente, as características do gás são medidos tanto em termos das partículas de gás-se (velocidade, pressão, ou temperatura) ou os seus arredores (volume). Por exemplo, Boyle Robert estudada química pneumático para uma pequena parcela de sua carreira. Uma de suas experiências relacionadas com o propriedades macroscópicas de pressão e do volume de um gás. Seu experimento usou um tubo de J- manómetro que parece um tubo de ensaio na forma da letra J. Boyle preso um gás inerte na extremidade fechada do tubo de ensaio com uma coluna de mercúrio , tornando assim o número de partículas e a temperatura constante. Ele observou que, quando a pressão foi aumentada em gás, adicionando mais mercúrio para a coluna, o volume de gás aprisionado 'diminuiu (isto é conhecido como um relação inversa). Além disso, quando multiplicado Boyle a pressão e o volume de cada uma das observações, o produto era constante. Este relacionamento mantido para cada gás que Boyle observou que conduz à lei, (PV = k), nomeado para homenagear o seu trabalho neste campo.
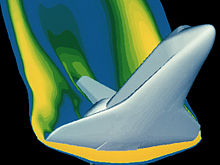
Existem muitas ferramentas matemáticas disponíveis para analisar as propriedades do gás. Como gases são submetidas a condições extremas, estas ferramentas tornam-se um pouco mais complexa, a partir da Equações de Euler para o fluxo de invíscido às equações de Navier-Stokes que totalmente responsáveis por efeitos viscosos. Estas equações são adaptados para as condições do sistema de gás em questão. Equipamentos de laboratório de Boyle permitido o uso de álgebra para obter seus resultados analíticos. Seus resultados foram possíveis porque ele estava estudando gases em situações relativamente baixa pressão onde eles se comportaram de forma "ideal". Estas relações ideais para aplicar cálculos de segurança para uma variedade de condições de voo sobre os materiais em uso. O equipamento de alta tecnologia em uso hoje foi projetado para nos ajudar a explorar com segurança os ambientes operacionais mais exóticos onde os gases não se comportam de forma "ideal". Esta matemática avançada, incluindo estatísticas e cálculo multivariado, torna possível a solução para tais situações dinâmicas complexas como a reentrada de veículos espaciais. Um exemplo é a análise da reentrada do vaivém espacial na foto para garantir as propriedades do material sob esta condição de carregamento são adequados. Neste regime de vôo, o gás é não comportando idealmente.
Pressão
O símbolo utilizado para representar a pressão nas equações é "p" ou "P" com unidades de SI pascais.
Ao descrever um recipiente de gás, o termo pressão (ou pressão absoluta) refere-se à força média por unidade de área que o gás exerce sobre a superfície do recipiente. Dentro deste volume, às vezes é mais fácil de visualizar as partículas de gás movendo-se em linha reta até colidirem com o recipiente (ver diagrama no topo do artigo). A força transmitida por uma partícula de gás para dentro do recipiente durante esta colisão é a alteração na dinâmica da partícula. Durante uma colisão apenas o componente normal (geometria) das mudanças de velocidade. Uma partícula viajar paralela à parede não muda a sua dinâmica. Portanto, a força média sobre uma superfície deve ser a mudança média no momento linear de todas essas colisões de partículas de gás.
A pressão é a soma de todos os componentes normais de força exercida pelas partículas de impacto nas paredes do recipiente dividida pela área da superfície da parede.
Temperatura

O símbolo usado para representar a temperatura nas equações é T com unidades SI de kelvins .
A velocidade de uma partícula de gás é proporcional à sua temperatura absoluta . O volume do balão no vídeo diminui quando as partículas de gás aprisionado abrandar com a adição de azoto extremamente frio. A temperatura de qualquer sistema físico está relacionado com os movimentos das partículas (moléculas e átomos) que compõem o sistema [gás]. Em mecânica estatística , a temperatura é a medida da energia cinética armazenada em média uma partícula. Os métodos de armazenar esta energia são ditadas pela graus de liberdade da própria partícula ( modos de energia). A energia cinética acrescentado ( processo endotérmico) de partículas de gás por meio de colisões produz linear, rotativo, e o movimento vibracional. Em contraste, uma molécula na forma de um sólido só pode aumentar os seus modos vibracionais com a adição de calor quando a estrutura do cristal evita a estrutura linear e movimentos de rotação. Estas moléculas de gás aquecido têm uma gama maior velocidade que varia constantemente devido a colisões constantes com outras partículas. A gama de velocidades pode ser descrito pela Distribuição de Maxwell-Boltzmann. A utilização deste distribuição implica gases ideais próximos equilíbrio termodinâmico do sistema de partículas a ser considerada.
O volume específico
O símbolo usado para representar volume específico nas equações é "v" com unidades SI de metros cúbicos por quilograma.
O símbolo usado para representar o volume de equações é "V" com unidades SI de metros cúbicos.
Ao realizar uma termodinâmico análise, é típico para falar de propriedades intensivas e extensivas. Propriedades que dependem da quantidade de gás (ou, em massa ou volume) são chamados de propriedades extensivas, enquanto que as propriedades que não dependem da quantidade de gás são chamados propriedades intensivas. O volume específico é um exemplo de uma propriedade intensiva porque é o rácio do volume ocupado por uma unidade de massa de um gás que é idêntico ao longo de um sistema em equilíbrio. 1000 átomos de um gás ocupe o mesmo espaço que quaisquer outros átomos 1000 para qualquer dada temperatura e pressão. Este conceito é mais fácil de visualizar para sólidos, tais como ferro , que são incompressível em comparação com os gases. Uma vez que um gás enche qualquer recipiente em que é colocado, o volume é uma extensa propriedade.
Densidade
O símbolo usado para representar a densidade nas equações é ρ (rho), com unidades SI de quilogramas por metro cúbico. Este termo é a recíproco do volume específico.
Desde moléculas de gás pode se mover livremente dentro de um recipiente, sua massa é normalmente caracterizada pela densidade. A densidade é a quantidade de massa por unidade de volume de uma substância, ou o inverso de volume específico. No caso dos gases, a densidade pode variar dentro de uma vasta gama, porque as partículas são livres para se aproximam quando constrangido por pressão ou do volume. Esta variação de densidade é referido como compressibilidade. Tal como pressão e temperatura, a densidade é um variável de estado de um gás e a mudança na densidade durante todo o processo é regido pelas leis da termodinâmica. Para gás estático, a densidade é o mesmo em todo o contêiner inteiro. A densidade é, portanto, uma quantidade escalar. Pode ser demonstrado pela teoria cinética que a densidade é inversamente proporcional ao tamanho do recipiente em que uma massa fixa de gás está confinado. Neste caso de uma massa fixa, a densidade diminui à medida que se aumenta o volume.
Microscópico
Se pode-se observar um gás sob um microscópio poderoso, seria ver uma coleção de partículas (moléculas, átomos, íons, elétrons, etc.), sem qualquer forma definitiva ou volume que estão em movimento mais ou menos aleatória. Estas partículas de gás neutro a mudar de direcção quando eles colidem com uma outra partícula ou com os lados do recipiente. Em um gás ideal, essas colisões são perfeitamente elástico. Esta partícula ou vista microscópica de um gás é descrito pela Teoria cinético-molecular. Os pressupostos subjacentes a esta teoria pode ser encontrada na seção de postulados Teoria cinética.
Teoria cinética
Teoria cinética fornece insights sobre as propriedades macroscópicas de gases, considerando sua composição molecular e movimento. Começando com as definições de impulso e a energia cinética , pode-se utilizar o a conservação da quantidade de movimento e as relações geométricas de um cubo de se relacionar as propriedades do sistema macroscópicas de temperatura e pressão para a propriedade microscópica de energia cinética por molécula. A teoria fornece valores para a média destas duas propriedades.
A teoria também explica como o sistema de gás responde a mudar. Por exemplo, como um gás é aquecido a partir de zero absoluto, quando é (em teoria) perfeitamente ainda, a sua energia interna (temperatura) é aumentada. Como o gás é aquecido, as partículas e acelerar a sua temperatura sobe. Isso resulta em um maior número de colisões com o tempo por unidade de recipiente, devido às velocidades das partículas mais elevadas associadas com temperaturas elevadas. A pressão aumenta em proporção com o número de colisões por unidade de tempo.
Movimento browniano

Movimento Browniano é o modelo matemático utilizado para descrever o movimento aleatório das partículas suspensas num fluido. A animação de partículas de gás, usando rosa e partículas verdes, ilustra como esse comportamento resulta na divulgação de gases ( entropia ). Estes acontecimentos são também descritos por teoria das partículas.
Uma vez que é no limite de (ou além) a tecnologia atual para observar partículas de gás individuais (átomos ou moléculas), apenas cálculos teóricos dão sugestões sobre como eles se movem, mas seu movimento é diferente do movimento browniano, porque o movimento browniano envolve um arrasto suave devido para a força de atrito de muitas moléculas de gás, pontuado por colisões violentas de uma molécula individual de gás (ou vários) (s) com a partícula. A partícula (geralmente constituído por milhões ou bilhões de átomos) move-se, portanto, em um curso irregular, mas não de modo irregular como seria esperado se a uma molécula de gás individual foram examinados.
As forças intermoleculares

Como discutido anteriormente, pontos momentâneas (ou repulsões) entre partículas têm um efeito sobre dinâmica de gás. Em química física, o nome dado a essas forças intermoleculares é van der Waals. Estas forças têm um papel chave na determinação Propriedades físicas de um gás, tal como viscosidade e taxa (ver secção características físico) fluir. Ignorando essas forças em determinadas condições (ver Teoria cinético-molecular) permite que um gás real a ser tratado como um gás ideal. Esta suposição permite o uso de leis dos gases ideais que simplifica cálculos.
O uso adequado dessas relações de gás exige a Teoria cinético-molecular (KMT). Quando as partículas possuem uma carga de gás ou magnético Força intermolecular que, gradualmente, se influenciam mutuamente, como o espaçamento entre eles é reduzida (o modelo de ligação de hidrogénio ilustra um exemplo). Na ausência de qualquer carga, em algum ponto, quando o espaçamento entre as partículas de gás é grandemente reduzido já não podem evitar as colisões entre si a temperaturas de gás normais. Outro caso de aumento colisões entre as partículas de gás que incluem um volume fixo de gás, o qual após aquecimento iria conter partículas muito rápidas. Isto significa que estas equações ideais de resultados razoáveis excepto para alta temperatura (ionizado) condições de pressão extremamente elevada (compressível) ou. Observe que todas estas condições isentos permitir a transferência de energia para ocorrer dentro do sistema de gás. A ausência destas transferências internos é o que é referido como condições ideais em que a troca de energia ocorre apenas nos limites do sistema. Gases reais experimentar algumas dessas colisões e forças intermoleculares. Quando estas colisões são estatisticamente insignificantes (incompressíveis), os resultados destas equações ideais são ainda significativos. Se as partículas de gás são comprimidas em estreita proximidade eles comportam-se mais como um líquido (ver dinâmica de fluidos).
Modelos simplificados
Uma equação de estado (para gases) é um modelo matemático usado para descrever mais ou menos ou prever as propriedades de estado de um gás. Actualmente, não existe uma única equação de estado que é capaz de predizer as propriedades de todos os gases sob todas as condições. Portanto, uma série de equações muito mais precisos de estado foram desenvolvidos para os gases em intervalos de temperatura e pressão específicas. Os "modelos a gás", que são mais amplamente discutidos são "gás perfeito", "gás ideal" e "gás real". Cada um destes modelos tem o seu próprio conjunto de pressupostos para facilitar a análise de um dado sistema termodinâmico. Cada modelo sucessivo expande a gama de temperaturas de cobertura a que se aplica.
Modelos de gás ideal e perfeito
O equação de estado para um gás ideal ou perfeito é o Lei de gás ideal e lê
onde P é a pressão, V é o volume, n é o volume de gás (em unidades molares), R é a constante universal dos gases perfeitos, 8,314 J / (K mol), e T é a temperatura. Escrito desta forma, às vezes é chamado de "versão do químico", uma vez que enfatiza o número de moléculas n. Ele também pode ser escrita como
onde 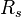 é a constante dos gases específico para um gás particular, em unidades de J / (K kg), e ρ = m / V é a densidade. Esta notação é a versão do "dynamicist gás", o que é mais prático na modelagem dos fluxos de gás envolvendo aceleração sem reações químicas.
é a constante dos gases específico para um gás particular, em unidades de J / (K kg), e ρ = m / V é a densidade. Esta notação é a versão do "dynamicist gás", o que é mais prático na modelagem dos fluxos de gás envolvendo aceleração sem reações químicas.
A lei do gás ideal não faz uma suposição sobre o calor específico de um gás. No caso mais geral, o calor específico é uma função da temperatura e pressão. Se a pressão de dependência é negligenciado (e, possivelmente, a temperatura dependência bem) numa aplicação particular, por vezes, o gás é dito ser um gases perfeitos, embora os pressupostos exactas podem variar dependendo do autor e / ou campo da ciência.
Para um gás ideal, a lei do gás ideal é aplicável sem restrições sobre o calor específico. Um gás ideal é um simplificado "gás real" com a suposição de que o factor de compressibilidade Z é definido como um significado que este rácio pneumático permanece constante. Um fator de compressibilidade de um também requer as quatro variáveis de estado a seguir o lei do gás ideal.
Esta aproximação é mais apropriada para aplicações em engenharia embora os modelos mais simples pode ser usado para produzir uma "bola-parque" gama quanto ao local onde a verdadeira solução deve situar-se. Um exemplo em que a "aproximação do gás ideal" seria adequado seria dentro de uma câmara de combustão de um motor a jacto . Também pode ser útil para manter as reacções químicas elementares e dissociações de cálculo emissões.
Gás real

Cada um dos pressupostos listados abaixo aumenta a complexidade da solução do problema. À medida que a densidade de um gás aumenta com o aumento da pressão, as forças intermoleculares desempenhar um papel mais importante no comportamento do gás que resulta na lei dos gases ideais já não fornece resultados "razoáveis". Na extremidade superior das gamas de temperatura do motor (por exemplo, secções de combustores - 1300 K), as partículas de combustível complexos absorver energia interna por meio de rotações e vibrações que provocam seus calores específicos para diferentes dos das moléculas diatómicas e gases nobres. Em mais do que o dobro da temperatura, excitação electrónica e dissociação das partículas de gás começa a ocorrer fazendo com que a pressão a ajustar-se um maior número de partículas (transição de gás de plasma ). Finalmente, foram presumidos todos os processos termodinâmicos para descrever os gases uniformes, cujas velocidades variadas de acordo com uma distribuição fixa. Usando uma situação de não equilíbrio implica o campo de fluxo deve ser caracterizado de alguma maneira para permitir que uma solução. Uma das primeiras tentativas de expandir os limites da lei do gás ideal era para incluir a cobertura para diferentes processos termodinâmicos, ajustando a equação para ler pV = n constante e, em seguida, variar a N por meio de valores diferentes, como o rácio de calor específico, γ.
Efeitos de gases reais incluem os ajustes feitos para contabilizar uma gama maior de comportamento de gás:
- Efeitos de compressibilidade (Z permitido variar de 1,0)
- Variável capacidade de calor (calores específicos variam com a temperatura)
- Van der Waals (relacionados com a compressão, pode substituir outras equações de estado)
- Não-equilíbrio efeitos termodinâmicos
- Problemas com molecular e dissociação reações elementares com composição variável.
Para a maioria das aplicações, uma análise tão detalhada é excessivo. Exemplos onde "efeitos gás real" teria um impacto significativo seria no Nave Espacial reentrada onde extremamente altas temperaturas e pressões estão presentes ou os gases produzidos durante os eventos geológicos como na imagem da erupção de 1990 Mount Redoubt.
Síntese histórica
A lei de Boyle

A lei de Boyle foi talvez a primeira expressão de uma equação de estado. Em 1662, Robert Boyle realizada uma série de experiências que utilizam um tubo de vidro em forma de J, que foi selado numa das extremidades. Mercúrio foram adicionados ao tubo, prendendo uma quantidade fixa de ar na extremidade curta, selada do tubo. Em seguida, o volume de gás foi cuidadosamente medido como mercúrio adicional foi adicionado ao tubo. A pressão do gás pode ser determinado pela diferença entre o nível de mercúrio na extremidade curta do tubo e que na extremidade longa e aberta. A imagem de Equipamentos de Boyle mostra algumas das ferramentas exóticas usadas por Boyle durante seu estudo de gases.
Através destas experiências, Boyle notar-se que a pressão exercida por um gás mantido a uma temperatura constante varia inversamente com o volume do gás. Por exemplo, se o volume é reduzido para metade, a pressão é dobrada; e se o volume é duplicado, a pressão é reduzida para metade. Dada a relação inversa entre a pressão e o volume, o produto da pressão (P) e o volume (V) é uma constante (k) para uma dada massa de gás confinado, desde que a temperatura seja constante. Dito de uma fórmula, assim é:
Porque o antes e depois de volumes e pressões da quantidade fixa de gás, onde as temperaturas antes e depois do mesmo são ambos iguais a constante k, podem ser relacionados pela equação:
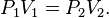
A lei de Charles
Em 1787, o físico francês e pioneiro do balão, Jacques Charles, encontrou que o oxigénio, azoto, hidrogénio, dióxido de carbono, ar e expanda na mesma extensão ao longo do mesmo intervalo de 80 Kelvin. Ele observou que, para um gás ideal, a pressão constante, o volume é directamente proporcional à sua temperatura:
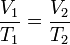
Lei de Gay-Lussac
Em 1802, Joseph Louis Gay-Lussac publicou os resultados de experimentos, embora mais extensa semelhantes. Gay-Lussac creditado trabalho anterior de Charle nomeando a lei em sua honra. O próprio Gay-Lussac é creditado com a pressão descrevendo lei, que ele encontrou em 1809. Ele afirma que a pressão exercida sobre os lados de um recipiente com um gás ideal é proporcional à sua temperatura.
A lei de Avogadro
Em 1811, verificou-se que Amedeo Avogadro volumes iguais de gases puros contêm o mesmo número de partículas. Sua teoria não era geralmente aceite até 1858, quando um outro químico italiano Stanislao Cannizzaro foi capaz de explicar as exceções não-ideais. Por seu trabalho com os gases de um século antes, o número que leva seu nome constante de Avogadro representa o número de átomos encontrados em 12 gramas de carbono elementar-12 (6,022 × 10 23 mol -1). Este número específico de partículas do gás, em condições normais de temperatura e pressão (lei dos gases ideais) ocupa 22,40 litros, que é referido como o volume molar.
A lei de Avogadro afirma que o volume ocupado por um gás ideal é proporcional ao número de (moles) ou moléculas presentes no recipiente. Isto dá origem à volume molar de um gás, que na STP é de 22,4 dm 3 (ou litros). A relação é dada pela
onde n é igual ao número de moles de gás (o número de moléculas dividido pelo número de Avogadro ).
A lei de Dalton

Em 1801, John Dalton publicada a Lei de pressões parciais do seu trabalho com relação lei dos gases ideais: A pressão de uma mistura de gases é igual à soma das pressões de todos os gases constituintes por si só. Matematicamente, isto pode ser representado por n espécies como:
Pressão de pressão total = 1 + 2 + Pressão ... + Pressão n
A imagem do diário de Dalton descreve simbologia ele usado como abreviação para gravar o caminho que ele seguiu. Entre suas observações de diário principais Após a mistura não reactivos "fluidos elásticos" (gases) foram os seguintes:
- Ao contrário de líquidos, gases mais pesados não deriva para o fundo, desde a mistura.
- Identidade de partículas de gás não desempenhou nenhum papel na determinação da pressão final (eles se comportavam como se seu tamanho era insignificante).
Tópicos especiais
Compressibilidade

Termodinamicistas utilizar este factor (Z) para alterar a equação de gás ideal para ter em conta os efeitos de compressibilidade dos gases reais. Este factor representa a relação de real para volumes específicos ideais. É por vezes referido como um "fudge factor" ou correção para expandir a gama útil da lei do gás ideal para fins de projeto. Normalmente esse valor Z é muito próximo da unidade. A imagem ilustra como factor de compressibilidade z varia ao longo de uma gama de temperaturas muito frias.
Número de Reynolds
Em mecânica dos fluidos, o número de Reynolds é a relação de forças inerciais (v s ρ) para forças viscosas (μ / L). É um dos números sem dimensão mais importantes na dinâmica dos fluidos e é usado, em geral, juntamente com outros números sem dimensão, para proporcionar um critério para determinar semelhança dinâmica. Como tal, o número de Reynolds fornece a ligação entre os resultados da modelagem (design) e as condições reais de grande escala. Ele também pode ser usado para caracterizar o fluxo.
Viscosidade

Viscosidade, uma propriedade física, é uma medida de quão bem moléculas adjacentes colados um ao outro. Um sólido pode resistir a uma força de corte, devido à força de estas forças intermoleculares pegajosas. Um fluido irá deformar-se de forma contínua quando sujeito a uma carga semelhante. Enquanto um gás tem um valor de viscosidade inferior do que um líquido, que é ainda uma propriedade observável. Se os gases não tinha viscosidade, então eles não aderir à superfície de uma asa e formar uma camada de fronteira. Um estudo da asa delta no Schlieren imagem revela que as partículas de gás ater a um outro (ver secção camada limite).
Turbulência

Na dinâmica de fluidos, turbulência ou fluxo turbulento é um regime de fluxo caracterizada por caóticos, alterações de propriedade estocásticos. Isso inclui baixa difusão impulso, de alta convecção momentum, e variação rápida de pressão e velocidade no espaço e no tempo. O Vista satélite de tempo em torno de Robinson Crusoe Ilhas ilustra apenas um exemplo.
Camada limite
As partículas serão, com efeito, "pau" para a superfície de um objecto em movimento através dela. Esta camada de partículas é chamada a camada de fronteira. Na superfície do objecto, que é essencialmente estática devida ao atrito da superfície. O objecto, com a sua camada limite é eficazmente a nova forma do objecto que o restante das moléculas de "ver" enquanto as abordagens de objectos. Esta camada limite pode separar a partir da superfície, essencialmente, criar uma nova superfície e mudar completamente o trajecto do fluxo. O exemplo clássico é uma protelando aerofólio. A imagem mostra claramente asa delta a camada limite espessamento como o gás flui da direita para a esquerda ao longo do bordo de ataque.
Princípio de entropia máxima
À medida que o número total dos graus de liberdade se aproxima do infinito, o sistema vai ser encontrado no macroestado que corresponde ao maior multiplicidade. A fim de ilustrar este princípio, observar a temperatura da pele de uma barra de metal congelado. Usando uma imagem térmica da temperatura da pele, observar a distribuição de temperatura sobre a superfície. Esta observação inicial de temperatura representa um " microstate. "Em algum tempo futuro, uma segunda observação da temperatura da pele produz uma segunda microstate. Ao continuar este processo de observação, é possível produzir uma série de micro que ilustram a história térmica da superfície da barra. Caracterização desta série histórica de microestados é possível, escolhendo o macroestado que classifica todos eles com sucesso em um único agrupamento.
Equilíbrio termodinâmico
Quando a transferência de energia cessa a partir de um sistema, esta condição é referida como equilíbrio termodinâmico. Normalmente, esta condição implica o sistema e ambiente estão à mesma temperatura de modo a que não mais transferências de calor entre eles. Implica também que forças externas estão equilibradas (volume não muda), e todas as reações químicas dentro do sistema estão completas. A linha de tempo varia para estes eventos, dependendo do sistema em questão. Um recipiente de gelo deixou-se fundir à temperatura ambiente leva horas, enquanto em semicondutores a transferência de calor que ocorre na transição a partir de um dispositivo em estado desligado para poderia ser da ordem de alguns nanossegundos.