Estado de oxidação
Você sabia ...
Os artigos desta seleção Escolas foram organizados por tópico currículo graças a voluntários Crianças SOS. Veja http://www.soschildren.org/sponsor-a-child para saber mais sobre apadrinhamento de crianças.
O estado de oxidação é um indicador do grau de a oxidação de um átomo de um composto químico . O estado de oxidação formal é o hipotético carga que um átomo teria se todas as ligações a átomos de diferentes elementos eram 100% iónico. Estados de oxidação são tipicamente representados por números inteiros , que pode ser positivo, negativo ou zero. Em alguns casos, o estado de oxidação médio de um elemento é uma fracção, tal como 8/3 para o ferro em magnetita (Fe 3 O 4). O estado de oxidação mais alto conhecido é 8 nos tetroxides de ruténio, xenon, ósmio, irídio , e hassium , e alguns complexos envolvendo plutônio , enquanto o estado de oxidação mais baixo conhecido é -4 para alguns elementos do grupo de carbono.
O aumento no estado de oxidação de um átomo por meio de uma reacção química é conhecida como uma oxidação; uma diminuição no estado de oxidação é conhecida como um redução. Tais reações envolvem a transferência formal de elétrons, um ganho líquido em elétrons sendo uma redução e uma perda líquida de elétrons sendo uma oxidação. Para elementos puros, o estado de oxidação é igual a zero.
A definição do estado de oxidação oferecida pela IUPAC é como se segue:
O estado de oxidação: Uma medida do grau de oxidação de um átomo em uma substância. Ela é definida como a taxa de um átomo pode ser imaginado ter quando elétrons são contados de acordo com um acordado conjunto de regras:Por exemplo, os estados de oxidação de enxofre em H 2 S, S 8 (enxofre elementar), SO2, SO 3 e H 2 SO 4 são, respectivamente: -2, 0, 4, 6 e 6. Quanto maior for o estado de oxidação de um átomo dado o seu maior grau de oxidação; quanto menor for o estado de oxidação maior é o seu grau de redução.
- (1) o estado de oxidação de um elemento livre (elemento não combinada) é zero
- (2) para um (monoatômico) ião simples, o estado de oxidação é igual à carga líquida sobre o ião
- (3) hidrogénio tem um estado de oxidação de 1 e de oxigénio tem um estado de oxidação de -2 quando eles estão presentes na maioria dos compostos. (As exceções a esta são que o hidrogênio tem um estado de oxidação de -1 em hidretos de metais ativos, por exemplo, LiH , e oxigênio tem um estado de oxidação de -1 em peróxidos, por exemplo, H 2 O 2
- (4) a soma algébrica dos estados de oxidação de todos os átomos numa molécula neutra tem de ser igual a zero, enquanto que na iões a soma algébrica dos estados de oxidação dos átomos constituintes deve ser igual à carga do ião.
Algumas regras gerais para determinar estados de oxidação, sem uso de estruturas de Lewis
Aqui estão as regras gerais para compostos simples, sem fórmulas estruturais:
- Qualquer elemento puro (mesmo que forma moléculas diatômicas, como o cloro, Cl 2) tem um tate o xidation s (OS) de zero. Exemplos disto são Cu ou O2.
- Para íons monoatômicos, o sistema operacional é o mesmo que a carga do íon. Por exemplo, S 2 tem um sistema operacional de -2, enquanto Li + tem um sistema operacional de um.
- A soma de todos os átomos de SOs em uma molécula ou ião poliatômico é igual à carga da molécula ou ião, de modo que o sistema operacional de um elemento pode ser calculado a partir do sistema operacional dos outros elementos. Por exemplo, em 2- SO
3 ( ião sulfito), a carga total do ião é -2, e assume-se cada um deles oxigénio para ter o seu estado de oxidação de -2 habitual. A soma de SOs é, em seguida, SO (S) + 3 (-2) = SO (S) - -2 = 6, de modo que o OS (S) = 4.
Para resumir: A soma algébrica dos estados de oxidação de todos os átomos numa neutro molécula deve ser igual a zero, enquanto que na poliatômico iões a soma algébrica dos estados de oxidação dos átomos constituintes deve ser igual à carga do ião. Este facto, aliado ao facto de que alguns elementos têm quase sempre determinados estados de oxidação (devido à sua muito elevada electropositivity ou electronegatividade), permite calcular os estados de oxidação para os átomos restantes (tais como metais de transição) em compostos simples.
As seguintes regras que são usados para atribuir inicialmente estados de oxidação de certos elementos, em compostos simples:
- O flúor tem um estado de oxidação de -1 quando ligado a qualquer outro elemento, uma vez que tem a maior eletronegatividade de todos os elementos reativos.
- Os halogéneos diferentes de flúor tem um estado de oxidação de -1 excepto quando eles estão ligados ao oxigénio, azoto, ou outro (mais electronegativo) halogéneo. Por exemplo, o estado de oxidação do cloro em monofluoretado cloro (ClF) é uma. No entanto, em brometo de cloro (ou cloreto de bromo) (BrCl) o estado de oxidação de Cl é -1.
- Hydrogen tem uma estado de oxidação de 1, excepto quando ligado a elementos mais electropositivos, tais como sódio , alumínio e boro , tal como no NaH, NaBH 4, LiAlH 4 , onde cada um, H tem um estado de oxidação de -1.
- Em compostos, oxigênio normalmente tem um estado de oxidação de -2, embora haja exceções que estão listados abaixo . Um exemplo é peróxidos (por exemplo, peróxido de hidrogênio H 2 O 2), quando se tem um sistema operacional de -1.
- Metais alcalinos tem um estado de oxidação de +1 em praticamente todos os seus compostos (de exceção, ver alkalide).
- Metais alcalino-terrosos tem um estado de oxidação de +2, em praticamente todos os seus compostos.
Exemplo para um sal complexo: Em Cr (OH) 3, o oxigénio tem um estado de oxidação de -2 (sem flúor ou O-S ligações presentes), e possui um átomo de hidrogénio de um estado (ligado ao oxigénio). Assim, cada um dos três hidróxido grupos tem um estado de oxidação de -2 + 1 = -1. À medida que o composto é neutro, Cr tem um estado de oxidação de +3.
Para moléculas com átomos inequivalent do mesmo elemento, o método da soma algébrica fornece apenas um estado de oxidação médio. Vamos considerar abaixo como encontrar o estado de oxidação de cada átomo, com a ajuda de uma estrutura de Lewis.
Estado de oxidação e acusação formal
O estado de oxidação de um átomo é muitas vezes diferente do carga formal frequentemente incluído em estruturas de Lewis (quando for diferente de zero). O estado de oxidação é calculada assumindo que cada ligação química (excepto entre átomos idênticos) é iónico de modo que ambos os electrões são atribuídos ao átomo ligado mais electronegativo. Em contraste, a carga formal é calculada assumindo que cada um representa ligações covalentes de modo a que um electrão é atribuído a cada átomo ligado. Por exemplo, em ião amónio (NH4 +) o estado de oxidação do azoto é -3, como todos os oito electrões de valência são atribuídos ao átomo de azoto, o qual é mais electronegativo que não hidrogénio. No entanto, a acusação formal é um, calculado através da atribuição de apenas quatro elétrons de valência (um por ligação) para nitrogênio. Para comparação, o azoto em amoníaco (NH3) tem estado de oxidação -3 mas também uma carga formal de zero. Em protonação de amônia a acusação formal sobre mudanças de nitrogênio, mas seu estado de oxidação não.
Cálculo dos estados formais de oxidação com uma estrutura de Lewis
Existem duas formas comuns de calcular o estado de oxidação de um átomo de um composto. A primeira é a técnica da soma algébrica simples acima, utilizado em compostos que não necessitam de um Estrutura de Lewis. O segundo é usado para moléculas quando se tem um Estrutura de Lewis.
Deve ser lembrado que o estado de oxidação de um átomo não representa a carga "real" em que átomo: Isto é particularmente verdadeiro para estados de oxidação elevado, onde o energia de ionização necessária para produzir um ião positivo multiplicar são muito maiores do que as energias disponíveis em reacções químicas. A atribuição de electrões entre átomos no cálculo um estado de oxidação é puramente um formalismo, mas é um útil para o entendimento de muitas reacções químicas.
Para mais informações sobre problemas com o cálculo cargas atômicas, consulte carga parcial.
A estrutura de Lewis
Quando um Estrutura de Lewis de uma molécula está disponível, os estados de oxidação pode ser atribuído pelo cálculo da diferença entre o número de electrões de valência que um átomo de neutro que teria elemento e o número de electrões que "pertence" a ele na estrutura de Lewis. Para fins de cálculo estados de oxidação, elétrons em uma ligação entre os átomos de diferentes elementos pertencem ao mais átomo electronegativo; elétrons em uma ligação entre os átomos de um mesmo elemento são divididos igualmente, e os elétrons em um par solitário pertencer apenas ao átomo com o par solitário.
Por exemplo, considere ácido acético :
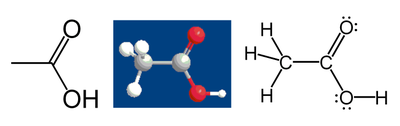
O metil átomo de carbono grupo tem seis elétrons de valência de seus títulos para os átomos de hidrogênio, porque carbono é mais eletronegativo que o hidrogênio. Além disso, um elétron é adquirida com a sua ligação com o outro átomo de carbono porque o par de elétrons na C-C vínculo é dividido em partes iguais, dando um total de 7 elétrons. Um átomo de carbono neutro teria quatro elétrons de valência, porque o carbono está em grupo 14 da tabela periódica. A diferença, 4-7 = -3, é o estado de oxidação do referido átomo de carbono. Isto é, se é assumido que todos os títulos eram 100% iónico (o que, de facto, eles não são), o carbono seriam descritos como C 3-.
A seguir as mesmas regras, o ácido carboxílico átomo de carbono tem um estado de oxidação de 3 (apenas deixa um electrão de valência a partir da ligação C-C, os átomos de oxigénio obter todos os outros electrões porque o oxigénio é mais electronegativo que o carbono). Os dois átomos de oxigénio tem um estado de oxidação de -2; eles ficam cada 8 elétrons (4 dos pares solitários e 4 dos laços), enquanto um átomo de oxigênio neutro teria 6. Os átomos de hidrogênio têm estado de oxidação +1, porque eles entregar sua elétron para os átomos mais eletronegativos a que estão ligados.
Inequivalent átomos de um elemento
Um exemplo de uma molécula com átomos inequivalent de um mesmo elemento é a de iões tiossulfato (S 2 O 3 2-), para que a regra soma algébrica produz o valor médio para dois de enxofre, onde os dois electrões ionizantes são atribuídos ao átomo de enxofre do terminal. No entanto, a utilização de uma estrutura de electrões e contagem de Lewis mostra que os dois átomos de enxofre são diferentes. O enxofre central é atribuído um único electrão de valência a partir da ligação de SS e não há electrões de valência dos assim ligações, em comparação com seis electrões de valência de um átomo de enxofre livre, de modo que o estado de oxidação do enxofre central é 5. O átomo de enxofre terminal é atribuído o outro elétron do vínculo SS além de três pares de elétrons para um total de sete elétrons de valência, de modo que seu estado de oxidação é -1.
Reações redox
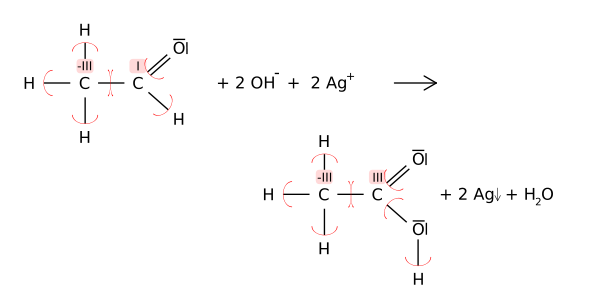
Estados de oxidação pode ser útil para o balanceamento de equações químicas de oxidação-redução (ou redox) reações, porque as mudanças nos átomos oxidados têm de ser equilibradas com as mudanças nos átomos reduzidos. Por exemplo, na reacção de acetaldeído com o Reagente de Tollens 'de ácido acético (mostrado abaixo), o átomo de carbono do carbonilo muda o seu estado de oxidação de 1-3 (oxidação). Esta oxidação é equilibrada através da redução de dois equivalentes de prata de Ag + Ag a 0.
Nesses diagramas estruturais para a química orgânica, estados de oxidação são representados por algarismos romanos para distingui-los acusações formais (calculados com toda ligações covalentes).
Elementos com vários estados de oxidação
A maioria dos elementos tem mais de um possível estado de oxidação. O carbono tem nove estados de oxidação número inteiro, e há também as moléculas em que o grau médio de oxidação de vários átomos de carbono é fraccionada.
Estados de oxidação inteiros de carbono com exemplos
- -4: CH 4
- -3: C 2 H 6
- -2: CH3 Cl
- -1: C 2 H 2
- 0: CH 2 Cl 2
- 1: CHCl 2 - CHCl2
- 2: CHCl3
- 3: C 2 Cl 6
- 4: CCl4
Exemplos de estados de oxidação fracionários para o carbono
- - (6/5): C 5 H 5 -
- - (6/7): C 7 H 7 +
- - (5/4): C 8 H 8 2-
O oxigênio tem 8 estados de oxidação diferentes
- -2 Em óxidos, por exemplo, ZnO, CO2 , H2O
- -1 Em peróxidos, por exemplo, H 2 O 2
- - (1/2) em superóxidos, por exemplo, KO2
- - (1/3) em inorgânico ozonídeos, por exemplo, RBO 3
- 0 em O 2
- + (1/2) em dioxygenyl, por exemplo dioxygenyl hexafluoroarsenate O2 + [AsF 6] -
- +1 Em O 2 F 2
- 2 em DE 2
Note-se que, uma vez que flúor é mais electronegativo que o oxigénio, O 2 F 2 e DE 2 fluoretos são considerados, em vez de, respectivamente, um peróxido e um óxido.
Estados de oxidação fracionários
Estados de oxidação fraccionários são muitas vezes utilizados para representar os estados médios de oxidação de vários átomos numa estrutura. Por exemplo, em KO 2, o ião superóxido tem uma carga de -1 dividida entre dois átomos de equivalentes, de modo que cada um deles oxigénio é atribuído um estado de oxidação de -½, Este ião é descrito como um ressonância híbrido de duas estruturas de Lewis, e cada um deles oxigénio tem estado de oxidação 0, em uma estrutura -1 e no outro.
Para o ião ciclopentadienilo C 5 H 5 -, o estado de oxidação do C é (-1) + (-1/5) = -6/5. O -1 ocorre porque cada C está ligado a um H menos electronegativo, e a -1/5 porque a carga iónica total é dividido entre cinco C. equivalente
Se a média refere-se a átomos que não são equivalentes, o estado de oxidação média pode não ser representativa de cada um dos átomos. Isto é verdade em magnetita Fe 3 O 4, cuja fórmula leva a um estado de oxidação de +8/3 média. De facto, dois terços dos iões de ferro são Fe3 +, e um terço de Fe 2+.
Da mesma forma, o ozonide ion O 3 - tem um estado de oxidação médio de -1/3. Este ião é oxigénio com uma central, que não é equivalente aos outros dois e não pode ser assumido como tendo o mesmo estado de oxidação em forma de V.
O número de oxidação
O estado de oxidação termos e número de oxidação são freqüentemente usados alternadamente. No entanto, número de oxidação é usado no química de coordenação com um significado ligeiramente diferente. Em química de coordenação, as regras utilizadas para a contagem de elétrons são diferentes: cada elétron em uma ligação metal-ligante pertence à ligando, independentemente da electronegatividade. Além disso, números de oxidação são convencionalmente representados com números romanos, enquanto os estados de oxidação usar numerais indo-arábicos.
História
O conceito atual de "estado de oxidação" foi introduzido por WM Latimer em 1938. A oxidação em si foi estudado pela primeira vez por Antoine Lavoisier , que acreditava que a oxidação foi sempre o resultado de reações com oxigênio , daí o nome. Embora a idéia de Lavoisier demonstrou estar incorreta, o nome que ele propôs ainda é utilizado, ainda que de forma mais geral.
Estados de oxidação foram um dos intelectuais "degraus" Mendeleev utilizado para elaborar a tabela periódica moderna.
Incomuns estados formais de oxidação
Estados formais de oxidação de metais não usuais são importantes em processos bioquímicos, os quais se destacam o Fe (IV) e Fe (V) em Citocromo P450 sistemas -contendo.