
Boro
Você sabia ...
Os artigos desta seleção Escolas foram organizados por tópico currículo graças a voluntários Crianças SOS. Clique aqui para saber mais sobre apadrinhamento de crianças.
| Boro | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
5 B | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||
marrom-preto  | |||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||
| Nome, símbolo, número | boro, B, 5 | ||||||||||||||||||||||||
| Pronúncia | / b ɔər ɒ n / | ||||||||||||||||||||||||
| Categoria Metallic | metalóide | ||||||||||||||||||||||||
| Grupo, período, bloco | 13, 2, p | ||||||||||||||||||||||||
| Peso atômico padrão | 10,81 (1) | ||||||||||||||||||||||||
| Configuração eletrônica | [Ele] 2s 2p 2 1 2, 3 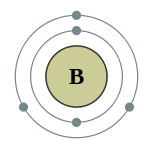 | ||||||||||||||||||||||||
| História | |||||||||||||||||||||||||
| Descoberta | Joseph Louis Gay-Lussac e Louis Jacques Thénard (30 de junho de 1808) | ||||||||||||||||||||||||
| Primeiro isolamento | Humphry Davy (09 de julho de 1808) | ||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||
| Líquido densidade no pf | 2,08 g cm -3 · | ||||||||||||||||||||||||
| Ponto de fusão | 2349 K , 2076 ° C, 3769 ° F | ||||||||||||||||||||||||
| Ponto de ebulição | 4200 K, 3927 ° C, 7101 ° F | ||||||||||||||||||||||||
| Calor de fusão | 50,2 kJ mol -1 · | ||||||||||||||||||||||||
| Calor de vaporização | 480 kJ mol -1 · | ||||||||||||||||||||||||
| Capacidade calorífica molar | 11,087 J · · mol -1 K -1 | ||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||
| Estados de oxidação | 3, 2, 1 (Moderadamente ácida óxido) | ||||||||||||||||||||||||
| Eletronegatividade | 2,04 (escala de Pauling) | ||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 800,6 kJ · mol -1 | ||||||||||||||||||||||||
| 2: 2427,1 kJ · mol -1 | |||||||||||||||||||||||||
| 3: 3659,7 kJ · mol -1 | |||||||||||||||||||||||||
| Raio atômico | 90 pm | ||||||||||||||||||||||||
| O raio de covalência | 84 ± 15:00 | ||||||||||||||||||||||||
| Van der Waals raio | 192 pm | ||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||
| A estrutura de cristal | rhombohedral 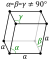 | ||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | ||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) de 10 ~ 6 m Ω · | ||||||||||||||||||||||||
| Condutividade térmica | 27,4 W · m -1 · K -1 | ||||||||||||||||||||||||
| Expansão térmica | (25 ° C) (forma β) 5-7 uM · · K -1 m -1 | ||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) de 16.200 m · s -1 | ||||||||||||||||||||||||
| Dureza de Mohs | ~ 9.5 | ||||||||||||||||||||||||
| Número de registo CAS | 7440-42-8 | ||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||
| Ver artigo principal: Isótopos de boro | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
O boro é um elemento químico com o símbolo químico B e número atômico 5. Porque boro é inteiramente produzido por spallation raios cósmicos e não por nucleossíntese estelar, é um elemento de baixa abundância, tanto no sistema solar e crosta da Terra. Boron está concentrada na Terra por a solubilidade em água de seus mais comuns compostos naturais, o minerais borato. Estes são extraídos como industrialmente evaporites, tal como e bórax kernite.
Quimicamente boro não combinada, que é classificado como um metalóide, não é encontrado naturalmente na Terra. Industrialmente, boro muito puro é produzido com dificuldade, como boro tende a formar materiais refractários que contêm pequenas quantidades de carbono ou outros elementos. Vários allotropes de boro existe: boro amorfo é um pó castanho e boro cristalino é preto, extremamente duro (cerca de 9,5 na escala de Mohs ), e um condutor pobre à temperatura ambiente. Boro elementar é usado como um dopante na indústria de semicondutores.
As principais utilizações à escala industrial de compostos de boro estão em branqueadores de perborato de sódio, bórax e o componente de isolamento de fibra de vidro. Polímeros de boro e cerâmicas desempenham funções especializadas como materiais estruturais e refractários leves de alta resistência. Os compostos de boro são utilizados nos vidros e cerâmicas à base de sílica para lhes dar resistência à choque térmico. Boro contendo Os reagentes são utilizados como intermediários para a em síntese de produtos químicos finos orgânicos. Alguns produtos farmacêuticos orgânicos contendo boro são utilizados, ou estão em estudo. Boro natural é constituído por dois isótopos estáveis, uma das quais ( boro-10) tem um número de utilizações como um agente de captura de neutrões.
Em biologia, boratos possuem baixa toxicidade em mamíferos (semelhantes ao sal de mesa), mas são mais tóxicos para os artrópodes e são utilizados como insecticidas. O ácido bórico é suavemente antimicrobiana, e um antibiótico orgânico contendo boro natural é conhecida. O boro é essencial à vida. Pequenas quantidades de compostos de boro desempenhar um papel reforço nas paredes celulares de todas as plantas, tornando necessário boro em solos. Experiências indicam um papel para o boro como um elemento ultratrace em animais, mas seu papel na fisiologia animal é desconhecida.
História e etimologia
O nome de boro origina do árabe palavra بورق buraq ou o Palavra persa بوره burah; que são nomes para o mineral bórax.

Compostos de boro eram conhecidos há milhares de anos. Bórax era conhecido desde os desertos do oeste do Tibet, onde recebeu o nome de tincal, derivado do sânscrito . Esmaltes bórax foram utilizados na China a partir de AD300, e alguns até mesmo tincal atingiu o Oeste, onde o alquimista persa Jābir ibn Hayyān parece mencioná-lo em 700. Marco Polo trouxe alguns esmaltes de volta para a Itália no século 13. Agricola, por volta de 1600, relata o uso de bórax como fundente em metalurgia . Em 1777, ácido bórico foi reconhecido nas fontes termais ( Soffioni) perto Florença, Itália, e ficou conhecido como sedativum sal, com usos principalmente médicos. O mineral raro é chamada sassolite, que é encontrado em Sasso, Itália. Sasso foi a principal fonte de bórax Europeia 1827-1872, em que fontes americanas data substituiu. Compostos de boro foram relativamente raramente utilizados produtos químicos até o final de 1800, quando Francis Marion Smith Pacific Coast Borax Empresa primeiro popularizou estes compostos e os fez em volume e, portanto, mais barato.
Boron não foi reconhecido como um elemento até que foi isolado por Sir Humphry Davy e por Joseph Louis Gay-Lussac e Louis Jacques Thénard. Em 1808 Davy observado que a corrente eléctrica enviada por meio de uma solução de borato produzido um precipitado castanho em um dos eléctrodos. Em seus experimentos subsequentes ele usou potássio para reduzir o ácido bórico, em vez de electrólise . Ele produziu boro suficiente para confirmar um novo elemento e nomeou o boracium elemento. Gay-Lussac e Thénard usado ferro para reduzir o ácido bórico em altas temperaturas. Eles mostraram por oxidação de boro com o ar que o ácido bórico é um produto de oxidação de boro. Jöns Jakob Berzelius identificado boro como um elemento em 1824. boro Pure foi, sem dúvida, produzido pela primeira vez pelo químico americano Ezequiel Weintraub em 1909.
Características
Allotropes

O boro é semelhante ao carbono na sua capacidade para formar estável covalentemente ligados redes moleculares. Mesmo nominalmente desordenado ( amorfo) boro contém boro regulares icosahedra os quais são, no entanto, ligado de forma aleatória uns com os outros, sem ordem de longo alcance. Boro cristalino é muito difícil, material preto com um ponto de fusão elevado acima de 2000 ° C. Ela existe em quatro grandes polimorfos: α, β, γ e T. Considerando α, β fases e T são baseados em 12 icosahedra B, a fase γ pode ser descrito como um sal gema arranjo do tipo do icosaedro e B dois pares atómicas. Pode ser produzido por compressão de outras fases de boro para 12-20 GPa e aquecimento a 1500-1800 ° C; ele permanece estável após a liberação do temperatura e pressão. A fase T é produzida com pressões semelhantes, mas as temperaturas mais elevadas de 1800-2200 ° C. Como para as fases α e β, eles podem coexistir em ambos condições ambientais com a fase β sendo mais estável. A compactação de boro acima de 160 GPa produz uma fase de boro com uma estrutura ainda desconhecida, e esta fase é um supercondutor a temperaturas 12/06 K.
| Fase Boron | α | β | γ | T |
|---|---|---|---|---|
| Simetria | Romboédrico | Romboédrico | Orthorhombic | Tetragonal |
| Átomos / célula unitária | 12 | ~ 105 | 28 | |
| Densidade (g / cm 3) | 2.46 | 2.35 | 2.52 | 2.36 |
| Dureza Vickers (ACP) | 42 | 45 | 50-58 | |
| Massa de módulo (ACP) | 185 | 224 | 227 | |
| Bandgap (eV) | 2 | 1.6 | 2.1 |
Química do elemento
Boro elementar é rara e pouco estudada, porque o material é extremamente difícil de preparar. A maioria dos estudos sobre "boro" envolvem amostras que contêm pequenas quantidades de carbono. Quimicamente, o boro se comporta mais semelhante ao silício do que a de alumínio . Boro cristalino é quimicamente inerte e resistente ao ataque por fervura fluorídrico ou ácido clorídrico . Quando finamente dividido, ele é atacado lentamente quente concentrada de peróxido de hidrogénio , quente concentrada ácido nítrico , quente ácido sulfúrico ou mistura quente de ácido sulfúrico e ácidos crômico.
A taxa de oxidação de boro depende da cristalinidade, tamanho de partícula, e pureza temperatura. O boro não reagem com o ar à temperatura ambiente, mas a temperaturas mais elevadas se queima para formar boro trióxido:
- 4 B + 3 O 2 → 2 B 2 O 3
O boro é submetido a halogenação para dar tri-halogenetos, por exemplo,
- 2 B + 3 Br 2 → 2 BBr3
O tricloreto de, na prática, é normalmente feito a partir do óxido.
Os compostos químicos

Em seus compostos mais familiares, boro tem o estado de oxidação formal III. Estes incluem óxidos, sulfetos, nitretos, e halogenetos.
Os trialogenetos adotar uma estrutura trigonal planar. Estes compostos são Ácidos de Lewis em que eles formam facilmente adutos com doadores de elétron-par, que são chamados Bases de Lewis. Por exemplo, fluoreto (F -) e trifluoreto de boro (BF3) combinados para se obter o anião tetrafluoroborato, BF 4 -. Trifluoreto de boro é usado na indústria petroquímica como um catalisador. Os halogenetos de reagir com a água para formar ácido bórico.
O boro é encontrada na natureza na Terra inteiramente como vários óxidos de B (III), muitas vezes associada com outros elementos. A mais de cem boratos tudo boro recurso no estado de oxidação +3. Estas assemelham-se silicatos minerais em alguns aspectos, embora boro é frequentemente encontrada não só em coordenação tetraédrica com o oxigénio, mas também em uma configuração planar trigonal. Ao contrário de silicatos, os minerais de boro não dispõem de boro com número de coordenação maior do que quatro. Um motivo típico é exemplificado pelos aniões tetraborato do mineral comum bórax, mostrada à esquerda. A carga negativa formal dos centros tetraédricos borato é equilibrada por catiões de metal em minerais, tais como o sódio (Na +) de bórax.
O nitretos de boro são notáveis para a variedade de estruturas que venham a adoptar. Eles adotam estruturas análogas a vários alótropos do carbono , incluindo grafite, diamante, e nanotubos. No nitreto de boro cúbico diamond-like estrutura chamada (nome comercial Borazon), átomos de boro existirem na estrutura de átomos de carbono tetraédrico em diamante, mas um em cada quatro ligações BN pode ser visto como um coordenar ligação covalente, em que dois electrões são doados pelo átomo de azoto, o qual actua como o Lewis base para uma ligação à Lewis boro ácido (III) centro. Nitreto de boro cúbico, entre outras aplicações, é usado como um abrasivo, uma vez que tem uma dureza comparável com diamante (as duas substâncias são capazes de provocar riscos em si). No composto análogo de BN de grafite, o nitreto de boro hexagonal (H-BN), o boro carregada positivamente e átomos de azoto carregados negativamente em cada plano de ficar adjacente ao átomo de carga oposta no plano seguinte. Consequentemente grafite e h-BN têm propriedades muito diferentes, embora ambos sejam lubrificantes, como estes planos deslizar passado uns aos outros com facilidade. No entanto, h-BN é um condutor elétrico e térmico relativamente pobre nas direções planas.
Organoboro química
Um grande número de compostos de organoboro são conhecidos e muitos deles são úteis no síntese orgânica. Organoboro compostos (III) são geralmente planar tetraédrica ou trigonal, por exemplo, tetrafenilborato (B (C 6 H 5) 4 -) vs trifenilborano (B (C 6 H 5) 3). Muitos são produzidos a partir de hidroboração, que emprega diborano (B 2 H 6).
Os compostos de B (i) e B (II)
Embora estes não são encontrados naturalmente na Terra, boro forma uma grande variedade de compostos estáveis com o estado de oxidação formal inferior a três. Como para muitos compostos covalentes, estados formais de oxidação são muitas vezes de pouco significado em hidretos de boro e boretos de um metal. Os halogenetos também formar derivados de B (i) e B (ii). BF, isoeletrônica com N 2, não é isolável de forma condensada, mas B 2 e B F 4 4 4 Cl estão bem caracterizados.

Compostos binários de metal-boro, os boretos de metal, recurso de boro no estado de oxidação inferior a III. É ilustrativa diboreto de magnésio (MgB 2). Cada átomo de boro tem uma carga -1 formal e magnésio é atribuída uma carga formal de 2+. Neste material, os centros de boro são planar trigonal, com uma dupla ligação extra para cada boro, com os átomos de boro formando folhas semelhante ao carbono em grafite. No entanto, ao contrário do caso com o nitreto de boro hexagonal, que por comparação carece de electrões no plano dos átomos covalentes, os electrões deslocalizados no plano de diboreto de magnésio permitir a conduzir electricidade semelhante à grafite isoeletrônica. Além disso, em 2001, este material foi encontrado para ser um de alta temperatura supercondutor .
Alguns outros boretos metálicos encontrar aplicações especializadas como materiais duros para ferramentas de corte.
Do ponto de vista estrutural, os compostos químicos mais distintivas de boro são os hidretos. Incluídos nesta série são os compostos de fragmentação dodecaborate (B 12 H 12 2-), decaborano (10 H 14 B), e o carboranos tais como C 2 B 10 H 12. Caracteristicamente tais compostos possuem números de coordenação de boro com maiores do que quatro.
Isótopos
Boro tem duas que ocorrem naturalmente e estáveis isótopos , 11 B (80,1%) e 10 B (19,9%). A diferença de massa resulta numa vasta gama de valores δ 11 B, que são definidos como a diferença entre o fraccionada 11 B e 10 B e tradicionalmente expressas em partes por mil, em águas naturais que variam de -16 a 59. Existem 13 isótopos conhecidos de boro, o isótopo de vida mais curta é de 7 B que decai através emissão de prótons e decaimento alfa. Tem uma meia-vida de 3,5 x 10 -22 s. Fraccionamento isotópica de boro é controlado pelas reacções de permuta da espécie de boro B ( O H ) 3 e [B (OH) 4] -. Isótopos de boro também são fraccionados durante a cristalização mineral, durante H2O mudanças de fase sistemas hidrotérmicos, e durante a alteração hidrotermal de rocha . O efeito último resulta na remoção preferencial de 10 a B (OH) 4 ião em argilas. Isso resulta em soluções enriquecidas em 11 B (OH) 3 e, portanto, pode ser responsável por um grande enriquecimento de 11 B em relação à água do mar, tanto oceânica crosta e continental crosta; esta diferença pode actuar como um assinatura isotópica. O exótico 17 B apresenta um auréola nuclear, ou seja, o seu raio é sensivelmente maior do que o previsto pela modelo da gota de líquido.
O isótopo 10 B é bom em capturar neutrões térmicos. Natural de boro é de cerca de 20% 10 B e 80% 11 B. A indústria nuclear enriquece boro natural para quase puro 10 B. A menos valioso subproduto, boro esgotados, é quase puro 11 B.
Enriquecimento isotópico comercial
Por causa de sua seção transversal alta de nêutrons, boro-10 é muitas vezes usado para controlar a fissão em reatores nucleares como uma substância de captura de nêutrons. Vários processos de enriquecimento à escala industrial têm sido desenvolvidos, no entanto, apenas a destilação fraccionada sob vácuo do dimetil éter de aducto trifluoreto de boro (BF3-DME) e cromatografia de coluna boratos estão a ser utilizados.
Boro enriquecido (boro-10)
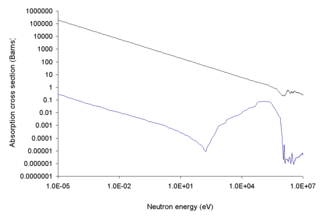
Boro enriquecido ou 10 B é usado em ambos proteção contra radiações e é o nuclide primária utilizada na terapia por captura de neutrões de câncer. Neste último ("terapia de captura de neutrões de boro" ou BNCT), um composto contendo 10 B está incorporado em um produto farmacêutico o qual é levado selectivamente por um tumor maligno e tecidos perto dele. O paciente é então tratado com um feixe de neutrões térmicos quer, ou então neutrões de baixa energia, a uma dose de radiação de neutrões relativamente baixos. Os nêutrons, no entanto, provocar energético e curto alcance secundário partícula alfa e 7-lítio radiação iões pesados que são produtos de boro + neutrão reacção nuclear e esta radiação ião adicionalmente bombardeia o tumor, especialmente a partir de dentro das células tumorais.
Em reatores nucleares, 10 B é usado para controle de reatividade e em sistemas de paragem de emergência. Ela pode servir ambas as funções sob a forma de borosilicato hastes de controle ou como ácido bórico. Em reatores de água pressurizada, ácido bórico é adicionado à refrigeração do reator quando a planta é desligado para reabastecimento. Ele é, em seguida, filtrou-se lentamente ao longo de muitos meses, material físsil é usado para cima e que o combustível se torna menos reativa.
No futuro naves interplanetárias tripuladas, 10 B tem um papel teórico como material estrutural (como fibras de boro ou BN material de nanotubos), que serviria também um papel especial na proteção contra radiação. Uma das dificuldades em lidar com raios cósmicos, que são na sua maioria prótons de alta energia, é que alguns radiação secundária a partir da interação de raios cósmicos e materiais nave espacial é de alta energia nêutrons espalação. Esses nêutrons podem ser moderadas por materiais de alta em elementos leves, como polietileno, mas os nêutrons moderados continuar a ser um perigo de radiação a menos ativamente absorvido na blindagem. Entre elementos leves que absorvem nêutrons térmicos, 6 Li e 10 B aparecem nave espacial estrutural materiais como potenciais que servem tanto para reforço mecânico e protecção contra radiações.
Boro empobrecido (boro-11)
A radiação cósmica irá produzir nêutrons secundários se bate estruturas de naves espaciais. Estes neutrões serão capturados no 10 B, se este estiver presente na nave espacial semicondutores , um produzindo Gamma Ray, um partícula alfa e um lítio íon. Estes produtos de decaimento resultantes podem, em seguida, irradiar semicondutores estruturas vizinhas "chip", causando perda de dados (flipping pouco, ou evento único chateado). Em reforçados contra radiações projetos de semicondutores, uma contramedida é usar boro empobrecido que é grandemente enriquecido em 11 B e contém quase nenhum 10 11 B. B é em grande parte imune a danos da radiação. Boro empobrecido é um subproduto da indústria nuclear .
11 B é igualmente um candidato como um combustível para a fusão não neutrónicos. Quando atingido por um próton com energia de cerca de 500 k eV, que produz três partículas alfa e 8,7 MeV de energia. A maioria das outras reacções de fusão envolvendo hidrogênio e hélio produzem radiação penetrante de nêutrons, o que enfraquece as estruturas do reactor e induz radioatividade longo prazo pondo assim em perigo o pessoal de operação. Considerando que, a partículas alfa de 11 B de fusão pode ser transformado diretamente em energia elétrica, e toda a radiação pára assim que o reator é desligado.
Espectroscopia de RMN
Ambos 10 B e 11 B possuem spin nuclear. O spin nuclear de 10 de B é de 3 e de 11 B é 3/2. Estes isótopos são, por conseguinte, de utilização em espectroscopia de ressonância magnética nuclear; e espectrómetros especialmente adaptado para detectar os boro-11 núcleos estão disponíveis comercialmente. Os 10 B e 11 B núcleos também provocar cisão no ressonâncias de núcleos em anexo.
Ocorrência


O boro é um elemento relativamente raro na crosta da Terra, o que representa apenas 0,001%. Os depósitos de borato comerciais em todo o mundo são estimadas em 10 milhões de toneladas. Turquia e Estados Unidos são os maiores produtores mundiais de boro. A Turquia tem 63% das reservas de boro do mundo. O boro não aparecer na Terra na forma elementar, mas é encontrado combinado em bórax, ácido bórico, colemanite, kernite, ulexite e boratos. O ácido bórico é por vezes encontrado em vulcânicas águas de nascente.
Ulexita é um dos mais de cem minerais borato; é um cristal fibroso onde as fibras individuais pode guiar a luz como as fibras ópticas .
Economicamente importantes fontes de boro são rasorite ( kernite) e tincal (minério de bórax). Ambos são encontrados no Deserto de Mojave da Califórnia , onde o Rio Tinto Borax Mine (também conhecida como os EUA bórax Boron meus) 35 ° 2'34.447 "N 117 ° 40'45.412" W perto Boron, CA é California maior mina a céu aberto 's ea maior bórax mina do mundo, produzindo quase metade do mundo boratos a partir deste local único. No entanto, os maiores depósitos conhecidos de bórax, muitos ainda inexplorado, são na Europa Central e Ocidental Turquia , incluindo as províncias de Eskisehir, Kütahya e Balıkesir.
Produção
A produção de compostos de boro não envolve a formação de boro elementar, mas explora a disponibilidade conveniente de boratos.
As primeiras rotas para boro elementar envolvido redução de óxido bórico com metais tais como magnésio ou alumínio . No entanto, o produto é quase sempre contaminados com metais boretos. Boro puro pode ser preparado por redução de halogenetos de boro voláteis com hidrogénio a altas temperaturas. Ultrapura de boro, para a utilização na indústria de semicondutores, é produzido pela decomposição de diborano a temperaturas elevadas e, em seguida, adicionalmente purificado com o zona de fusão ou Processos Czochralski.
Tendência do mercado
Consumo global estimado de boro subiu para um recorde de 1,8 milhões de toneladas de B 2 O 3 em 2005, após um período de forte crescimento da demanda da Ásia, Europa e América do Norte. Capacidades de mineração e refino de boro são considerados adequados para atender aos níveis esperados de crescimento através da próxima década.
A forma em que o boro é consumido mudou nos últimos anos. O uso de minérios, como colemanite diminuiu seguinte preocupações com arsênico conteúdo. Os consumidores mudaram-se para a utilização de boratos refinados e ácido bórico que têm um teor de poluentes inferior. O custo médio de boro cristalino é US $ 5 / g.
A procura crescente de ácido bórico tem levado alguns produtores a investir em capacidade adicional. Eti Mine Company da Turquia abriu uma nova fábrica de ácido bórico com a capacidade de produção de 100.000 toneladas por ano em Emet em 2003. Rio Tinto Group aumentou a capacidade de sua fábrica de boro de 260 mil toneladas por ano em 2003 para 310 mil toneladas por ano até Maio de 2005, com planos para crescer para 366 mil este toneladas por ano em 2006. Os produtores chineses de boro têm sido incapazes de atender rapidamente à crescente demanda por boratos de alta qualidade. Isto levou a importações de tetraborato de sódio ( bórax) crescente por cem vezes entre 2000 e 2005 e as importações de ácido bórico a aumentar em 28% ao ano no mesmo período.
O aumento da demanda global tem sido impulsionada por altas taxas de crescimento em fibra de vidro e produção de borosilicato. Um rápido aumento na fabricação de fibra de vidro de reforço de grau na Ásia, com o consequente aumento da demanda por boratos tem compensado o desenvolvimento de fibra de vidro de reforço de grau livre de boro na Europa e nos EUA. Os recentes aumentos nos preços da energia pode levar a uma maior utilização de fibra de vidro de isolamento grau, com conseqüente crescimento no consumo de boro. Roskill Consulting Group prevê que a procura mundial de boro crescerá 3,4% ao ano, para atingir 21 milhões de toneladas até 2010. O maior crescimento da demanda é esperado para estar na Ásia, onde a demanda pode subir por uma média de 5,7% ao ano.
Aplicações
Quase todo o minério de boro extraído da terra é destinada para o refinamento em ácido bórico e pentahidrato tetraborato de sódio. Nos Estados Unidos, 70% de boro é usado para a produção de vidro e cerâmica.
Vidro e cerâmica

Vidro de borossilicato, que é tipicamente 12-15% de B 2 O 3, 80% de SiO 2, e 2% de Al 2 O 3, tem um baixo coeficiente de expansão térmica dando-lhe uma boa resistência ao choque térmico. Duran e Pyrex são duas grandes marcas para este vidro, utilizados tanto em vidraria de laboratório e no consumidor panelas e assadeiras, principalmente para essa resistência.
Filamentos de boro são de alta resistência, materiais leves que são usados principalmente para avançado estruturas aeroespaciais, como componente de materiais compostos, bem como a produção de produtos de consumo e de desporto, tais como limitados clubes de golfe e Canas de pesca. As fibras podem ser produzidas pelos deposição de vapor químico de boro em um tungstênio do filamento.
Fibras de boro e sub-milímetro de tamanho molas de boro cristalino são produzidos por laser de -assisted deposição de vapor químico. Tradução do feixe de laser focado permite produzir estruturas helicoidais mesmo complexas. Essas estruturas apresentam boas propriedades mecânicas ( módulo de elasticidade de 450 GPa, deformação na ruptura de 3,7%, tensão de rotura 17 GPa) e podem ser aplicados como reforço de materiais cerâmicos ou em sistemas de micromecânica.
Formulações de detergentes e agentes de branqueamento
Bórax é usado em vários produtos de limpeza e roupa de uso doméstico, incluindo o conhecido " 20 Mule Team Borax "reforço de lavandaria e" Boraxo "sabonete em pó. Também está presente em alguns fórmulas de clareamento dental.
O perborato de sódio funciona como uma fonte de oxigénio activo em muitos detergentes, detergentes para a roupa, produtos de limpeza e lavanderia alvejantes. No entanto, apesar de seu nome, "Borateem" lavanderia lixívia já não contém quaisquer compostos de boro, usando O percarbonato de sódio em vez de um agente de branqueamento.
Inseticidas
O ácido bórico é utilizado como um insecticida, nomeadamente contra as formigas, moscas e baratas.
Semiconductors
O boro é um útil dopante para semicondutores tais como silício , germânio , e carboneto de silício. Tendo menos um elétron de valência do que o átomo de host, ele doa uma buraco resultando em p-type condutividade. Método tradicional de introdução de boro em semicondutores é através do seu difusão atómica a altas temperaturas. Este processo utiliza o sólido (B 2 O 3), líquido (BBr3), ou fontes de boro gasoso (B 2 H 6 ou BF3). No entanto, após a década de 1970, foi substituído na maior parte pelos implantação de íons, que se baseia principalmente no BF 3 como uma fonte de boro. Boron gás trichloride é também uma importante substância química na indústria de semicondutores, porém não por doping, mas sim para gravação com plasma de metais e os seus óxidos. Trietilborano também é injectado dentro reactores de deposição de vapor como fonte de boro. Exemplos são a deposição de filmes de carbono de plasma duras contendo boro, nitreto de filmes de nitreto de silício-boro, e para dopagem do diamante filme com boro.
Ímãs
O boro é um componente de ímãs de neodímio (Nd 2 Fe 14 B), que são o tipo mais forte de ímã permanente. Eles são encontrados em uma variedade de dispositivos electrónicos e electromecânicos domésticos e profissionais, tais como A ressonância magnética (MRI), vários motores e atuadores, HDDs de computador, CD e DVD players, telefones celulares, interruptores temporizador, alto-falantes, e assim por diante.
De alta dureza e compostos abrasivos
Vários compostos de boro são conhecidos pela sua extrema dureza e tenacidade.
Carboneto de boro e nitreto cúbico de boro em pó são amplamente utilizados como abrasivos. Metal boretos são utilizados para ferramentas de revestimento através ou deposição de vapor químico deposição de vapor físico. A implantação de iões de boro em metais e ligas, através implantação de íons ou deposição de feixe de íons, resulta em um aumento espectacular resistência superficial e microdureza. Liga laser também tem sido utilizado com sucesso para a mesma finalidade. Estes boretos são uma alternativa para ferramentas de diamante revestidos, e as suas superfícies (tratados) tem propriedades semelhantes às do boreto de grandes quantidades.
Carboneto de boro
Carboneto de boro é um material cerâmico, que é obtido pela decomposição de B 2 O 3 com o carbono no forno eléctrico:
- 2 B 2 O 3 + 7 C → B 4 C + 6 CO
Estrutura de carboneto de boro é apenas cerca de B 4 C, e mostra uma diminuição clara de carbono a partir desta sugeriu relação estequiométrica. Isto é devido à sua estrutura muito complexa. A substância pode ser visto com fórmula empírica C B 12 3 (ou seja, com B 12 dodecaedros ser um motivo), mas com menos de carbono como as sugeridas C 3 unidades são substituídas por cadeias BC, e há menor (B-6) assim octaedros presente. (Veja o artigo para a análise estrutural).
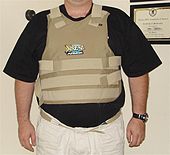
O polímero mais semi-cristalino estrutura de repetição de carboneto de boro lhe confere grande resistência estrutural por peso. É utilizado em blindagem de tanques, coletes à prova de balas, e muitas outras aplicações estruturais.
Capacidade de carboneto de boro para absorver nêutrons sem formar longa duração radionuclídeos (especialmente quando dopado com adicional de boro-10) faz com que o material atraente como um absorvente para radiação de nêutrons produzidos em usinas nucleares. Aplicações nucleares de carboneto de boro incluem blindagem, hastes de controle e pelotas paragem. Dentro de barras de controlo, o carboneto de boro é muitas vezes em pó, para aumentar a sua área de superfície.
| Material | Diamante | cúbico-BC 2 N | cúbico-BC 5 | cúbico-BN | B 4 C | Reb 2 |
|---|---|---|---|---|---|---|
| Dureza Vickers (ACP) | 115 | 76 | 71 | 62 | 38 | 22 |
| Tenacidade à fratura (MPa m 1/2) | 5.3 | 4,5 | 9,5 | 6.8 | 3,5 |
Outros compostos de boro superduros
- Heterodiamond (também chamado BCN);
- O nitreto de boro. Este material é isoeletrônica de carbono . Semelhante ao carbono, tem tanto hexagonal (c,-BN rígidos diamante-como formas) (macios grafite-como h-BN) e cúbico. h-BN é utilizado como um componente de alta temperatura e lubrificante. c-BN, também conhecido sob o nome comercial borazon, é um abrasivo superior. A sua dureza é apenas um pouco menor, mas a estabilidade química é superior à do diamante.
- Diboreto de rénio podem ser produzidos a pressões ambientais, mas é bastante caro porque de rénio. A dureza da Reb 2 exibe considerável anisotropia devido à sua estrutura em camadas hexagonal. O seu valor é comparável à de carboneto de tungstênio, carboneto de silício, diboreto de titânio ou diboreto de zircónio.
- AlMgB 14 + TiB 2 compostos possuem elevada dureza e resistência ao desgaste e são utilizados em qualquer das formas a granel ou como revestimentos para componentes expostos a altas temperaturas e ao desgaste cargas.
Blindagem em reatores nucleares
Boro blindagem é usado como um controlo para reatores nucleares, aproveitando sua alta corte transversal para captura de nêutrons.
Outros usos não médicos
- Devido à sua chama verde distinta, de boro amorfo é usado em foguetes pirotécnicos.
- Amido e colas à base de caseína contêm deca-hidrato de tetraborato de sódio (Na 2 B 4 O 7 10 • H2O)
- Alguns sistemas anti-corrosão contêm bórax.
- Boratos de sódio são usados como um fluxos para soldar prata e ouro, e com cloreto de amônio para soldagem de metais não ferrosos. Eles também são fogo retardamento aditivos para plásticos e artigos de borracha.
- Ácido bórico (também conhecido como ácido ortobórico) H 3 BO 3 é utilizado na produção de fibra de vidro e têxteis monitores de tela plana e, em muitos PVAc e Adesivos base de PVOH.
- Trietilborano é uma substância que inflama o JP-7 do combustível Pratt & Whitney J58 turbojet / ramjet motores que alimentam o Lockheed SR-71 Blackbird . Também foi usada para inflamar o F-1 motores no Saturno V foguete utilizado pela NASA 's Apollo e Programas de Skylab desde 1967 até 1973. Trietilborano é adequado para isso por causa de sua Propriedades pirofóricas, especialmente o fato de que ele queima com uma temperatura muito elevada. Trietilborano é uma industrial iniciador reacções de radicais, em que é eficaz, mesmo a baixas temperaturas.
Farmacêuticos e aplicações biológicas
O ácido bórico tem anti-séptico, antifúngica, e propriedades anti-virais e por essa razão é aplicada como um clarificador de água no tratamento da água da piscina. Soluções suaves de ácido bórico foram utilizados como anti-sépticos olho.
O bortezomib (Velcade). Boron aparece como um elemento activo no seu primeiro-aprovado pharamaceutical orgânica na novela bortezomib farmacêutica, uma nova classe de medicamentos chamados de inibidores de proteassoma, que são ativo em mieloma e uma forma de linfoma (está em actualmente em ensaios experimentais contra outros tipos de linfoma). O átomo de boro na liga bortezomib o sítio catalítico da Proteassoma 26S com elevada afinidade e especificidade.
- Um número de potenciais fármacos utilizando boro foram preparados de boro-10, para uso em terapia por captura de neutrões de boro (BNCT).
- Alguns compostos de boro mostram a promessa no tratamento artrite, embora nenhum deles tenha ainda sido geralmente aprovado para o efeito.
Áreas de pesquisa
Diboreto de magnésio é um importante material supercondutor com a temperatura de transição de 39 K. MGB dois fios são produzidos com o pó-em-tubo de processo e aplicado em ímanes supercondutores.
Boro amorfo é usado como um depressor do ponto de fusão, em ligas de soldadura a forte de níquel-crómio.
Hexagonal formas de nitreto de boro atomicamente camadas finas, que têm sido utilizados para melhorar a mobilidade de elétrons em dispositivos de grafeno. Também forma estruturas nanotubular ( BNNTs), que tem com alta força, alta estabilidade química e elevada condutividade térmica, entre a sua lista de propriedades desejáveis.
Papel biológico natural
Há um naturais contendo boro antibiótico , boromycin, isolado a partir de Streptomyces. O boro é um planta essencial de nutrientes , necessário principalmente para a manutenção da integridade das paredes celulares. Por outro lado, altas concentrações de solo> 1.0 ppm pode causar necrose marginal e nas folhas de ponta, bem como o fraco desempenho de crescimento global. Níveis tão baixos quanto 0,8 ppm pode causar estes mesmos sintomas que aparecem nas plantas particularmente sensíveis ao boro no solo. Quase todas as plantas, mesmo aqueles pouco tolerante com boro no solo, vai mostrar pelo menos alguns sintomas de toxicidade de boro quando teor de boro no solo é superior a 1,8 ppm. Quando este conteúdo for superior a 2,0 ppm, algumas plantas terão um bom desempenho e alguns podem não sobreviver. Quando os níveis de boro em tecidos de plantas exceder 200 ppm sintomas de toxicidade de boro são susceptíveis de aparecer.
Como ultratrace elemento, de boro é necessária para a saúde óptimo de ratos, embora seja necessária em quantidades tão pequenas que ultrapurificada alimentos e filtração poeira do ar é necessária para induzir a deficiência de boro, que se manifestam revestimento ou do cabelo como má qualidade. Presumivelmente, o boro é necessária para outros mamíferos. Nenhuma síndrome de deficiência em seres humanos tem sido descrita. Pequenas quantidades de boro ocorrem amplamente na dieta, e as quantidades necessárias na dieta seria, por analogia com os estudos de roedores, ser muito pequena. O papel fisiológico exacta de boro no reino animal, é pouco compreendida.
Boron ocorre em todos os alimentos produzidos a partir de plantas. Desde 1989 o seu valor nutricional tem sido argumentado. Pensa-se que o boro desempenha várias funções bioquímicas em animais, incluindo seres humanos. O Departamento de Agricultura dos EUA realizaram um experimento em que as mulheres pós-menopáusicas levou 3 mg de boro por dia. Os resultados mostraram que o boro suplementar redução da excreção de cálcio por 44%, e activado estrogénio e vitamina D , sugerindo um possível papel na supressão da osteoporose. No entanto, se estes efeitos eram convencionalmente nutricional, ou medicamento, não pôde ser determinada. Os EUA National Institutes of Health afirma que "ingestão diária total de boro no normais dietas humanas varia 2,1-4,3 mg de boro / dia. "
Congénita tipo distrofia endotelial 2, uma forma rara dedistrofia corneana, está associada a mutações nogene que codifica SLC4A11 um transportador alegadamente regulação da concentração intracelular de boro.
Quantificação analítica
Para a determinação do teor de boro em alimentos ou materiais do método colorimétrico curcumina é usado. Boro tem de ser transferido para o ácido bórico ou boratos e na reacção com a curcumina em solução ácida, um de cor vermelha, sem boro complexo de quelato, rosocyanine, é formado.
As questões de saúde e toxicidade
Boro elementar, de óxido de boro, ácido bórico, boratos, e diversos compostos de organoboro não são tóxicos para os seres humanos e animais (aproximadamente semelhantes ao sal de mesa). O LD 50 (dose à qual há 50% de mortalidade) para animais é de cerca de 6 g por kg de peso corporal. Substâncias com LD 50 acima de 2 g são considerados não-tóxicos. A dose mínima letal para os seres humanos não foi estabelecida. A ingestão de 4 g / dia de ácido bórico foi relatado sem incidentes, mas mais do que isso é considerado tóxico para mais do que algumas doses. Os consumos de mais de 0,5 gramas por dia para 50 dias causar digestivo menor e outros problemas sugestivo de toxicidade. Doses médicos individuais de 20 g de ácido bórico para a terapia de captura de neutrões foram usadas sem toxicidade indevida. Peixes sobreviveram durante 30 min em solução de ácido bórico saturado e pode sobreviver mais tempo em soluções fortes de bórax. O ácido bórico é mais tóxico para insectos do que para os mamíferos, e é utilizada rotineiramente como um insecticida.
O boranos (compostos de boro de hidrogênio) e compostos gasosos semelhantes são bastante venenosa. Como de costume, não é um elemento que é intrinsecamente venenosos, mas a toxicidade depende da estrutura.
Os boranos são tóxicos, bem como altamente inflamável e requerem cuidados especiais no manuseio. Borohidreto de sódio apresenta um risco de incêndio devido à sua natureza de redução, ea libertação de hidrogénio ao contacto com ácido. Halogenetos de boro são corrosivos.

