
Alumínio
Você sabia ...
Crianças SOS produziu este website para as escolas, bem como este site de vídeo sobre a África . SOS Criança patrocínio é legal!
| Aluminium | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
13 Al | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||
cinza metálico prateado  Linhas espectrais de alumínio | |||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||
| Nome, símbolo, número | de alumínio, Al, 13 | ||||||||||||||||||||||||
| Pronúncia | Reino Unido / ˌ æ lj ʉ m ɪ n Eu ə m / AL -ew- MIN -ee-əm; EU / ə lj u m ɨ n əm / | ||||||||||||||||||||||||
| Categoria Metallic | metais de transição pós- | ||||||||||||||||||||||||
| Grupo, período, bloco | 13, 3, p | ||||||||||||||||||||||||
| Peso atômico padrão | 26,981 386 5 (13) | ||||||||||||||||||||||||
| Configuração eletrônica | [ Ne ] 3s 2 3p 1 2, 8, 3 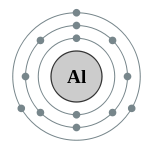 | ||||||||||||||||||||||||
| História | |||||||||||||||||||||||||
| Predição | Antoine Lavoisier (1787) | ||||||||||||||||||||||||
| Primeiro isolamento | Friedrich Wöhler (1827) | ||||||||||||||||||||||||
| Nomeado por | Humphry Davy (1807) | ||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||
| Densidade (perto RT) | 2,70 g cm -3 · | ||||||||||||||||||||||||
| Líquido densidade no pf | 2,375 g · cm -3 | ||||||||||||||||||||||||
| Ponto de fusão | 933,47 K , 660,32 ° C, 1220,58 ° F | ||||||||||||||||||||||||
| Ponto de ebulição | 2792 K, 2519 ° C, 4566 ° F | ||||||||||||||||||||||||
| Calor de fusão | 10,71 kJ mol -1 · | ||||||||||||||||||||||||
| Calor de vaporização | 294,0 kJ mol -1 · | ||||||||||||||||||||||||
| Capacidade calorífica molar | 24,200 J · · mol -1 K -1 | ||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||
| Estados de oxidação | 3, 2, 1 ( óxido anfotérico) | ||||||||||||||||||||||||
| Eletronegatividade | 1,61 (escala de Pauling) | ||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 577,5 kJ · mol -1 | ||||||||||||||||||||||||
| 2: 1816,7 kJ · mol -1 | |||||||||||||||||||||||||
| 3: 2744,8 kJ · mol -1 | |||||||||||||||||||||||||
| Raio atômico | 143 pm | ||||||||||||||||||||||||
| O raio de covalência | 121 ± 16:00 | ||||||||||||||||||||||||
| Van der Waals raio | 184 pm | ||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||
| A estrutura de cristal | cúbica de face centrada  | ||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | ||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 28,2 Nco · m | ||||||||||||||||||||||||
| Condutividade térmica | 237 W · m -1 · K -1 | ||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 23,1 pM · · K -1 m -1 | ||||||||||||||||||||||||
| Velocidade do som (haste fina) | ( rt) (laminado) 5.000 m · s -1 | ||||||||||||||||||||||||
| O módulo de Young | 70 GPa | ||||||||||||||||||||||||
| Módulo de cisalhamento | 26 GPa | ||||||||||||||||||||||||
| Massa de módulo | 76 GPa | ||||||||||||||||||||||||
| Rácio de Poisson | 0.35 | ||||||||||||||||||||||||
| Dureza de Mohs | 2.75 | ||||||||||||||||||||||||
| Dureza de Vickers | 167 MPa | ||||||||||||||||||||||||
| Dureza Brinell | 245 MPa | ||||||||||||||||||||||||
| Número de registo CAS | 7429-90-5 | ||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||
| Ver artigo principal: Isótopos de alumínio | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
De alumínio (ou de alumínio) é um elemento químico na grupo de boro com o símbolo Al e número atômico 13. É branco prateado, e não é solúvel em água, sob circunstâncias normais.
O alumínio é o terceiro elemento mais abundante (depois de oxigénio e de silício ), ea metal mais abundante, na Terra 's crosta . Faz-se cerca de 8% em peso de superfície sólida da Terra. Alumínio metal é tão reativo que os espécimes nativos são raros e limitado a extrema reduzindo ambientes. Em vez disso, ele é encontrado combinado em mais de 270 diferentes minerais . O chefe minério de alumínio é bauxita.
O alumínio é notável para baixo do metal de densidade e para a sua capacidade de resistir à corrosão devido ao fenômeno de passivation. Componentes estruturais feitos de alumínio e os seus ligas são vitais para o indústria aeroespacial e são importantes em outras áreas de transporte e materiais estruturais. Os compostos mais úteis de alumínio, pelo menos, numa base de peso, são os óxidos e sulfatos.
Apesar da sua prevalência no ambiente, sais de alumínio não são conhecidos por serem utilizados por qualquer forma de vida. Em consonância com sua onipresença, o alumínio é bem tolerado pelas plantas e animais. Devido à sua prevalência, possíveis papéis biológicos benéficos (ou não) de compostos de alumínio são de interesse de continuar.
Características

Físico
O alumínio é um relativamente macio, durável, leve, dúctil e maleável de metal com aparência prateada que vão desde a cinza opaco, dependendo da rugosidade da superfície. É não magnético e não facilmente inflamar. Uma película de fresco de alumínio serve como um bom reflector (aproximadamente 92%) da luz visível e uma excelente reflector (tanto quanto 98%) de meio e radiação infravermelho distante. O resistência à deformação de alumínio puro é 11/07 MPa, enquanto ligas de alumínio têm forças rendimento variando de 200 MPa a 600 MPa. Alumínio tem cerca de um terço da densidade e rigidez de aço . É facilmente usinado, fundido, e desenhada extrudida.
Átomos de alumínio são dispostas numa cúbico estrutura (FCC) de face centrada. De alumínio tem um energia de empilhamento a falhas de aproximadamente 200 mj / m 2.
O alumínio é um bom e térmica condutor eléctrico, tendo 59% da condutividade de cobre, tanto térmica como eléctrica, ao mesmo tempo que apenas 30% da densidade do cobre. O alumínio é capaz de ser um supercondutor , com uma temperatura crítica supercondutor de 1,2 Kelvin e um campo magnético de cerca de 100 crítica Gauss (10 milliteslas).
Químico
A corrosão pode ser excelente resistência devido a uma fina camada superficial de óxido de alumínio que se forma quando o metal estiver exposta ao ar, impedindo ainda mais oxidação. As ligas de alumínio mais fortes são menos resistentes à corrosão devido à reacções galvânicas com liga de cobre . Esta resistência à corrosão é também muitas vezes grandemente reduzida por sais aquosos, especialmente na presença de metais diferentes.
Devido à sua resistência à corrosão, o alumínio é um dos poucos metais que retêm reflectância prateada em forma de pó fino, tornando-se um componente importante de tintas na cor prata. Acabamento espelhado de alumínio tem a maior reflectância de qualquer metal sob a 200-400 nm ( UV ) e a 3,000-10,000 nm (distante IR) regiões; na faixa do visível 400-700 nm é ligeiramente superado por estanho e prata e no 700-3000 (perto IR) pela prata, ouro e cobre.
O alumínio é oxidada por água para produzir hidrogénio e calor:
- 2 Al + 3 H2O → Al 2 O 3 + 3H 2
Esta conversão é de interesse para a produção de hidrogénio. Os desafios incluem contornar a camada de óxido formada, a qual inibe a reacção e as despesas associadas com o armazenamento de energia através da regeneração do metal Al.
Isótopos
Alumínio tem muitos conhecidos isótopos , cujos números de massa variam de 21 a 42; no entanto, apenas 27 Al ( isótopo estável ) e 26 Al ( isótopo radioactivo, t 1/2 = 7,2 × 10 5 y) ocorrem naturalmente. 27 Al tem uma abundância natural acima de 99,9%. 26 Al é produzido a partir de argônio na atmosfera por espalação causada pela de raios cósmicos prótons . Isótopos de alumínio têm encontrado aplicação prática em namoro marinhos sedimentos, nódulos de manganês, gelo glacial, quartzo em rocha exposições, e meteoritos. A proporção de 26 a 10 Al Be foi usado para estudar o papel do transporte, deposição, sedimento de armazenamento, os tempos de sepultamento, e erosão em escalas de tempo 10 maio - 10 junho ano. Cosmogênico 26 Al foi aplicado pela primeira vez em estudos da Lua e meteoritos. Fragmentos de meteoróides, após a partida de seus corpos pai, estão expostos a intensos bombardeamentos de raios cósmicos durante a sua viagem através do espaço, causando substancial 26 Al produção. Depois de cair na Terra, blindagem atmosférica reduz drasticamente 26 Al de produção, e a sua decomposição pode então ser usada para determinar a idade terrestre do meteoritos. Pesquisa de meteoritos também mostrou que 26 Al era relativamente abundante no momento da formação do nosso sistema planetário. A maioria dos cientistas meteorito acreditam que a energia liberada pela decomposição de 26 de Al foi responsável pela fusão e diferenciação de alguns asteróides após a sua formação 4,55 bilhões anos atrás.
Ocorrência natural
Alumínio estável é criado quando hidrogênio se funde com magnésio quer em grandes estrelas ou supernovas .
No crosta terrestre , o alumínio é o mais abundante (8,3% em peso) elemento metálico e o terceiro mais abundante de todos os elementos (depois de oxigénio e de silício). Devido à sua forte afinidade ao oxigênio, ele quase nunca é encontrado no estado elementar; em vez disso, é encontrado em óxidos ou silicatos. feldspatos , o grupo mais comum de minerais na crosta da Terra, são aluminossilicatos. Metal de alumínio nativo só pode ser encontrada como uma fase de menor na baixa de oxigênio fugacidade ambientes, tais como o interior de certos vulcões. Nativo alumínio tem sido relatada em fontes frias no nordeste talude continental do Mar da China Meridional e Chen et al. (2011) propuseram uma teoria da sua origem como resultante por redução de tetrahydroxoaluminate Al (OH) 4 - ao alumínio metálico por bactérias .
Também ocorre nos minerais berilo, cryolite, granada, espinélio e turquesa . Impurezas em Al 2 O 3, tais como cromo ou ferro rendimento do pedras preciosas rubi e safira, respectivamente.
Embora o alumínio é um elemento extremamente comum e difundido, os minerais comuns de alumínio não são fontes econômicas do metal. Quase todo o alumínio metálico é produzido a partir da minério de bauxita (AlO x (OH) 3-2 x). A bauxite ocorre como um intemperismo produto de baixo teor de ferro e sílica alicerce em condições climáticas tropicais. Grandes depósitos de bauxita ocorrem na Austrália, Brasil , Guiné e Jamaica e as áreas de mineração principais para o minério estão em Austrália , Brasil, China , Índia , Guiné, Indonésia , Jamaica, Rússia e Suriname .
Produção e refinamento

Formas de alumínio fortes ligações químicas com o oxigênio. Em comparação com a maioria dos outros metais, é difícil de extrair a partir de minérios, tais como bauxita, devido à elevada reactividade do alumínio e o ponto de fusão elevado de mais de seus minérios. Por exemplo, redução directa com carbono , como é usado para a produção de ferro , não é quimicamente possível porque o alumínio é um agente de redução mais forte do que o carbono. Redução carbotérmica indireta pode ser realizada utilizando carbono e Al 2 O 3, que constitui um intermediário Al 4 C 3 e isso pode produzir ainda mais metal de alumínio a uma temperatura de 1900-2000 ° C. Este processo ainda está em desenvolvimento; requer menos energia e produz menos do que o CO 2 Processo Hall-Héroult, o principal processo industrial para a extração de alumínio. Fundição electrolítica de alumina foi originalmente um custo proibitivo, em parte, por causa do ponto de fusão elevado de alumina ou óxido de alumínio, (cerca de 2000 ° C (3600 ° F)). Muitos minerais, no entanto, irá dissolver-se em um segundo mineral já fundido, mesmo se a temperatura da massa fundida é significativamente mais baixa do que o ponto de fusão do primeiro mineral. Fundido criolite foi descoberto para dissolver alumina a temperaturas significativamente inferiores ao ponto de fusão da alumina pura sem interferir no processo de fundição. No Processo-Héroult Hall, alumina é dissolvido primeiro em fundido Criolite com cálcio e, em seguida, fluoreto de electroliticamente reduzida para alumínio a uma temperatura entre 950 e 980 ° C (1740 a 1800 ° F). Criolite é um composto químico de alumínio e sódio fluoretos: (Na 3 Alf 6). Embora criolite é encontrado como um mineral em Gronelândia , sua forma sintética é usada na indústria. O próprio óxido de alumínio é obtido por refinação de bauxita no Processo Bayer.
O processo electrolítico substituiu o Wöhler processo, que envolveu a redução de cloreto de alumínio anidro com potássio . Ambos o eléctrodos utilizados na electrólise de óxido de alumínio são de carbono. Uma vez que a alumina refinada é dissolvido no eletrólito, que dissocia e seus íons são livres para se movimentar. A reacção no cátodo é:
- Al 3+ + 3-E - Al →
Aqui, o ião de alumínio está sendo reduzida. O metal de alumínio, em seguida, vai para o fundo e é batido fora, geralmente lançados grandes blocos chamados lingotes de alumínio para posterior processamento.
No ânodo, o oxigénio é formada:
- 2 O 2 → O 2 + 4 e -
Em certa medida, o ânodo de carbono é consumido por reacção subsequente com o oxigénio para formar dióxido de carbono. Os ânodos numa célula de redução deve, portanto, ser substituídas regularmente, uma vez que eles são consumidos durante o processo. Os catodos não corroer, principalmente devido a processos eletroquímicos e metal movimento. Depois de cinco a dez anos, dependendo da corrente usada na electrólise, uma célula tem que ser reconstruído por causa do desgaste cátodo.
Electrólise em alumínio com o Processo Hall-Héroult consome muita energia, mas processos alternativos sempre foram encontrados para ser menos viável economicamente e / ou ecologicamente. O consumo específico de energia média mundial é de aproximadamente 15 ± 0,5 quilowatts-hora por quilograma de alumínio produzida (52 a 56 MJ / kg). As fundições mais modernas alcançar aproximadamente 12,8 kW · h / kg (46,1 MJ / kg). (Compare isso com o calor de reacção, 31 MJ / kg, ea energia livre de Gibbs de reacção, 29 MJ / kg.) Redução correntes de linha para tecnologias mais antigas são tipicamente 100 a 200 kiloamperes; fundições de state-of-the-art operar em cerca de 350 kA. Trials foram relatados com 500 células kA.
O processo de Hall-Heroult produz alumínio com um grau de pureza superior a 99%. A purificação adicional pode ser feito pela Hoope processo. O processo envolve a electrólise de alumínio fundido com um sal de sódio, bário e fluoreto de alumínio electrólito. O alumínio resultante tem uma pureza de 99,99%.
Energia eléctrica representa cerca de 20% a 40% do custo de produção de alumínio, dependendo da localização da fundição. Produção de alumínio consome cerca de 5% da eletricidade gerada nas fundições dos EUA tendem a ser situado onde energia elétrica é tanto abundante e barato, como os Emirados Árabes Unidos com excesso de fornecimentos de gás natural e Islândia e Noruega com a energia gerada a partir de fontes renováveis. A maior do mundo fundições de alumina são a República Popular da China, Rússia e Quebec e British Columbia, no Canadá .
Em 2005, a República Popular da China foi o maior produtor de alumínio com quase um quinto share mundial, seguido pela Rússia, do Canadá e dos EUA, relata o British Geological Survey.
Nos últimos 50 anos, a Austrália tornou-se um grande produtor de minério de bauxita e um grande produtor e exportador de alumina (antes de ser ultrapassada pela China em 2007). Austrália produziu 68 milhões toneladas de bauxita em 2010. Os depósitos australianos têm alguns problemas de refino, sendo alguns ricos em sílica, mas tem a vantagem de ser raso e relativamente fácil de mina.
Reciclagem

O alumínio é teoricamente 100% reciclável sem qualquer perda das suas qualidades naturais. De acordo com Painel Internacional de Recursos do Stocks Metal em relatório Society, o global estoque capita de alumínio em uso na sociedade por (ou seja, em carros, edifícios, eletrônica etc.) é de 80 kg. Muito disso é nos países mais desenvolvidos (350-500 kg per capita) em vez de países menos desenvolvidos (35 kg per capita). Conhecer os estoques per capita e da sua vida útil aproximados é importante para a reciclagem de planejamento.
Recuperação do metal através de reciclagem tornou-se um uso importante da indústria do alumínio. Reciclagem era uma atividade de baixo perfil até o final dos anos 1960, quando o crescimento do uso do alumínio latas de bebidas trouxe-o para a sensibilização da opinião pública.
A reciclagem envolve a fusão do refugo, um processo que requer apenas 5% da energia utilizada para a produção de alumínio a partir de minérios, embora uma parte significativa (até 15% do material de entrada) está perdido como escórias (óxido de ash-like). A escória pode ser submetida a um novo processo para extrair alumínio.
Na Europa alumínio experimenta elevadas taxas de reciclagem, variando de 42% de latas de bebidas, 85% de materiais de construção e 95% de veículos de transporte.
O alumínio reciclado é conhecido como alumínio secundário, mas mantém as mesmas propriedades físicas como alumínio primário. Alumínio secundário é produzido numa vasta gama de formatos e é empregado em 80% de injecções de liga. Outro uso importante é para a extrusão.
Escória Branco de produção de alumínio primário e de operações de reciclagem secundária ainda contém quantidades úteis de alumínio que podem ser extraídos industrialmente. O processo produz lingotes de alumínio, em conjunto com um material de resíduos altamente complexo. Este desperdício é difícil de gerir. Reage com água, libertando uma mistura de gases (incluindo, entre outros, hidrogénio , acetileno , e amónia ), que inflama espontaneamente em contacto com o ar; entre em contato com o ar húmido resultados na liberação de grandes quantidades de gás de amônia. Apesar destas dificuldades, o desperdício é usado como um enchimento em e asfalto concreto.
Compostos
Estado de oxidação +3
A grande maioria dos compostos, incluindo todas as Al contendo minerais e todos os compostos comercialmente significativos de alumínio, apresentam alumínio no estado de oxidação 3+. O número de coordenação de tais compostos varia, mas geralmente Al 3+ é de seis coordenar ou tetracoordinate. Quase todos os compostos de alumínio (III) são incolores.
Halides
Todos os quatro trihaletos são bem conhecidos. Ao contrário das estruturas dos três tri-halogenetos de mais pesadas, fluoreto de alumínio (AlF 3) apresenta seis coordenadas Al. O ambiente de coordenação octaédrica para AlF 3 está relacionado com a compacidade de íon fluoreto, seis dos quais pode caber em torno do centro da pequena Al 3+. AlF 3 sublima (com fissuras) em 1291 ° C (2356 ° F). Com halogenetos mais pesados, os números de coordenação são mais baixos. Os outros são trihalogenetos dimérica ou polimérico com centros Al tetraédricos. Estes materiais são preparados por tratamento de metal de alumínio com o halogéneo, embora existam outros métodos. A acidificação dos óxidos ou hidróxidos proporciona hidratos. Em solução aquosa, os halogenetos frequentemente formar misturas, geralmente contendo seis coordenar centros de Al, que são característica tanto haleto e ligantes aquo. Quando o fluoreto de alumínio e são juntos em solução aquosa, eles formam facilmente iões complexos, tais como [AlF (H2O) 5] 2+, AlF 3 (H 2 O) 3, e [AlF 6] 3-. No caso de cloreto, são formados grupos de polialumínio, tais como [Al 13 O 4 (OH) 24 (H2O) 12] 7+.
Óxido e hidróxidos
Alumínio forma um óxido estável, conhecido pelo seu nome mineral corindo . Sapphire e rubi são corindo impuro contaminado com pequenas quantidades de outros metais. Os dois-hidróxidos de óxido, ALO (OH), são boehmite e diaspore. Existem três trihydroxides: bayerite, gibbsite, e nordstrandita, que diferem na sua estrutura cristalina ( polimorfos). A maior parte são produzidos a partir de minérios através de uma variedade de processos por via húmida utilizando ácido e de base. Aquecendo os hidróxidos leva à formação de corindo. Estes materiais são de importância central para a produção de alumínio e são eles próprios extremamente útil.
Carboneto de alumínio (Al 4 C 3) é feita por aquecimento de uma mistura dos elementos acima de 1.000 ° C (1.832 ° F). Os cristais amarelos pálidos do composto de alumínio centros tetraédricos. Ele reage com a água ou ácidos diluídos para dar metano . O acetileto, Al 2 (C 2) 3, é feita pela passagem de acetileno através de alumínio aquecido.
Nitreto de alumínio (AlN) é a única conhecida por nitreto de alumínio. Ao contrário dos óxidos possui centros Al tetraédricos. Ela pode ser feita a partir dos elementos a 800 ° C (1472 ° F). É material estável ao ar com uma elevada utilmente Condutividade térmica. Fosforeto de alumínio (ALP) é feita de forma semelhante, e hidrolisa para dar fosfina:
- AlP + 3 H2O → Al (OH) 3 + 3 PH
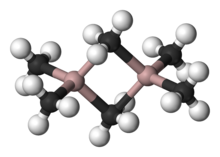
Uma variedade de compostos de fórmula empírica AlR 3 e AlR 1,5 Cl 1,5 existir. Estas espécies geralmente apresentam centros Al tetraédricos, por exemplo " trimetilalumínio "tem a fórmula Al 2 (CH 3) 6 (ver figura). Com grandes grupos orgânicos, triorganoaluminium existir como monómeros três coordenadas, tal como triisobutilalumínio. Estes compostos são amplamente utilizados na indústria química, apesar do facto de que eles são muitas vezes altamente pirofórico. Existem poucos análogos entre os compostos organoalumínicos e organoboro exceto para grandes grupos orgânicos.
O hidreto de alumínio e é importante hidreto de alumínio e lítio (LiAlH4), que é usado como um agente de redução em química orgânica . Ela pode ser produzida a partir de hidreto de lítio e tricloreto de alumínio:
- 4 LiH + AlCl3 → LiAlH 4 + 3 LiCl
Vários derivados úteis de LiAlH4 são conhecidos, por exemplo, hidreto de bis (2-metoxietoxi) dihydridoaluminate. O hidreto simples, hidreto de alumínio ou alano, permanece uma curiosidade laboratorial. É um polímero com a fórmula (AIH3) n, em contraste com o hidreto de boro correspondente com a fórmula (BH 3) 2.
Estados de oxidação +1 e +2
Embora a grande maioria dos compostos de alumínio incluem centros de Al 3+, compostos com estados de oxidação mais baixos são conhecidos e, por vezes de importância como precursores para as espécies Al 3+.
Alumínio (I)
Alf, AlCl e AlBr existir na fase gasosa quando o tri-halogeneto de alumínio é aquecido com. A composição Ali é instável à temperatura ambiente com respeito ao triiodeto:
- 3 AlI → AlI 3 + 2 Al
Um derivado estável do monoiodide alumínio é o cíclico aducto formado com trietilamina, Al 4 I 4 (NET 3) 4. Também de interesse teórico mas apenas da existência fugaz são Al 2 O e Al 2 S. Al 2 O é feito por aquecimento do óxido normal, Al 2 O 3, com silício a 1800 ° C (3272 ° F) numa vácuo. Tais materiais rapidamente disproportionates para os materiais de partida.
De alumínio (II)
Compostos muito simples Al (II) são invocadas ou observado nas reações de Al metálicos com oxidantes. Por exemplo, monóxido de alumínio, AlO, foi detectado na fase gasosa após a explosão e em espectros de absorção estelar. Mais cuidadosamente investigados são os compostos da fórmula R4 Al 2 em que R é um grande orgânica ligando.
Análise
A presença de alumínio pode ser detectado na análise qualitativa usando aluminon.
Aplicações
Uso geral
O alumínio é o mais amplamente usado metais não ferrosos. A produção mundial de alumínio em 2005 foi de 31,9 milhões de toneladas. Ele excedeu a de qualquer outro metal, exceto de ferro (837,5 milhões de toneladas). Previsão para 2012 é 42-45000000 de toneladas, impulsionada pela crescente produção chinesa.
O alumínio é quase sempre ligado, o que melhora significativamente as suas propriedades mecânicas, especialmente quando temperado. Por exemplo, o comum as folhas de alumínio e latas para bebidas são ligas de 92% a 99% de alumínio. A principal agentes de liga de cobre são, zinco , magnésio , manganês e silício (por exemplo, duralumínio) e os níveis de estes metais estão na gama de uns poucos por cento em peso.



Alguns dos muitos usos para o metal de alumínio está em:
- Transportes ( automóveis , aviões, caminhões, vagões ferroviários, embarcações, bicicletas , etc.) como folha, tubo, fundição, etc.
- Embalagem ( latas, papel alumínio, etc.)
- Construção ( janelas, portas, tapume, a construção de arame, etc.).
- Uma vasta gama de artigos para o lar, a partir de utensílios de cozinha para bastões de beisebol, relógios.
- ILUMINAÇÃO PÚBLICA pólos, navio à vela mastros, bastões para caminhadas, etc.
- Outer conchas de eletrônicos de consumo, também casos de equipamentos, por exemplo equipamento fotográfico.
- Linhas de transmissão elétrica para distribuição de energia
- MKM aço e Alnico
- Super pureza de alumínio (SPA, 99,980% para 99,999% Al), usados em equipamentos eletrônicos e CDs .
- Dissipadores de calor para aparelhos eletrônicos, tais como transistores e CPUs .
- Material de substrato de cobre revestido laminados de metal-core usados em alto brilho Iluminação LED.
- De alumínio em pó é utilizado em pintar e, em pirotecnia, tais como combustíveis de foguetes sólidos e thermite.
- O alumínio pode ser feito reagir com ácido clorídrico ou com hidróxido de sódio para produzir o gás de hidrogénio.
- Uma variedade de países, incluindo França , Itália , Polónia , Finlândia , Roménia , Israel , ea ex- Jugoslávia , emitiram moedas cunhadas em ligas de alumínio ou de alumínio de cobre.
- Alguns modelos de guitarra desporto placas de diamante de alumínio sobre a superfície dos instrumentos, geralmente cromo ou preto. Kramer Guitars e Travis feijão são ambos conhecidos por terem guitarras produzidas com o pescoço feito de alumínio, o que dá ao instrumento um som muito distinto.
O alumínio é geralmente ligado - é utilizado como metal puro apenas quando a resistência à corrosão e / ou trabalhabilidade é mais importante do que a força ou dureza. Uma fina camada de alumínio pode ser depositado sobre uma superfície plana por ou deposição de vapor físico (muito raramente) deposição de vapor químico ou outros meios químicos para formar e revestimentos ópticos espelhos.
Os compostos de alumínio
Porque o alumínio é mais abundante e dos seus derivados exibem baixa toxicidade, os compostos de alumínio desfrutar aplicações em grande escala de largura e, às vezes.
Alumina
Óxido de alumínio (Al 2 O 3) e os oxi-hidróxidos associados trihydroxides e são produzidos a partir de minerais ou extraído em grande escala. A grande maioria deste material é convertido em alumínio metálico. Cerca de 10% da capacidade de produção é utilizada para outras aplicações. A utilização principal é como um absorvente, por exemplo alumina irá remover a água de hidrocarbonetos, para permitir processos subsequentes que são envenenados pela umidade. Óxidos de alumínio são catalisadores comuns para processos industriais, por exemplo, o Noel processo para a conversão sulfureto de hidrogénio em enxofre em refinarias e para o alquilação de aminas . Muitos catalisadores são industriais "Suportada", significando que geralmente um catalisador caro (por exemplo, platina ) é dispersa ao longo de um material de elevada área superficial tais como alumina. Sendo um material muito duro ( dureza de Mohs 9), a alumina é amplamente usado como um abrasivo e a produção de aplicações que exploram a sua inércia, por exemplo, em lâmpadas de sódio de alta pressão.
Sulfatos
Vários sulfatos de alumínio encontrar aplicações. Sulfato de alumínio (Al 2 (SO 4) 3 (H 2 O) 18) é produzido na escala anual de vários milhares de milhões de quilos. Cerca de metade da produção é consumida na tratamento de água. A próxima aplicação importante é no fabrico de papel. É também utilizado como mordente, em extintor de incêndio, como aditivo alimentar, em fireproofing, e no curtimento de couro. Sulfato de amónio de alumínio, que também é chamado alúmen de amónio, (NH4) Al (SO 4) 2 · 12H 2 O, é usado como um mordaz e em curtimento de couro. Sulfato de alumínio de potássio ([Al (K)] (SO 4) 2) (H 2 O) 12 é utilizado de forma semelhante. O consumo de ambos os ex-alunos está em declínio.
Cloretos
O cloreto de alumínio (AICI3) é usado em petróleo refinação e na produção sintética de borracha e polímeros. Embora tenha um nome similar, cloridrato de alumínio e tem menos aplicações muito diferentes, por exemplo, como um agente de endurecimento e um antitranspirante. É um intermediário na produção de metal de alumínio.
Compostos de nicho
Dada a escala de compostos de alumínio, uma aplicação de pequena escala ainda poderia envolver milhares de toneladas. Um dos muitos compostos utilizados a este nível intermediário incluir acetato de alumínio, um sal utilizado na solução como um adstringente. Borato de alumínio (Al 2 O 3 · B 2 O 3) é utilizada na produção de vidro e cerâmica. Silicofluoreto de alumínio (Al 2 (SiF 6) 3) é utilizada na produção de fibras sintéticas pedras preciosas, vidro e cerâmica. Fosfato de alumínio (AlPO 4) é utilizada no fabrico: de vidro e de cerâmica, celulose e produtos de papel, cosméticos, tintas e vernizes e em fazer dentário cimento. O hidróxido de alumínio (Al (OH) 3) é utilizado como um antiácido, como mordente, em água de purificação, na fabricação de vidro e de cerâmica e na impermeabilização de tecidos. hidreto de alumínio e lítio é um poderoso agente de redução usado em química orgânica . São utilizados como Organoaluminiums E co-catalisadores ácidos de Lewis. Por exemplo, é um co-catalisador de metilaluminoxano para Ziegler-Natta de olefinas de polimerização para produzir polímeros de vinilo tais como polietileno.
As ligas de alumínio em aplicações estruturais

Ligas de alumínio com uma vasta gama de propriedades são usadas em estruturas de engenharia. Os sistemas de ligas são classificados por um sistema de número ( ANSI) ou por nomes que indicam os seus principais constituintes de liga ( DIN e ISO).
A resistência e durabilidade de ligas de alumínio variar amplamente, não só como um resultado de os componentes da liga específica, mas também como resultado de tratamentos de calor e processos de fabricação. A falta de conhecimento desses aspectos tem de vez em quando levou a impropriamente projetado estruturas e alumínio ganhou uma má reputação.
Uma limitação estrutural importante de ligas de alumínio é a sua resistência à fadiga. Ao contrário de aços, ligas de alumínio não têm bem definido limite de fadiga, o que significa que falha por fadiga eventualmente ocorre, mesmo sob muito pequenos carregamentos cíclicos. Isto implica que os engenheiros devem avaliar essas cargas e projeto para um vida fixa em vez de uma vida infinita.
Outra propriedade importante das ligas de alumínio é a sua sensibilidade ao calor. Oficina procedimentos que envolvam o aquecimento são complicadas pelo fato de que o alumínio, ao contrário de aço, derrete sem primeiro vermelho brilhante. Operações de conformação, onde uma maçarico é usado, portanto, requerem alguma experiência, uma vez que não há sinais visuais revelam o quão perto o material é a fusão. As ligas de alumínio, como todas as ligas estruturais, também estão sujeitos a tensões internas seguintes operações de aquecimento, tais como soldagem e fundição. O problema com ligas de alumínio a este respeito é o seu baixo ponto de fusão , que os tornam mais suscetíveis a distorções de alívio do estresse induzido termicamente. Alívio do estresse controlado pode ser feito durante a fabricação por tratamento térmico das peças em um forno, seguido de arrefecimento gradual em vigor recozer as tensões.
O baixo ponto de fusão de ligas de alumínio não tem impedido a sua utilização em foguetes; mesmo para utilização na construção de câmaras de combustão onde os gases podem chegar a 3500 K. A Agena engine estágio superior usado um design de alumínio regenerativamente arrefecida para algumas partes do bocal, incluindo a região da garganta termicamente crítico.
Outra liga de algum valor é bronze de alumínio (liga de Cu-Al).
História

Antigos gregos e romanos usados sais de alumínio como mordentes tingimento e como adstringente para curativos; alúmen é ainda usado como um styptic. Em 1761, Guyton de Morveau sugeriu chamar o alumine alum base. Em 1808, Humphry Davy identificou a existência de uma base de metal de alumínio, que na primeira ele chamou alumium e alumínio mais tarde (ver secção etimologia , abaixo).
O metal foi produzido pela primeira vez em 1825 em uma forma impura por Danish físico e químico Hans Christian Oersted. Ele reagiu anidro cloreto de alumínio com potássio amálgama, dando origem a um pedaço de metal que olha similar ao estanho. Friedrich Wöhler tinha conhecimento destas experiências e citou-los, mas depois de refazer os experimentos de Ørsted ele concluiu que este metal era de potássio puro. Ele conduziu uma experiência semelhante em 1827 através da mistura de cloreto de alumínio anidro com potássio e alumínio rendeu. Wöhler é geralmente creditado com isolamento de alumínio ( latino- alumen, alum), mas também Ørsted podem ser listados como seu descobridor. Além disso, Pierre Berthier descoberto em alumínio e minério de bauxita extraída com sucesso. Francês Henri Etienne Sainte-Claire Deville melhorou o método de Wöhler em 1846, e descreveu suas melhorias em um livro, em 1859, o principal dos quais sendo a substituição de sódio para o potássio consideravelmente mais caros. Deville provavelmente também concebeu a idéia da eletrólise de óxido de alumínio dissolvido em criolite; Charles Martin Hall e Paul Héroult pode ter desenvolvido o processo mais prático após Deville.
Antes de Processo Hall-Héroult foi desenvolvido no final de 1880, o alumínio era extremamente difícil extrair de seus vários minérios. Isso fez com que o alumínio puro mais valioso do que o ouro. Barras de alumínio foram exibidas na Exposição Universal de 1855. Napoleão III de França tem a fama de ter dado um banquete onde os convidados mais honrados receberam utensílios de alumínio, enquanto os outros fez ver com ouro.
O alumínio foi seleccionado como o material para ser usado para a cumeeira 100 onças (2,8 kg) do Monumento de Washington em 1884, num momento em que um onça (30 gramas) custam o salário diário de um trabalhador comum sobre o projeto. O ponto crucial, que foi fixado no lugar em 6 de Dezembro de 1884, em uma cerimônia de dedicação elaborado, era a maior peça única de alumínio fundido na época, quando o alumínio era tão caro como prata.
O Empresas Cowles fornecido liga de alumínio em quantidade no Estados Unidos e na Inglaterra usando fundições como o forno de Carl Wilhelm Siemens por 1.886. Charles Martin Hall of Ohio em os EUA e Paul Héroult de França desenvolvida de forma independente a Hall-Héroult processo eletrolítico que fez a extração de minerais de alumínio mais barato e é agora o principal método utilizado mundialmente. Processo de Hall, em 1888 com o apoio financeiro de Alfred E. Hunt, começou a Pittsburgh Reduction Company, hoje conhecida como a Alcoa. Processo de Héroult estava em produção por volta de 1889 na Suíça em alumínio Industrie, agora Alcan, e ao britânico de alumínio, agora Luxfer Grupo Alcoa e, por 1896 em Scotland .
Em 1895, o metal estava sendo usado como material de construção tão distantes comoSydney, Austrália na cúpula do edifício do Secretário Chefe.
Muitas marinhas têm usado uma lata de alumínio superestrutura para os seus navios; 1975 fogo a bordo de USS Belknap que eviscerado sua superestrutura de alumínio, bem como a observação de danos de batalha para navios britânicos durante a Guerra das Malvinas, levou a muitas marinhas que mudam para todos os aço superestruturas. O Arleigh Burke classe foi o primeiro navio norte-americano, que está sendo construído inteiramente de aço.
Fio de alumínio já foi amplamente utilizado para a fiação elétrica doméstica. Devido às falhas induzidas por corrosão, um número de fogos resultou.
Etimologia
Duas variantes do nome do de metal estão em uso atual, de alumínio e de alumínio (além do obsoleto alumium ). O União Internacional de Química Pura e Aplicada (IUPAC) adotou o alumínio como o nome padrão internacional para o elemento em 1990, mas, três anos depois, reconhecido de alumínio como uma variante aceitável. Daí a sua tabela periódica inclui tanto. IUPAC prefere o uso do alumínio em suas publicações internas, embora quase tantas publicações IUPAC usar a ortografia de alumínio .
A maioria dos países utiliza a ortografia de alumínio . Nos Estados Unidos, a ortografia de alumínio predomina. O Canadian Oxford Dictionary prefere alumínio , enquanto a australiana Macquarie Dictionary prefere alumínio . Em 1926, a American Chemical Society decidiu oficialmente para usar alumínio em suas publicações; Dicionários americanos tipicamente rotular a ortografia de alumínio como uma variante britânica.
O nome deriva de alumínio seu status como uma base de alúmen. É emprestado de Francês Velho;sua fonte última,alumen, por sua vez, é umLatinapalavra que significa literalmente "sal amargo".
A mais antiga citação dada no Dicionário Oxford de Inglês para qualquer palavra utilizada como um nome para este elemento é alumium , que o químico e inventor britânico Humphry Davy empregados em 1808 para o metal que ele estava tentando isolar electroliticamente a partir do mineral alumina . A citação é do jornal Philosophical Transactions, da Royal Society de Londres : "Se eu tivesse sido a sorte de ter obtido mais certas evidências sobre este assunto, e ter adquirido as substâncias metálicas eu estava em busca de, eu deveria ter proposto para nelas os nomes dos silício, alumium, zircónio, e glucium ".
Davy liquidada em alumínio pelo tempo que ele publicou seu livro 1812 Filosofia Chemical : "Esta substância parece conter um metal peculiar, mas ainda alumínio não foi obtido em um estado perfeitamente livre, embora ligas dele com outras substâncias metalline foram adquiridos suficientemente distintas para indicar a natureza provável de alumina. " Mas no mesmo ano, um colaborador anônimo para o Quarterly Review, uma revista político-literário britânico, em uma resenha do livro de Davy, opôs- alumínio e propôs o nome de alumínio ", por isso vamos tomar a liberdade de escrever a palavra, em de preferência de alumínio, que tem um som menos clássica ".
O ónio sufixo conformados com o precedente estabelecido em outros elementos recém-descobertas da época: potássio, sódio, magnésio, cálcio e estrôncio (todos os que Davy isolou-se). No entanto, -um grafias para elementos não eram desconhecidos na época, como por exemplo platina , conhecido pelos europeus desde o século 16, molibdênio , descoberto em 1778, e tântalo , descoberto em 1802. O -um sufixo é consistente com a ortografia universal de alumina para o óxido, enquanto o óxido de lantânio é o de lantânio e magnésia, cério, e tória são os óxidos de magnésio , cério , e tório , respectivamente.
A grafia usada ao longo do século 19 pela maioria dos químicos dos Estados Unidos era de alumínio , mas de uso comum é menos clara. O alumínio ortografia é usado no Dicionário Webster de 1828. Em seu folheto de publicidade para seu novo método eletrolítico de produzir o metal 1892, Charles Martin Hall usou o -um ortografia, apesar de seu uso constante do ónio ortografia em todas as patentes ele arquivada entre 1886 e 1903. Foi, por conseguinte, sugerido que a ortografia reflete uma mais fácil de pronunciar palavra com menos uma sílaba, ou que a ortografia no folheto foi um erro. Dominação da produção do metal de Hall garantiu que a ortografia de alumínio tornou-se o padrão na América do Norte; o dicionário Webster Unabridged de 1913, porém, continuou a usar o ónio versão.
Preocupações com a saúde
| NFPA 704 |
|---|
 0 0 0 |
| Diamante fogo para o tiro de alumínio |
Apesar de sua abundância natural, alumínio não tem nenhuma função conhecida na biologia. Ele é notavelmente não tóxico, sulfato de alumínio tendo uma LD50 de 6207 mg / kg (oral, rato), o que corresponde a 500 gramas para uma pessoa 80 kg. Apesar de a toxicidade extremamente baixa aguda, os efeitos sobre a saúde de alumínio são de interesse, tendo em vista a ampla ocorrência do elemento no ambiente e no comércio.
Alguns toxicidade podem ser rastreados para a deposição nos ossos e o sistema nervoso central, o que é particularmente aumentada em pacientes com função renal reduzida. Porque o alumínio compete com cálcio para a absorção, o aumento da quantidade de alumínio dietético pode contribuir para a redução da mineralização óssea (osteopenia) observado em lactentes prematuros e as crianças com atraso de crescimento. Em doses muito elevadas, o alumínio pode causar neurotoxicidade, e é associada com a função alterada da barreira sangue-cérebro. Uma pequena porcentagem de pessoas são alérgicas ao alumínio e experiência dermatite de contato, distúrbios digestivos, vómitos ou outros sintomas após contato ou ingestão de produtos contendo alumínio, tais como desodorantes ou antiácidos. Em aqueles sem alergias, o alumínio não é tão tóxica como metais pesados, mas não há evidência de alguma toxicidade se for consumido em quantidades excessivas. Embora o uso de alumínio panelas não foi mostrado para levar a toxicidade de alumínio de um modo geral, o consumo excessivo de antiácidos contendo alumínio e compostos uso excessivo de antiperspirantes contendo alumínio proporcionar níveis mais significativos de exposição. Estudos têm mostrado que o consumo de alimentos ácidos ou líquidos com alumínio aumenta significativamente a absorção de alumínio, e maltol tem sido demonstrado que o aumento da acumulação de alumínio no tecido nervoso e Osseus. Além disso, o alumínio aumenta relacionada com estrogénio a expressão do gene em humanos células de cancro da mama cultivadas em laboratório. Os efeitos similares ao estrogênio destes sais levaram à sua classificação como um metalloestrogen.
Os efeitos de alumínio em antitranspirantes foi examinado ao longo de décadas, com poucos indícios de irritação da pele. No entanto, sua ocorrência em antitranspirantes, corantes (como o alumínio lago), e aditivos alimentares é controversa em alguns trimestres. Embora haja pouca evidência de que a exposição normal ao alumínio apresenta um risco para adultos saudáveis, alguns estudos apontam para riscos associados com o aumento da exposição ao metal. Alumínio em alimentos pode ser absorvido mais de alumínio da água. Alguns pesquisadores têm expressado preocupações de que o alumínio em antitranspirantes podem aumentar o risco de câncer de mama e de alumínio foi controversa como um fator implicado na doença de Alzheimer . O Camelford poluição da água incidente envolveu um número de pessoas que consomem sulfato de alumínio. As investigações sobre os efeitos na saúde a longo prazo ainda estão em curso, mas as concentrações de alumínio cérebro elevada foram encontrados nos exames post-mortem de vítimas, e mais pesquisas para determinar se existe uma ligação com a angiopatia amilóide cerebral foi encomendado.
De acordo com Sociedade de Alzheimer, a opinião médica e científica é que os estudos não demonstraram de forma convincente uma relação causal entre o alumínio ea doença de Alzheimer. No entanto, alguns estudos, como os da coorte PAQUID, citar a exposição de alumínio como um fator de risco para a doença de Alzheimer . Alguns placas no cérebro foram encontrados para conter o aumento dos níveis do metal. A investigação nesta área tem sido inconclusivos; acumulação de alumínio pode ser uma consequência da doença, em vez de um agente causal. Em qualquer caso, se houver alguma toxicidade de alumínio, que deve ser por meio de um mecanismo muito específico, uma vez que a exposição humana total com o elemento em forma de argila que ocorre naturalmente no solo e poeira é extremamente grande durante toda a vida. O consenso científico ainda não existe sobre se a exposição de alumínio poderia aumentar directamente o risco de doença de Alzheimer.
Efeito sobre plantas
O alumínio é primário entre os fatores que reduzem o crescimento das plantas em solos ácidos. Embora seja geralmente inofensivas para o crescimento das plantas em solos com pH neutro, a concentração em solos ácidos tóxicos de Al 3+ cações aumenta e perturba o crescimento da raiz e função.
A maioria dos solos ácidos são saturados com alumínio em vez de íons de hidrogênio. A acidez do solo é, portanto, um resultado da hidrólise de compostos de alumínio. Este conceito de "potencial de cal corrigido" para definir o grau de saturação por bases em solos tornou-se a base para procedimentos já utilizados em laboratórios de análise de solo para determinar a " necessidade de calagem "dos solos.
Trigo 's adaptação para permitir tolerância de alumínio é de tal forma que o alumínio induz uma libertação de compostos orgânicos que se ligam ao alumínio prejudiciais catiões . Sorgo se acredita ter o mesmo mecanismo de tolerância. O primeiro gene de tolerância ao alumínio foi identificada em trigo. Foi demonstrado que a tolerância de alumínio de sorgo é controlada por um único gene, como no caso do trigo. Este não é o caso em todas as plantas.
