
Sódio
Sobre este escolas selecção Wikipedia
Crianças SOS tentou tornar o conteúdo mais acessível Wikipedia por esta selecção escolas. Todas as crianças disponíveis para apadrinhamento de crianças de Crianças SOS são cuidadas em uma casa de família pela caridade. Leia mais ...
| Sódio | |||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
11 Na | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||
metálico branco prateado  Linhas espectrais de sódio | |||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||
| Nome, símbolo, número | de sódio, Na, 11 | ||||||||||||||||||||||||||||
| Pronúncia | / s oʊ d Eu ə m / SOH -dee-əm | ||||||||||||||||||||||||||||
| Categoria elemento | metal alcalino | ||||||||||||||||||||||||||||
| Grupo, período, bloco | (1) metais alcalinos , 3, s | ||||||||||||||||||||||||||||
| Peso atômico padrão | 22.98976928 (2) | ||||||||||||||||||||||||||||
| Configuração eletrônica | [ Ne ] 3s 1 2,8,1 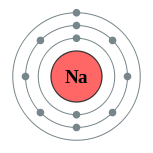 | ||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||
| Descoberta | Humphry Davy (1807) | ||||||||||||||||||||||||||||
| Primeiro isolamento | Humphry Davy (1807) | ||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||
| Densidade (perto RT) | 0,968 g · cm -3 | ||||||||||||||||||||||||||||
| Líquido densidade no pf | 0,927 g · cm -3 | ||||||||||||||||||||||||||||
| Ponto de fusão | 370,87 K , 97,72 ° C, 207,9 ° F | ||||||||||||||||||||||||||||
| Ponto de ebulição | 1,156 K, 883 ° C, 1621 ° F | ||||||||||||||||||||||||||||
| Ponto crítico | (Extrapolada) 2573 K, 35 MPa | ||||||||||||||||||||||||||||
| Calor de fusão | 2.60 kJ mol -1 · | ||||||||||||||||||||||||||||
| Calor de vaporização | 97,42 kJ mol -1 · | ||||||||||||||||||||||||||||
| Capacidade calorífica molar | 28,230 J · · mol -1 K -1 | ||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||
| Estados de oxidação | 1, -1 (Fortemente óxido de base) | ||||||||||||||||||||||||||||
| Eletronegatividade | 0,93 (escala de Pauling) | ||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 495,8 kJ · mol -1 | ||||||||||||||||||||||||||||
| Segunda: 4562 kJ mol -1 · | |||||||||||||||||||||||||||||
| 3: 6910,3 kJ · mol -1 | |||||||||||||||||||||||||||||
| Raio atômico | 186 pm | ||||||||||||||||||||||||||||
| O raio de covalência | 166 ± 21:00 | ||||||||||||||||||||||||||||
| Van der Waals raio | 227 pm | ||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||
| A estrutura de cristal | cúbica de corpo centrado  | ||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | ||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 47,7 Nco · m | ||||||||||||||||||||||||||||
| Condutividade térmica | 142 W · m -1 · K -1 | ||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) 71 uM · · K -1 m -1 | ||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 3200 m · s -1 | ||||||||||||||||||||||||||||
| O módulo de Young | 10 GPa | ||||||||||||||||||||||||||||
| Módulo de cisalhamento | 3.3 GPa | ||||||||||||||||||||||||||||
| Massa de módulo | 6.3 GPa | ||||||||||||||||||||||||||||
| Dureza de Mohs | 0,5 | ||||||||||||||||||||||||||||
| Dureza Brinell | 0,69 MPa | ||||||||||||||||||||||||||||
| Número de registo CAS | 7440-23-5 | ||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de sódio | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
Sódio é um elemento químico com o símbolo de Na (a partir Latina : sódico) na tabela periódica e número atómico 11. É um branco prateado, metal macio, altamente reactivo e é um membro dos metais alcalinos ; sua única estável isótopo é de 23 Na. O metal livre não ocorre na natureza, mas em vez disso tem de ser preparado a partir dos seus compostos; que foi isolado pela primeira vez por Humphrey Davy em 1807 pela electrólise do hidróxido de sódio . O sódio é o sexto mais abundante elemento na crosta da Terra, e existe em numerosos minerais, como feldspatos , sodalita e Rock Salt. Muitos sais de sódio são altamente solúveis em água, e seus sais de sódio foi lixiviado pela acção da água, de modo que cloreto de sódio e são os elementos dissolvidos mais comuns em peso em órgãos da Terra água oceânica .
Muitos compostos de sódio são úteis, tal como o hidróxido de sódio (soda cáustica) para soapmaking, e cloreto de sódio para utilização como um agente de degelo e um nutriente ( sal comestível). Sódio é um elemento essencial para todos os animais e algumas plantas. Em animais, os íons de sódio são usados contra potássio íons acumular cargas sobre as membranas celulares, permitindo a transmissão de impulsos nervosos quando a carga é dissipada. A consequente necessidade de animais de sódio faz com que ela seja classificada como uma dieta inorgânica macro-mineral.
Características
Físico
De sódio a a temperatura e pressão padrão é um metal macio que pode ser facilmente cortada com uma faca e é um bom condutor de electricidade. Recentemente exposto, de sódio tem um brilho brilhante, prateado que mancha rapidamente, formando uma camada branca de hidróxido de sódio e carbonato de sódio. Estas propriedades alterar a pressões elevadas: em 1.5 Mbar, a cor muda para preto, em seguida, para vermelho transparentes em 1,9 Mbar e, finalmente claros transparente a 3 mbar. Todos estes allotropes são isolantes e electrides.
Quando o sódio ou os seus compostos são introduzidos numa chama, eles transformá-lo amarelo, porque o animado 3s elétrons de sódio emitir um fóton quando eles caem de 3p a 3s; o comprimento de onda de fotão este corresponde ao A linha D em 589,3 nm. Interações spin-órbita envolvendo o elétron na divisão orbital 3p a linha D em dois; estruturas hiperfinos envolvendo tanto orbitais causam muitas mais linhas.
Químico


O sódio é geralmente menos reactivos do que os de potássio e mais reactivo do que o lítio . Como todos os metais alcalinos , reage exotermicamente com a água, para que o ponto de fusão suficientemente grandes pedaços para uma esfera e podem explodir; Esta reacção produz cáustica de hidróxido de sódio e inflamável hidrogénio gás. Quando queimado no ar seco, ele se forma principalmente peróxido de sódio, bem como alguns óxido de sódio. No ar úmido, os resultados de hidróxido de sódio. De metal de sódio é altamente redutor, com a redução de iões de sódio -2,71 volts, mas que necessitam de potássio e de lítio têm ainda potenciais mais negativos. Assim, a extracção de metais a partir dos seus compostos de sódio (tal como com cloreto de sódio) utiliza uma quantidade significativa de energia.
Isótopos
20 isótopos de sódio são conhecidas, mas apenas 23 Na é estável. Dois radioactivos, isótopos cosmogénicos são o subproduto de Espalhamento de raios cósmicos: 22 Na com uma meia-vida de 2,6 anos e de Na 24 com uma meia-vida de 15 horas; todos os outros isótopos têm uma meia-vida de menos de um minuto. Dois isómeros nucleares foram descobertas, a mais longa duração um 24m estar Na com uma meia-vida de cerca de 20,2 microssegundos. Radiações de neutrões aguda, tal como a partir de um nuclear acidente de criticidade, converte algum do estábulo 23 Na no sangue humano a 24 Na; através da medição da concentração de Na 24 em relação a 23 de Na, a dosagem de radiação de neutrões da vítima pode ser calculada.
Ocorrência
23 Na é criado no processo através da fusão de duas de queima de carbono de carbono átomos juntos; isso requer temperaturas superiores a 600 megakelvins e uma estrela com pelo menos três massas solares. A crosta da Terra tem 2,6% de sódio, em peso, tornando-o o sexto elemento mais abundante na Terra. Devido à sua elevada reactividade, que não é encontrado como elemento puro. Pode ser encontrada em muitos minerais diferentes, alguns muito solúvel, tal como halita e natron, outros muito menos solúveis, tais como anfibólio, e zeolite. A insolubilidade de certos minerais tais como de sódio criolite e feldspato surge a partir de seus aniões poliméricos, que, no caso de feldspato é um polissilicato. No meio interestelar, de sódio é identificado pela linha D; que tem uma temperatura de vaporização elevada, a sua abundância permitiu que fosse detectado por Mariner 10 em Mercury atmosfera.
Compostos

Compostos de sódio são de enorme importância comercial, sendo particularmente central para indústrias produtoras de vidro , papel, sabão, e têxteis . Os compostos de sódio, que são os mais importantes incluem o sal de mesa (Na Cl), carbonato de sódio (Na 2 CO 3 ), bicarbonato de sódio (Na HCO 3), soda cáustica (NaOH), de nitrato de sódio (Na NO 3 ), di- e tri-fosfatos de sódio, tiossulfato de sódio (Na 2 S 2 O 3 · 5H 2 O), e bórax (Na 2 B 4 O 7 · 10H 2 O). Nos seus compostos, de sódio é geralmente ionicamente ligado à água e aniões, e é visto como um duro Ácido de Lewis.

Mais sabões são sais de sódio de ácidos gordos . Sabões de sódio são mais elevados (de fusão) sabonetes mais duros do que os sabões de potássio. O cloreto de sódio é amplamente utilizado para anti-gelo e de-crosta de gelo e como conservante; bicarbonato de sódio é usado principalmente para cozinhar. Junto com potássio, muitos medicamentos importantes de sódio adicionado para melhorar a sua biodisponibilidade; embora na maioria dos casos de potássio é o melhor íon, o sódio é seleccionado para o seu preço mais baixo e peso atômico. O hidreto de sódio é utilizado como base para várias reacções (tais como a reacção de aldol ) em química orgânica, e como um agente de redução em química inorgânica.
As soluções aquosas
De sódio tende a formar compostos solúveis em água, tais como halogenetos, sulfatos, nitratos, carboxilatos e carbonatos. As principais espécies aquosas são os complexos aquo [Na (H2O) n] +, em que n = 4-6. A elevada afinidade para o oxigénio de sódio baseado no ligandos é a base de éteres coroa; antibióticos macrolídeos, que interferem com o transporte de Na + no organismo infectante, são funcionalmente relacionados e mais complexa.
Precipitação directa de sais de sódio a partir de soluções aquosas é rara, porque os sais de sódio, tipicamente têm uma elevada afinidade para a água; uma exceção é bismutato de sódio (NaBiO 3). Devido a isso, os sais de sódio são geralmente isolados como sólidos por evaporação ou por precipitação com um solvente orgânico, tal como etanol ; por exemplo, apenas 0,35 g / L de cloreto de sódio vai dissolver em etanol. Os éteres de coroa, como o 15-coroa-5, pode ser utilizado como um catalisador de transferência de fase.
O conteúdo de sódio em grandes quantidades podem ser determinadas por tratamento com um grande excesso de acetato de zinco uranyl; o hexa-hidrato de (UO2) 2 ZnNa (CH 3 CO 2) · 6H 2 O precipitados, que pode ser pesado. Rubídio e césio não interferir com esta reacção, mas de potássio e de lítio fazer. Concentrações mais baixas de sódio pode ser determinada pela espectrofotometria de absorção atómica ou por potenciometria utilizando eletrodos íon-seletivo.
Electrides e sodides
Tal como os outros metais alcalinos, de sódio dissolve-se em amoníaco e algumas aminas para dar soluções de cor profunda; a evaporação das soluções deixa uma película brilhante de sódio metálico. As soluções contêm o complexo de coordenação (Na (NH 3 6)) +, cuja carga positiva é contrabalançado por elétrons como ânions; criptandos permitir o isolamento destes complexos como sólidos cristalinos. Criptandos, como éteres de coroa e os outros ionóforos, têm uma elevada afinidade para o ião de sódio; derivados da alkalide Na - são obtidos pela adição de criptandos para soluções de sódio em amoníaco através disproporciona�o.
Compostos Organosodium

Muitos compostos organosodium foram preparadas. Por causa da elevada polaridade das ligações C-Na, comportam-se como fontes de carbaniões (sais orgânicos com aniões ). Alguns derivados bem conhecidos incluem ciclopentadieneto de sódio (NAC 5 H 5) e tritilo de sódio ((C 6 H 5) 3 CNA).
História
O sal tem sido uma commodity importante nas atividades humanas, como mostrado pelo salário Inglês palavra, que deriva de salarium, as bolachas de sal, por vezes, dado a soldados romanos junto com seus outros salários. Na Europa medieval, um composto de sódio com o nome latino de sodanum foi usado como uma dor de cabeça remédio. O nome de sódio é pensado para originar a partir do árabe suda (صداع), ou seja, dor de cabeça, como as propriedades de aliviar a dor de cabeça de carbonato de sódio ou soda eram bem conhecidos nos primeiros tempos. A abreviatura química para o sódio foi publicado pela primeira vez por Jöns Jakob Berzelius em seu sistema de símbolos atômicos, e é uma contração do elemento de natrium novo nome em latim, que remete para o egípcio natron, um sal mineral natural feito principalmente de carbonato de sódio hidratado. Natron historicamente teve vários usos industriais e domésticos importantes, depois eclipsado por outros compostos de sódio. Apesar de sódio, às vezes chamado de refrigerante, por muito tempo tinha sido reconhecido em compostos, o metal em si não foi isolado até 1807 por Sir Humphry Davy através da eletrólise do hidróxido de sódio .
De sódio confere uma cor amarela intensa às chamas. Já em 1860, Kirchhoff e Bunsen notou a alta sensibilidade de um teste chama de sódio, e afirmou em Annalen der Physik und Chemie:
| " | Em um canto da nossa sala de 60 m 3 mais distante do aparelho, que explodiu 3 mg. de clorato de sódio com açúcar do leite, enquanto observa a chama não luminosa antes da fenda. Depois de um tempo, ele brilhou um amarelo brilhante e mostrou uma linha forte de sódio que desapareceram somente após 10 minutos. A partir do peso do sal de sódio e o volume de ar na sala, que facilmente calcular que uma parte em peso de ar não pode conter mais do que 1/20 de peso milionésimos de sódio. | " |
A produção comercial
Desfrutando de aplicações em vez especializados, apenas cerca de 100 mil toneladas de sódio metálico são produzidas anualmente. De sódio metálico foi produzido comercialmente pela primeira vez em 1855 por redução carbotérmica de carbonato de sódio a 1100 ° C, no que é conhecido como o Processo Deville:
- Na 2 CO 3 + 2 C 2 → Na + 3 CO
Um processo relacionado com base na redução de hidróxido de sódio foi desenvolvido em 1886.
Sódio é actualmente produzida comercialmente através da electrólise de fundido de cloreto de sódio , baseado em um processo patenteado em 1924. Isto é feito de um Downs celular no qual o NaCl é misturado com cloreto de cálcio para reduzir o ponto de fusão abaixo de 700 ° C. Como o cálcio é menos electropositivo do que o sódio, o cálcio não vai ser depositado no cátodo. Este método é menos dispendioso do que o anterior Castner processo de eletrólise de hidróxido de sódio .
De sódio de grau reagente em quantidades tonelada vendida por cerca de US $ 3,30 / kg em 2009; menor pureza do metal é vendido por muito menos. O mercado de sódio é volátil devido à dificuldade no seu armazenamento e transporte; ele deve ser armazenado em local seco atmosfera de gás inerte ou anidro óleo mineral para evitar a formação de uma camada superficial de óxido de sódio ou superóxido de sódio. Estes óxidos podem reagir violentamente na presença de orgânicos materiais. Pequenas quantidades de sódio custar muito mais, na faixa de US $ 165 / kg; o alto custo é parcialmente devido ao custo do transporte materiais perigosos.
Aplicações
Apesar de sódio metálico tem alguns usos importantes, as principais aplicações de sódio usá-lo em seus muitos compostos; milhões de toneladas de cloreto , hidróxido , e carbonato são produzidos anualmente.
Elemento livre
De sódio metálico é usado principalmente para a produção de boro-hidreto de sódio, de azida de sódio, índigo, e trifenilfosfina. Usos anteriores foram para a fabricação de tetraetilchumbo e metal titânio; porque aplicações para estes produtos químicos foram interrompidas, a produção de sódio diminuiu após 1970. sódio também é utilizado como um metal de liga, uma agente anti-incrustação, e como um agente redutor para metal quando outros materiais são ineficazes. Lâmpadas de vapor de sódio são muitas vezes utilizada para iluminação pública nas cidades e dar cores que variam do amarelo-laranja para pêssego como a pressão aumenta. Por si só ou com o potássio, o sódio é um dessecante; ele dá uma intensa coloração azul com benzofenona quando o desiccate é seco. Em síntese orgânica, de sódio é usado em várias reacções, tais como a Redução de Birch, eo teste de fusão de sódio é conduzida para analisar qualitativamente compostos. Os lasers que emitem luz na linha D, utilizando de sódio, são usados para criar artificial guia de laser estrelas que auxiliar na óptica adaptativa para telescópios de luz visível terrestres.
Transferência de calor

Líquido de sódio é usado como um fluido de transferência de calor em alguns reatores rápidos, devido a sua alta condutividade térmica e baixa absorção de nêutrons secção transversal, que é necessária para atingir um elevado fluxo de neutrões; o ponto de ebulição elevado permite que o reactor para operar à pressão ambiente. Desvantagens do uso de sódio incluem a sua opacidade, o que dificulta a manutenção visual, e as suas propriedades explosivas. Radioativo -24 de sódio pode ser formada por activação de neutrões durante a operação, o que representa um ligeiro perigo de radiação; a radioactividade pára dentro de poucos dias após a remoção do reactor. Se um reactor tem de ser frequentemente encerradas, NaK é utilizado; devido ao facto de ser líquido à temperatura ambiente, tubos de refrigeração não congelar. Neste caso, o piroforicidade de potássio significa precauções extra contra vazamentos precisam ser tomadas. Outra aplicação é a transferência de calor de alta performance em motores de combustão interna com As válvulas de assento, em que hastes de válvula parcialmente cheios com sódio são usados como um tubo de calor para arrefecer as válvulas.
Papel biológico
Nos seres humanos, o sódio é um nutriente essencial que regula o volume de sangue, a pressão arterial, e o equilíbrio osmótico pH; o requisito mínimo para fisiológica de sódio é de 500 miligramas por dia. O cloreto de sódio é a principal fonte de sódio na dieta, e é usado como tempero e conservante, tal como, por e decapagem jerky; a maior parte dela vem de alimentos processados. O DRI para o sódio é de 2,3 gramas por dia, mas em média as pessoas nos Estados Unidos consumir 3,4 gramas por dia, a quantidade mínima que promove hipertensão ; este, por sua vez faz com que 7,6 milhões de mortes prematuras em todo o mundo.
O sistema renina-angiotensina regula a quantidade de fluidos e de sódio no corpo. Redução da pressão arterial e da concentração de sódio no rim resultado na produção de renina, que por sua vez produz e aldosterona angiotensina, retenção de sódio na urina. Por causa do aumento da concentração de sódio, a diminuição de produção de renina, e a concentração de sódio retorna ao normal. De sódio é igualmente importante na a função do neurônio e osmoregulation entre as células e os fluido extracelular, a sua distribuição mediada em todos os animais por Na + / K + -ATPase; Assim, o catião sódio é mais proeminente no fluido extracelular.
Em As plantas C4, de sódio é um micronutrientes que auxilia no metabolismo, especificamente na regeneração de fosfoenolpiruvato e síntese da clorofila. Em outros, ele substitui por potássio em várias funções, tais como a manutenção pressão de turgescência e auxiliando na abertura e fechamento de estômatos. O excesso de sódio no solo limita a absorção de água, devido à diminuição potencial de água, o que pode resultar em murcha; concentrações semelhantes no citoplasma pode conduzir à inibição da enzima, que por sua vez provoca necrose e clorose. Para evitar esses problemas, plantas mecanismos desenvolvidos que limitam a absorção de sódio por raízes, armazená-los em células vacúolos, e controlá-los através de longas distâncias; o excesso de sódio podem também ser armazenados no tecido vegetal de idade, o que limita o dano para novo crescimento.
Precauções
É necessário cuidado no manuseamento elementar de sódio, uma vez que gera hidrogénio inflamável e cáustica de hidróxido de sódio quando em contacto com água; pó de sódio pode entrar em combustão espontânea em ar ou oxigénio. O excesso de sódio pode ser removido com segurança pela hidrólise em um armário ventilado; Isto é tipicamente feito por tratamento sequencial com isopropanol, etanol e água. Isopropanol reage muito lentamente, gerando o correspondente alcóxido e hidrogênio. Extintores de incêndio em base de água acelerar fogos de sódio; aqueles à base de dióxido de carbono e bromochlorodifluoromethane perdem sua eficácia quando se dissipar. Um agente extintor é eficaz Met-LX, que compreende aproximadamente 5% Saran em cloreto de sódio em conjunto com agentes de fluxo; é mais comumente aplicada à mão com uma colher. Outros materiais incluem Lith +, que possui e um pó de grafite organofosforado retardante de chamas, e areia seca.
