
Metal alcalino
Sobre este escolas selecção Wikipedia
SOS acredita que a educação dá uma chance melhor na vida de crianças no mundo em desenvolvimento também. SOS mães cada um cuidar de uma família de crianças apadrinhadas .
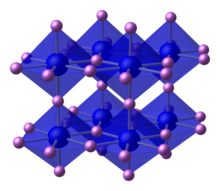
| Metais alcalinos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ↓ Período | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 |  3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 |  11 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 |  19 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 |  37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 |  55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | Francium (Fr) 87 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Lenda
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Os metais alcalinos são um grupo na tabela periódica consistindo dos elementos químicos de lítio (Li), sódio (Na), potássio (K), o rubídio (Rb), césio (Cs), e frâncio (Pe). Este encontra-se no grupo s-bloco da tabela periódica como os metais alcalinos todos têm os seus electrões externo numa s-orbital. Os metais alcalinos fornecer o melhor exemplo de tendências de grupo em propriedades na tabela periódica, com elementos que exibem bem caracterizado comportamento homóloga.
Os metais alcalinos têm propriedades muito semelhantes: todos eles são brilhante, macio, altamente metais reactivos na temperatura padrão e pressão e facilmente perdem o seu de electrões externo para formar catiões com carga 1. Eles podem todos ser facilmente cortada com uma faca, devido à sua suavidade, expondo uma superfície brilhante que mancha rapidamente no ar, devido à oxidação. Devido à sua elevada reactividade, estes devem ser armazenados sob óleo para evitar a reacção com o ar, e é encontrado naturalmente somente em sais e nunca como o elemento livre. No moderno Nomenclatura IUPAC, os metais alcalinos compreendem o grupo de elementos 1, com excepção de hidrogénio (H), que é nominalmente um elemento do Grupo 1, mas normalmente não é considerado para ser um metal alcalino, uma vez que raramente apresenta um comportamento comparável ao dos metais alcalinos. Todos os metais alcalinos reagem com a água, com os metais alcalinos mais pesados reagir mais vigorosamente do que os mais leves.
Todos os metais alcalinos descobertos ocorrem na natureza: a fim de abundância, o sódio é o mais abundante, seguido de potássio, lítio, rubídio, césio e frâncio, finalmente, que é muito rara devido ao seu extremamente alta radioactividade e, assim, ocorre apenas em traça devido à sua presença no naturais cadeias de desintegração. Os experimentos foram realizados para tentar a síntese de ununénnio (Uue), que é susceptível de ser o próximo membro do grupo, mas todos eles têm se reuniu com falha a partir de 2012. No entanto, ununénnio não pode ser um metal alcalino, devido à efeitos relativistas, que são previstas para ter uma grande influência sobre as propriedades químicas de elementos superpesados; mesmo que não vir a ser um metal alcalino, é previsível que têm algumas diferenças nas propriedades físicas e químicas dos seus homólogos mais leves.
A maioria dos metais alcalinos têm muitas aplicações diferentes. Duas das aplicações mais conhecidas dos elementos puros são rubídio e césio relógios atómicos, dos quais césio relógios atómicos são a representação mais precisa de tempo conhecido como de 2013. Uma aplicação comum dos compostos de sódio é a lâmpada de vapor de sódio, que emite uma luz muito eficiente. O sal de mesa, ou cloreto de sódio, tem sido utilizado desde a antiguidade. De sódio e de potássio são igualmente elementos essenciais, tendo como principais papéis biológicos electrólitos, e embora os outros metais alcalinos não são essenciais, eles também têm vários efeitos no corpo, tanto positivos e negativos.
Características
Químico

À semelhança de outros grupos, os membros conhecidos desta mostra família padrões em sua configuração eletrônica, especialmente as camadas externas, resultando em tendências de comportamento química:
| Z | Elemento | Número de elétrons / shell | Elétron configuração |
|---|---|---|---|
| 3 | lítio | 2, 1 | [ Ele ] 2s 1 |
| 11 | sódio | 2, 8, 1 | [ Ne ] 3s 1 |
| 19 | potássio | 2, 8, 8, 1 | [ Ar ] 4s 1 |
| 37 | rubídio | 2, 8, 18, 8, 1 | [ Cr ] 5s 1 |
| 55 | césio | 2, 8, 18, 18, 8, 1 | [ Xe ] 6s 1 |
| 87 | francium | 2, 8, 18, 32, 18, 8, 1 | [ Rn ] 7s 1 |
A maior parte da química foi observada apenas para os primeiros cinco membros do grupo. A química de frâncio não está bem estabelecida, devido à sua extrema radioactividade; Assim, a apresentação das suas propriedades aqui é limitada.
Todos os metais alcalinos são altamente reactivos e não são encontrados na forma de elemento na natureza. Devido a isso, eles são normalmente armazenados em óleo mineral ou querosene (óleo de parafina). Eles reagem agressivamente com os halogéneos para formar o halogenetos de metais alcalinos, que são branco compostos cristalinos iónicos que são todos solúveis em água, com excepção fluoreto de lítio ( Li F ). Os metais alcalinos, também reage com a água para formar fortemente alcalinas hidróxidos e, portanto, deve ser tratado com muito cuidado. Os metais alcalinos mais pesados reagem mais vigorosamente do que os mais leves; por exemplo, quando deixado cair na água, o césio produz uma explosão maior do que potássio. Os metais alcalinos têm o mais baixo primeiro energias de ionização em seus respectivos períodos da tabela periódica por causa de sua baixa carga nuclear efetiva ea capacidade de atingir um gás nobre configuração por perder apenas um elétron . A segunda energia de ionização de todos os metais alcalinos, é muito alta, uma vez que é em um escudo completo que também está mais próximo do núcleo; assim, eles quase sempre perder um único elétron, formando cátions. O alkalides são uma excepção: eles são compostos instáveis que contêm metais alcalinos em um estado de oxidação -1, o que é muito raro que antes da descoberta dos alkalides, não se esperava que os metais alcalinos para ser capaz de formar aniões e foram pensados para ser capaz a aparecer em sais apenas como catiões. Os ânions alkalide encheram subshells-s, o que lhes dá mais estabilidade e permite que eles existem. Todos os metais alcalinos estáveis, com excepção de lítio são conhecidos por serem capazes de formar alkalides, e os alkalides tem muito interesse teórico devido à sua invulgar estequiometria e baixo potenciais de ionização. Alkalides são quimicamente semelhantes ao electrides, que são sais com presas electrões na qualidade de aniões. Um exemplo particularmente impressionante de um alkalide é "inversa hidreto de sódio ", H + Na -, em oposição à habitual hidreto de sódio, Na + H -: é instável em isolamento, devido à sua elevada energia resultante do deslocamento de dois electrões do átomo de hidrogénio de sódio, apesar de vários derivados são previstos ser metaestável ou estável.
A química de lítio mostra várias diferenças de que do restante do grupo pequeno como o catião Li + polariza ânions e dá seus compostos mais uma caráter covalente. De lítio e magnésio têm um relação diagonal: por isso, lítio tem algumas semelhanças com magnésio. Por exemplo, lítio forma uma estável nitreto, uma propriedade comum entre todos os metais alcalino-terrosos (grupo de magnésio), mas único entre os metais alcalinos. Além disso, entre os seus respectivos grupos, única forma de lítio e magnésio covalente compostos organometálicos (por exemplo, Li Me e MgMe 2). Fluoreto de lítio é o único halogeneto de metal alcalino que não é solúvel em água, e hidróxido de lítio é o único hidróxido de metal alcalino que não seja deliquescente. Frâncio também está previsto mostram algumas diferenças devido ao seu alto peso atômico, fazendo com que os seus electrões para viajar em frações consideráveis de a velocidade da luz e, assim, fazer efeitos relativísticos mais proeminente. Em contraste com a tendência de diminuição eletronegatividades e energias de ionização de metais alcalinos, eletronegatividade e energia de ionização do francium estão previstas para ser maior que o de césio devido à estabilização relativístico dos elétrons 7s; Além disso, a sua raio atômico é esperado para ser anormalmente baixo.
Os compostos e reacções
A reacção com água (hidróxidos de metais alcalinos)

Todos os metais alcalinos ou explosivamente reagir vigorosamente com água fria, um produzindo solução aquosa do fortemente metal alcalino básico hidróxido e liberar gás hidrogênio. Essa reação se torna mais vigorosa que vai abaixo do grupo: lítio reage de forma constante com efervescência, mas o sódio eo potássio podem inflamar e rubídio e césio afundar na água e gerar gás hidrogênio tão rapidamente que formar ondas de choque na água que pode quebrar recipientes de vidro. Quando um metal alcalino é deixado cair na água, produz uma explosão, de que existem duas etapas separadas. O metal reage com a água em primeiro lugar, que quebra as ligações de hidrogénio em água e a produção de hidrogénio gás; este terá lugar mais rapidamente para os metais alcalinos mais pesadas mais reactivos. Em segundo lugar, o calor gerado por a primeira parte da reacção muitas vezes inflama o gás de hidrogénio, fazendo-a queimar explosivamente para o ar circundante. Esta explosão de gás de hidrogênio secundário produz a chama visível acima da bacia de água, lago ou outro corpo de água, e não a reação inicial do metal com água (que tende a acontecer na maior parte sob a água).
A reacção química dos metais alcalinos com água é:
- 2 H (s) + 2H 2 O (l) → 2 MS (aq) + H 2 (g) (em que M representa um metal alcalino)
A reacção com azoto (nitretos de metal alcalino)
Lítio, o mais leve dos metais alcalinos, é o único metal alcalino que reage com azoto em condições padrão, e a sua nitreto é a única estável nitreto de um metal alcalino. O nitrogênio é um gás não reactivo, porque quebrar o forte ligação tripla na dinitrogen molécula (N 2) requer muita energia. A formação de um nitreto de um metal alcalino iria consumir a energia de ionização do metal alcalino (formando iões M +), a energia necessária para quebrar a ligação tripla em N 2 e a formação de N 3- iões, e toda a energia libertada a partir da formação de um nitreto de um metal alcalino é o de energia de rede do nitreto de um metal alcalino. A energia de rede é maximizada com íons pequenos, altamente carregadas; os metais alcalinos não formam iões altamente carregadas, apenas a formação de iões, com uma carga de 1, portanto, apenas o lítio, o mais pequeno de metal alcalino, pode libertar energia de rede suficiente para tornar a reacção com azoto exotérmica, formando nitreto de lítio. As reações dos outros metais alcalinos com nitrogênio não iria liberar energia de rede suficiente e seria, portanto, endotérmico, para que eles não formam nitretos nas condições normais. ( Nitreto de sódio (Na 3 N) e nitreto de potássio (K 3 N), enquanto existente, são extremamente instável, sendo propenso a decomposição de volta para os seus elementos constituintes, e não podem ser produzidos por reacção dos elementos entre si, em condições normalizadas.)
A reacção química de lítio com azoto é:
- 6 Li (s) + N 2 (g) → 2 Li 3 N (s)
A reacção com oxigénio (óxidos de metais alcalinos)
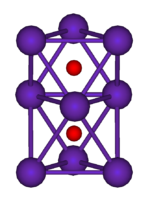 | 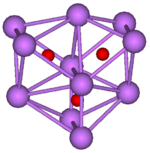 | |
Rb 9 O2 aglomerado, composto por dois regulares octaedros ligados uns aos outros por uma face | Cs 11 O 3 de cluster, composto por três octaedros regulares onde cada octaedro está ligado a a ambos os outros por cada uma das faces. Todos os três octahedra tem uma aresta em comum. |
Todos os metais alcalinos reagir vigorosamente com oxigênio em condições normais. Eles formam vários tipos de óxidos, tais como simples (óxidos que contêm o ião O) 2-, peróxidos (contendo o S 2-
2 de iões, onde existe uma ligação simples entre os dois átomos de oxigénio), superóxidos (contendo o S -
2 ion), e muitos outros. Lithium queima no ar para formar óxido de lítio, de sódio, mas reage com o oxigénio para formar uma mistura de óxido de sódio e peróxido de sódio. Potássio forma uma mistura de peróxido de potássio e superóxido de potássio, rubídio e césio, enquanto a formar superóxido exclusivamente. Seus aumentos de reactividade que vão para baixo do grupo: enquanto lítio, sódio e potássio simplesmente queimar no ar, rubídio e césio são pyrophoric (pegar fogo espontaneamente no ar).
Os menores metais alcalinos tendem a polarizar os aniões mais complexas (o peróxido e superóxido), devido ao seu pequeno tamanho. Isto atrai os electrões nos aniões mais complexos para com um dos seus átomos constituintes de oxigénio, formando um ião de óxido e um átomo de oxigénio. Isto faz com que de lítio para formar o óxido exclusivamente na reacção com oxigénio à temperatura ambiente. Este efeito torna-se drasticamente fraca para o maior de sódio e de potássio, o que lhes permite formar os peróxidos menos estáveis. Rubídio e césio, na parte inferior do grupo, são tão grandes que mesmo os superóxidos menos estáveis podem formar. Porque o superóxido libera mais energia quando formados, o superóxido é preferencialmente formado por metais alcalinos maiores, onde os ânions mais complexos não são polarizados. (Os óxidos e os peróxidos de metais alcalinos estes existem, mas não formam por reacção directa do metal com o oxigénio, em condições normalizadas.)
A reacção química dos metais alcalinos com oxigénio que se forma o óxido é:
- 4 M (s) + O2 (g) → 2 H 2 O (s) (em que M representa um metal alcalino)
A reacção química que forma o peróxido é:
- 2 H (s) + O2 (g) → H 2 O 2 (s) (em que M representa um metal alcalino)
A reacção química que forma o superóxido é:
- H (s) + O2 (g) → MO 2 (s) (em que M representa um metal alcalino)
Rubídio e césio pode formar até mesmo óxidos mais complicado do que o superoxides. Rubídio pode formar 6 Rb e Rb O 9 O 2 por oxidação no ar, enquanto césio forma uma imensa variedade de óxidos, tais como o ozonido CSO 3 e vários coloridos subóxidos, como Cs 7 O, 4 Cs O, Cs 11 O 3, 3 Cs O (verde-escuro), CSO, Cs 3 O 2, assim como Cs 7 O 2. Este último pode ser aquecida sob vácuo para produzir 2 O Cs.
A reacção com os halogénios (haletos de metal alcalino)

Os metais alcalinos são os mais eletropositivos elementos na tabela periódica e, portanto, tendem a vínculo ionicamente ao mais elementos electronegativos na tabela periódica, os halogéneos , formando sais conhecidos como os halogenetos de metais alcalinos. Isto inclui cloreto de sódio , também conhecido como sal comum. A reactividade torna-se mais elevado a partir de lítio e de césio gotas de flúor de iodo . Todos os halogenetos de metais alcalinos têm a fórmula MX, em que M é um metal alcalino e X é um halogéneo. Eles são todos os sólidos cristalinos iónicos brancos. Todos os halogenetos de metal alcalino são solúveis em água, excepto para fluoreto de lítio (LiF), que é insolúvel em água devido à sua muito elevada entalpia treliça. A entalpia elevada da estrutura de fluoreto de lítio é devido às pequenas dimensões das Li + e F - iões, fazendo com que as interacções electrostáticas entre eles sejam fortes.
A reacção química dos metais alcalinos com os halogéneos é:
- M + 2 X 2 2 → MX (em que M representa um metal alcalino e o símbolo X representa um átomo de halogénio)
Físico
Os metais alcalinos são todos excepto para césio, que tem uma tonalidade de cor de ouro-prata. Todos são suaves e têm baixas densidades , pontos de fusão e pontos de ebulição .
O quadro que se segue é um resumo das propriedades físicas e chaves atómicas dos metais alcalinos. Dados marcados com pontos de interrogação são ou incerto ou são estimativas parcialmente com base em tendências periódicas em vez de observações.
| Metal alcalino | Padrão peso atômico ( u) | Ponto de fusão | Ponto de ebulição | Densidade (G / cm 3) | Eletronegatividade ( Pauling) | Primeiro energia de ionização ( · kJ mol-1) | Raio atômico ( pm) | Chama cor teste | |
|---|---|---|---|---|---|---|---|---|---|
| Lítio | 6,94 (1) | 453,69 K , 180,54 ° C , 356,97 ° F | 1615 K, 1342 ° C, 2448 ° F | 0,534 | 0.98 | 520,2 | 152 | Vermelho | |
| Sódio | 22.98976928 (2) | 370,87 K, 97,72 ° C, 207,9 ° F | 1156 K, 883 ° C, 1621 ° F | 0,968 | 0.93 | 495,8 | 186 | Laranja persistente forte ou amarelo | |
| Potássio | 39,0983 (1) | 336,53 K, 63,38 ° C, 146,08 ° F | 1032 K, 759 ° C, 1398 ° F | 0,89 | 0.82 | 418,8 | 227 | Lilás ou rosa | |
| Rubídio | 85,4678 (3) | K 312,467, 39,31 ° C, 102,76 ° F | 961 K, 688 ° C, 1270 ° F | 1.532 | 0.82 | 403,0 | 248 | Vermelho ou violeta-avermelhado | |
| Césio | 132.9054519 (2) | 301,59 K, 28,44 ° C, 83.19 ° F | 944 K, 671 ° C, 1240 ° F | 1.93 | 0.79 | 375,7 | 265 | Azul ou violeta | |
| Frâncio | [223] | ? 300 K, ? 27 ° C, ? 80 ° F | ? 950 K, ? 677 ° C, ? 1250 ° F | ? 1.87 | ? 0,7 | 380 | ? | ? | |
Nuclear
| Z | Metal alcalino | Estável | Decaimentos | instáveis: itálico isótopos ímpar-ímpar de cor rosa | ||
|---|---|---|---|---|---|---|
| 3 | lítio | 2 | - | 7 Li | 6 Li | |
| 11 | sódio | 1 | - | 23 Na | ||
| 19 | potássio | 2 | 1 | 39 K | 41 K | 40 K |
| 37 | rubídio | 1 | 1 | 85 Rb | 87 Rb | |
| 55 | césio | 1 | - | 133 Cs | ||
| 87 | francium | - | - | Sem isótopos primordiais | ||
Todos os metais alcalinos têm números atômicos ímpares; por isso, os seus isótopos deve ser ou ímpar-ímpar (ambos próton e número de nêutrons são ímpar) ou ímpar-par ( número de prótons é estranho, mas o número de nêutrons é ainda). Núcleos ímpar-ímpar têm mesmo números de massa, enquanto núcleos ímpar-sequer têm números de massa estranha. Ímpar-ímpar nuclidos primordiais são raros porque os núcleos mais estranho e poucos são altamente instáveis com relação a decaimento beta, porque os produtos de decaimento são mesmo-mesmo, e são, portanto, mais fortemente ligados, devido à efeitos de emparelhamento nucleares: das 254 estáveis nuclídeos ou observationally estáveis, apenas cinco têm ambos um número ímpar de prótons e número ímpar de nêutrons: hidrogênio-2 ( deutério), lítio-6, boro-10, azoto-14, e tântalo-180m. Os primeiros quatro destes têm massa baixa, para que a alteração de um protão de um neutrão, ou vice-versa iria conduzir a uma proporção de protões de neutrões muito desequilibrado; o último, tântalo-180m, é o primordial única isómero nuclear, que ainda não tenha sido observada a deterioração apesar das tentativas experimentais e as previsões teóricas que não pode ser verdadeiramente estável (o decaimento é grandemente inibida por sua alta rotação). Além disso, quatro nuclides ímpares e tantos radioactivos de longa vida ( potássio-40, vanádio-50, lantânio-138, e lutécio-176) ocorrem naturalmente.
Devido à grande raridade dos núcleos ímpar-ímpar, quase todos os isótopos primordiais dos metais alcalinos são impares-mesmo (sendo as excepções a luz isótopo estável de lítio-6 e de longa duração radioisótopo de potássio-40). Para um dado número de massa estranho, pode haver apenas uma única beta-nuclide estável, uma vez que não há uma diferença na energia de ligação entre par-ímpar e ímpar sequer comparável à que existe entre even-par e ímpar-ímpar, deixando outros nuclídeos com o mesmo número de massa ( isobars) livre para decaimento beta para o nuclide de menor massa. Um efeito da instabilidade de um número ímpar de ambos os tipos de núcleos é que os elementos com números ímpares, tais como os metais alcalinos, tendem a ter menos isótopos estáveis do que os elementos de número par. Dos 26 monoisotópico elementos que têm apenas um único isótopo estável, apenas um tem um número atômico estranho - a única exceção para ambas as regras sendo berílio . Todos estes elementos também têm um número par de neutrões, com a única excepção de estar novamente berílio.
Todos os metais alcalinos, com excepção de lítio e césio têm, pelo menos, uma que ocorre naturalmente radioisótopo: de sódio e 22- de sódio-24 está radioisótopos traço produzido cosmogenically, potássio-40 e rubídio-87 tem muito longas semi-vidas e, assim, ocorrem naturalmente, e todos isótopos de frâncio são radioactivo. Césio também foi pensado para ser radioativo no início do século 20, embora tenha radioisótopos não ocorre naturalmente. (Frâncio não tinha sido descoberto ainda nesse momento.) O radioisótopo natural de potássio, potássio-40, torna-se cerca de 0,012% de potássio natural, e de potássio, assim, natural é fracamente radioactivo. O cientista soviético DK Dobroserdov observado este radioactividade fraca em uma amostra de potássio em 1925 e incorretamente assumido que eka-césio (atualmente conhecido por ser francium) estava contaminando a amostra. Em seguida, ele afirmou ter descoberto eka-césio e previu suas propriedades, nomeando-russium após seu país de origem. Pouco tempo depois, Dobroserdov começou a se concentrar em sua carreira de professor no Instituto Politécnico de Odessa, e ele não perseguir o elemento mais.

Césio-137, com uma meia-vida de 30,17 anos, é um dos dois principais produtos de cisão, juntamente com vivido médio estrôncio-90, que são responsáveis pela maior parte da de radioactividade combustível nuclear após vários anos de arrefecimento, até várias centenas de anos após o uso. Ela constitui a maior parte da radioatividade ainda à esquerda do acidente de Chernobyl . 137 Cs beta decai para bário-137m (a curta duração isómero nuclear), decai para que, em seguida, não radioactivo bário-137. É um forte emissor de radiação gama. 137Cs tem uma taxa muito baixa de captura de neutrões e não pode ser viável eliminados desta forma, mas deve ser permitido a decair. 137 CS tem sido utilizado como um marcador nos estudos de hidrologia, análogo ao uso de 3 H. Pequenas quantidades de césio-134 e césio-137 foram liberados no meio ambiente durante quase todo ensaios de armas nucleares e alguns acidentes nucleares, principalmente o Goiânia acidente eo desastre de Chernobyl . A partir de 2005, o césio-137 é a principal fonte de radiação no zona de afastamento em torno da Chernobyl usina nuclear. Juntamente com césio-134, iodo-131, e estrôncio-90, césio-137 estava entre os isótopos distribuídos pela explosão de reactor que constituem o maior risco para a saúde. O manuseio inadequado de césio-137 fontes de raios gama pode levar à liberação de esta radioisótopos e radiação lesões. Talvez o caso mais conhecido é o acidente Goiânia, de 1987, em que an-dispostos inadequadamente-de sistema de radioterapia de uma clínica abandonada na cidade de Goiânia, Brasil , foi eliminado de um ferro-velho, eo brilhante sal de césio vendido para curiosos, compradores iletrados. Isso levou a quatro mortes e ferimentos graves de exposição à radiação.
Tendências periódicas
Os metais alcalinos são mais semelhantes entre si do que os elementos em qualquer outra grupo são uns aos outros. Por exemplo, quando se movendo para baixo da mesa, todos os metais alcalinos conhecidos mostram aumento raio atômico, diminuindo eletronegatividade, aumentando reactividade, e decrescentes de fusão e pontos de ebulição. Em geral, as suas densidades aumentar quando se deslocam para baixo da mesa, com a excepção de que o potássio é menos denso do que o sódio.
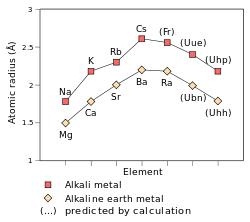
Raios atómicos e iónicos
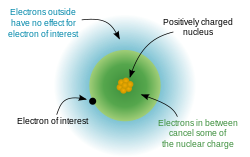
O raio atómico dos metais alcalinos aumentar a descer o grupo. Por causa da efeito de blindagem, quando um átomo possui mais do que um elétron shell, cada elétron sente repulsão elétrica dos outros elétrons, bem como a atração elétrica a partir do núcleo. Nos metais alcalinos, o elétron mais externo só se sente uma carga líquida de um, como alguns dos carga nuclear (que é igual ao número atómico ) seja cancelado por os electrões interiores; o número de electrões interiores de um metal alcalino é sempre um menor que a carga nuclear. Portanto, o único factor que afecta o raio atómico dos metais alcalinos é o número de conchas de electrões. Uma vez que este número aumenta para baixo o grupo, o raio atómico também deve aumentar-se o grupo.
O raios iónicos de metais alcalinos são muito menores do que os seus raios atómicos. Isto é porque o electrão mais exterior dos metais alcalinos é de uma forma diferente escudo do elétron que os elétrons internos, e, portanto, quando ele é removido do átomo resultante tem menos um escudo do elétron e é menor. Além disso, o carga nuclear efetiva aumentou, e, assim, os elétrons são atraídos mais fortemente para o núcleo e os decréscimos raio iônico.
Primeiro energia de ionização
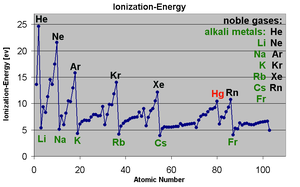
A primeira energia de ionização de um elemento ou molécula é a energia necessária para mover o electrão mais frouxamente realizada de um mole de átomos gasosos do elemento ou moléculas para formar uma mole de iões gasosos com carga eléctrica 1. Os factores que afectam a primeira energia de ionização são o carga nuclear, a quantidade de blindagem pelos elétrons internos e a distância do elétron mais fracamente retidos no núcleo, que é sempre um elétron exterior principais elementos do grupo. Os dois primeiros fatores mudar a carga nuclear efetiva o elétron mais fracamente realizada sente. Uma vez que o mais externo de electrões de metais alcalinos sempre sentir a mesma carga nuclear eficaz (1), o único factor que afecta a primeira energia de ionização é a distância entre o electrão mais exterior para o núcleo. Uma vez que esta distância aumenta para baixo o grupo, o mais externo de electrões sente menos atracção do núcleo e, portanto, a primeira energia de ionização diminui. (Esta tendência está quebrado em francium devido à estabilização relativista e contracção dos 7s orbitais, trazendo electrões de valência do frâncio mais perto do núcleo do que seria esperado a partir de cálculos não relativísticas. Isso faz com que elétron mais externo do francium sentir mais atração do núcleo, aumentando a sua primeira energia de ionização um pouco além da césio.)
A segunda energia de ionização dos metais alcalinos é muito maior do que o primeiro como o segundo mais mantido livremente electrões é parte de uma totalmente preenchida elétron shell e é, portanto, difícil de remover.
Reatividade
As reactividades dos metais alcalinos aumentar a descer o grupo. Este é o resultado de uma combinação de dois factores: os primeiros e energias de ionização energias de atomização de metais alcalinos. Porque a primeira energia de ionização dos metais alcalinos diminui para baixo o grupo, é mais fácil para o electrão mais exterior a ser removida a partir do átomo e participar em reacções químicas , aumentando assim a reactividade do grupo de baixo. A energia de atomização mede a força do ligação metálica de um elemento, o qual cai para baixo o grupo como os átomos em aumentar raio e, assim, a ligação metálica deve aumentar em comprimento, fazendo com que os electrões deslocalizados mais longe da atracção dos núcleos dos metais alcalinos mais pesados. Adicionando a atomização e energias de ionização primeiro dá uma quantidade intimamente relacionada com (mas não igual) a energia de activação da reacção de um metal alcalino com uma outra substância. Esta quantidade diminui a descer o grupo, e assim faz a energia de ativação; Assim, as reacções químicas podem ocorrer aumentos mais rápidos e a reactividade do grupo de deslocamento.
Eletronegatividade
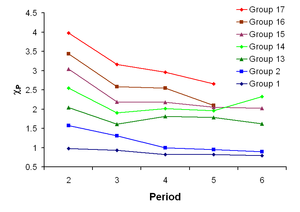
É uma electronegatividade propriedade química que descreve a tendência de um átomo ou um grupo funcional para atrair elétrons (ou densidade electrónica) para si. Se o vínculo entre sódio e cloro em cloreto de sódio foram covalente, a par de elétrons compartilhado seriam atraídos para o cloro, porque a carga nuclear efetiva sobre os elétrons exteriores é +7 em cloro, mas é apenas um em sódio. O par de electrões é atraído tão perto do átomo de cloro que eles são praticamente transferido para o átomo de cloro (uma ligação iônica). No entanto, se o átomo de sódio foi substituído por um átomo de lítio, os electrões não será atraído o mais próximo do átomo de cloro, como antes, porque o átomo de lítio é menor, fazendo com que o par de electrões mais fortemente atraída para a carga nuclear mais perto eficaz de lítio. Assim, os maiores átomos de metal alcalino (na parte inferior do grupo) será menos electronegativo como o par de ligação é menos fortemente atraído para eles.
Devido à maior electronegatividade de lítio, alguns dos seus compostos têm um carácter mais covalente. Por exemplo, iodeto de lítio ( Li I ) irá dissolver-se em solventes orgânicos , uma propriedade da maior parte dos compostos covalentes. Fluoreto de lítio (Li F ) é a única haleto alcalino que não é solúvel em água, e hidróxido de lítio (Li OH ) é o único hidróxido de metal alcalino que não seja deliquescente.
Ponto de fusão e pontos de ebulição
Os pontos de fusão e de ebulição dos metais alcalinos Metal alcalino Ponto de fusão Ponto de ebulição Lítio K 453,69 (180,54 ° C) 1615 K (1342 ° C) Sódio K 370,87 (97,72 ° C) 1156 K (883 ° C) Potássio K 336,53 (63,38 ° C) 1032 K (759 ° C) Rubídio K 312,46 (39,31 ° C) 961 K (688 ° C) Césio K 301,59 (28,44 ° C) 944 K (671 ° C) Frâncio 300 K (? 27 ° C) 950 K (? 677 ° C)
O ponto de fusão de uma substância é o ponto em que ele muda estado de sólido para líquido , enquanto o ponto de ebulição de uma substância (no estado líquido) é o ponto onde o a pressão de vapor do líquido é igual à pressão do meio ambiente circundante e o líquido todo o estado líquido muda para gás . Como um metal é aquecido até ao seu ponto de fusão, o ligações metálicas manter os átomos em lugar enfraquecer de forma que os átomos podem se movimentar, e as ligações metálicas, eventualmente, quebrar completamente em ponto de ebulição do metal. Por isso, os que caem de fusão e pontos de ebulição dos metais alcalinos indicam que a força das ligações metálicas de metais alcalinos diminui para baixo o grupo. Isso ocorre porque os átomos de metal são mantidos juntos pela atração eletromagnética dos íons positivos para os elétrons deslocalizados. À medida que os átomos de aumentar de tamanho que vai abaixo do grupo (porque as suas raio atómico aumentos), os núcleos dos iões afaste-se os electrões deslocalizados e, consequentemente, a ligação metálica torna-se mais fraca, de modo que o metal pode mais facilmente fundir e fervura, baixando assim os pontos de fusão e ebulição. (A carga nuclear aumento não é um fator relevante devido ao efeito de blindagem.)
Densidade
Os metais alcalinos têm todos a mesma estrutura cristalina ( assim, os únicos factores relevantes cúbica centrada corpo) e são o número de átomos que podem caber em um determinado volume e a massa de um dos átomos, uma vez que a densidade é definida como a massa por unidade de volume. O primeiro factor depende do volume do átomo e, portanto, o raio atómico, o que aumenta a descer o grupo; assim, o volume de um átomo de metal alcalino aumenta a descer o grupo. A massa de um átomo de metal alcalino aumenta também a descer o grupo. Assim, a tendência para as densidades dos metais alcalinos depende seus pesos atómicos e raios atómicos; Se são conhecidas figuras para estes dois factores, as proporções entre as densidades de metais alcalinos podem, em seguida, ser calculado. A tendência resultante é que as densidades dos metais alcalinos aumentar para baixo da mesa, com uma excepção no potássio. Devido a ter o menor peso atômico de todos os elementos, no seu período e ter o maior raio atômico para os seus períodos, os metais alcalinos são os metais menos densas na tabela periódica. Lítio, sódio, potássio e são as únicas três metais da tabela periódica que são menos denso do que a água.
Extensões
Embora frâncio é o mais pesado de metal alcalino que tem sido descoberto, tem havido algum trabalho teórico predizer as características físicas e químicas dos hipotéticos metais alcalinos mais pesados. Sendo o primeiro período de 8 elemento, o elemento não descoberto ununénnio (elemento 119) está previsto para ser o próximo metal alcalino após francium e se comportam como seu mais leve congêneres; No entanto, também se prevê que diferem dos metais alcalinos mais leves em algumas propriedades. Sua química está previsto para ser mais próximo do de potássio ou de rubídio em vez de césio ou francium. Isto é incomum como tendências periódicas, ignorando os efeitos relativísticos poderia prever ununénnio ser ainda mais reativo do que de césio e frâncio. Este reduzido reatividade é devido à estabilização relativista da valência eletrônica de ununénnio, aumentando a primeira energia de ionização do ununénnio e diminuindo o e metálico raio iônico; este efeito já é visto por francium. Isso pressupõe que ununénnio irá se comportar quimicamente como um metal alcalino, que, apesar de provável, não pode ser verdade, devido aos efeitos relativísticos. A estabilização relativista do 8s orbital também aumenta de ununénnio afinidade eletrônica que vai muito além do césio e frâncio; de facto, ununénnio deverá ter uma afinidade de electrões superior a todos os metais alcalinos mais leves do que. Efeitos relativísticos também causar uma grande queda no polarisability de ununénnio. Por outro lado, ununénnio está prevista para continuar a tendência de os pontos de fusão decrescentes descer o grupo, a ser esperado ter um ponto de fusão entre 0 ° C e 30 ° C.

A estabilização de electrões de valência de ununénnio e, portanto, a contracção da causa orbital 8s seu raio atómico de ser reduzido a 240 pm, muito próxima da de rubídio (247 pm), de modo a que a química da ununénnio no estado de oxidação deve ser um mais semelhante à química de rubídio do que para a de frâncio. Por outro lado, o raio iónico do Uue + ião é predito para ser maior do que a de Rb + , porque os 7p orbitais são desestabilizadas e são, portanto, maior do que as orbitais p das conchas inferiores. Ununénnio pode também mostrar o 3 estado de oxidação , o que não é vista em qualquer outro metal alcalino, para além do estado de oxidação que é uma característica dos outros metais alcalinos e é também o principal estado de oxidação de todos os metais alcalinos conhecidas: isto é porque a desestabilização e de expansão do 7p 3/2 espinor, fazendo com que os seus electrões periféricas a fim de ter uma energia de ionização inferior do que o que de outro modo seria esperado.
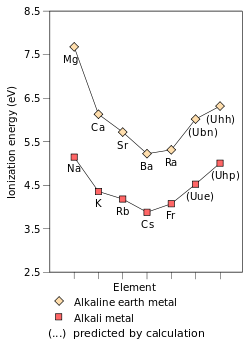
Não como muito trabalho tem sido feito predizer as propriedades dos metais alcalinos além ununénnio. Embora uma simples extrapolação da tabela periódica poria elemento 169, unhexennium, sob ununénnio, cálculos de Dirac-Fock prever que a próxima metal alcalino após ununénnio pode realmente ser elemento 165, unhexpentium, que está previsto para ter a configuração de electrões [UUO] 5g 18 6f 14 7d 10 8s 2 8p 1/2 2 9s 1 . Os cálculos adicionais mostram que unhexpentium se seguir a tendência crescente de energia de ionização para além de césio, com uma energia de ionização comparável à de sódio, e que também deve continuar a tendência decrescente de raios atómicos além de césio, com um raio atómico comparável à de potássio . No entanto, os elétrons 7d de unhexpentium também pode ser capaz de participar de reações químicas, juntamente com o elétron 9s, possivelmente permitindo estados de oxidação para além de um e talvez até mesmo fazer unhexpentium comportar mais como um elemento de grupo de boro do que um metal alcalino.
As propriedades prováveis dos metais alcalinos além unhexpentium não foram exploradas ainda a partir de 2012. Em períodos 8 e acima da tabela periódica, os efeitos relativísticos e shell-estrutura tornou tão forte que extrapolações de congéneres mais leves tornam-se completamente impreciso. Além disso, os efeitos relativísticos e shell-estrutura (que estabilizam os s-orbitais e desestabilizam e expandir o d-, f-, e G-orbitais de conchas superior) têm efeitos opostos, causando ainda maior diferença entre relativista e não relativista cálculos das propriedades dos elementos com esses altos números atómicos. Devido aos alcalinos e metais alcalino-terrosos , sendo ambos os elementos do bloco s, essas previsões para as tendências e propriedades de ununénnio e unhexpentium também se aplicam principalmente para os metais alcalino-terrosos correspondente unbinílio (NBI) e unhexhexium (Ahnn).
Outras substâncias semelhantes
Hidrogênio

O elemento de hidrogénio , com um átomo de electrões por neutro, é normalmente colocada no topo do grupo 1 da Tabela Periódica, por conveniência, mas o hidrogénio não é normalmente considerado como sendo um metal alcalino; quando ele é considerado um metal alcalino, é por causa de suas propriedades atômicas e não as suas propriedades químicas. Sob condições típicas, o hidrogénio puro existe como um gás diatómico que consiste em dois átomos por molécula (H 2 ); no entanto, os metais alcalinos formam apenas moléculas diatómicas (tais como di-lítio, Li 2 ) a altas temperaturas, quando eles estão na gasoso estado.
Hidrogênio, como os metais alcalinos, tem um elétron de valência e reage facilmente com os halogênios , mas as semelhanças param por aí. Sua colocação acima de lítio é principalmente devido a sua configuração eletrônica e não suas propriedades químicas. Às vezes, é colocado acima de carbono devido a seus eletronegatividades ou semelhantes flúor devido às suas propriedades químicas semelhantes.
A primeira energia de ionização de hidrogénio (1312,0 kJ / mol) é muito mais elevada do que a dos metais alcalinos. Como apenas um electrão adicional é requerido para preencher a camada mais externa do átomo de hidrogénio, muitas vezes hidrogénio se comporta como um átomo de halogénio, formando o negativo de ião hidreto e é por vezes considerada como um halogéneo. (Os metais alcalinos também podem formar iões negativos, conhecidos como alkalides, mas estes são pouco mais do que curiosidades de laboratório, sendo instável.) Sob extremamente altas pressões, tais como aqueles encontrados nos núcleos de Júpiter e Saturn , hidrogénio se torna metálico e se comporta como um metal alcalino; nesta fase, que é conhecido como hidrogénio metálico.

Amônio
O ião amónio (NH +
4 ) tem propriedades muito semelhantes às dos metais alcalinos mais pesados, na qualidade de um metal alcalino intermediário entre o potássio e rubídio, e é frequentemente considerada um parente próximo. Por exemplo, metais alcalinos mais sais são solúveis em água, uma propriedade que sais de amónio partes. Amónio é esperado para se comportar como um metal (NH +
4 íons em um mar de elétrons) a pressões muito elevadas, tais como no interior dos gigantes de gelo Urano e Netuno .
Tálio

Tálio exibe a um estado de oxidação que toda a visualização de metais alcalino conhecido, e compostos de tálio com tálio em um estado de oxidação são muito semelhantes às de potássio ou correspondentes prata compostos devido à raios iónicos semelhante do Tl + (164 pm), K + ( 152 pm) e Ag + (129 pm) íons. Foi por vezes considerado um metal alcalino na Europa continental (mas não na Inglaterra) nos anos imediatamente após a sua descoberta, e foi colocado imediatamente depois de césio como o sexto metal alcalino Dmitri Mendeleev 1869 's tabela periódica e 1.868 tabela periódica de Julius Lothar Meyer . (1871 tabela periódica de Mendeleev e 1870 tabela periódica de Meyer colocar tálio na sua posição atual no grupo de boro e deixar o espaço abaixo de césio em branco.) No entanto, tálio também exibe o estado de oxidação +3, que não sabe de metal exibe alcalinos (embora ununénnio, a sétima metal alcalino desconhecida, é predito para possivelmente indicar o estado de oxidação +3). O sexto metal alcalino é agora considerado francium.
História
Etimologia
Os metais alcalinos são assim chamados porque os seus hidróxidos são todos fortesálcalis quando dissolvidos em água.
Descoberta
Lítio

Petalite ( Li Al Si 4 O 10 ) foi descoberto em 1800 pelo brasileiro químico José Bonifácio de Andrada em uma mina na ilha de Utö, Suécia. No entanto, não foi até 1817 que Johan agosto Arfwedson, que então trabalhava no laboratório do químico Jöns Jacob Berzelius, detectou a presença de um novo elemento ao analisar minério petalita. Este novo elemento de compostos semelhantes aos de sódio e potássio formado, embora sua carbonato e hidróxido são menos solúveis em água e mais alcalino do que os outros metais alcalinos. Berzelius deu o material desconhecido o nome " Lithion / lithina ", do grego palavra λιθoς (transliterado como lithos , que significa "pedra"), de modo a reflectir a sua descoberta em um mineral sólido, ao contrário de potássio, que tinha sido descoberto em cinzas de plantas , e de sódio, a qual foi parcialmente conhecido pela sua elevada abundância no sangue dos animais. Ele nomeou o metal dentro do "material de lítio ".
Sódio

Compostos de sódio são conhecidos desde os tempos antigos; sal ( cloreto de sódio ) tem sido um produto importante nas atividades humanas, como testemunhado pelo Inglês palavra salário , referindo-se salarium , as bolachas de sal, por vezes, dado a soldados romanos junto com seus outros salários. Em medieval Europa um composto de sódio com a Latin nome de sodanum foi usado como um remédio dor de cabeça. Pura de sódio não foi isolado até 1807 por Humphrey Davy através da electrólise de soda cáustica (agora chamado de hidróxido de sódio), um método muito semelhante ao utilizado para isolar potássio no início do ano.
Potássio

Enquanto o potássio tem sido usado desde os tempos antigos, ele não foi compreendido por maioria de sua história para ser uma substância fundamentalmente diferente de sais minerais de sódio. Georg Ernst Stahl obtido evidência experimental que o levou a sugerir a diferença fundamental de sais de sódio e potássio em 1702 , e Henri Louis Duhamel du Monceau foi capaz de provar que esta diferença de 1736. A composição química exacta de compostos de potássio e de sódio, e o estado como elemento químico de potássio e de sódio, não era conhecida, em seguida, e, assim, Antoine Lavoisier que incluem o alcalóide na sua lista de elementos químicos em 1789. potássio puro foi isolado pela primeira vez em 1807 em Inglaterra por Sir Humphry Davy , que ele derivado de potassa cáustica (KOH, hidróxido de potássio) através da utilização de electrólise do sal fundido com o recém inventado pilha voltaica . O potássio foi o primeiro metal que foi isolado por meio de electrólise. Mais tarde nesse mesmo ano, Davy relatado extracção de sódio a partir da substância semelhante a soda cáustica (NaOH, soda cáustica) por uma técnica semelhante, demonstrando os elementos e, assim, os seus sais, a ser diferente.
Rubídio

Rubídio foi descoberto em 1861 em Heidelberg, Alemanha por Robert Bunsen e Gustav Kirchhoff, as primeiras pessoas a sugerir encontrar novos elementos de análise de espectro , no mineral lepidolite através do uso de um espectroscópio. Por causa das linhas vermelhas brilhantes do seu espectro de emissão, eles escolheram um nome derivado do latim palavra rubidus , significando vermelho escuro. A descoberta de rubídio que sucedeu de césio, também descoberto por Bunsen e Kirchhoff através de espectroscopia.
Césio
Em 1860, Robert Bunsen e Gustav Kirchhoff descobriu o césio na água mineral de Dürkheim, Alemanha. Devido às linhas brilhantes azuis em seu espectro de emissão, eles escolheram um nome derivado da palavra latina caesius , que significa azul-celeste. O césio foi o primeiro elemento a ser descoberto espectroscopicamente , apenas um ano após a invenção do espectroscópio por Bunsen e Kirchhoff.
Frâncio
Havia pelo menos quatro descobertas errôneas e incompletas antes de Marguerite Perey do Instituto Curie, em Paris, França descobriu francium em 1939 por purificação de uma amostra de actinium-227, que havia sido relatada a ter uma energia de decaimento de 220 keV. No entanto, Perey notou partículas de decaimento com um nível de energia inferior a 80 keV. Perey pensei que esta atividade decadência pode ter sido causada por um produto de decaimento anteriormente não identificado, que foi separada durante a purificação, mas saiu novamente para fora do puro actinium -227. Vários testes eliminou a possibilidade de o elemento desconhecido sendo tório , rádio , chumbo , bismuto , ou tálio . Os novos produtos exibiu propriedades químicas de um metal alcalino (como coprecipitando com sais de césio), o que levou Perey a acreditar que era elemento 87, causada pelo decaimento alfa de actinium-227. Perey em seguida, tentou determinar a proporção de decaimento beta para decaimento alfa em actinium-227. Seu primeiro teste colocar o alfa ramificação em 0,6%, um número que ela mais tarde revisto para 1%. Foi descoberto o último elemento na natureza , em vez de por síntese.
Eka-francium
O próximo elemento abaixo francium ( eka-francium) é muito provável que seja ununénnio (Uue), elemento 119, embora este não é completamente certo devido a efeitos relativísticos. A síntese de ununénnio foi tentada pela primeira vez em 1985 por bombardear um alvo de einsteinium -254 com cálcio -48 íons no acelerador superHILAC em Berkeley, Califórnia. Não foram identificados quaisquer átomos, que conduz a um rendimento de 300 limitando NB.
- 254
99Es+ 48
20Ca→302
119uue* →nenhum átomo
É altamente improvável que esta reacção será capaz de criar quaisquer átomos de ununénnio no futuro próximo, dada a tarefa extremamente difícil de fazer uma quantidade suficiente de 254 ES, que é favorecido para a produção de elementos ultraheavy devido à sua grande massa, relativamente longa meia -vida de 270 dias, e disponibilidade de quantidades significativas de alguns microgramas, para fazer um alvo grande o suficiente para aumentar a sensibilidade do ensaio ao nível exigido; einsteinium não foi encontrada na natureza e apenas tem sido produzido em laboratórios. No entanto, dado que ununénnio é apenas o primeiro período de 8 elemento na tabela periódica prolongada, que pode muito bem ser descobertos no futuro próximo, por meio de outras reacções; na verdade, mais uma tentativa de sintetizar ununénnio bombardeando um berquélio alvo com titânio íons está em curso no Centro Helmholtz GSI de Heavy Ion Research in Darmstadt, Alemanha . Actualmente, nenhuma das período de 8 elementos foram descobertas, no entanto, e também é possível, devido ao pingar instabilidades, que apenas os menor período de 8 elementos, até cerca de elemento 128, são fisicamente possível. Não há tentativas de síntese foram feitos por quaisquer metais alcalinos mais pesados, como unhexpentium, devido ao seu extremamente alto número atômico.
Ocorrência
No Sistema Solar
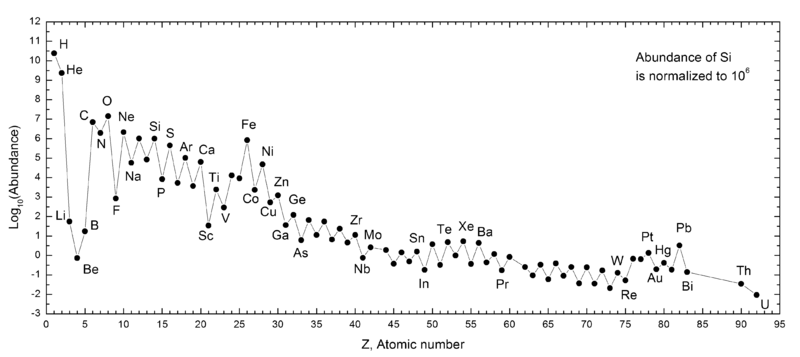
O Regra Oddo-Harkins sustenta que os elementos com até mesmo números atômicos são mais comuns que as pessoas com números atômicos ímpares, com a excepção de hidrogénio. Esta regra argumenta que elementos com número atômico ímpares têm um próton não pareado e são mais propensos a capturar outro, aumentando assim o seu número atômico. Em elementos com mesmo números atômicos, prótons são emparelhados, com cada membro do par compensando a rotação da outra, aumentando a estabilidade. Todos os metais alcalinos têm números atómicos ímpares e eles não são tão comuns como os elementos com números atómicos mesmo adjacentes a eles (os gases nobres e os metais alcalino-terrosos ) no sistema solar. Os metais alcalinos são mais pesados também menos abundantes do que os mais leves, como os metais alcalinos de rubídio em diante só podem ser sintetizados em supernovas e não em nucleosíntese estelar. O lítio também é muito menos abundante do que o de sódio e de potássio, uma vez que é pouco sintetizado em ambos nucleosíntese big bang e em estrelas: Big Bang só poderia produzir quantidades vestigiais de lítio, berílio e boro , devido à ausência de um núcleo estável, com 5 ou 8 nucleons, e nucleossíntese estelar só poderia passar esse gargalo pelo processo triplo alfa, fundindo três núcleos de hélio para formar carbono , e saltando sobre esses três elementos.
Na Terra

A Terra formada a partir da mesma nuvem de matéria que formou o Sol, os planetas, mas adquiriu composições diferentes durante a formação e evolução do sistema solar. Por sua vez, a história natural da Terra causada partes do planeta ter diferentes concentrações dos elementos. A massa da Terra é de aproximadamente 5,98 × 10 24 kg. É composto principalmente de ferro (32,1%), oxigénio (30,1%), de silício (15,1%), magnésio (13,9%), enxofre (2,9%), níquel (1,8%), de cálcio (1,5%), e de alumínio ( 1,4%); com o restante consistindo de 1,2% de vestígios de outros elementos. Devido a massa segregação, a região do núcleo acredita-se ser composto principalmente de ferro (88,8%), com pequenas quantidades de níquel (5,8%), enxofre (4,5%), e menos de 1% de oligoelementos.
Os metais alcalinos, devido à sua elevada reatividade, não ocorrem naturalmente na forma pura na natureza. Eles são lithophiles e, portanto, manter-se próximo à superfície da Terra, porque eles combinam facilmente com oxigênio e assim associar fortemente com sílica , formando relativamente minerais de baixa densidade que fazer não afundar-se o núcleo da Terra. Potássio, rubídio e césio também são elementos incompatíveis, devido à sua baixa raios iônicos.
O sódio eo potássio são muito abundantes na terra, sendo ambos entre os dez elementos mais comuns na crosta terrestre; de sódio representa cerca de 2,6% da Terra crosta medido pelo peso, tornando-se o sexto elemento mais abundante global eo mais abundante metal alcalino. Potássio representa cerca de 1,5% da crosta terrestre e é o sétimo elemento mais abundante. Sódio é encontrada em muitos minerais diferentes, das quais a mais comum é o sal comum (cloreto de sódio), o qual ocorre em grandes quantidades dissolvidos na água do mar. Outros depósitos sólidos incluem halita, anfibólio, criolita, nitratine, e zeolite.
Lítio, devido à sua reactividade relativamente baixa, podem ser encontrados na água do mar, em grandes quantidades; Estima-se que a água do mar é de cerca de 0,14-0,25 partes por milhão (ppm) ou 25 micromolar.
Rubídio é aproximadamente tão abundante como zinco e mais abundante do que o cobre. Ela ocorre naturalmente no minerais leucita, pollucite, carnallite, zinnwaldita, e lepidolite. O césio é mais abundante do que alguns elementos comummente conhecidos, tais como antimónio , cádmio , estanho , e tungsténio , mas é muito menos abundante do que o de rubídio.
Frâncio-223, o isótopo ocorrendo apenas naturalmente de francium, é o produto do decaimento alfa de actinium-227 e pode ser encontrada em pequenas quantidades em urânio e tório minerais. Em uma dada amostra de urânio, não é estimada em apenas um átomo de frâncio por cada 10 18 átomos de urânio. Calculou-se que haja, no máximo 30 g de frâncio na crosta terrestre , a qualquer momento, devido ao seu extremamente curta meia-vida de 22 minutos.
Produção


A produção de metais alcalinos puro é difícil devido à sua extrema reactividade com substâncias vulgarmente utilizados, tais como água. Os metais alcalinos são tão reactivos que eles não podem ser deslocadas por outros elementos e tem de ser isolado por meio de electrólise.
Os sais de lítio têm de ser extraídos a partir da água de nascentes de água, piscinas e salmoura, depósitos de salmoura. O metal é produzido electroliticamente a partir de uma mistura fundida de cloreto de lítio e cloreto de potássio.
Potássio ocorre em muitos minerais, tais como silvite ( cloreto de potássio). É ocasionalmente produzido através de separar o potássio do cloro em cloreto de potássio, mas é mais frequentemente produzido através da eletrólise de hidróxido de potássio, encontrado extensivamente em lugares como Canadá , Rússia , Bielorrússia , Alemanha , Israel , Estados Unidos , e Jordan , em um método semelhante à forma como sódio foi produzido no final de 1800 e início de 1900. Ele também pode ser produzido a partir de água do mar . De sódio ocorre principalmente na água do mar e secou-se fundo do mar, mas agora é produzido através da electrólise de cloreto de sódio através da redução do ponto de fusão da substância para abaixo de 700 ° C através do uso de uma célula de Downs. Extremamente pura de sódio pode ser produzido através da decomposição térmica de azida de sódio.

Durante vários anos na década de 1950 e 1960, um subproduto da produção de potássio chamado Alkarb era uma fonte principal de rubídio. Alkarb continha 21% de rubídio, enquanto o resto foi de potássio e uma pequena fracção de césio. Hoje os maiores produtores de césio, por exemplo, a mina Tanco, Manitoba, Canadá, produzir rubídio como subproduto da pollucite. Hoje em dia, um método comum para a separação de rubídio a partir de potássio e de césio é a cristalização fraccionada de um rubídio e césio alúmen ( Cs , Rb ) Al ( SO 4 ) 2 · 12 H 2 Ó , que produz puro alúmen rubídio após aproximadamente 30 diferentes reacções. As aplicações limitadas e à falta de um mineral rico em rubídio limita a produção de compostos de rubídio de 2 a 4 toneladas por ano. Césio, no entanto, não é produzido a partir da reacção anterior. Em vez disso, a mineração de minério de pollucite é o principal método de obtenção de césio puro, extraído do minério, principalmente, por três métodos: digestão ácida, alcalina de decomposição, e de redução direta.
Frâncio-223, o isótopo ocorrendo apenas naturalmente de francium, é produzido naturalmente como o produto do decaimento alfa de actinium-227. Frâncio pode ser encontrada em pequenas quantidades em urânio e tório minerais; calcula-se que no máximo há 30 g de francium na crosta da Terra em determinado momento. Como resultado da sua extrema raridade na natureza, a maioria frâncio é sintetizado na reacção nuclear 197 Au + 18 S → 210 Pe 5 + n , obtendo-se o frâncio-209, 210-frâncio, e frâncio-211. A maior quantidade de frâncio já montada a data é de cerca de 300.000 átomos neutros, os quais foram sintetizados utilizando a reacção nuclear dada acima.
Aplicações
Todos os metais alcalinos descobertos excluindo frâncio têm muitas aplicações. Lítio é frequentemente usado em baterias, e óxido de lítio pode ajudar a processo de sílica. O lítio também pode ser usado para fazer as massas lubrificantes, de tratamento de ar, e de produção de alumínio.
Pura de sódio tem muitas aplicações, incluindo a utilização em lâmpadas de vapor de sódio, que produzem luz muito eficientes em comparação com outros tipos de iluminação, e podem ajudar a alisar a superfície de outros metais. Compostos de sódio têm muitas aplicações, bem como, o ser composto mais conhecido sal de mesa. De sódio também é utilizado na fabricação de sabão na forma de sais de ácidos gordos .
Compostos de potássio são freqüentemente usados como fertilizantes como o potássio é um elemento importante para a nutrição das plantas. Outros iões de potássio são muitas vezes utilizados para segurar aniões . O hidróxido de potássio é uma base muito forte, e é usado para controlar o pH de várias substâncias.

Rubídio e césio são muitas vezes utilizados em relógios atómicos. Césio relógios atômicos são extraordinariamente precisas; se um relógio tinha sido feita na época dos dinossauros, seria desligado por menos de quatro segundos (depois de 80 milhões de anos). Por essa razão, átomos de césio são usados como a definição do segundo. Íons rubídio são frequentemente utilizados em roxo fogos de artifício, e césio é frequentemente usado em fluidos de perfuração na indústria do petróleo.
Frâncio não tem aplicações comerciais, mas por causa do relativamente simples de francium estrutura atômica , entre outras coisas, ele tem sido usado em espectroscopia de experiências, levando a mais informações sobre os níveis de energia e as constantes de acoplamento entre partículas subatômicas. Os estudos sobre a luz emitida por francium-210 íons presos por laser forneceram dados precisos sobre as transições entre níveis de energia atômica, semelhantes aos previstos pela teoria quântica .
Papel biológico e precauções

O lítio não ocorrem naturalmente em sistemas biológicos e não tem nenhum papel biológico, mas não tem efeitos sobre o organismo quando ingerido. carbonato de lítio é usado como um estabilizador do humor em psiquiatria para tratar a doença bipolar ( depressão maníaca) em doses diárias de cerca de 0,5 a 2 gramas, embora haja efeitos secundários. Ingestão excessiva de lítio provoca sonolência, fala arrastada e vómitos, entre outros sintomas, e os venenos do sistema nervoso central, o que é perigoso como a dosagem requerida de lítio para tratar a doença bipolar é apenas ligeiramente menor do que a dose tóxica. Sua bioquímica, a forma como é tratado pelo corpo humano e estudos utilizando ratos e cabras sugerem que é um essencial oligoelemento, embora a função biológica natural do lítio em seres humanos ainda tem que ser identificada.
De sódio e de potássio ocorrer em todos os sistemas biológicos conhecidos, geralmente funcionando como electrólitos dentro e fora células . Sódio é um nutriente essencial que regula o volume de sangue, a pressão sanguínea, o equilíbrio osmótico e pH; o requisito mínimo para fisiológica de sódio é de 500 miligramas por dia. O cloreto de sódio (também conhecido como sal comum) é a principal fonte de sódio na dieta, e é usado como tempero e conservante, tal como por decapagem e de carne seca; a maior parte dela vem de alimentos processados. O DRI para o sódio é de 1,5 gramas por dia, mas a maioria das pessoas nos Estados Unidos consomem mais de 2,3 gramas por dia, a quantidade mínima que promove hipertensão; este, por sua vez faz com que 7,6 milhões de mortes prematuras em todo o mundo.
O potássio é o principal catião (ião positivo) dentro de células de animais , enquanto o sódio é o principal catião fora células animais. O diferenças de concentração dessas partículas carregadas provoca uma diferença de potencial eléctrico entre o interior e exterior das células, conhecido como o potencial de membrana. O equilíbrio entre o potássio e de sódio é mantida por bombas de iões na membrana celular. O potencial de membrana celular criada por iões de potássio e de sódio permite que a célula para gerar um potencial de acção -a "pico" de descargas eléctricas. A capacidade das células para produzir descarga eléctrica é crítica para as funções corporais, tais como a neurotransmissão, contracção muscular, e a função do coração.
Rubídio não tem papel biológico conhecido, mas pode ajudar a estimularo metabolismo, e, à semelhança do césio, substitua potássio no corpo causandodeficiência de potássio.
Compostos de césio são raramente encontrados pela maioria das pessoas, mas a maioria dos compostos de césio são ligeiramente tóxico por causa da semelhança química de césio de potássio, permitindo que o césio para substituir o potássio no corpo, fazendo com que a deficiência de potássio. A exposição a grandes quantidades de compostos de césio pode causar hiperirritabilidade e espasmos, mas uma vez que tais quantidades não seriam normalmente encontradas em fontes naturais, césio não é um poluente ambiental importante produto químico. O dose letal (LD mediana 50 ) valor de cloreto de césio em murganhos é de 2,3 g por quilograma, a qual é comparável aos LD 50 valores de cloreto de potássio e cloreto de sódio . De cloreto de césio tem sido promovido como uma terapia alternativa do cancro, mas tem sido associada a morte de mais de 50 pacientes, nos quais foi utilizado como parte de um tratamento de câncer cientificamente unvalidated.
Frâncio não tem nenhum papel biológico e é mais provável de ser tóxico devido à sua extrema radioatividade, causandoenvenenamento por radiação, mas uma vez que a maior quantidade de francium jamais reunida até à data é de cerca de 300 mil átomos neutros, é pouco provável que a maioria das pessoas nunca vai encontrar francium.
