
Peróxido de hidrogênio
Você sabia ...
SOS acredita que a educação dá uma chance melhor na vida de crianças no mundo em desenvolvimento também. Antes de decidir sobre o patrocínio de uma criança, por que não aprender sobre as diferentes instituições de caridade de patrocínio primeiro ?
| Peróxido de hidrogênio | |
|---|---|
 |  |
Dióxido de Di- | |
Outros nomes μ-1κO, 2κO'-Dioxidodihydrogen | |
| Identificadores | |
| Número CAS | 7722-84-1 |
| Número RTECS | MX0900000 |
| Propriedades | |
| Fórmula molecular | H 2 O 2 |
| Massa molar | 34,0147 g · · mol -1. |
| Aparência | Cor azul muito pálido; em solução incolor |
| Densidade | 1,4 g / cm 3, líquida |
| Ponto de fusão | -11 ° C (262,15 K) |
| Ponto de ebulição | 150,2 ° C (423,35 K) |
| Solubilidade em água | Miscível |
| Acidez (p Ka) | 11.65 |
| Viscosidade | 1.245 c P a 20 ° C |
| Momento de dipolo | 2.26 D |
| Perigos | |
| MSDS | 30% de peróxido de hidrogênio msds 60% de peróxido de hidrogênio msds |
| Frases R | R5, R8, R20, R22, R35 |
| Frases-S | (S1), (S2), S17, S26, S28, S36, S37, S39, S45 |
| Principal Perigos | Oxidante, corrosivo |
| NFPA 704 |  0 3 1 OX |
| Ponto de centelha | Não inflamável |
| Os compostos relacionados | |
| Os compostos relacionados | Água Ozônio Hidrazina |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
O peróxido de hidrogénio (H 2 O 2) é um líquido azul muito pálido, o qual aparece incolor numa solução diluída, ligeiramente mais viscoso do que a água. É um fraco ácido . Tem forte As propriedades oxidantes e é, portanto, um poderoso agente de branqueamento que é usado principalmente para o branqueamento de papel, mas também encontrou o uso como um desinfectante, como um oxidador, como um anti-séptico, e em foguetes (particularmente em altas concentrações como peróxido de alta teste (HTP)) como um monopropelente, e em sistemas bipropulsores. A capacidade de oxidação de peróxido de hidrogénio é tão forte que o produto químico é considerado altamente espécies reativas de oxigênio.
História
O peróxido de hidrogênio foi isolado pela primeira vez em 1818 por Louis Jacques Thénard fazendo reagir peróxido de bário com ácido nítrico . Uma versão melhorada deste processo usado ácido clorídrico , seguido por ácido sulfúrico , para precipitar o sulfato de bário subproduto. Processo de Thénard foi utilizado a partir do fim do século 19 até meados do século 20. Métodos de produção modernos são discutidos abaixo.
Usos
Aplicações industriais
Cerca de 50% da produção mundial de peróxido de hidrogênio em 1994 foi usada para pulp- e papel-branqueamento. Outras aplicações de branqueamento estão se tornando mais importante como o peróxido de hidrogênio é visto como uma alternativa ambientalmente benigna para cloro alvejantes baseados. Ele é altamente corrosivo para os metais.
Outras aplicações industriais importantes para o peróxido de hidrogénio incluem o fabrico de O percarbonato de sódio e perborato de sódio, utilizado como branqueadores suaves em lavanderia detergentes. Ele é usado na produção de certos peróxidos orgânicos, tais como peróxido de dibenzoílo, utilizado em polimerizações e outros processos químicos. O peróxido de hidrogénio é também usada na produção de epóxidos, tais como óxido de propileno. A reacção com ácidos carboxílicos produz um correspondente ácido peroxi. O ácido peracético e ácido meta-cloroperoxibenzóico (comummente abreviado mCPBA) são preparados a partir de ácido acético e ácido meta-clorobenzóico, respectivamente. O último é geralmente feito reagir com alcenos para dar os correspondentes epóxido.
No processo de fabrico de PCB, o peróxido de hidrogénio misturados com ácido sulfúrico foi usado como o produto químico de micro ataque químico para tornar rugosa a superfície de cobre preparação.
Uma combinação de um pó à base de metal precioso catalisador, peróxido de hidrogénio, metanol e água podem produzir vapor sobreaquecido em um ou dois segundos, libertando única de CO2 e de vapor de alta temperatura para uma variedade de fins ..
Usos domésticos
- H 2 O 2 (cerca de 15%) diluída é utilizado para branquear humano cabelo, daí a frase "peróxido blonde". É absorvido pela pele com o contato e cria um local da pele capilar embolia que aparece como um branqueamento temporária da pele. Ele é usado para branquear os ossos que estão a ser colocados em exposição. A força de uma solução pode ser descrita como uma percentagem de volume ou, onde 1% de peróxido de hidrogénio liberta 3,3 volumes de oxigénio durante decomposition.Thus, uma solução a 3% é equivalente a 10 volumes, e uma solução a 6% do volume a 20, etc.
- 3% de H 2 O 2 é utilizada clinicamente para a limpeza de feridas, a remoção de tecido morto, e como um oral agente de desbridamento. Peróxido de pára lento (pequena embarcação) sangramento ferida / exsudação, bem. A maioria das soluções de peróxido de over-the-counter não são adequados para ingestão.
- 3% H 2 O 2 é eficaz no tratamento frescos (vermelho) manchas de sangue na roupa e em outros artigos. Deve ser aplicado a roupa antes de manchas de sangue pode ser acidentalmente "set" com água aquecida. A água fria e sabão são então utilizados para remover o sangue tratado com peróxido.
- O Food and Drug Administration (FDA) classificou o peróxido de hidrogênio como uma prioridade de Regulamentação (LRP) droga Baixa para uso no controle de fungos em peixe e ovos. (Ver ectoparasita.)
- Alguns jardineiros e usuários de hidroponia defendem o uso de peróxido de hidrogênio em soluções de rega. Eles afirmam que a sua decomposição espontânea libera oxigênio que aumenta o desenvolvimento da raiz de uma planta e ajuda a tratar podridão radicular (raiz morte celular devido à falta de oxigênio).
- Testes laboratoriais conduzidos por piscicultores nos últimos anos têm demonstrado que o peróxido de hidrogênio comum do agregado familiar pode ser usado com segurança para fornecer oxigênio para os peixes pequenos. O peróxido de hidrogénio liberta oxigénio por decomposição quando exposto a catalisadores tais como o dióxido de manganês.
- O peróxido de hidrogênio é um oxidante forte eficaz no controle de sulfureto e orgânicos odores relacionados em sistemas de recolha e tratamento de águas residuais. É tipicamente aplicado a um sistema de águas residuais, onde existe um tempo de retenção de 30 minutos a 5 horas antes de sulfureto de hidrogénio é libertado. O peróxido de hidrogénio oxida o sulfeto de hidrogénio e promove a bio-oxidação de odores orgânicos. O peróxido de hidrogênio se decompõe em oxigênio e água, adicionando oxigênio dissolvido ao sistema negando assim alguns Demanda Biológica de Oxigênio (DBO).
- O peróxido de hidrogénio é utilizado com éster de oxalato de fenil e um adequado O corante nas brilho paus como um agente oxidante. Ela reage com o éster de modo a formar uma instável CO 2 dímero que excita o corante para uma estado animado; o corante emite um fóton (luz) quando se relaxa espontaneamente de volta para o estado fundamental.
Armazenamento
Regulamentos variam, mas baixas concentrações, como 2,5% são amplamente disponíveis e legal para comprar para uso médico. Pequenas quantidades de muitas concentrações e graus diferentes podem ser legalmente armazenados e utilizados com poucas regulamentações.
O peróxido de hidrogénio deve ser armazenado em um recipiente feito de um material que não reage com e não catalisa a sua decomposição. Numerosos materiais e processos estão disponíveis, alguns aços inoxidáveis, muitos plásticos, vidros e algumas ligas de alumínio são compatíveis.
O peróxido é um oxidante forte e deve ser armazenado longe de fontes de combustíveis e as fontes de contaminação catalítica (ver secção decomposição ). Para além do risco de incêndio óbvias, o vapor de peróxido pode reagir com hidrocarbonetos e álcoois para formar explosivos de contacto. Porque o oxigénio é formado durante a decomposição natural do peróxido, o resultante aumento da pressão pode fazer com que um recipiente (por exemplo feito de vidro) para quebrar. Peróxido deve ser mantida sob refrigeração, como vapor de peróxido pode detonar acima de 70 ° C. Mortes ocorreram a partir do armazenamento em recipientes rotulados de forma inadequada devido a sua aparente semelhança com água.
Use como carburante
H 2 O 2 pode ser usado tanto como um monopropelente (não misturado com o combustível) ou como o componente oxidante de um foguete bipropelente. Uso como um monopropelente aproveitou a decomposição de 70-98 +%, a concentração de peróxido de hidrogénio no vapor e oxigénio. O propulsor é bombeado para uma câmara de reacção onde um catalisador, geralmente uma tela de prata ou platina, provoca a decomposição, a produção de vapor em mais de 600 ° C, que é expelido através de um bocal, geradora empuxo. H 2 O 2 monopropelente produz um máximo impulso específico (sp I) de 161 s (1,6 kN · s / kg), o que o torna um monopropelente de baixo desempenho. Peróxido gera muito menos pressão do que tóxico hidrazina, mas não é tóxico. O Sino de Rocket Belt usada água oxigenada monopropelente.
Como bipropelente H 2 O 2 é decomposto para queimar um combustível como um oxidante. Impulsos específicas tão elevadas quanto 350 s (3,5 kN · s / kg) podem ser obtidos, dependendo do combustível. O peróxido utilizado como um oxidante dá um sp um pouco menor I do que o oxigénio líquido, mas é densa, armazenável, não criogênicos e pode ser mais facilmente utilizado para accionar as turbinas a gás para dar pressões elevadas. Ele também pode ser usado para o arrefecimento de motores foguete regenerativa. Peróxido foi usado com muito sucesso como oxidante em foguetes alemães World-Guerra-II (por exemplo, T-Stoff pela Me-163), e para o low-cost britânica Black Knight e Seta lançadores pretas.
Em 1940 e 1950 os Walter turbina utilizado peróxido de hidrogénio para utilização em submarinos , enquanto submersa; verificou-se ser muito barulhento e exigem muita manutenção para comparação sistemas de energia diesel-elétrico. Alguns torpedos utilizado peróxido de hidrogénio como oxidante ou propulsor, mas esta era perigoso e foi interrompida pela maioria marinhas. Vazamentos de peróxido de hidrogênio foram responsabilizados pelos afundamentos de HMS Sidon eo Submarino russo Kursk. Foi descoberto, por exemplo, pela marinha japonesa em ensaios de torpedo, que a concentração de H 2 O 2 em curvas em ângulo reto em HTP tubagens muitas vezes pode levar a explosões em submarinos e torpedos. O peróxido de hidrogénio é utilizado ainda em Soyuz para a condução de turbinas a gás para turbobombas de energia, no entanto. SAAB Underwater Systems está fabricando o Torpedo 2000. Este torpedo, usado pela marinha sueca, é alimentado por um motor a pistão impulsionado por HTP como um oxidante e querosene como combustível num sistema bipropelente.
Embora raramente usado agora como um monopropelente para os motores grandes, peróxido de hidrogênio pequena controle de atitude propulsores ainda estão em uso em alguns satélites. Eles são fáceis de estrangular, e mais seguro para alimentar e tratar antes do lançamento de propulsores de hidrazina. No entanto, hidrazina é mais frequentemente usado em naves espaciais por causa de sua maior impulso específico e menor taxa de decomposição.
Recentemente H 2 O 2 / propileno tem sido proposto como uma abordagem para barato Estágio único para orbitar: um tanque de combustível que contém propileno tem uma bexiga flutuante contendo H 2 O 2. Esta combinação oferece 15% eu superiores sp O2 / RP4 (um querosene utilizado como propulsor do foguete), não precisa ou turbinas armazenamento criogénico ou hardware, e reduz o custo do reforço. O potencial deste e de outros sistemas alternativos é discutido em algum detalhe no Engenharia Dunn.
Uso terapêutico
O peróxido de hidrogênio é geralmente reconhecido como seguro (GRAS) como um agente antimicrobiano, um agente oxidante e para outros fins por os EUA Food and Drug Administration.
O peróxido de hidrogénio foi utilizado como um agente anti-séptico e anti-bacteriana durante muitos anos devido ao seu efeito oxidante. Embora seu uso tem diminuído nos últimos anos com a popularidade de melhor-cheiro e mais facilmente disponível sobre os produtos contrários, ele ainda é usado por muitos hospitais, médicos e dentistas em esterilização, limpeza e tratamento de tudo, do piso à procedimentos de canal radicular.
- Como muitos anti-sépticos oxidativas, hidrogênio perioxide causa danos leves a tecido em feridas abertas, mas também é eficaz em parar rapidamente sangramento capilar (sangue escorrendo lenta a partir de pequenas embarcações em abrasões), e às vezes é usado com moderação para esse fim, bem como a limpeza .
- O peróxido de hidrogénio pode ser usado como uma pasta de dentes, quando misturado com as quantidades correctas de bicarbonato de sódio e sal.
- Peróxido de hidrogênio e peróxido de benzoíla são por vezes utilizados para tratar a acne .
- O peróxido de hidrogénio é utilizado como um emético na prática veterinária.
- usos "Alternativas"
- Algumas pessoas tentaram usar o peróxido como um tratamento para o câncer. O American Cancer Society afirma que "não há evidência científica de que o peróxido de hidrogénio é um seguro, eficaz e útil tratamento do câncer", e aconselha pacientes com câncer para "permanecer sob os cuidados de médicos qualificados que usam métodos de tratamento provado e aprovado ensaios clínicos de promissor novos tratamentos. "
- Outro procedimento médico alternativo é controversa inalação de peróxido de hidrogénio a uma concentração de cerca de 1%. Utilização interna de peróxido de hidrogénio tem uma história de causar fatal doenças do sangue, e a sua utilização recente como um tratamento terapêutico tem sido associada a várias mortes .
Propriedades físicas
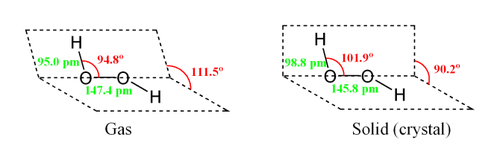
Enquanto o anti confórmero minimizaria repulsões estéricas, um ângulo de 90 ° de torção se optimizar a mistura entre o p-tipo, carregados orbital do oxigénio (um dos pares livres) e o LUMO do vínculo vicinal OH. Reflectindo um compromisso entre as duas interacções, peróxido de hidrogénio gasoso e líquido adopta uma anticlinal forma "enviesada". Esta conformação de rotação é um compromisso entre o confórmero anti, que minimize repulsão estérica, e entre o confórmero syn que associa com ligações OH pares solitários sobre os átomos de oxigênio. Apesar do facto de a ligação OO é uma ligação simples, a molécula tem uma notavelmente elevada barreira para completar a rotação de 29,45 kJ / mol (em comparação com 12,5 kJ / mol para a barreira de rotação do etano ). O aumento da barreira também é atribuída a repulsão entre um par solitário e outros pares solitários. O ângulos de ligação são afectados pela ligação de hidrogénio, que é relevante para a diferença estrutural entre gasoso e formas cristalinas; na verdade, uma vasta gama de valores é visto em cristais contendo molecular H 2 O 2.
Propriedades químicas
H 2 O 2 é um dos mais potentes oxidantes conhecidos - mais forte do que o cloro , dióxido de cloro, e permanganato de potássio . Além disso, através de catálise, H 2 O 2 podem ser convertidos em radicais hidroxilo (.OH) com reactividade apenas a segunda flúor.
| Oxidante | Potencial de oxidação, V |
|---|---|
| Flúor | 3.0 |
| Radical hidroxila | 2.8 |
| Ozônio | 2.1 |
| Peróxido de hidrogênio | 1,8 |
| O permanganato de potássio | 1,7 |
| O dióxido de cloro | 1,5 |
| Cloro | 1.4 |
Peróxido de hidrogênio pode se decompor espontaneamente em água e oxigênio. Geralmente, actua como um agente de oxidação, mas existem muitas reacções onde actua como um agente redutor, libertando oxigénio como um subproduto.
É também facilmente forma tanto inorgânicos e orgânicos peróxidos.
Decomposição
O peróxido de hidrogênio sempre decompõe (disproportionates) exotermicamente em água e oxigênio gás espontaneamente:
- 2 H 2 O 2 → 2 H2O + O2
Este processo é muito favorável; ele tem uma Δ H o de -98,2 kJ · mol -1 e um Δ G o de -119,2 kJ mol -1 · Ds e um de 70,5 J · · mol -1 K -1. A taxa de decomposição é dependente da temperatura e da concentração do peróxido, bem como a o pH e a presença de impurezas e estabilizadores. O peróxido de hidrogénio é incompatível com muitas substâncias que catalisam a sua decomposição, incluindo a maioria dos metais de transição e dos seus compostos. Catalisadores comuns incluem o dióxido de manganês e a prata . A mesma reacção é catalisada pela enzima catalase, encontrado no fígado, cuja função principal do corpo é a remoção de subprodutos tóxicos de metabolismo e a redução de estresse oxidativo. A decomposição ocorre mais rapidamente em alcalino, de modo que o ácido é muitas vezes adicionado como um estabilizador.
A libertação de oxigénio e de energia na decomposição tem efeitos colaterais perigosos. Derramando peróxido de alta concentração de uma substância inflamável pode causar um fogo imediato, que é alimentada pelo oxigênio liberado pela decomposição de peróxido de hidrogênio. Peróxido de alta resistência (também chamado peróxido de alta teste, ou HTP) deve ser armazenado num recipiente adequado, ventilada para impedir a acumulação de gás de oxigénio, o que, de outra forma conduzir à eventual ruptura do recipiente.
Na presença de certos catalisadores, tal como Fe 2+ ou Ti 3+, a decomposição pode ser um caminho diferente, com radicais livres tais como HO · ( hidroxilo) e HOO · sendo formada. Uma combinação de H 2 O 2 e Fe 2+ é conhecido como O reagente de Fenton.
A concentração comum para o peróxido de hidrogénio é "volume de 20", o que significa que, quando um volume de peróxido de hidrogénio é decomposto, que produz 20 volumes de oxigénio. A 20 "volume" concentração de peróxido de hidrogênio é equivalente a 1,67 mol / dm 3 ( Solução molar) ou cerca de 6%.
O peróxido de hidrogênio disponível em lojas da droga é de três por cento solução. Em tais pequenas concentrações, é menos estável, e decompõe-se mais rapidamente. É geralmente estabilizadas com acetanilida, uma substância que tem efeitos secundários tóxicos em quantidades significativas.
Reações redox
Em solução aquosa, o peróxido de hidrogénio pode oxidar ou reduzir uma grande variedade de iões inorgânicos. Quando actua como um agente redutor, de oxigénio gás também é produzido. Em ácido solução de Fe2 + é oxidado a Fe3 +,
- 2 Fe2 + (aq) + H 2 O 2 + 2 H + (aq) 2 → Fe3 + (aq) + 2H 2 O (l)
e sulfito (SO 3 2-) é oxidado a sulfato (SO 4 2-). No entanto, o permanganato de potássio é reduzida a Mn 2+ por H 2 O 2 ácida. Sob condições alcalinas, no entanto, algumas destas reacções reversa; por exemplo, Mn 2+ Mn é oxidado a 4+ (conforme MnO 2).
Outro exemplo de peróxido de hidrogénio actua como um agente de redução é a reacção com hipoclorito de sódio, este é um método conveniente para a preparação de oxigénio no laboratório.
- NaOCl + H 2 O 2 → O2 + NaCl + H2O
O peróxido de hidrogênio é frequentemente utilizado como um agente oxidante em química orgânica. Uma aplicação é para a oxidação de tio�eres para sulfóxidos. Por exemplo, metilo sulfureto de fenil-hidropirano para se fenil metil sulfóxido em 99% de rendimento em metanol em 18 horas (ou 20 minutos usando um TiCl3 catalisador):
- Ph-S-CH3 + H 2 O 2 → Ph-S (O) -CH 3 + H2O
Peróxido de hidrogénio alcalino é usado para epoxidação de alcenos deficientes em electrões tais como ácidos acrílicos, e também para a oxidação de para alquilboranos álcoois , o segundo passo de hidroboração-oxidação.
A formação de compostos de peróxido
O peróxido de hidrogénio é um ácido fraco, e pode formar hidroperóxido ou peróxido sais ou derivados de diversos metais.
Por exemplo, em adição a uma solução aquosa de ácido crómico (CrO3) ou soluções de sais de ácidos de dicromato, que irá formar um peróxido azul instável CrO (O 2) 2. Em solução aquosa ele decompõe-se rapidamente para formar gás de oxigénio e sais de crómio.
Ela também pode produzir peroxoanions por reacção com ânions ; por exemplo, reacção com bórax leva a perborato de sódio, um alvejante usado em detergentes para a roupa:
- Na 2 B 4 O 7 + 4 H2O + 2 2 NaOH → 2 Na 2 B 4 O 2 (OH) 4 + H2O
H 2 O 2 converte ácidos carboxílicos (RCOOH) em ácidos peroxi (RCOOOH), que são por sua vez utilizados como agentes oxidantes. O peróxido de hidrogénio reage com acetona para formar peróxido de acetona, e que interage com ozono para formar trióxido de hidrogénio. A reacção com a ureia produz peróxido de carbamida, usado para branqueamento dos dentes. Um aduto ácido-base com óxido de trifenilfosfina é um "transportador" útil para a H 2 O 2 em algumas reacções.
O peróxido de hidrogénio reage com ozono para formar trioxidane.
Alcalinidade
O peróxido de hidrogênio é um muito mais fraco de base de água, mas ainda pode formar aductos com ácidos muito fortes. O superácido HF / SBF 5 formas compostos instáveis que contenham a [H 3 O 2] + ion.
Fabricação
O peróxido de hidrogênio é fabricado hoje quase que exclusivamente pelo autoxidação de 2-etil-9,10-hidr (C 16 H 14 O 2) a 2-etil-antraquinona (C 16 H 12 O 2) e peróxido de hidrogénio utilizando o oxigénio do ar.
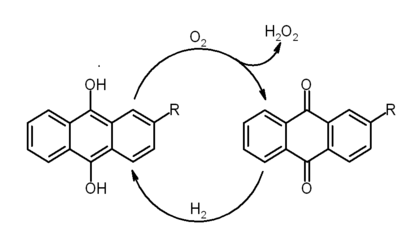
Nesta reacção, os grupos hidroxi no anel do meio de antraceno são desprotonados e são transformados em cetonas , enquanto duas ligações duplas são perdidos a partir do anel do meio e são substituídos como C = O ligações duplas nos grupos cetona. O derivado de antraquinona é então extraiu-se para fora e para trás reduzida para o composto di-hidroxi com hidrogénio gás na presença de um metal catalisador . A equação geral para o processo é extremamente simples:
- H 2 O 2 + → H 2 O 2
No entanto a economia do processo de reciclagem dependerá eficaz dos solventes de quinona e de extracção, e de a hidrogenação do catalisador .
Anteriormente foram utilizados processos inorgânicos, empregando a electrólise de uma solução aquosa de ácido sulfúrico ou ácido bissulfato de amónio (NH4 HSO 4), seguido pela hidrólise do peroxidissulfato ((SO 4) 2) 2- que é formado.
Em 1994, a produção mundial de H 2 O 2 foi de cerca de 1,9 milhões toneladas e cresceu a 2,2 milhões em 2006, a maior parte dos quais era a uma concentração de 70% ou menos. Nesse ano a granel 30% H 2 O 2 vendido por cerca de US $ 0,54 por kg , o equivalente a US $ 1,50 por kg (US $ 0,68 por lb) em uma "base de 100%".
Concentração
O peróxido de hidrogênio funciona melhor como um propulsor em altíssima concentrations-- aproximadamente mais de 70%. Embora qualquer concentração de peróxido irá gerar algum do gás quente (de oxigénio, mais um pouco de vapor), em concentrações acima de aproximadamente 67%, o calor de decomposição de peróxido de hidrogénio se torna grande o suficiente para vaporizar completamente todo o líquido à temperatura normal. Isto representa um ponto de segurança e de utilização de viragem, uma vez que a decomposição de qualquer concentração superior a esta quantidade é capaz de transformar o líquido inteiramente para gás aquecido (quanto maior for a concentração, o mais quente do gás resultante). Esta mistura de vapor / oxigénio muito quente pode então ser utilizada para gerar um impulso máxima, potência, ou de trabalho, mas também faz com que a decomposição explosiva do material muito mais perigosa.
As concentrações normais de grau propulsor, por conseguinte, variar de 70 a 98%, com os tipos comuns de 70, 85, 90, e 98%. Muitos destes tipos e variações encontram-se descritos em pormenor nos Estados Unidos número de especificação propulsor MIL-P-16005 Revisão F, que está actualmente disponível. Os fornecedores disponíveis de alta concentração de peróxido de hidrogênio grau propulsor são geralmente uma das grandes empresas comerciais que fazem outros tipos de peróxido de hidrogénio; Incluindo Solvay Interox, FMC, Degussa e Peróxido de Propulsão. Outras empresas que fizeram o peróxido de hidrogênio grau propulsor no passado recente incluem Air Liquide e DuPont. DuPont recentemente vendeu seu negócio de fabricação de peróxido de hidrogênio a Degussa.
Peróxido de hidrogênio grau propulsor está disponível para compradores qualificados. Normalmente este produto químico só é vendido a empresas comerciais ou instituições governamentais que têm a capacidade de manusear e utilizar o material corretamente. Não profissionais têm adquirido 70% ou menor concentração de peróxido de hidrogénio (a 30% restante é água com vestígios de impurezas e de materiais de estabilização, tais como sais de estanho, fosfatos, nitratos, e outros aditivos químicos), e aumentou-se a sua concentração. Muitos amadores tentar destilação , mas isso é extremamente perigoso com peróxido de hidrogénio; vapor de peróxido pode inflamar-se ou explodir, dependendo das combinações específicas de temperatura e pressão. Em geral, qualquer massa fervente de peróxido de hidrogênio de alta concentração à pressão ambiente irá produzir peróxido de hidrogênio vapor fase que pode detonar. Este risco é mitigado, mas não totalmente eliminada com destilação a vácuo. Outras abordagens para a concentração de peróxido de hidrogénio são sparging e cristalização fraccionada.
Alta concentração de peróxido de hidrogênio está prontamente disponível em 70, 90 e 98% concentrações em tamanhos de 1 litro, de 30 litros, e volumes de caminhões-tanque a granel. Peróxido de hidrogênio grau propulsor está sendo usado em sistemas militares atuais e está em numerosos programas de defesa e aeroespacial investigação e desenvolvimento. Muitas empresas de foguetes financiamento privado está usando peróxido de hidrogénio, nomeadamente Blue Origin, e alguns grupos amadores têm manifestado interesse em fabricar seu próprio peróxido, para a sua utilização e para a venda em pequenas quantidades para os outros.
Perigos
O peróxido de hidrogénio, quer em estado puro ou diluído, pode representar vários riscos:
- Acima de concentrações de cerca de 10%, de peróxido de hidrogénio pode desprender vapor que pode detonar acima de 50 ° C (158 ° F) à pressão atmosférica normal. Isto pode então provocar uma explosão de vapor líquido em ebulição em expansão ( BLEVE) do líquido restante. A destilação de peróxido de hidrogénio a pressões normais é, portanto, altamente perigosa.
- Vapores de peróxido de hidrogénio podem formar explosivos contacto sensíveis com hidrocarbonetos, tais como graxas. Reacções perigosas que variam de ignição para a explosão têm sido relatadas com álcoois , cetonas , ácidos carboxílicos (particularmente ácido acético ), aminas e fósforo . O provérbio é "peróxidos matar químicos".
- O peróxido de hidrogênio, se derramado na roupa (ou outros materiais inflamáveis), será preferencialmente evaporar a água até que a concentração atinge força suficiente, então a roupa vai inflamar espontaneamente. ;
- Peróxido de hidrogénio concentrado (> 50%) é corrosivo, e até mesmo soluções doméstico-força pode causar irritação nos olhos, membranas mucosas e pele. A ingestão de soluções de peróxido de hidrogénio é particularmente perigosa, como decomposição no estômago liberta grandes quantidades de gás (10 vezes o volume de uma solução a 3%) que conduz a hemorragias internas. Inalar mais de 10% pode causar irritação pulmonar grave.
- As baixas concentrações de peróxido de hidrogénio, na ordem de 3% ou menos, quimicamente irá branquear muitos tipos de roupa que entra em contacto com a uma tonalidade rosada. O cuidado deve ser exercitado ao usar produtos comuns que podem conter peróxido de hidrogênio, como o limpador facial ou solução para lentes de contato, que facilmente borrifar sobre outras superfícies.
O peróxido de hidrogénio é produzido naturalmente como um subproduto do metabolismo do oxigénio, e virtualmente todos os organismos conhecidos como enzimas possuem peroxidases, que aparentemente inofensiva cataliticamente decompõe baixas concentrações de peróxido de hidrogénio em água e oxigénio (ver decomposição acima).
Em um incidente, várias pessoas ficaram feridas após um derramamento de peróxido de hidrogênio a bordo Northwest Airlines vôo 957 porque o confundiu com água.
Durante a Segunda Guerra Mundial alguns campos de extermínio experimentalmente matou pessoas com injeções de peróxido de hidrogênio.
O peróxido de hidrogênio também fez parte dos ingredientes nas 21 de julho de 2005 bombas de metro de Londres, que não explodiram.
Um MSDS conterá mais informações sobre os riscos de trabalhar com este produto químico.
