
Chlorure de zinc
À propos de ce écoles sélection Wikipedia
SOS Enfants, un organisme de bienfaisance de l'éducation , a organisé cette sélection. Parrainer un enfant de faire une réelle différence.
| Chlorure de zinc | |
|---|---|
 | |
Chlorure de zinc | |
Autres noms Zinc (II) chlorure, | |
| Identificateurs | |
| Numéro CAS | 7646-85-7 |
| Numéro RTECS | ZH1400000 |
| Propriétés | |
| Formule moléculaire | ZnCl 2 |
| Masse molaire | 136,315 g / mol |
| Apparence | Solide cristallin blanc. |
| Densité | 2,907 g / cm³, solide |
| Point de fusion |
275 ° C (548 K) |
| Point d'ébullition | 756 ° C (1029 K) |
| Solubilité dans l'eau | 432 g / 100 ml (25 ° C) |
| Structure | |
| Crystal structure | Quatre formes connues Hexagonale emballés gros (δ) est la seule forme stable lorsque anhydre. |
| Coordination géométrie | Tétraédrique , quatre coordonnée, linéaire dans la phase gazeuse. |
| Risques | |
| FS | MSDS externe |
| Classification UE | Irritant (I), Corrosif (C). |
| Phrases-R | R34, R50, R53 |
| Phrases S | S7 / 8, S28, S45, S60, S61 |
| Des composés apparentés | |
| D'autres anions | Le fluorure de zinc, le bromure de zinc, l'iodure de zinc |
| D'autres cations | Cuivre (II) chlorure , le chlorure de cadmium |
| Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
Chlorure de zinc est le nom du composé chimique avec la formule Zn Cl 2 et de ses hydrates. Les chlorures de zinc, dont neuf formes cristallines sont connues, sont incolores ou blanches et très soluble dans l'eau. ZnCl 2 est lui-même hygroscopique et même déliquescente. Les échantillons doivent donc être protégés des sources d'humidité, y compris la vapeur d'eau présente dans l'air ambiant. Chlorure de zinc trouve une large application dans le textile de traitement, flux métallurgiques, et la synthèse chimique.
Structure et propriétés de base
Quatre formes cristallines, que l'on appelle polymorphes, de ZnCl 2 sont connus, et dans chaque cas, les ions Zn 2+ sont coordinence tétraédrique à quatre ligands de chlorure. Le refroidissement rapide de ZnCl 2 en fusion donne un verre, ce est un solide amorphe rigide. En outre ZnCl 2 formes hydrates et au moins un hydroxyde mixte, ZnClOH.
Le caractère covalent est de la matière anhydre est indiqué par son relativement faible point de fusion de 275 ° C. Une preuve supplémentaire de la covalence est fourni par la forte solubilité du dichlorure de éthérées solvants tels que dans lequel il forme adduits avec la formule ZnCl 2 L 2 où L = ligand tel que O (C 2 H 5) 2. Conformément à la Une acidité de Lewis de Zn 2+, des solutions aqueuses de ZnCl 2 sont des solutions acides: un 6 Solution aqueuse a un M pH de 1.
Quatre hydrates de chlorure de zinc sont connus. ZnCl 2 (H 2 O) 4 cristallise à partir de solutions aqueuses de chlorure de zinc. Caractérisé également des ZnCl 2 (H 2 O) n où n = 1, 1,5, 2,5 et 3. Lorsque le chlorure de zinc hydraté est chauffé, on obtient un résidu de ZnOHCl.
En solution aqueuse, le chlorure de zinc se dissocie complètement en Zn 2+. Ainsi, bien que de nombreux sels de zinc ont différentes formules et différents structures cristallines, ces sels se comportent de manière similaire en solution aqueuse. Par exemple, les solutions préparées à partir de l'une quelconque des polymorphes de ZnCl 2 ainsi que d'autres halogénures (bromure, iodure) et le sulfate peuvent souvent être utilisés de manière interchangeable pour la préparation d'autres composés de zinc. Des exemples est la préparation de carbonate de zinc:
- ZnCl 2 ( aq) + Na 2 CO 3 (aq) → ZnCO 3 (s) + 2 NaCl (aq)
Préparation et purification
ZnCl2 anhydre peut être préparé à partir de zinc et du chlorure d'hydrogène.
- Zn 2 + HCl → H 2 + ZnCl 2
Les formes hydratées et les solutions aqueuses peuvent être aisément préparés par traitement de pièces de Zn métal avec de l'acide chlorhydrique concentré. L'oxyde de zinc et le sulfure de zinc réagit avec HCl:
Contrairement à de nombreux autres éléments, le zinc existe essentiellement dans un seul état d'oxydation, 2+, ce qui simplifie la purification.
Les échantillons commerciaux de chlorure de zinc contiennent typiquement de l'eau et des produits de produit d'hydrolyse. De tels échantillons peuvent être purifiés par extraction à chaud dans le dioxanne, que l'on filtre à chaud et on refroidit le filtrat pour obtenir un précipité de ZnCl 2. Échantillons anhydres peuvent être purifiés par sublimation dans un courant de chlorure d'hydrogène gazeux, puis on chauffe à 400 ° C dans un courant sec de l'azote gazeux. Enfin, la méthode la plus simple repose sur le traitement du chlorure de zinc avec le chlorure de thionyle.
Applications
Comme un flux métallurgique
Chlorure de zinc a la capacité d'attaquer des oxydes métalliques (MO) pour donner des dérivés de formule MZnOCl 2. Cette réaction est en rapport avec l'utilité de ZnCl 2 en tant que Flux pour souder - il se dissout revêtements d'oxyde d'exposer la surface métallique propre. Typiquement, ce flux est préparée en dissolvant une feuille de zinc dilué dans de l'acide chlorhydrique jusqu'à ce que le liquide a cessé d'évoluer hydrogène; pour cette raison, ce flux a été autrefois connue comme esprits tués . En raison de sa nature corrosive, ce flux ne est pas adapté pour les situations où tout résidu ne peut pas être nettoyés de là, comme le travail électronique. Cette propriété conduit également à son utilisation dans la fabrication de magnésie pour ciments plombages dentaires et certains les bains de bouche comme ingrédient actif.
En synthèse organique
Au laboratoire, le chlorure de zinc trouve une large utilisation, principalement en tant que force modérée Acide de Lewis. Il peut catalyser (A) le Synthèse de Fischer-indole, ainsi que (B) Réactions d'acylation de Friedel-Crafts impliquant activés des cycles aromatiques
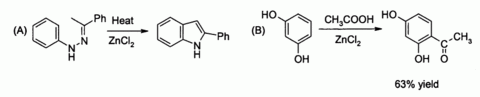
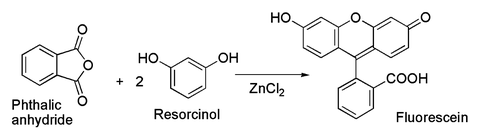
En rapport avec cette dernière est la préparation classique du colorant fluorescéine partir l'anhydride phtalique et le résorcinol, ce qui implique un Acylation de Friedel-Crafts. Cette transformation a en fait été réalisée en utilisant même le hydraté ZnCl2 échantillon représenté dans l'image ci-dessus.
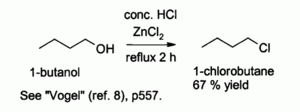
L'acide chlorhydrique seul réagit mal avec alcools primaires et les alcools secondaires , mais une combinaison de HCl avec ZnCl 2 (aussi appelées " Lucas réactif ") est efficace pour la préparation de chlorures d'alkyle. Les réactions typiques sont effectuées à 130 ° C. Cette réaction se déroule probablement par l'intermédiaire d'un N 2 S mécanisme avec des alcools primaires, mais S N 1 voie avec des alcools secondaires.
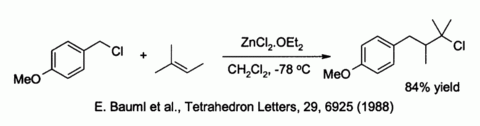
Le chlorure de zinc active également benzylique et halogénures allyliques vers la substitution par faible des nucléophiles tels que des alcènes :
De la même façon, ZnCl2 favorise sélective NaBH 3 CN réduction d'halogénures tertiaires allyliques ou benzyliques des hydrocarbures correspondants.
Le chlorure de zinc est également un réactif de départ utile pour la synthèse de nombreux organozincique réactifs, tels que ceux utilisés dans la catalysées par le palladium Couplage avec Negishi des halogénures d'aryle ou les halogénures de vinyle. Dans de tels cas, le composé organique du zinc est habituellement préparé par transmétallation d'un ou un organolithien Réactif de Grignard, par exemple:
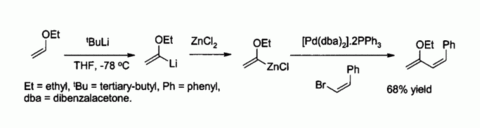
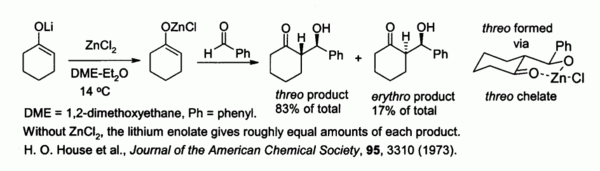
Zinc énolates, préparé à partir d'énolates de métaux alcalins et de ZnCl 2, de fournir un contrôle dans stéréochimie réactions d'aldolisation en raison de chélation sur le zinc. Dans l'exemple illustré ci-dessous, la thréo produit a été favorisée par rapport à la erythro par un facteur de 5: 1 à 2 lorsque ZnCl DME / l'éther a été utilisé. Le chelate est plus stable lorsque le groupe phényle est volumineux pseudo équatoriale plutôt que pseudo- axial, ce est-thréo plutôt que érythro.
Dans le traitement du textile
Des solutions aqueuses concentrées de chlorure de zinc (plus de 64% de chlorure en poids / poids de zinc dans l'eau) ont la propriété intéressante de dissolution amidon, soie, et cellulose. Ainsi, ces solutions ne peuvent pas être filtrés à travers des papiers filtres standard. Pertinentes pour son affinité pour ces matériaux, ZnCl 2 est utilisé comme un agent d'ignifugation et en tissu "Rafraîchisseurs» comme Febreze
Les considérations de sécurité
Les sels de zinc sont relativement non toxiques. Précautions qui se appliquent à ZnCl anhydre 2 sont ceux applicables aux autres halogénures métalliques anhydre, ce est à dire l'hydrolyse peut être exothermique et le contact doit être évité. Les solutions concentrées sont acides et corrosif et attaque spécifiquement cellulose et soie Des acides de Lewis. Voir la fiche signalétique dans le tableau.

