
Paracétamol
Renseignements généraux
SOS Enfants a fait cette sélection Wikipedia aux côtés d'autres écoles des ressources . SOS Enfants a regardé des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
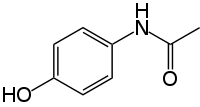 | |
|---|---|
 | |
| Systématique ( UICPA ) nom | |
| N - (4-hydroxyphényl) éthanamide N - (4-hydroxyphényl) acétamide | |
| Les données cliniques | |
| Les noms commerciaux | Tylenol (USA), Anacin Aspirin gratuit (USA), Apra (USA), Crocine (Inde), Feverall (USA), Genapap (USA), Panadol (Royaume-Uni), Panadol (Australie), Panodil (Danemark), Efferalgan (France ), Doliprane (France) Dafalgan (France) |
| AHFS / Drugs.com | monographie |
| MedlinePlus | a681004 |
| les données de licence | FDA: lien |
| Chat de grossesse. | Un ( UA ) B ( US ) en toute sécurité |
| Statut légal | U nscheduled ( UA ) GSL ( Royaume-Uni ) OTC ( US ) |
| Routes | Oral, rectale, intraveineuse |
| Des données pharmacocinétiques | |
| Biodisponibilité | ~ 100% |
| Métabolisme | 90 à 95% Hépatique |
| Demi-vie | 1-4 h |
| Excrétion | Rénal |
| Identificateurs | |
| Numéro CAS | 103-90-2 |
| Code ATC | N02 BE01 |
| PubChem | CID 1983 |
| DrugBank | DB00316 |
| ChemSpider | 1906 |
| UNII | 362O9ITL9D |
| KEGG | D00217 |
| ChEBI | CHEBI: 46195 |
| ChEMBL | CHEMBL112 |
| données chimiques | |
| Formule | C 8 H 9 N O 2 |
| Mol. masse | 151,17 g / mol |
SMILES
| |
InChI
| |
| Les données physiques | |
| Densité | 1,263 g / cm³ |
| Faire fondre. point | 169 ° C (336 ° F) |
| Solubilité dans l'eau | 12,78 mg / ml (20 ° C) |
Paracétamol INN (pron .: / ˌ p ær ə s Je t ə m ɒ l / Ou / ˌ p ær ə s ɛ t ə m ɒ l /), Ou l'acétaminophène USAN / ə ˌ s Je t ə m ɪ n ə fa ɨ n /, Nommé chimiquement N-acétyl-p-aminophénol, est largement utilisé over-the-counter analgésiques (analgésique) et antipyrétique (antipyrétique).
Le paracétamol est classé comme un analgésique doux. Il est couramment utilisé pour le soulagement des maux de tête et autres douleurs mineures et est un ingrédient important dans de nombreux froid et la grippe remèdes. En combinaison avec analgésiques opioïdes, le paracétamol peuvent également être utilisés dans la gestion de la douleur plus sévère telle que la douleur post-chirurgicale et de fournir soins palliatifs chez les patients atteints de cancer avancé. Bien que l'acétaminophène est utilisé pour traiter la douleur inflammatoire, il ne est généralement pas considéré comme un AINS car il présente seulement une activité anti-inflammatoire faible.
Le début de l'analgésie est d'environ 11 minutes après l'administration orale de paracétamol et son demi-vie est de 1-4 heures. Bien que généralement sans danger pour l'utilisation aux doses recommandées (1000 mg par dose unique et jusqu'à 4000 mg par jour pour les adultes), aiguë surdoses de paracétamol peut endommager les reins potentiellement mortelle, le cerveau et dommages au foie et, dans de rares individus, une dose normale peut faire la même chose. Le risque peut être accentué par chronique l'abus d'alcool. la toxicité de paracétamol est la première cause de l'insuffisance hépatique aiguë dans le Monde occidental, et les comptes pour la plupart des surdoses de drogue aux États-Unis, le Royaume-Uni, l'Australie et la Nouvelle-Zélande.
Ce est le métabolite actif de la goudron de houille dérivés phénacétine, une fois populaire comme un analgésique et antipyrétique dans son propre droit. Cependant, contrairement à la phénacétine et ses combinaisons, le paracétamol est pas considéré cancérogène à doses thérapeutiques. Les mots de l'acétaminophène (utilisé aux États-Unis, Canada, Japon, Corée du Sud, Hong Kong, et l'Iran) et le paracétamol (utilisé ailleurs) deux proviennent d'un nom chimique pour le composé: para - ACET yl aminophen ol et par un - ACET yl h inophen ol. Dans certains contextes, il est simplement abrégé en APAP, pour une p cétyl- Ara- un henol mino p.
Les utilisations médicales
Fièvre
Le paracétamol est approuvé pour réduire la fièvre chez les personnes de tous âges. L' Organisation mondiale de la Santé (OMS) recommande que seul le paracétamol être utilisé pour traiter la fièvre chez les enfants si leur température est supérieure à 38,5 ° C (101,3 ° F). L'efficacité de paracétamol par lui-même chez les enfants atteints de fièvre a été interrogé et une méta-analyse a montré qu'il est moins efficace que l'ibuprofène.
Douleur
Le paracétamol est utilisé pour le soulagement des douleurs associées à de nombreuses parties du corps. Il dispose d' analgésiques propriétés comparables à celles de l'aspirine , tandis que ses effets anti-inflammatoires sont plus faibles. Il est mieux tolérée que l'aspirine chez les patients chez lesquels excessive sécrétion d'acide gastrique ou la prolongation du temps de saignement peut être un sujet de préoccupation. Disponible sans ordonnance, il a, ces dernières années de plus en plus devenir un médicament ménage commun.
Le paracétamol peut soulager la douleur de l'arthrite légère mais n'a aucun effet sur l'inflammation sous-jacente, la rougeur et l'enflure de l'articulation. Il est aussi efficace que le non-stéroïdiens médicament anti-inflammatoire ( AINS) ibuprofène pour soulager la douleur de l'arthrose du genou.
Le paracétamol a relativement peu d'activité anti-inflammatoire, à la différence d'autres analgésiques courants tels que la AINS aspirine et l'ibuprofène.
En ce qui concerne comparative l'efficacité, les études montrent des résultats contradictoires par rapport aux AINS. Un essai contrôlé randomisé de la douleur chronique de l'arthrose chez les adultes a révélé avantage analogue de paracétamol et l'ibuprofène.
L'efficacité du paracétamol lorsqu'il est utilisé dans une forme de combinaison avec des opioïdes faibles (comme la codéine) a été mise en doute par des études récentes de données; la faible quantité de données disponibles ont fait parvenir à une conclusion difficile. médicaments de combinaison de paracétamol et opioïdes forts comme la morphine ont été montré pour réduire la quantité d'opioïde utilisé et améliorer l'effet analgésique ainsi que la surutilisation décourageant d'opioïdes addictifs en raison d'effets toxiques de APAP, car elle épuise glutathion et exacerbe ainsi la maladie en général.
Un essai contrôlé randomisé de la douleur musculosquelettique aiguë chez les enfants a révélé que l'over-the-counter dose standard d'ibuprofène donne plus de soulagement de la douleur à la dose standard de paracétamol.
Les effets indésirables
Aux doses recommandées, le effets secondaires de paracétamol sont doux, voire inexistante. A la différence de l'aspirine, ce ne est pas un antithrombotique, et peut donc être utilisé chez les patients dont coagulation est une préoccupation, et il ne cause pas d'irritation gastrique. Toutefois, le paracétamol ne aide pas à réduire l'inflammation, tandis que l'aspirine fait. Par rapport à ibuprofène dont les effets secondaires peuvent inclure la diarrhée, des vomissements et des douleurs abdominales-paracétamol a moins d'effets secondaires gastro-intestinaux. Utilisation quotidienne prolongée augmente le risque de complications gastro-intestinales supérieures tels que saignement de l'estomac, et peut causer des reins ou du foie dommages. Le paracétamol est métabolisé par le foie et est hépatotoxiques; effets secondaires peuvent être plus susceptibles de alcooliques chroniques ou les patients ayant des lésions du foie.
Jusqu'en 2010, le paracétamol a cru danger pendant la grossesse (comme il ne affecte pas la fermeture du fœtus canal artériel que les AINS peuvent). Cependant, dans une étude publiée en Octobre 2010, il a été lié à l'infertilité dans la vie adulte de l'enfant à naître. Contrairement à l'aspirine, il est sécuritaire pour les enfants, le paracétamol ne est pas associé à un risque de Le syndrome de Reye chez les enfants atteints de maladies virales. l'utilisation de paracétamol pour la fièvre dans la première année de vie a été associée à une augmentation de l'incidence de l'asthme symptômes à 6-7 ans, et que l'utilisation de paracétamol, à la fois dans la première année de vie et chez les enfants âgés de 6-7 ans, a été associé à une incidence accrue de rhino-conjonctivite et l'eczéma . Les auteurs ont reconnu que leurs "conclusions auraient pu être en raison de la confusion par indication", ce est à dire, que l'association ne peut être causale, mais plutôt en raison de la maladie traitée avec du paracétamol, et a souligné que de plus amples recherches sont nécessaires. En outre, un certain nombre d'éditoriaux, de commentaires, de la correspondance, et leurs réponses ont été publiés dans The Lancet concernant la méthodologie et les conclusions de cette étude. L'organisme de réglementation du Royaume-Uni de la Médicaments et produits Healthcare Regulatory Agency, également passé en revue ces recherches et publié un certain nombre de préoccupations quant à l'interprétation des données, et offrent les conseils suivants pour les professionnels de la santé, les parents et les soignants: «Les résultats de cette nouvelle étude ne nécessitent aucune modification les directives actuelles pour une utilisation chez les enfants. paracétamol reste un choix sûr et approprié d'analgésique chez les enfants. Il ya pas suffisamment de preuves de cette recherche de changer d'orientation concernant l'utilisation de antipyrétiques chez les enfants. "
Les utilisateurs chroniques de paracétamol peuvent avoir un risque plus élevé de développer cancer du sang.
Dose excessive
Paracétamol hépatotoxicité est, de loin, la cause la plus fréquente d'insuffisance hépatique aiguë à la fois aux États-Unis et le Royaume-Uni. Toxicité de paracétamol se pose souvent en raison de son métabolite quinone. Résultats de surdosage de paracétamol en plus d'appels à centres antipoison aux États-Unis que surdose de toute autre substance pharmacologique. Signes et symptômes de toxicité du paracétamol peuvent être initialement absent ou vague. Surdosage non traitée peut conduire à insuffisance hépatique et la mort en quelques jours. Le traitement vise à retirer le paracétamol et le corps de substitution, glutathion. Le charbon activé peut être utilisé pour diminuer l'absorption de paracétamol si le patient présente pour le traitement peu après le surdosage. Bien que l'antidote, acétylcystéine, (également appelé N-acétylcystéine ou NAC) agit comme un précurseur de glutathion, aidant le corps à se régénérer suffisamment pour éviter d'endommager le foie, une greffe du foie est souvent nécessaire en cas de dommages au foie devient grave. N-acétylcystéine aide également à neutraliser le métabolite imidoquinone d'acétaminophène. L'insuffisance rénale est aussi un effet secondaire possible.
Il ya comprimés disponibles (de marque au Royaume-Uni Paradote) qui combinent paracétamol avec un antidote ( methionine), pour protéger le foie en cas de surdosage.
En Juin 2009, un US Food and Drug Administration (FDA) Comité consultatif a recommandé que de nouvelles restrictions devraient être placés sur l'utilisation du paracétamol aux États-Unis pour aider à protéger les gens contre les effets toxiques potentiels. La dose maximale à un moment donné serait diminué de 1,000 mg à 650 mg, tandis que des combinaisons de paracétamol et narcotiques analgésiques seraient interdites. Les membres du comité ont été particulièrement préoccupés par le fait qu'on ne avait démontré les doses maximales actuelles de paracétamol pour produire des altérations dans la fonction hépatique. Le 13 Janvier 2011, la FDA a demandé aux fabricants de produits de combinaison d'ordonnance contenant du paracétamol pour limiter la quantité de paracétamol à pas plus de 325 mg par comprimé ou capsule et a commencé à exiger des fabricants de mettre à jour les étiquettes de tous les produits combinaison de prescription de paracétamol pour avertir de la risque potentiel pour de graves dommages au foie. Les fabricants auront trois ans pour limiter la quantité de paracétamol dans leurs produits de médicaments d'ordonnance à 325 mg par unité de dosage. En Novembre 2011, le Médicaments et produits de santé Agence de réglementation révisé UK dosage de paracétamol liquide pour les enfants.
Classification
Le paracétamol est partie de la classe de médicaments appelés " analgésiques aniline ";.. ce est la seule de ces médicaments encore en usage aujourd'hui ne est pas considéré comme un AINS, car il ne présente pas d'activité anti-inflammatoire significative (il est un inhibiteur de la COX faible) Ce est en dépit de la preuve que le paracétamol et les AINS ont une activité pharmacologique similaire.
Mécanisme d'action

A ce jour, le mécanisme d'action du paracétamol est pas complètement compris. Le principal mécanisme proposé est l'inhibition de la cyclo-oxygénase (COX), et des découvertes récentes suggèrent qu'il est hautement sélectif pour COX-2. Bien qu'il ait analgésique et propriétés fébrifuges comparables à ceux de l'aspirine ou autre AINS, son activité anti-inflammatoire périphérique est généralement limitée par plusieurs facteurs, dont l'un est le niveau élevé de les peroxydes présents dans lésions inflammatoires. Cependant, dans certaines circonstances, une activité anti-inflammatoire comparable à même périphérique Les AINS peuvent être observées. Un article paru dans Nature Communications de chercheurs à Londres, Royaume-Uni et Lund, en Suède en Novembre 2011 a trouvé un indice pour le mécanisme analgésique du paracétamol (acétaminophène), étant que les métabolites de paracétamol par exemple NAPQI, agir sur TRPA1-récepteurs dans la moelle épinière pour supprimer la transduction du signal à partir des couches superficielles de la corne dorsale, pour soulager la douleur. Cette conclusion a été contestée dans un nouveau document d'hypothèse sur la façon dont le paracétamol pourrait agir. L'auteur reconnaît que NAPQI est le métabolite actif mais que ce composé réactif doit réagir non seulement avec le thiol dans TRPA1 mais aussi avec tout autre nucléophile appropriée disponible, il arrive que de rencontrer. Il est suggéré que des groupes thiol proteases à cysteine, par exemple, les protéases qui participent à la transformation de procytokines, tels que ceux générant IL-1β et IL-6, pourrait être la cible donnant lieu à des effets analgésiques généraux.
En raison de sa sélectivité pour la COX-2 ne inhibe pas significativement la production de la pro-coagulation thromboxanes.
La famille d'enzymes COX sont responsables du métabolisme de de l'acide arachidonique la prostaglandine H 2, une molécule instable qui, à son tour, converti en de nombreux autres composés pro-inflammatoires. Les anti-inflammatoires classiques tels que la AINS bloquent cette étape. Seulement lorsqu'il est oxydé appropriée est l'enzyme COX très actif.
Paracétamol réduit la forme oxydée de l'enzyme COX, l'empêchant de former des produits chimiques pro-inflammatoires. Cela conduit à une quantité réduite de prostaglandine E2 dans le SNC, réduisant ainsi la consigne hypothalamique dans le centre de la thermorégulation.
Paracétamol module également la système cannabinoïde endogène. Le paracétamol est métabolisé en AM404, un composé avec plusieurs actions; ce qui est plus important, ce est qu'il inhibe la recapture de la cannabinoïde endogène / vanilloïde anandamide par les neurones. L'anandamide recapture aboutirait à des niveaux plus faibles et moins synaptiques l'activation du récepteur de la douleur principale (nocicepteurs) du corps, le TRPV1 (nom plus: récepteur vanilloïde). En inhibant la recapture de l'anandamide, les niveaux de la synapse restent élevés et sont capables de désensibiliser le récepteur TRPV1 semblable la capsaïcine. En outre, AM404 inhibe les canaux de sodium, comme le font les anesthésiques lidocaïne et la procaine. Chacune de ces actions par eux-mêmes a été montré pour réduire la douleur, et sont un mécanisme possible pour le paracétamol. Cependant, il a été démontré que, après blocage des récepteurs de cannabinoïdes avec des antagonistes synthétiques, les effets analgésiques de paracétamol sont empêchées, ce qui suggère son action anti-douleur implique le système cannabinoïde endogène. Spinal récepteurs TRPA1 ont également été démontré que la médiation des effets antinociceptifs de paracétamol et Δ9-tetrahydrocannabiorcol chez la souris.
L'aspirine est connue pour inhiber la cyclooxygénase (COX) famille d'enzymes et, parce que l'action de paracétamol est partiellement similaire à l'aspirine de, beaucoup de recherches ont porté sur l'opportunité paracétamol inhibe également COX. Il est maintenant clair que le paracétamol agit par au moins deux voies.
Les mécanismes exacts par lesquels COX est inhibée dans diverses circonstances sont encore un sujet de discussion. En raison des différences dans l'activité de paracétamol, l'aspirine et d'autres AINS, il a été émis l'hypothèse que d'autres variantes peuvent exister COX. Une théorie soutient que le paracétamol agit en inhibant la COX-3 isoforme - un inhibiteur de COX-1 variant d'épissage - de la famille des enzymes COX. Lorsqu'elle est exprimée chez le chien, cet enzyme part une forte similitude avec les autres enzymes COX, produit chimiques pro-inflammatoires, et est sélectivement inhibée par le paracétamol. Toutefois, certaines études ont suggéré que, chez les humains et les souris, le COX-3 enzyme est sans action inflammatoire et le blocage de paracétamol de celui-ci ne est pas significatif dans son fonctionnement chez l'homme. Une autre possibilité est que les blocs de paracétamol cyclo-oxygénase (tel que l'aspirine), mais que, dans un environnement inflammatoire où la concentration de peroxydes est élevé, l'état d'oxydation du paracetamol élevé empêche son action. Cette idée signifierait que le paracétamol n'a aucun effet direct sur le site de l'inflammation, et agit plutôt dans le SNC où l'environnement ne est pas oxydatif, pour réduire la température, etc. Le mécanisme exact par lequel le paracétamol est censé affecter la COX-3 est contestée .
Structure et réactivité

Le paracétamol est constitué d'un benzène noyau annulaire, substitué par un un groupe hydroxyle et l' azote d'un atome un groupe amide en position para (1,4) motif. Le groupe amide est acétamide (éthanamide). Ce est un largement système conjugué, comme le seule paire sur l'oxygène hydroxyle, le benzène pi nuage, la paire libre d'azote, le p orbital sur la carbonyle carbone, et le doublet libre sur l'oxygène du carbonyle sont tous conjugués. La présence de deux groupes activateurs font également le noyau benzénique fortement réactifs vis une substitution aromatique électrophile. Comme les substituants sont ortho, para -directing et para par rapport à l'autre, toutes les positions sur l'anneau sont plus ou moins également activé. La conjugaison permet également de réduire considérablement la basicité des oxygènes et l'azote, tout en faisant l'hydroxyle acide à travers la délocalisation de la charge développée sur le phénoxyde anion .
Synthèse
En laboratoire, le paracétamol est facilement préparé par la nitration du phénol avec le nitrate de sodium, la séparation du para-nitrophénol à partir de la position ortho désirée - sous-produit, et la réduction du un groupe nitro avec le borohydrure de sodium. La résultante 4-aminophénol est ensuite acétylé avec l'anhydride acétique. Dans cette réaction, le phénol est fortement activation, ainsi que la réaction ne nécessite que des conditions douces (cf. la nitration du benzène). Le procédé industriel est analogue, mais l'hydrogénation est utilisée à la place de la réduction au borohydrure de sodium.
Une synthèse plus simple par Hoechst-Celanese implique l'acylation directe du phénol avec de l'anhydride acétique catalysée par HF, de la conversion de la cétone à une cétoxime avec hydroxylamine, suivie par la catalyse acide Réarrangement de Beckmann pour donner l'amide.
La demande de paracétamol aux États-Unis a été estimé à 30 à 35000 tonnes par an en 1997, égale à la demande du reste du monde.
Métabolisme
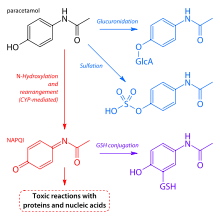
Le paracétamol est métabolisé principalement dans le foie, en produits toxiques et non toxiques. Trois voies métaboliques sont remarquables:
- La glucuronidation est censé représenter 40% à deux tiers du métabolisme du paracétamol.
- Sulfatation (sulfate conjugaison) peut représenter de 20 à 40%.
- N-hydroxylation et réarrangement, puis GSH conjugaison, comptent pour moins de 15%. Le hépatique système enzymatique du cytochrome P450 métabolise le paracétamol, la formation d'un métabolite d'alkylation significative encore mineure connue sous le nom NAPQI (p-benzo-quinone-imine de la N de) (également connu sous le nom N-acetylimidoquinone). NAPQI est alors irréversible conjuguée avec la groupes sulfhydryle de glutathion.
Les trois voies donnent des produits finals qui sont inactives, non toxique, et finalement excrété par les reins. Dans la troisième voie, cependant, le produit intermédiaire de NAPQI est toxique. NAPQI est principalement responsable des effets toxiques de paracétamol; ce qui constitue un exemple de intoxication.
Production de NAPQI est principalement attribuable à deux isoenzymes du cytochrome P450: CYP2E1 et CYP1A2. Le gène de la P450 est fortement polymorphes, cependant, et les différences individuelles dans la toxicité du paracétamol On pense due à un troisième isoenzyme, CYP2D6. Polymorphismes génétiques des CYP2D6 peut contribuer sensiblement différents taux de production de NAPQI. En outre, les individus peuvent être classés comme "étendus", "ultra-rapides", "intermédiaires" et "pauvres" métaboliseurs (producteurs de NAPQI), en fonction de leurs niveaux d'expression CYP2D6. Bien CYP2D6 métabolise dans NAPQI paracétamol dans une moindre mesure que d'autres enzymes du cytochrome P450, son activité peut contribuer à la toxicité du paracetamol dans métaboliseurs rapides et ultrarapides, et lorsque le paracétamol est pris à des doses très importantes. Aux doses habituelles, est rapidement détoxifié NAPQI par conjugaison avec le glutathion. À la suite de surdosage, et éventuellement aussi chez les métaboliseurs ultra-rapides et importantes, cette voie de détoxification se sature, et, en conséquence, NAPQI accumule provoquant une toxicité rénale et hépatique.
Réactions
4-aminophénol peut être obtenu par l'amide hydrolyse de paracétamol. 4 aminophénol préparé de cette façon, et lié à la vente dans le commerce Metol, a été utilisé comme révélateur dans la photographie par les amateurs. Cette réaction est également utilisé pour déterminer le paracétamol dans des échantillons d'urine: Après hydrolyse avec de l'acide chlorhydrique, 4-aminophénol réagit dans une solution d'ammoniac avec un dérivé de phénol, par exemple l'acide salicylique, pour former un indophénol teindre en vertu de l'oxydation par l'air.
Histoire

Acétanilide a été le premier dérivé d'aniline par hasard trouvé à posséder analgésique ainsi que des propriétés fébrifuges, et a été rapidement introduite dans la pratique médicale sous le nom de Antifebrin par A. Cahn et P. Hepp en 1886. Mais ses effets toxiques inacceptables, l'être le plus alarmant cyanose due à la méthémoglobinémie, stimulé la recherche pour les dérivés de l'aniline moins toxiques. Harmon Northrop Morse avait déjà synthétisé au paracétamol Johns Hopkins University via la réduction des p -nitrophénol avec l'étain dans glaciaire de l'acide acétique en 1877, mais ce ne est qu'en 1887 que pharmacologue clinicien Joseph von Mering essayé paracétamol sur les patients. En 1893, von Mering a publié un rapport de papier sur les résultats cliniques de paracétamol avec la phénacétine, un autre dérivé d'aniline. Von Mering affirmé que, contrairement à la phénacétine, le paracétamol avait une légère tendance à produire une méthémoglobinémie. Le paracétamol a ensuite été rapidement écartée en faveur de la phénacétine. Les ventes de la phénacétine établis Bayer comme une société pharmaceutique de premier plan. Éclipsé en partie par l'aspirine , introduit dans la médecine par Heinrich Dreser en 1899, la phénacétine était populaire pendant de nombreuses décennies, en particulier dans largement annoncés over-the-counter "mélanges de maux de tête", contenant généralement la phénacétine, un aminopyrine dérivé de l'aspirine, la caféine, et parfois barbiturique.
Les allégations de Von Mering demeurées essentiellement incontesté pendant un demi-siècle, jusqu'à ce que deux équipes de chercheurs des États-Unis ont analysé le métabolisme d'acétanilide et le paracétamol. En 1947, David Lester et Leon Greenberg trouvé des preuves solides que le paracétamol était un métabolite majeur de la acétanilide dans le sang humain, et dans une étude ultérieure ils ont signalé que de fortes doses de paracétamol donnés à des rats albinos ne ont pas provoqué une méthémoglobinémie. Dans trois articles publiés dans le numéro de Septembre 1948, de la Journal of Pharmacology and Experimental Therapeutics, Bernard Brodie, Julius Axelrod et Frederick Flinn confirmés en utilisant des méthodes plus spécifiques que le paracétamol était le principal métabolite de acétanilide dans le sang humain, et ont établi qu'il était tout aussi efficace un analgésique comme son précurseur. Ils ont également suggéré que la méthémoglobinémie est produit chez les humains principalement par un autre métabolite, phénylhydroxylamine. Un document de suivi par Brodie et Axelrod en 1949 a établi que la phénacétine a également été métabolisé au paracétamol. Cela a conduit à une «redécouverte» de paracétamol. Il a été suggéré que la contamination de paracétamol avec 4-aminophénol, la substance von Mering synthétisé à partir, peut être la cause de ses conclusions fausses.
Le paracétamol a été commercialisé pour la première aux États-Unis en 1953 par Sterling Winthrop-Co., qui a favorisé qu'il est préférable de l'aspirine car il était sûr de prendre pour les enfants et les personnes souffrant d'ulcères. La marque la plus connue aujourd'hui pour paracétamol aux États-Unis, Tylenol, a été créé en 1955, lorsque Laboratoires McNeil a commencé à vendre du paracétamol comme un soulagement de la douleur et la fièvre pour les enfants, sous le nom de la marque Elixir-le mot «Tylenol» de Tylenol pour enfants était une contraction de para -ACE Tyl aminoph énol. En 1956, 500 comprimés mg de paracétamol sont en vente au Royaume-Uni sous le nom commercial Panadol, produit par Frédéric Stearns & Co, une filiale de Sterling Drug Inc. Panadol était à l'origine disponible uniquement sur ordonnance, pour le soulagement de la douleur et la fièvre, et a été annoncé comme étant «doux à l'estomac», car d'autres agents analgésiques de l'époque contenaient l'aspirine, un irritant d'estomac connu. En 1963, le paracetamol a été ajouté à la Pharmacopée britannique, et a gagné en popularité depuis lors comme agent analgésique avec peu d'effets secondaires et peu d'interaction avec d'autres agents pharmaceutiques. Les préoccupations concernant la sécurité de paracétamol retardés son acceptation généralisée jusqu'à ce que les années 1970, mais dans les années 1980 les ventes de paracétamol ont dépassé celles de l'aspirine dans de nombreux pays, y compris le Royaume-Uni. Ceci a été accompagné par la disparition commerciale de la phénacétine, blâmé comme la cause de la néphropathie analgésique et la toxicité hématologique.
Les É.U brevet sur paracétamol a expiré depuis longtemps, et les versions génériques de ce médicament sont largement disponibles dans le cadre du Prix des médicaments de la concurrence et de brevets Restoration Act terme de l'année 1984, bien que certaines préparations de Tylenol ont été protégés jusqu'à 2007. Le brevet américain 6,126,967 déposée le 3 Septembre, 1998 a été accordée pour la libération "particules d'acétaminophène étendus".
Formulaires disponibles


Le paracétamol est disponible dans un comprimé, capsule, suspension liquide, suppositoire, par voie intraveineuse, et forme intramusculaire. La dose commune pour adultes est de 500 mg à 1000 mg. La dose quotidienne maximale recommandée, pour les adultes, est de 4000 mg. Aux doses recommandées, le paracétamol est généralement sans danger pour les enfants et les nourrissons, ainsi que pour les adultes, bien que de rares cas d'atteinte hépatique aiguë ont été liés à des montants inférieurs à 2 500 mg par jour.
Panadol, qui est commercialisé en Afrique, en Asie, en Europe, en Amérique centrale, et Australasie, est la marque la plus largement disponible de paracétamol, vendu dans plus de 80 pays. En Amérique du Nord, le paracétamol est vendu sous forme générique (généralement étiqueté comme l'acétaminophène) ou sous un certain nombre de noms commerciaux, par exemple, Tylenol ( McNeil-PPC, Inc.), Anacin-3, Tempra, Datril et Ofirmev. Même se il est tout paracétamol nommé disponibles au Royaume-Uni (par exemple Panadol), paracétamol sans marque ou générique est plus communément vendu. ACAMOL, un nom de marque pour le paracétamol produit par Teva Pharmaceutical Industries en Israël , est l'un des médicaments les plus utilisés dans ce pays. Aux Philippines, le plus vendu de la marque paracétamol est Biogesic, fabriqué par le géant pharmaceutique United Laboratories. Ventes de tablettes Biogesic atteignent près d'un milliard d'unités chaque année dans le pays seul, non compris les formats de suspension liquide. La marque est également disponible dans la plupart des Pays de l'ASEAN où le géant pharmaceutique a présence sur le marché. En Europe, les marques les plus courantes de paracétamol sont Efferalgan et Doliprane. En Inde, la marque la plus commune de paracétamol est crocine fabriqué par Glaxo SmithKline Asie. Au Bangladesh, la deuxième marque la plus populaire sont Napa et Renova fabriqué par Beximco Pharma et opsonine Pharma respectivement. En Chine paracétamol est vendu sur le comptoir que Duìyǐxiān'ānjīfēn Pian (对乙酰氨基酚片). De même au Japon, il est vendu sous le nom de l'acétaminophène (アセトアミノフェンAsetoaminofen). En Corée du Nord, la coentreprise de la RPDC en Suisse PyongSu Pharma commercialise le médicament que PyongSu Cetamol.
Dans certaines formulations, le paracétamol est combinée avec le opioïde la codéine, parfois dénommée co-codamol ( BAN). Aux États-Unis et au Canada, ce est commercialisée sous le nom de Tylenol # 1/2/3/4, qui contient 8-10 mg, 15 mg, 30 mg et 60 mg de la codéine, respectivement. Aux États-Unis, cette combinaison est disponible uniquement sur ordonnance, tandis que la préparation la plus faible résistance est over-the-counter au Canada, et, dans d'autres pays, d'autres forces peuvent être disponibles sur le comptoir. Il existe des formes génériques de ces combinaisons ainsi. Au Royaume-Uni et dans de nombreux autres pays, cette combinaison est commercialisé sous les noms de Tylex CD et Panadeine. Autres noms incluent Captin, Disprol, Dymadon, Fensum, Hedex, Mexalen, Nofedol, Panocod, Paralen, Pediapirin, Perfalgan et Solpadeine. Le paracétamol est également combiné avec d'autres opioïdes comme dihydrocodéine, dénommé co-dydramol ( BAN), oxycodone ou hydrocodone, commercialisé aux Etats-Unis comme Percocet et Vicodin, respectivement. Une autre combinaison analgésique très couramment utilisé comprend en combinaison avec du paracétamol napsylate propoxyphène, vendu sous le nom de marque Darvocet. Une combinaison de paracetamol, la codéine et l'agent apaisant succinate de doxylamine est commercialisé comme Syndol ou Mersyndol. L'efficacité de l'association paracétamol / codéine ont été interrogés par la recherche récente.
Le paracétamol est couramment utilisé dans les préparations multi-ingrédients pour la migraine, y compris typiquement butalbital et le paracétamol avec ou sans caféine , et parfois contenant de la codéine.
Usage vétérinaire
Le paracétamol est extrêmement toxique pour les chats, qui ne disposent pas nécessairement glucuronyl transférase enzymes pour briser toute sécurité vers le bas. Les premiers symptômes sont des vomissements, salivation, et la décoloration de la langue et les gencives. Contrairement à un surdosage chez l'homme, des dommages au foie est rarement la cause du décès; à la place, la formation de méthémoglobine et la production de Corps de Heinz dans les globules rouges inhibent le transport de l'oxygène par le sang, causant asphyxie ( methemoglobemia et l'anémie hémolytique). Le traitement avec N-acétylcystéine, bleu de méthylène ou les deux est parfois efficace après l'ingestion de petites doses de paracétamol.
Bien que le paracetamol est censé avoir aucune activité anti-inflammatoire significative, il a été rapporté aussi efficace que l'aspirine dans le traitement de la douleur musculo-squelettique chez les chiens. Un produit de paracétamol-codéine (nom commercial Pardale-V) sous licence pour une utilisation chez les chiens est disponible sur ordonnance vétérinaire au Royaume-Uni. Il doit être administré à des chiens seulement sur des conseils vétérinaires et avec une extrême prudence. Le principal effet de la toxicité chez les chiens est des dommages au foie, GI ulcérations ont été signalées. Traitement N-acétylcystéine est efficace chez les chiens lorsqu'il est administré au bout de deux heures de paracétamol ingestion.
Le paracétamol est aussi mortelle pour les serpents, et a été suggérée comme un programme de contrôle chimique pour la invasive brun serpent d'arbre (Boiga de irregularis) dans Guam . Des doses de 80 mg sont insérés dans des souris mortes dispersées par hélicoptère.



