
Étain (II) chlorure
Contexte des écoles Wikipédia
Enfants SOS bénévoles ont aidé à choisir des articles et faites autre matériel de curriculum Voir http://www.soschildren.org/sponsor-a-child pour connaître le parrainage d'enfants.
| Étain (II) chlorure | |
|---|---|
 | |
Étain (II) chlorure | |
Autres noms Chlorure d'étain | |
| Identificateurs | |
| Numéro RTECS | XP8700000 (anhydre) XP8850000 (dihydrate) |
| Propriétés | |
| Formule moléculaire | SnCl 2 |
| Masse molaire | 189,60 g / mol (anhydre) 225,63 (dihydrate) |
| Apparence | Solide cristallin blanc |
| Densité | 3,95 g / cm³, solide anhydre 2,71 g / cm³, dihydrate (15 ° C) |
| Point de fusion | 246 ° C (519 K) |
| Point d'ébullition | 623 ° C (896 K) |
| Solubilité dans l'eau | 83,9 g / 100 ml (0 ° C) Hydrolyse dans l'eau chaude |
| Structure | |
| Crystal structure | Structure de la couche (chaînes de SnCl 3 groupes) |
| Coordination géométrie | Trigonale pyramidale (anhydre) Dihydrate également trois coordonnées |
| Forme moléculaire | Bent (phase gazeuse) |
| Risques | |
| FS | MSDS externe |
| Phrases-R | 22-34-37 |
| Phrases S | 26-36 / 37 / 39-45 |
| Principal dangers | Corrosif |
| Des composés apparentés | |
| D'autres anions | Étain (II) fluorure Bromure d'étain (II) |
| D'autres cations | Tin (IV) chloride Germanium dichlorure Plomb (II) chlorure |
| Page de données supplémentaire | |
| Structure et propriétés | n, ε r, etc. |
| Thermodynamique données | comportement de phase Solide, liquide, gaz |
| Les données spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
Tin chlorure (II) (chlorure stanneux) est un blanc cristallin solide à la formule Sn Cl 2. Il forme un dihydrate stable, mais les solutions aqueuses ont tendance à subir hydrolyse, en particulier si chaud. SnCl 2 est largement utilisé comme un agent réducteur (en solution acide), et d'électrolyse de bains étamage. Tin (II) ne doit pas être confondu avec l'autre chlorure d'étain; étain (IV) de chlorure stannique ou le chlorure (SnCl 4).
Structure chimique
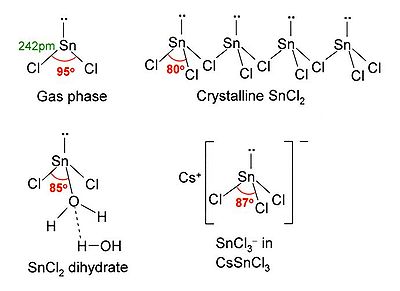
SnCl 2 a un seule paire d' électrons , de telle sorte que la molécule dans la phase gazeuse est plié. À l'état solide, cristalline SnCl 2 formes reliées par des chaînes ponts de chlorure de l'illustration. Le dihydrate est également trois coordonnées, avec une eau à la coordonnée sur l'étain, et une deuxième coordonnée de l'eau à la première. La partie principale de la molécule piles en couches doubles dans le réseau cristallin, avec le «deuxième» l'eau en sandwich entre les couches.
Propriétés chimiques
Tin (II) chlorure peut se dissoudre dans moins de sa propre masse d'eau sans décomposition apparente, mais la solution est diluée hydrolyse se produit pour former un sel basique insoluble:
- SnCl 2 (aq) + H 2 O (l) ↔ Sn (OH) Cl (s) + HCl (aq)
Par conséquent, si des solutions claires d'étain (II) chlorure doivent être utilisés, l'acide chlorhydrique doit être ajouté afin de maintenir l' équilibre vers la gauche (à l'aide Le principe de Le Chatelier). Solutions de SnCl 2 sont également instable vers l'oxydation par l'air:
Ceci peut être évité en stockant la solution sur des morceaux de métal étain.
Il existe de nombreux cas où les actes d'étain (II) de chlorure en tant qu'agent réducteur, la réduction de l'argent et l'or des sels de métal, et le fer (III) des sels de fer (II), par exemple:
- SnCl 2 (aq) + 2 FeCl3 (aq) → SnCl 4 (aq) + 2 FeCl 2 (aq)
Solutions d'étain (II) peuvent également servir simplement en tant que source d'ions Sn 2+, qui peut former un autre étain (II) des composés par réactions de précipitation, par exemple brun (ou noir) étain (II): le sulfure
- SnCl 2 (aq) + Na 2 S (aq) → SnS (s) + 2 NaCl (aq)
Si alcalin est ajouté à une solution de SnCl 2, un précipité blanc hydraté de étain (II) les formes d'oxyde initialement; cette dissout ensuite dans un excès de base pour former un sel tel que stannite stannite de sodium:
- SnO · H 2 O (s) + NaOH (aq) → NaSn (OH) 3 (aq)
SnCl2 anhydre peut être utilisé pour fabriquer une variété de intéressant étain (II) des composés dans des solvants non aqueux. Par exemple, le lithium le sel de 4-méthyl-2,6-di-tert-butylphénol réagit avec SnCl 2 dans THF pour donner le linéaire jaune à deux coordonnées composé Sn (OAr) 2 (Ar = aryle).
Étain (II) chlorure se comporte aussi comme un Acide de Lewis, formant des complexes avec des ligands tels que l'ion chlorure, par exemple:
- SnCl 2 (aq) + CsCl (aq) → CsSnCl 3 (aq)
La plupart de ces complexes sont pyramidale , et depuis complexes tels que SnCl 3 ont une pleine octet, il ya peu de tendance à ajouter plus d'un ligand. Le seule paire d'électrons dans ces complexes est disponible pour la liaison, cependant, et par conséquent le complexe lui-même peut agir en tant que Base ou ligand Lewis. Cette vue dans le produit de la réaction suivante concernant ferrocène:
- SnCl 2 + Fe (η 5 -C 5 H 5) (CO) 2 HgCl → Fe (η 5 -C 5 H 5) (CO) 2 SnCl 3 + Hg
SnCl 2 peut être utilisé pour fabriquer une variété de tels composés contenant des liaisons métal-métal, par exemple:
- SnCl 2 + Co 2 (CO) 8 → (CO) 4 Co (SnCl 2) -CO (CO) 4
Préparation
Anhydre SnCl 2 est préparé par l'action de sec le chlorure d'hydrogène gazeux sur l'étain métal. Le dihydrate est effectuée par une réaction similaire, en utilisant de l'acide chlorhydrique :
L'eau est ensuite soigneusement évaporé de la solution acide pour produire des cristaux de SnCl 2 · 2H 2 O. Cela peut être dihydrate déshydraté pour anhydre aide l'anhydride acétique.
Utilisations
Une solution d'étain (II) contenant un peu de chlorure de l'acide chlorhydrique est utilisé pour le étamage de l'acier, afin de faire des boîtes de conserve. Un potentiel électrique est appliqué, et l'étain métallique est formée au niveau de la cathode par l'intermédiaire d'électrolyse .
Il est utilisé comme catalyseur dans la production de la matière plastique acide polylactique (PLA).
Étain (II) chlorure trouve aussi large utilisation en tant que agent réducteur. Cela se voit dans son utilisation pour les miroirs d'argenture, où l'argent métal est déposé sur la vitre:
- Sn 2+ (aq) + 2 Ag + → Sn 4+ (aq) + 2 Ag (s)
Une réduction liée a été traditionnellement utilisé comme un test analytique pour Hg 2+ (aq). Par exemple, si on ajoute SnCl2 goutte à goutte dans une solution de de mercure (II) chlorure, un précipité blanc de mercure (I) est le chlorure d'abord formé; comme plus SnCl 2 est ajouté devient noir comme le mercure métallique est formé. Chlorure stanneux peut être utilisé pour tester la présence de l'or composés . SnCl 2 tourne lumineuse violet en présence d'or.
Cette réaction entre le chlorure d'étain très et or a été utilisé dans l'épisode # 215: Clueless des Maison d'affirmer l'intoxication d'or.
En chimie organique , SnCl 2 est principalement utilisé dans la Stephen réduction, par lequel un nitrile est réduite (par l'intermédiaire d'un le chlorure d'imidoyle de sel) à un imine qui est facilement hydrolyse en un aldéhyde.
La réaction fonctionne généralement mieux avec des nitriles aromatiques Aryl-CN. Une réaction associée (appelée méthode Sonn-Müller) commence par un amide, qui est traité avec PCI5 pour former le sel de chlorure d'imidoyle.
La réduction Stephen est moins utilisé aujourd'hui, car il a été remplacé par la plupart diisobutylaluminium hydrure de réduction.
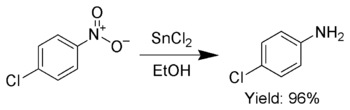
En outre, SnCl 2 est utilisée pour réduire sélectivement aromatique groupes nitro en anilines.
SnCl 2 réduit également Quiñones hydroquinones.
Le chlorure stanneux est également ajouté comme Additif alimentaire avec Numéro E E512 à certains aliments en conserve et en bouteille, où il sert comme agent couleur rétention et antioxydant .
Dans la culture populaire
Ce composé a été sélectionnée dans le House, MD épisode " Clueless », dans lequel il a été utilisé pour détecter la présence de thiomalate or et de sodium utilisé par l'épouse du patient de l'empoisonner.

