
Baryum
Contexte des écoles Wikipédia
Enfants SOS ont produit une sélection d'articles de wikipedia pour les écoles depuis 2005. enfants SOS a regardé des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| Baryum | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
56 Ba | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
gris argenté  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | baryum, Ba, 56 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / b ɛər Je ə m / -Əm de BAIR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | métaux alcalino-terreux | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 2 (métaux alcalino-terreux) , 6, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 137,327 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 6s 2 2, 8, 18, 18, 8, 2 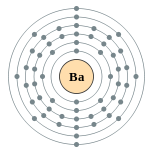 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Carl Wilhelm Scheele (1772) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 3,51 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 3,338 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1000 K , 727 ° C, 1341 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 2170 K, 1897 ° C, 3447 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 7,12 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 140,3 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 28,07 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 2 (Fortement oxyde de base) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 0,89 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1e: 502,9 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 965,2 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 3600 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 222 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 215 ± 23 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 268 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique centré  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 332 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 18,4 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 20,6 um · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 1,620 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 13 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 4,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 9,6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 1,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-39-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de baryum | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le baryum est un élément chimique avec le symbole Ba et de numéro atomique 56. Ce est le cinquième élément du groupe 2, un mou argenté métallique alcalino-terreux . En raison de sa haute chimique la réactivité de baryum ne est jamais trouvé dans la nature comme un élément libre. Son hydroxyde a été connu dans l'histoire pré-moderne baryte; cette substance ne se produit pas comme un minéral, mais peut être préparé par chauffage de carbonate de baryum.
Les minéraux d'origine naturelle la plus courante de baryum sont la barytine (sulfate de baryum, BaSO 4) et withérite (carbonate de baryum, BaCO 3), les deux étant insoluble dans l'eau. Le nom de baryum originaire de la dérivée alchimique "baryte", qui lui-même vient de grecs βαρύς (barys), ce qui signifie «lourd». Baryum a été identifié comme un élément nouveau en 1774, mais ne se réduit pas à un métal jusqu'en 1808, peu de temps après des techniques d'isolement électrolytiques sont devenus disponibles.
Baryum a seulement quelques applications industrielles. Le métal a été historiquement utilisé pour piéger air les tubes à vide. Ce est un composant de YBCO ( les supraconducteurs à haute température) et électrocéramique, et on ajoute à l'acier et fonte pour réduire la taille des grains de carbone au sein de la microstructure du métal. Les composés de baryum sont ajoutés à des feux d'artifice pour donner une couleur verte. Le sulfate de baryum est utilisé comme additif insoluble lourd à puits de pétrole fluide de forage, et dans une forme plus pure, comme X-ray radiocontrast agents pour l'imagerie du tractus gastro-intestinal humain. Composés solubles de baryum sont toxiques en raison de la libération de l'ion de baryum soluble, et donc ont été utilisés comme rodenticides.
Caractéristiques
Propriétés physiques

Le baryum est un métal blanc argenté doux, avec une légère nuance d'or où ultrapure. La couleur blanc argenté de baryum métallique disparaît rapidement après oxydation à l'air produisant une couche d'oxyde gris foncé. Le baryum a un moyen poids spécifique et une bonne conductivité électrique. Ultrapure baryum est très difficile à préparer, et donc de nombreuses propriétés de baryum ont pas encore été mesurée avec précision.
A température et pression ambiantes, le baryum a une corps-structure cubique centrée, avec une distance de baryum-baryum 503 picomètres, l'expansion avec chauffage à une vitesse d'environ 1,8 x 10 -5 / ° C. Ce est un métal très doux avec une dureté Mohs de 1,25. Sa température de fusion de 1 000 K (730 ° C; 1 340 ° F) est intermédiaire entre ceux du strontium briquet (1050 K, 780 ° C; 1 430 ° F) et le radium plus lourde (973 K, 700 ° C; 1 292 ° F) ; cependant, son point de 2170 K (1900 ° C; 3450 ° F) Point d'ébullition supérieur à celui du strontium (1655 K, 1382 ° C; 2519 ° F). La densité (3,62 g · cm -3) est de nouveau intermédiaires entre celles de strontium (2,36 g · cm -3) et le radium (~ 5 g · cm -3).
Réactivité chimique
Le baryum est chimiquement similaire à magnésium, calcium, strontium et, étant encore plus réactif. Il présente toujours l'état d'oxydation de +2. Réactions avec chalcogènes sont très exothermique (à libérer l'énergie); la réaction avec de l'oxygène ou de l'air se produit à la température ambiante, et donc baryum est stocké sous atmosphère d'huile ou de gaz inerte. Réactions avec d'autres les non-métaux, tels que le carbone, l'azote, le phosphore, le silicium et l'hydrogène, sont généralement exothermique et se déroulent lors d'un chauffage. Réactions avec l'eau et les alcools sont également très exothermique et libèrent de l'hydrogène gazeux:
- Ba 2 + ROH → Ba (OR) 2 + H 2 ↑ (R est un groupe alkyle ou un atome d'hydrogène)
En outre, le baryum réagit avec l'ammoniac pour former des complexes tels que Ba (NH 3) 6.
Le métal est facilement attaqué par la plupart des acides. L'acide sulfurique est une exception notable, que passivation arrête la réaction par la formation du insoluble le sulfate de baryum. Le baryum se combine avec plusieurs métaux, y compris l'aluminium , le zinc , le plomb et l'étain , formant phases intermétalliques et alliages.
Composés
| O 2- | S 2- | F - | Cl - | SO 2- 4 | CO 2- 3 | O 2- 2 | H - | |
|---|---|---|---|---|---|---|---|---|
| Ca 2+ | 3,34 | 2,59 | 3,18 | 2,15 | 2,96 | 2,83 | 2,9 | 1,7 |
| Sr 2+ | 5.1 | 3,7 | 4,24 | 3,05 | 3,96 | 3,5 | 4,78 | 3,26 |
| Ba 2+ | 5,72 | 4.3 | 2.1 | 1,9 | 4,49 | 4,29 | 4,96 | 4.16 |
| Zn 2+ | 5.6 | 4,09 | 4,9 | 2,09 | 3,8 | 4.4 | 1,57 | - |
sels de baryum sont généralement blanc lorsqu'ils sont solides et incolore lorsqu'il est dissous, les ions de baryum ne fournissent aucune coloration spécifique. Ils sont également plus dense que leurs strontium ou calcium analogues, à l'exception de la halogénures (voir tableau; zinc est donné à titre de comparaison).
Hydroxyde de baryum («baryte») a été connus pour alchimistes qui ont produit en chauffant du carbonate de baryum. Contrairement à l'hydroxyde de calcium, il absorbe très peu de CO 2 dans des solutions aqueuses et est donc insensible aux variations atmosphériques. Cette propriété est utilisée pour l'étalonnage des équipements de pH.
Composés de baryum volatiles brûlent avec un vert à vert pâle flamme, qui est un test efficace pour détecter un composé de baryum. Les résultats de couleur de raies spectrales à 455,4, 493,4, 553,6, et 611,1 nm.
Organobarium composés constituent une classe de composés de croissance: par exemple, dialkylbariums sont connus, comme le sont alkylhalobariums.
Isotopes
Baryum se produit naturellement sur Terre comme un mélange de sept nucléides primordiaux, baryum-130, 132, et 134 à travers 138. Les deux premiers sont pensés pour être radioactifs: baryum-130 devrait se désintégrer au xénon-130 via deux désintégration bêta plus, et le baryum-132 devraient également se désintégrer au xénon-132. Les demi-vies correspondantes devraient dépasser le âge de l'Univers par au moins mille fois. Les abondances sont ~ 0,1% par rapport à celle de baryum naturel. Leur radioactivité est si faible qu'ils ne posent pas de danger pour la vie. Sur les isotopes stables, le baryum-138 représente 71,7% de l'ensemble de baryum et le briquet l'isotope, moins elle est abondante. Au total, le baryum a environ 50 isotopes connus, allant de masse entre 114 et 153. L'isotope métastable plus stable est le baryum-133, qui a une demi-vie d'environ 10,51 années, et les cinq autres isotopes ont leur demi-vie plus longue que un jour. Baryum a aussi 10 Etats méta, dont baryum-133m1 est la plus stable, ayant une demi-vie d'environ 39 heures.
Histoire

Alchimistes au début du Moyen Age connaissaient certains minéraux de baryum. Pierres lisses de galets comme de barytine minérale trouvés dans Bologne , en Italie , étaient connus comme "pierres de Bologne." Les sorcières et les alchimistes ont été attirés par eux parce que, après exposition à la lumière qu'ils briller pendant des années. Les propriétés phosphorescentes de barytine chauffés avec des matières organiques ont été décrits par V. Casciorolus en 1602.
Carl Scheele identifié barytine comme contenant un élément nouveau en 1774, mais n'a pas pu isoler de baryum, ne l'oxyde de baryum. Johan Gottlieb Gahn également isolé oxyde de baryum deux ans plus tard dans des études similaires. Baryum oxydé fut d'abord appelé "barote," par Guyton de Morveau, un nom qui a été modifié par Antoine Lavoisier à baryte. Toujours dans le 18ème siècle, anglais minéralogiste William Withering a noté un minéral lourd dans les mines de plomb de Cumberland, maintenant connu pour être withérite. Baryum a été isolé par électrolyse de sels de baryum fondus en 1808, par Sir Humphry Davy en Angleterre . Davy, par analogie avec le calcium nommé "baryum" après baryte, avec la "-ium" fin signifiant un élément métallique. Robert Bunsen et Auguste Matthiessen baryum obtenu pur par électrolyse d'un mélange fondu de le chlorure de baryum et chlorure d'ammonium.
La production d'oxygène pur dans le Brin processus était une application à grande échelle de peroxyde de baryum dans les années 1880, avant qu'il ne soit remplacé par électrolyse et distillation fractionnée de l'air liquéfié dans le début des années 1900. Dans ce procédé, l'oxyde de baryum réagit à 500-600 ° C (932-1112 ° F) avec de l'air pour former du peroxyde de baryum, qui se décompose au-dessus de 700 ° C (1292 ° F) en libérant de l'oxygène:
- 2 BaO + O 2 ⇌ 2 BaO 2
En 1908, le sulfate de baryum a été appliqué en tant que Produit de contraste dans Imagerie par rayons X de l'appareil digestif.
Présence et la production
L'abondance de baryum est 0,0425% dans la croûte de la Terre et 13 ug / L dans l'eau de mer. La principale source commerciale de baryum est barytine (également appelés barytine ou barytine), qui est un minéral de sulfate de baryum. Ses dépôts sont répartis partout dans le monde. La seule autre source commerciale est beaucoup moins importante que la barytine; il est withérite, un minéral de carbonate de baryum. Ses principaux gisements sont situés en Angleterre, la Roumanie et l'ex-URSS.

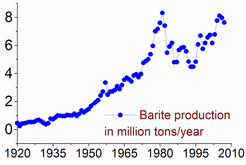
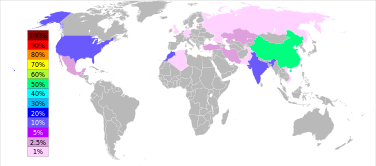
Les réserves de barytine sont estimés entre 0,7 et 2 milliards tonnes. La production maximale a été atteint en 1981, à 8,3 millions de tonnes, et seulement 7-8% de celui-ci a été utilisé pour faire de baryum ou de ses composés. La production de barytine a de nouveau augmenté depuis la deuxième moitié des années 1990: de 5,6 millions de tonnes en 1996 à 7,6 en 2005 et 7,8 en 2011. La Chine représente plus de 50% de cette production, suivie par l'Inde (14% en 2011), Maroc (8,3%), Etats-Unis (8,2%), la Turquie (2,5%), l'Iran et le Kazakhstan (2,6% chacun).
Le minerai extrait est lavé, broyé, classé, et séparée de quartz. Si le quartz pénètre trop profondément dans le minerai, ou le fer, le zinc, ou la teneur en plomb est anormalement élevé, alors méthodes de flottation par mousse sont appliquées. Le produit est une barytine pur à 98% (en masse); la pureté doit pas être inférieure à 95%, avec une teneur minimale en fer et dioxyde de silicium . Il est ensuite réduit par le carbone au sulfure de baryum:
- BaSO 4 + 2 C → BaS + 2 CO 2 ↑
Le sulfure de baryum soluble dans l'eau est le point de départ pour d'autres composés: BaS dissous par réaction avec l'oxygène donne l'hydroxyde, avec de l'acide nitrique du nitrate, avec du dioxyde de carbone du carbonate, et ainsi de suite. Le nitrate peut être décomposé thermiquement pour produire l'oxyde. Le baryum métallique est produit par réduction avec de l'aluminium à 1100 ° C (2010 ° F). Le composé intermétallique BaAl 4 est d'abord produit:
- 3 BaO + Al → 14 BaAl 4 3 + Al 2 O 3
Ce est un intermédiaire qui réagit avec l'oxyde de baryum pour donner le métal. Notez que le baryum tout ne est pas réduite.
- 8 BaO + BaAl 4 → Ba ↑ + 7 BaAl 2 O 4
L'oxyde de baryum restant réagit avec l'oxyde d'aluminium formé:
- BaO + Al 2 O 3 → BaAl 2 O 4
et la réaction globale est
- 4 BaO + 2 Al → 3 Ba ↑ + BaAl 2 O 4
La vapeur de baryum ainsi produit est recueilli à la partie plus froide de l'appareil et ensuite emballé dans des moules sous une atmosphère d'argon. Cette méthode est utilisée dans le commerce et peut donner ultrapure baryum. Baryum est vendu couramment environ 99% pure, avec principales impuretés étant du strontium et du calcium (jusqu'à 0,8% et 0,25%) et d'autres contaminants contribuant pour moins de 0,1%.
Une réaction similaire avec du silicium à 1200 ° C (2190 ° F), on obtient le baryum et le baryum métasilicate. L'électrolyse est pas utilisé car le baryum se dissout facilement dans halogénures fondus et est plutôt impure lorsqu'il est isolé avec cette méthode.

Gemme
Un minéral contenant du baryum benitoite (silicate de titane de baryum) se produit comme une pierre précieuse bleue fluorescente très rare, et ce est la pierre officielle de l'État de la Californie .
Applications
Métal et alliages
Le baryum, en métal ou en alliage avec de l'aluminium, est utilisé pour éliminer les gaz non désirés ( getter) de tubes à vide, comme les tubes cathodiques des téléviseurs. Le baryum est approprié à cette fin en raison de sa faible la pression de vapeur et la réactivité à l'oxygène, l'azote, le dioxyde de carbone et de l'eau; il peut même éliminer en partie les gaz rares en les dissolvant dans le réseau cristallin. Cette application est progressivement en train de disparaître en raison de la popularité croissante de l'écran LCD et plasma tubeless ensembles.
D'autres utilisations de baryum élémentaire sont mineures et comprennent un additif à silumin (Les alliages aluminium-silicium) qui affine la structure, ainsi que
- portant alliages;
- plomb-étain alliages de soudure - pour augmenter la résistance au fluage;
- alliage de nickel pour bougies;
- additif à l'acier et la fonte comme inoculant;
- alliages contenant du calcium, du manganèse, du silicium et de l'aluminium de haute qualité comme désoxydants de l'acier.
Le sulfate de baryum et la barytine
Le sulfate de baryum (barytine de la minérale, BaSO 4) est importante pour l'industrie pétrolière, par exemple, en tant que Fluide de forage à puits de pétrole et de gaz. Le précipité du composé (appelé «blanc fixe", à partir d'une expression française qui signifie «permanent blanc") est utilisé dans les peintures et vernis, et aussi comme une charge dans sonner encre, les plastiques et les caoutchoucs. Ce est également un pigment de couchage du papier. Dans la forme de nanoparticules, on peut améliorer les propriétés physiques de certains polymères, tels que les époxydes.
Le sulfate de baryum a une faible toxicité et relativement forte densité de ca. 4,5 g · cm -3 (et donc l'opacité aux rayons X). Pour cette raison, il est utilisé en tant que Produit de contraste dans Imagerie par rayons X de l'appareil digestif (" baryum repas "et" lavements barytés »). Lithopone, un pigment qui contient du sulfate de baryum et sulfure de zinc, est un blanc permanente qui a un bon pouvoir couvrant, et ne fonce pas lorsqu'ils sont exposés à des sulfures.
D'autres composés du baryum

Mis à part le sulfate, d'autres composés de baryum ne trouvent que des applications de niche. Les applications sont limitées par la toxicité des ions Ba 2+ (carbonate de baryum est un le poison à rat), qui ne est pas un problème pour l'insoluble BaSO 4.
- L'oxyde de baryum est utilisé dans un revêtement pour le des électrodes les lampes fluorescentes, ce qui facilite la libération des électrons .
- Le carbonate de baryum est utilisé en verrerie. Être un élément lourd, le baryum augmente la indice de réfraction et l'éclat du verre. Le composé est également utilisé pour réduire les fuites de rayons X à partir de tubes cathodiques (CRT) de postes de télévision.
- De baryum, généralement sous forme nitrate de baryum, est ajouté à des feux d'artifice pour les donner une couleur verte. Les espèces responsables du vert brillant est le baryum monochlorure; en l'absence de chlore d'une "pomme" jaune ou vert est produit à la place.
- Le peroxyde de baryum peut être utilisé en tant que catalyseur, pour fournir une réaction aluminothermique lors du soudage voies ferrées ensemble. Il peut également être utilisé en vert munitions traçantes et comme agent de blanchiment.
- Le titanate de baryum est un prometteur électrocéramique.
- fluorure de baryum est utilisé pour l'optique dans les applications infrarouges en raison de sa plage de transparence large de 0,15 à 12 micromètres.
- YBCO a été le premier supraconducteur à haute température qui peut être refroidi par l'azote liquide, en tant que sa température de transition de 93 K (-180,2 ° C; -292,3 ° F) a dépassé le point d'ébullition de l'azote (77 K, -196,2 ° C; -321,1 ° F) .
Dangers et précautions biologiques
En raison de la forte réactivité du métal, les données toxicologiques ne sont disponibles que pour les composés. Composés de baryum solubles dans l'eau sont toxiques. A faibles doses, des ions baryum agissent comme un stimulant du muscle, tandis que des doses plus élevées affectent la système nerveux, provoquant des irrégularités cardiaques, tremblements, faiblesse, anxiété, dyspnée et la paralysie. Cela peut être dû à la capacité de Ba 2+ pour bloquer les canaux ioniques de potassium, qui sont essentiels au bon fonctionnement du système nerveux. Autres organes cibles pour les composés de baryum solubles dans l'eau (ce est à dire, des ions de baryum) sont les yeux, le système immunitaire, le coeur, le système respiratoire et la peau. Ils affectent le corps fortement, provoquant, par exemple, la cécité et la sensibilisation.
Le baryum est pas cancérigène, et ce ne est pas bioaccumulation. Cependant, d'inhalation de la poussière contenant des composés de baryum solubles peut se accumuler dans les poumons, causant une affection bénigne appelée barytose. Pour comparaison avec les poisons solubles, le sulfate insoluble est non toxique et ne est donc pas considéré comme une marchandise dangereuse.
Pour éviter une réaction chimique potentiellement vigoureuse, le baryum métallique est maintenue sous argon ou huiles minérales. Contact avec l'air est dangereuse, car elle peut provoquer l'inflammation. L'humidité, la friction, la chaleur, des étincelles, des flammes, des chocs, électricité statique, des réactions avec des oxydants et des acides doit être évité. Tout ce qui peut prendre contact avec le baryum devrait être mise à la terre. Ceux qui travaillent avec le métal devrait porter des chaussures préalablement nettoyées anti-étincelles, des vêtements en caoutchouc ignifuges, des gants en caoutchouc, un tablier, des lunettes et un masque à gaz; ils ne sont pas autorisés à fumer dans la zone de travail et doivent se laver après la manipulation de baryum.

