
Plomb
Contexte des écoles Wikipédia
Enfants SOS bénévoles ont aidé à choisir des articles et faites autre matériel de programme de parrainage d'enfants aide les enfants du monde en développement à apprendre aussi.
| Plomb | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
82 Pb | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||
gris métallique  | ||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | plomb, Pb, 82 | |||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / l ɛ ré / LED | |||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | post-métal de transition | |||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 14, 6, p | |||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 207,2 | |||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 14 5d 10 6s 6p 2 2 2, 8, 18, 32, 18, 4 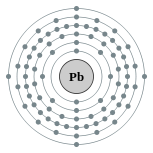 | |||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Moyen-Orientaux ( 7000 BC) | |||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 11,34 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 10,66 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 600,61 K , 327,46 ° C, 621,43 ° C | |||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 2022 K, 1749 ° C, 3180 ° F | |||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 4,77 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 179,5 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 26,650 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 4, 3, 2, 1 ( Oxyde amphotère) | |||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 2,33 (échelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 715,6 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1450,5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 3081,5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 175 h | |||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 146 ± 17 heures | |||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 202 h | |||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | |||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | |||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 208 nΩ · m | |||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 35,3 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 28,9 um · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | ( rt) (recuit) 1190 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 16 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 5,6 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 46 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,44 | |||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 1,5 | |||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 38,3 MPa | |||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7439-92-1 | |||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de plomb | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
Le plomb est un élément chimique dans la groupe de carbone avec le symbole Pb (du latin : plumbum) et de numéro atomique 82. Le plomb est un doux et malléable métal , qui est considérée comme un métaux lourds et pauvre en métaux. Le plomb métallique a une couleur blanc bleuâtre après avoir été fraîchement coupé, mais il est vite ternit à une couleur grisâtre terne lorsqu'il est exposé à l'air. Le plomb a un lustre chrome-argent brillant quand il est fondu dans un liquide.
Le plomb est utilisé dans la construction, batteries plomb-acide, balles et tir, poids, dans le cadre de soudures, potins, alliages fusibles, et en tant que protection contre les radiations. Le plomb a le plus haut numéro atomique de tous les des éléments stables, même si l'élément supérieur suivant, le bismuth , a une demi-vie qui est si longue (beaucoup plus longue que l'âge de l'univers) qu'elle peut être considérée comme stable. Ses quatre stables isotopes ont 82 protons , un nombre magique dans le Modèle en couches des noyaux atomiques .
Plomb, à certains degrés de contact, est une substance toxique pour les animaux, y compris les humains. Il endommage les système nerveux et provoque cerveau troubles. Plomb excessive provoque également des troubles sanguins chez les mammifères. Comme l'élément le mercure , un autre métal lourd, le plomb est un neurotoxine qui se accumule à la fois dans les tissus mous et les os. L'empoisonnement au plomb a été documentée de la Rome antique , la Grèce antique , et la Chine ancienne .
Caractéristiques

Le plomb est un métal brillant et argenté avec une très légère nuance de bleu dans une atmosphère sèche. Lors du contact avec l'air, il commence à se ternir en formant un mélange complexe de composés selon les conditions. La couleur des composés peut varier. La couche de ternissement peut contenir des quantités importantes de carbonates et hydroxycarbonates. Il a quelques propriétés caractéristiques: haute densité , de la douceur, ductilité et la malléabilité, la mauvaise la conductivité électrique par rapport aux autres métaux, une résistance élevée à la corrosion et la capacité de réagir avec des produits chimiques organiques.
Diverses traces d'autres métaux changent de façon significative ses propriétés: l'addition de petites quantités d' antimoine ou de cuivre au plomb augmente la dureté de l'alliage et améliore la résistance à la corrosion de l'acide sulfurique . Quelques autres métaux améliorent également que la dureté et la lutte la fatigue du métal, tels que le cadmium , l'étain , ou le tellure ; métaux comme le sodium ou le calcium ont aussi cette capacité, mais elles affaiblissent la stabilité chimique. Enfin, zinc et bismuth simplement nuisent à la résistance à la corrosion (0,1% teneur en bismuth est le seuil d'utilisation industrielle). En retour, les impuretés de plomb se aggravent souvent la qualité des matériaux industriels, mais il ya des exceptions: par exemple, de petites quantités de plomb améliorer la ductilité de l'acier.
Le plomb a un seul allotrope commun, qui est cubique à faces centrées, avec la distance plomb-plomb étant 349 h. A 327,5 ° C (621,5 ° F), de plomb fondu; le point de fusion est supérieure à celle de l'étain (232 ° C, 449,5 ° F), mais sensiblement inférieur à celui de germanium (938 ° C, 1721 ° F). Le point d'ébullition du plomb est 1749 ° C (3180 ° F), ce qui est inférieur à celui des deux étain (2602 ° C, 4716 ° F) et le germanium (2833 ° C, 5131 ° F). Densités augmentent le groupe dans: Ge et les valeurs Sn (5,23 et 7,29 g · cm -3, respectivement) sont nettement inférieurs à celle du plomb: 11,32 g · cm -3.
Un atome de plomb a 82 électrons, ayant une configuration électronique de [ Xe ] 4f 14 5d 10 6s 6p 2 2. Dans ses composés, le plomb (contrairement à l'autre groupe 14 éléments) perd le plus souvent ses deux et non quatre électrons ultrapériphériques, devenant des ions de plomb (II), Pb 2+. Un tel comportement inhabituel est rationalisée en considérant la inerte effet de couple, ce qui se produit en raison de la stabilisation des 6s-orbitales dues aux effets relativistes, plus fortes plus près du fond de la classification périodique. Tin montre un tel effet plus faible: l'étain (II) est encore un réducteur.
Les chiffres pour électrode spectacle potentiel que le plomb est seulement un peu plus facile pour oxyder à l'hydrogène . Ainsi plomb peut se dissoudre dans les acides, mais ce est souvent impossible en raison de problèmes spécifiques (telles que la formation de sels insolubles). Plomb en poudre brûle avec une flamme bleuâtre-blanc. Comme avec de nombreux métaux, finement divisée plomb poudre expositions pyrophoricité. Vapeurs toxiques sont libérés lorsque le plomb est brûlé.
Isotopes
Le plomb se produit naturellement sur Terre exclusivement sous la forme de quatre isotopes: le plomb-204, -206, -207, -208 et. Toutes les quatre peuvent être radioactives que la désintégration alpha hypothétique d'une serait exothermique, mais la limite demi-vie inférieure a été mis seulement pour le plomb-204: plus de 1,4 × 10 17 ans. Cet effet est cependant si faible que le plomb naturel ne pose aucun risque d'irradiation. Trois isotopes sont également présents dans trois des quatre grands chaînes de désintégration: plomb-206, -207 et -208 sont des produits de désintégration finale de l'uranium 238, l'uranium 235 et le thorium-232, respectivement. Depuis les montants d'entre eux dans la nature dépendent aussi de la présence d'autres éléments, la composition isotopique du plomb naturelle varie selon échantillon: en particulier, la quantité relative de plomb-206 varie entre 20,84% et 27,78%.
Mis à part ceux stables, trente-quatre radio-isotopes ont été synthétisés: ils ont des nombres de masse de 178 à 215. Le plomb-205 est le radio-isotope le plus stable de plomb, avec une demi-vie de plus de 10 7 ans. 47 isomères nucléaires (à long terme des Etats nucléaires excités), correspondant à 24 plomb isotopes, ont été caractérisés. L'isomère le plus long terme ne est plomb 204m2 (demi-vie d'environ 1,1 heures).
Réactivité chimique
Le plomb est classé comme un post-transition et de métal est également un membre de la groupe de carbone. Le plomb ne forme une couche d'oxyde de protection bien en poudre fine plomb hautement purifiée peut se enflammer à l'air. Plomb fondu est oxydé dans l'air pour monoxyde de plomb. Tous chalcogènes oxydent plomb lors du chauffage.
Le fluor ne se oxyde pas de plomb froid. Le plomb peut être oxydé à chaud, mais la formation d'un protecteur couche halogénure abaisse l'intensité de la réaction au-dessus de 100 ° C (210 ° F). La réaction avec le chlore est similaire: grâce à la couche de chlorure, la persistance de plomb contre le chlore dépasse ceux du cuivre ou de l'acier jusqu'à 300 ° C (570 ° F).
De l'eau en présence d'attaques de l'oxygène conduisent à démarrer une réaction d'accélération. La présence de carbonates ou sulfates conduit à la formation de sels de plomb insolubles, qui protègent le métal contre la corrosion. Il en va de dioxyde de carbone , comme l'insoluble le carbonate de plomb est formée; Cependant, un excès de gaz conduit à la formation du bicarbonate soluble; ce qui rend l'utilisation de tuyaux de plomb dangereuses. Le plomb se dissout dans les acides organiques (en présence d'oxygène) et concentré (≥80%) d'acide sulfurique grâce à la complexation; cependant, il ne est que faiblement affectée par l'acide chlorhydrique et est stable à l'acide fluorhydrique, comme les halogénures correspondants sont faiblement solubles. Le plomb se dissout aussi dans très concentrée alcalis (≥10%) en raison de la caractère amphotère et la solubilité de plombites.
Composés
Les composés de plomb existent principalement dans deux principaux états d'oxydation, 2 et 4. Le premier est plus commun. Plomb inorganique (IV) sont généralement composés oxydants forts ou ne existent que dans les solutions très acides.
Les oxydes et sulfures
Trois oxydes sont connus: plomb (II) ou oxyde le monoxyde de plomb (PbO), tétroxyde de plomb (Pb 3 O 4) (parfois appelé «minium»), et le dioxyde de plomb (PbO 2). Le monoxyde existe que deux allotropes: α-β-PbO et PbO, deux avec structure en couches et le plomb tétracoordiné. L'alpha polymorphe est de couleur rouge et a la distance Pb-O de 230 h; le polymorphe bêta est de couleur jaune et a la distance Pb-O de 221 et 249 heures (en raison de l'asymétrie). Les deux polymorphes peuvent exister sous conditions standard (avec de petits bêta (10) par rapport -5 impuretés telles que Si, Ge, Mo, etc.). PbO réagit avec les acides pour former des sels, et avec des alcalis pour donner plombites, [Pb (OH) 3] - ou [Pb (OH) 4] 2-. Le monoxyde oxyde à l'air pour triplomb tétroxyde, qui à 550 ° C (1020 ° F) se dégrade de nouveau dans PbO.
Le dioxyde peut être préparé par, par exemple, halogenization sels de plomb (II). Peu importe la forme polymorphe, il a une couleur brun-noir. La forme allotropique alpha est rhomboédrique et le bêta est allotrope tétragonale. Les deux allotropes sont brun-noir en couleur et contiennent toujours de l'eau, qui ne peut être enlevé, le chauffage provoque également la décomposition (à PbO et Pb 3 O 4). Le dioxyde est un oxydant puissant: il peut oxyder les acides chlorhydrique et sulfurique. Il ne réagit pas avec la solution alcaline, mais réagit avec des alcalis solides pour donner hydroxyplumbates, ou avec des oxydes basiques pour donner plombates.
La réaction de sels de plomb avec les rendements en sulfure d'hydrogène monosulfure plomb. Le solide a le sel gemme-comme la structure cubique simple, qui le maintient jusqu'au point de fusion, 1114 ° C (2037 ° F). Lorsqu'il est chauffé dans l'air, il se oxyde à l' sulfate et l'oxyde. Monosulfure de plomb est presque insoluble dans l'eau, des acides faibles, et (NH 4) 2 S / (NH 4) 2 S 2 est la solution clé pour la séparation du plomb dans les groupes I à III d'analyse des ions, étain , arsenic et antimoine . Cependant, il se dissout dans l' acide nitrique et les acides chlorhydrique , pour donner élémentaire du soufre et du sulfure d'hydrogène, respectivement. Lors du chauffage sous des pressions élevées avec du soufre, il donne la disulfure. Dans le composé, les atomes de plomb sont liés octaédrique avec des atomes de soufre. Ce est aussi un semi-conducteur. Un mélange du monoxyde de carbone et le monosulfure formes chauffées lorsque le métal.
- 2 PbO + PbS → 3 Pb + SO 2
Les halogénures et autres sels

carbonate de plomb de chauffage avec du fluorure d'hydrogène donne le fluorhydrate, qui se décompose à la DIFLUORURE quand elle fond. Cette poudre cristalline blanche est plus soluble que le diiodure, mais inférieure à la et le dibromure dichlorure. Le tétrafluorure d'une poudre cristalline jaune, est instable.
Autres dihalogénures sont obtenus lors du chauffage sels de plomb (II) avec les halogénures d'autres métaux; dihalogénures plomb précipitent pour donner blanche cristaux orthorhombiques (formes de diiodure cristaux hexagonaux jaunes). Ils peuvent également être obtenus par réaction directe de leurs éléments constitutifs à la température dépassant les points de fusion des dihalogénures. Leur solubilité augmente avec la température; ajoutant plusieurs halogénures diminue abord la solubilité, mais augmente en raison de complexation, avec le maximum nombre de coordination étant 6. La complexation dépend du nombre d'ions halogénure, le nombre atomique du métal alcalin , de l'halogénure qui est ajouté, la température et la force ionique solution. Le tétrachlorure est obtenue lors de la dissolution de l'anhydride dans l'acide chlorhydrique; pour empêcher la décomposition exothermique, il est maintenu sous de l'acide sulfurique concentré. Le tétrabromure peut pas, et le tétraiodure ne existe certainement pas. Le diastatide a également été préparé.
Le métal ne est pas attaqué par sulfurique ou chlorhydrique acides. Il se dissout dans l'acide nitrique avec l'évolution de l'oxyde nitrique gazeux à l'état dissous Pb (NO 3) 2 . Ce est un solide et soluble dans l'eau; ce est donc une clé pour recevoir les précipités de halogénures, sulfate, chromate, un carbonate, un carbonate basique et de Pb 3 (OH) 2 (CO 3) 2 sels de plomb. |
Organoplomb
Les composés les plus connus sont les deux plus simple dérivés Plombane: tétraméthyle (TML) et tétraéthylplomb (TEL). Le des homologues de ceux-ci, ainsi que hexaethyldilead (HEDL), sont de moindre stabilité. Les dérivés de tétraalkyl contiennent du plomb (IV), où les liaisons Pb-C sont covalente. Ils ressemblent donc des composés organiques typiques.
Lead forme facilement un alliage équimolaire avec le sodium métallique qui réagit avec des halogénures d'alkyle pour former les composés organométalliques de plomb tels que tétraéthylplomb. Les énergies de liaison Pb-C dans PTM et du PTE ne sont 167 et 145 kJ / mol; les composés se décomposent par chauffage ainsi, avec les premiers signes de composition TEL observés à 100 ° C (210 ° F). Le rendements de pyrolyse de plomb et les radicaux alkyle élémentaires; leur interréaction provoque la synthèse de HEDL. TML et TEL décomposent aussi sur la lumière du soleil ou aux rayons UV. En présence de chlore, les alkyles commencent à être remplacées par des chlorures; R 2 PbCl 2 en présence de HCl (un sous-produit de la réaction précédente) conduit à la minéralisation complète pour donner PbCl 2. Réaction avec le brome suit le même principe.
Histoire



Le plomb a été couramment utilisé depuis des milliers d'années, car il est très répandue, facile à extraire et facile à travailler. Il est très malléable ainsi que facile à éperlan. Perles métalliques de plomb datant de 6400 avant notre ère ont été trouvés dans Çatalhöyük dans la Turquie moderne. Au début du Âge du Bronze , le plomb a été utilisé avec de l'antimoine et l'arsenic .
Le plus grand préindustrielle producteur de plomb était le Économie romaine, avec une production annuelle estimée à 80 000 tonnes, qui a été généralement gagné comme un sous-produit d'une vaste fusion d'argent. Activités minières romaines ont eu lieu dans l'Europe centrale , Grande-Bretagne romaine , le Balkans, la Grèce , Asie Mineure et Hispania, qui représente à lui seul 40% de la production mondiale.
Romain tuyaux de plomb souvent portaient les insignes des empereurs romains (voir Plomb romain des inscriptions de tuyaux). Le plomb et dans le Occident latin peut avoir été poursuivi au-delà de l'âge de Théodoric le Grand dans la période médiévale. Beaucoup de «porcs» romains (lingots) de la figure de plomb dans L'histoire de plomb Derbyshire minière et dans l'histoire de l'industrie dans d'autres centres anglais. Les Romains utilisaient le plomb aussi sous forme liquide pour sécuriser les repères de fer qui fermaient grande blocs de calcaire dans certains édifices monumentaux. Dans l'alchimie , le plomb a été pensé pour être le métal le plus ancien et a été associé à la planète Saturne . Alchimistes conséquence utilisés le symbole de Saturne (le faux, ♄) pour se référer au plomb.
Jusqu'à la 17ème siècle, l'étain a été souvent ne se distingue pas de plomb: le plomb a été appelé plumbum nigrum (littéralement, "fil noir"), tandis que l'étain a été appelé plumbum candidum (littéralement, "plomb brillant"). Leur inhérence à travers l'histoire peut aussi être vu dans d'autres langues: le mot «olovo" signifie plomb dans Tchèque, mais dans de Russie , il ("олово") signifie étain. Le symbole de plomb Pb est une abréviation de son latine nom plumbum pour les métaux mous; les mots anglais " plomberie "," plombier "," aplomb ", et" fil à plomb "tirent également de cette racine latine.
La production de plomb aux États-Unis a commencé dès la fin des années 1600 par des Indiens dans le Le Southeast Missouri plomb District, communément appelé le Ceinture de plomb, le plomb est un quartier de l'exploitation minière dans la partie sud-est de Missouri. Significative entre préoccupations minières plomb du Missouri dans le quartier a été le Famille et Desloge Desloge Consolidated plomb dans Desloge, Missouri et Bonne Terre - ayant été actif dans le commerce de plomb, de l'exploitation minière et entraîner la fusion de 1823 dans Potosi à 1929.
Occurrence

Le plomb métallique ne se produit dans la nature, mais il est rare. Le plomb se trouve généralement dans minerai avec le zinc , l'argent et (plus abondamment) de cuivre , et est extrait avec ces métaux. La principale plomb minérale est galène (PBS), qui contient 86,6% de plomb en poids. D'autres variétés sont communes cérusite (PbCO 3) et anglésite (PbSO 4).
Le traitement du minerai

La plupart des minerais contiennent moins de 10% de plomb, et les minerais contenant aussi peu que 3% de plomb peuvent être exploitées économiquement. Minerais sont broyés et concentrés par flottation par moussage généralement de 70% ou plus. minerais sulfurés sont rôti, la production d'oxyde de plomb et principalement un mélange de sulfates et des silicates de plomb et d'autres métaux contenus dans le minerai. L'oxyde de plomb dans le processus de torréfaction est réduite dans un feu de coke haut-fourneau au métal. Des couches supplémentaires séparent dans le processus et flottent à la surface de la sonde métallique. Ceux-ci sont scories (silicates contenant 1,5% de plomb), Matte (sulfures contenant 15% de plomb), et speiss (arséniures de fer et de cuivre). Ces déchets contiennent des concentrations de cuivre, le zinc, le cadmium, le bismuth et qui peuvent être récupérées économiquement, de même que leur teneur en plomb non réduit.
Le plomb métallique qui résulte des procédés de grillage et du haut fourneau contient encore contaminants importants de l'arsenic, l'antimoine, le bismuth, le zinc, le cuivre, l'argent et l'or. La masse fondue est traitée dans un four à réverbère avec de l'air, la vapeur, et du soufre, qui oxyde les contaminants à l'exception de l'argent, l'or, et le bismuth. Les contaminants oxydés sont éliminés par décrassage, où ils flottent à la surface et sont écumée. Depuis minerais de plomb contiennent des concentrations importantes de l'argent , le métal fondu est couramment aussi contaminée avec de l'argent. Argent métallique ainsi que l'or est éliminé et récupéré économiquement au moyen de la Processus Parkes. Désargenté plomb est libéré de bismuth selon la Procédé Kroll-Betterton en le traitant avec du calcium et du magnésium métallique, qui forme une écume de bismuth qui peut être écumée. Très plomb pur peut être obtenu par traitement électrolytique de plomb fondu au moyen de la Processus Betts. Le procédé utilise des anodes en plomb et des cathodes impur de plomb pur dans un électrolyte de fluorure de silice.
La production et le recyclage
Production et consommation de plomb augmente dans le monde entier. La production annuelle totale est d'environ 8 millions de tonnes; environ la moitié est produite à partir de déchets recyclés. Les principaux pays de production de plomb, à partir de 2008, sont l'Australie, la Chine, Etats-Unis, le Pérou, le Canada, le Mexique, la Suède, Maroc, Afrique du Sud et la Corée du Nord. L'Australie, la Chine et les États-Unis représentent plus de la moitié de la production primaire. En 2010, 9,6 millions de tonnes de plomb ont été produites, dont 4,1 millions de tonnes provenaient de l'exploitation minière.
A taux actuels d'utilisation, la fourniture de plomb est estimé à fonctionner dans 42 ans. Analyste de l'environnement Lester Brown a suggéré plomb pourrait manquer dans les 18 années sur la base d'une extrapolation de la croissance de 2% par an. Cela peut être revu pour tenir compte de regain d'intérêt pour le recyclage , et la progression rapide la technologie des piles à combustible. Selon le International des ressources du Groupe spécial Stocks de métaux dans les rapport de la Société, par habitant stock mondial de plomb en usage dans la société est de 8 kg. Beaucoup de ceci est dans les pays les plus développés (20 à 150 kg par habitant) plutôt que les pays moins développés (1-4 kg par habitant).
Applications
Forme élémentaire

Contrairement à la croyance populaire, les mines de crayons à crayons en bois ne ont jamais été fabriqués à partir de plomb. Le terme vient du stylet romain, appelé le penicillus, une petite brosse pour peindre. Lorsque le crayon origine comme un outil d'écriture de graphite enroulée, le type particulier de graphite utilisé a été nommé plumbago (lit. acte pour le plomb, ou maquette plomb).
Le plomb est utilisé dans des applications où sa faible point de fusion, de ductilité et de haute densité sont avantageuses. Le point de fusion bas rend coulée de plomb facile, et donc munitions d'armes légères et de fusils de chasse granulés peut être lancé avec un équipement technique minimale. Il est également peu coûteux et plus dense que les autres métaux communs.
En raison de sa densité élevée et de résistance à la corrosion, le plomb est utilisé pour la quille de ballast de voiliers. Sa haute densité lui permet de contrebalancer l'effet d'inclinaison du vent sur les voiles tout en même temps occupant un petit volume et offrant ainsi le moins de résistance sous l'eau. Pour la même raison il est utilisé dans plongée sous-marine ceintures de poids pour contrecarrer la flottabilité naturelle du plongeur et de son équipement. Il ne possède pas le rapport poids-volume de nombreux métaux lourds, mais son faible coût augmente son utilisation dans ces applications et d'autres.



Plus de la moitié de la production de plomb US (au moins 1,15 millions de tonnes en 2000) est utilisé pour les automobiles, surtout comme électrodes dans le batterie plomb-acide, largement utilisé comme batterie de voiture.
Cathode ( réduction)
- PbO 2 + 4 + H + SO 2-
4 + 2e - → PbSO 4 + 2 H 2 O
Anode ( oxydation)
- Pb + SO 2-
4 → PbSO 4 + 2e -
Le plomb est utilisé comme électrodes dans le processus de l'électrolyse . Il est utilisé dans souder pour l'électronique, bien que cet usage est progressivement éliminé par certains pays pour réduire la quantité de l'environnement des déchets dangereux, et dans les câbles haute puissance de tension comme matériau de gainage pour empêcher la diffusion de l'eau dans l'isolation. Le plomb est l'un des trois métaux utilisé dans le Oddy essai pour les matériaux de musée, aider à détecter des acides organiques, des aldéhydes et des gaz acides. Il est également utilisé en tant que de blindage rayonnement (par exemple, en Chambres X-ray). Plomb fondu est utilisé comme liquide de refroidissement (par exemple, pour plomb réacteurs rapides refroidis).
Le plomb est ajouté à laiton pour réduire l'usage de machine-outil. Dans la forme de bandes, ou du ruban, le plomb est utilisé pour la personnalisation des raquettes de tennis. Raquettes de tennis du passé avaient parfois plomb ajouté à leur disposition par le fabricant pour augmenter le poids. Il est également utilisé pour former des barres de vitrage pour vitrail ou d'autres fenêtres multi-éclairé. La pratique est devenue moins courante, pas de danger, mais pour des raisons stylistiques. Plomb, ou la feuille de plomb, est utilisé comme une couche de insonorisation dans certaines régions dans le mur, le plancher et la conception de plafond dans les studios d'enregistrement où les niveaux de bruit aérien et produit mécaniquement sont ciblées pour la réduction ou l'élimination virtuelle. Ce est le métal de base traditionnel de tuyaux d'orgue, mélangés avec des quantités variables de l'étain pour contrôler la tonalité du tuyau.
Le plomb a de nombreuses utilisations dans l'industrie de la construction (par exemple, feuilles de plomb sont utilisés comme métaux architecturaux en matériaux de toiture, bardage, clignotant, gouttières et les articulations de gouttière, et parapets de toit). Moulures détaillées de plomb sont utilisés comme motifs décoratifs utilisés pour fixer la feuille de plomb. Le plomb est encore largement utilisé dans les statues et sculptures. Le plomb est souvent utilisé pour équilibrer les roues d'une voiture; cette utilisation est progressivement abandonnée au profit d'autres matériaux pour des raisons environnementales. En raison de sa demi-vie de 22,20 années, l'isotope radioactif 210 Pb est utilisé pour la datation du matériel de marins sédiments noyaux par méthodes radiométriques.
Composés
Les composés du plomb sont utilisés comme un élément de coloration dans glaçures, notamment dans les couleurs rouge et jaune. Le plomb est fréquemment utilisé dans chlorure de polyvinyle (PVC), qui recouvre les cordons électriques.
Le plomb est utilisé dans certains bougies pour traiter la mèche afin d'assurer une plus longue, plus même brûler. En raison des dangers, les fabricants européens et nord-américains utilisent des alternatives plus coûteuses telles que le zinc. Le verre au plomb est composé de 12 à 28% l'oxyde de plomb. Il modifie les caractéristiques optiques du verre et de réduire la transmission du rayonnement.
Certains artistes utilisant des peintures à base d'huile de continuer à utiliser le carbonate de céruse, citant ses propriétés en comparaison avec les alternatives. Plomb tétra-éthyle est utilisé comme additif antidétonant pour le carburant de l'aviation dans les avions par piston. À base de plomb semi-conducteurs , tels que le tellurure de plomb, du séléniure de plomb et antimoniure plomb trouvent des applications dans photovoltaïques (énergie solaire) et de cellules des détecteurs à infrarouge.
Plomb, soit sous forme pure ou allié avec l'étain, de l'antimoine est le matériau traditionnel pour balles et tourné en armes à feu utilisation.
Anciens applications
Pigments de plomb ont été utilisés dans les peinture au plomb pour le blanc ainsi que jaune, orange, et rouge. La plupart des utilisations ont été abandonnées en raison des dangers de saturnisme. À compter du 22 Avril 2010, la loi fédérale américaine exige que les entrepreneurs réalisant les projets de rénovation, de réparation et de peinture qui perturbent plus de six pieds carrés de peinture dans les maisons, les établissements de soins de l'enfant, et les écoles construites avant 1978 doivent être certifiés et formés pour suivre les travaux spécifiques pratiques pour prévenir la contamination au plomb. Le chromate de plomb est encore en usage industriel. Le carbonate de plomb (blanc) est le pigment traditionnel pour le moyen d'amorçage de peinture à l'huile, mais il a été déplacé en grande partie par les pigments d'oxyde de zinc et de titane. Il a également été remplacé rapidement dans des milieux de peinture à base d'eau. Blanc carbonate de plomb a été utilisé par les Japonais geisha et dans l'Ouest pour le visage blanchissant maquillage, ce qui était préjudiciable à la santé.
Le plomb est le métal chaud qui a été utilisé dans la composition de métal chaud. Il a été utilisé pour plomberie (d'où le nom) ainsi que d'un agent de conservation de la nourriture et des boissons dans la Rome antique . Jusqu'au début des années 1970, le plomb a été utilisé pour l'assemblage des tuyaux d'eau exprimés en fer et utilisé comme matériau pour les tuyaux d'eau de petit diamètre.
Plomb tétraéthyle a été utilisé dans carburants au plomb pour réduire cognement du moteur, mais cette pratique a été éliminée dans de nombreux pays du monde dans les efforts pour réduire la pollution toxique qui affectent les humains et l'environnement.
Le plomb a été utilisé pour faire des balles pour élingues. Le plomb a été utilisé pour Grenaille aux États-Unis jusqu'en 1992 environ quand il a été interdit (pour chasse à la sauvagine seulement) et remplacé par grenaille non toxique, principalement billes d'acier. Dans les Pays-Bas , l'utilisation de la grenaille de plomb pour la chasse et le tir sportif a été interdit en 1993, qui a provoqué une baisse importante des émissions de plomb, de 230 tonnes en 1990 à 47,5 tonnes en 1995, deux ans après l'interdiction.
Le plomb a été une composante de la peinture utilisée sur les jouets pour enfants - aujourd'hui limitée aux États-Unis et en Europe ( Directive ROHS). Le plomb a été utilisé à une charge de corps de voiture, qui a été utilisé dans de nombreux voitures personnalisées dans les années 1940-années 60. D'où le terme Leadsled. Le plomb est un supraconducteur avec une température de transition de 7,2 K, et donc IBM a essayé de faire une Ordinateur à effet Josephson sur un alliage de plomb.
Le plomb a également été utilisé dans les pesticides avant les années 1950, lorsque les vergers ont été traités en particulier contre le carpocapse. Un cylindre de plomb attaché à une longue lignée a été utilisé par les marins pour la tâche de navigation vital de déterminer la profondeur de l'eau en jetant la sonde à intervalles réguliers. Insert de suif mou à sa base a permis à la nature du fond de la mer à déterminer, ce qui facilite encore la position constatation.
Effets sur la santé
Le plomb est un métal hautement toxique (indépendamment cas d'inhalation ou d'ingestion), touchant presque tous les organes et systèmes dans le corps. La principale cible de la toxicité du plomb est le système nerveux, à la fois chez les adultes et les enfants. L'exposition à long terme des adultes peut entraîner une baisse des performances dans certains tests qui mesurent les fonctions du système nerveux. L'exposition à long terme au plomb ou ses sels (notamment les sels solubles ou l'oxydant puissant PbO 2) peut causer la néphropathie, et colique comme les douleurs abdominales. Il peut aussi causer de la faiblesse dans les doigts, les poignets ou les chevilles. L'exposition au plomb provoque également de petites augmentations de la pression artérielle, en particulier chez les personnes d'âge moyen et plus âgés et peut causer de l'anémie. L'exposition à des concentrations élevées de plomb peut endommager le cerveau et les reins chez les adultes ou les enfants et finalement causer la mort. Chez les femmes enceintes, les niveaux élevés de l'exposition au plomb peut provoquer une fausse couche. , L'exposition de haut niveau chronique ont montré pour réduire la fertilité chez les hommes. Diriger également des dommages connexions nerveuses (en particulier chez les jeunes enfants) et causer des troubles sanguins et le cerveau. L'empoisonnement au plomb se traduit généralement par l'ingestion d'aliments ou d'eau contaminés par le plomb; mais peut également se produire après l'ingestion accidentelle de sol contaminé, de la poussière, ou de la peinture à base de plomb. Il est rapidement absorbé dans la circulation sanguine et est censé avoir des effets néfastes sur le système nerveux central, le système cardio-vasculaire, les reins et le système immunitaire. La limite composante de plomb (1,0 pg / g) est une référence de test pour les produits pharmaceutiques, représentant l'apport quotidien maximum qu'un individu devrait avoir. Toutefois, même à ce niveau bas, une consommation prolongée peut être dangereux pour les êtres humains. Le traitement de l'intoxication par le plomb se compose de dimercaprol et succimer.
| NFPA 704 |
|---|
 1 3 0 |
| "Diamant de feu» pour les granulés de plomb |
La préoccupation au sujet du rôle de chef de file dans les déficits cognitifs chez les enfants a entraîné une réduction généralisée dans son utilisation (exposition au plomb a été liée à des troubles d'apprentissage). La plupart des cas de adultes teneurs élevées en plomb dans le sang sont liées au travail. Des taux sanguins élevés sont associés à la puberté retardée chez les filles. Le plomb a été démontré à plusieurs reprises de réduire de façon permanente la capacité cognitive des enfants à très faibles niveaux d'exposition.
Pendant le 20ème siècle, l'utilisation du plomb dans les peintures pigments a été fortement réduite en raison du danger d'empoisonnement au plomb, en particulier pour les enfants. Vers le milieu des années 1980, un changement important dans les modes d'utilisation de plomb avait eu lieu. Une grande partie de ce changement était un résultat de la conformité des consommateurs américains de plomb avec les réglementations environnementales qui ont réduit ou éliminé l'utilisation du plomb dans les produits non-significative, y compris la batterie l'essence, les peintures, les soudures et les systèmes d'eau. L'utilisation du plomb est encore réduite par l'Union européenne de Directive RoHS. Le plomb peut encore être trouvé en quantités nuisibles en grès, le vinyle (tel que celui utilisé pour les tubes et l'isolation des fils électriques), et les cuivres chinois. Les vieilles maisons peuvent encore contenir des quantités importantes de la peinture au plomb. Blanc peinture au plomb a été retiré de la vente dans les pays industrialisés, mais le jaune chromate de plomb est encore en usage. La vieille peinture ne doit pas être dépouillé par ponçage, car cela produit de la poussière inhalable.
Les sels de plomb utilisés dans les glaçures de poterie ont parfois causé l'empoisonnement, lorsque des boissons acides, tels que les jus de fruits, ont lessivé ions de plomb sur l'émail. Il a été suggéré que ce qui a été appelé " Coliques Devon "résulte de l'utilisation de presses doublés de plomb pour en extraire le jus de pomme dans la fabrication de cidre . Le plomb est considéré comme particulièrement dangereux pour la capacité des femmes à se reproduire. Acétate de plomb (II) (aussi connu comme sucre de plomb) a été utilisé dans l' empire romain comme édulcorant pour le vin, et certains considèrent cela comme une explication plausible pour le la démence de nombreux empereurs romains, et, que l'intoxication chronique au plomb a contribué au déclin progressif de l'empire. (Voir Déclin de l'empoisonnement de plomb # Empire romain)
Biochemistry d'empoisonnement
Dans le corps humain, le plomb inhibe porphobilinogène synthase et ferrochélatase, prévenir à la fois porphobilinogène formation et l'incorporation de fer dans la protoporphyrine IX, la dernière étape la synthèse de l'hème. Cela provoque la synthèse de l'hème et inefficace ultérieur l'anémie microcytaire. Aux niveaux inférieurs, il agit comme un analogue de calcium, en interférant avec les canaux ioniques au cours de la conduction nerveuse. Ce est l'un des mécanismes par lesquels elle interfère avec la cognition. Saturnisme aiguë est traité en utilisant EDTA disodique de calcium: le calcium chelate du sel disodique de l'acide éthylène-diamine-tétracétique ( EDTA). Cet agent de chélation a une plus grande affinité pour le plomb et le calcium pour que le chélate de sorte plomb est formé par échange. Ce est ensuite excrété dans l'urine laissant derrière calcium inoffensif. Selon l'Agence pour les substances toxiques et les maladies, une petite quantité de plomb ingéré (1%) va se stocker dans les os, et le reste sera excrété par un adulte par l'urine et les fèces en quelques semaines d'exposition. Cependant, seulement environ 32% de plomb sera excrété par un enfant.
L'exposition au plomb et des produits chimiques plomb peut se produire par inhalation, ingestion et par contact cutané. La plupart exposition se produit par ingestion ou par inhalation; aux États-Unis l'exposition de la peau est peu probable que des additifs de l'essence au plomb ne sont plus utilisés. L'exposition au plomb est un problème mondial que l'exploitation minière de plomb et la fusion du plomb sont courantes dans de nombreux pays. La plupart des pays ont cessé d'utiliser de l'essence contenant du plomb d'ici à 2007. L'exposition au plomb se produit essentiellement par ingestion. La peinture au plomb est la principale source d'exposition au plomb pour les enfants. Comme la peinture au plomb se détériore, il épluche, est pulvérisé en poussière, puis pénètre dans le corps par contact main-à-bouche ou par des aliments contaminés, l'eau ou de l'alcool. L'ingestion de certains médicaments remède à la maison peut également exposer les gens à plomb ou des composés de plomb. Le plomb peut être ingérée par les fruits et légumes contaminés par des niveaux élevés de plomb dans les sols ont été cultivés dans. Le sol est contaminé par l'accumulation de particules de plomb dans les tuyaux, peinture au plomb et les émissions résiduelles de l'essence au plomb qui a été utilisé avant que la question de l'environnement Protection Agency la réglementation autour de 1980. L'utilisation du plomb pour les conduites d'eau est problématique dans les zones avec doux ou (et) de l'eau acide. L'eau dure forme des couches insolubles dans les tuyaux alors que l'eau douce et acide dissout les tuyaux de plomb. L'inhalation est la deuxième voie majeure d'exposition, en particulier pour les travailleurs dans les professions liées plomb. Presque tous plomb inhalé est absorbé dans le corps, le taux est de 20-70% pour le plomb ingéré; les enfants absorbent plus que les adultes. L'exposition cutanée peut être important pour une catégorie restreinte de personnes travaillant avec des composés organiques du plomb, mais il est de peu d'intérêt pour la population générale. Le taux d'absorption de la peau est également faible pour le plomb inorganique.

