
Thallium
Saviez-vous ...
Enfants SOS ont produit une sélection d'articles de wikipedia pour les écoles depuis 2005. Cliquez ici pour plus d'informations sur les enfants SOS.
| Thallium | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
81 Tl | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||
blanc argenté  | ||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||
| Nom, symbole, nombre | thallium, Tl, 81 | |||||||||||||||||||||||||||
| Prononciation | / θ æ l Je ə m / -Əm de THAL | |||||||||||||||||||||||||||
| Élément Catégorie | post-métal de transition | |||||||||||||||||||||||||||
| Groupe, période, bloc | 13, 6, p | |||||||||||||||||||||||||||
| Poids atomique standard | 204,38 (1) | |||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 14 5d 10 6s 6p 2 1 2, 8, 18, 32, 18, 3 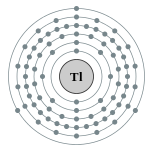 | |||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||
| Découverte | William Crookes (1861) | |||||||||||||||||||||||||||
| Premier isolement | Claude-Auguste Lamy (1862) | |||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||
| Densité (à proximité rt) | 11,85 g · cm -3 | |||||||||||||||||||||||||||
| Liquid densité au mp | 11,22 g · cm -3 | |||||||||||||||||||||||||||
| Point de fusion | 577 K , 304 ° C, 579 ° F | |||||||||||||||||||||||||||
| Point d'ébullition | 1746 K, 1473 ° C, 2683 ° F | |||||||||||||||||||||||||||
| La chaleur de fusion | 4.14 kJ · mol -1 | |||||||||||||||||||||||||||
| Chaleur de vaporisation | 165 kJ · mol -1 | |||||||||||||||||||||||||||
| Capacité thermique molaire | 26,32 J · mol -1 .K -1 | |||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||
| États d'oxydation | 3, 2, 1 (Légèrement oxyde de base) | |||||||||||||||||||||||||||
| Électronégativité | 1,62 (échelle de Pauling) | |||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 589,4 kJ · mol -1 | |||||||||||||||||||||||||||
| 2ème: 1971 kJ · mol -1 | ||||||||||||||||||||||||||||
| 3ème: 2878 kJ · mol -1 | ||||||||||||||||||||||||||||
| Rayon atomique | 170 h | |||||||||||||||||||||||||||
| Rayon covalente | 145 ± 19 heures | |||||||||||||||||||||||||||
| Rayon de Van der Waals | 196 h | |||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | |||||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | |||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 0,18 μΩ · m | |||||||||||||||||||||||||||
| Conductivité thermique | 46,1 W · m -1 · K -1 | |||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 29,9 um · m -1 · K -1 | |||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 818 m · s -1 | |||||||||||||||||||||||||||
| Le module d'Young | 8 GPa | |||||||||||||||||||||||||||
| Module de cisaillement | 2,8 GPa | |||||||||||||||||||||||||||
| Module Bulk | 43 GPa | |||||||||||||||||||||||||||
| Coefficient de Poisson | 0,45 | |||||||||||||||||||||||||||
| Dureté Mohs | 1.2 | |||||||||||||||||||||||||||
| Dureté Brinell | 26,4 MPa | |||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-28-0 | |||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||
| Article détaillé: Isotopes de thallium | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Le thallium est un élément chimique de symbole Tl et de numéro atomique 81. Ce gris doux post-métal de transition ne est pas trouvé libre dans la nature. Lorsque isolé, il ressemble à l'étain , mais se décolore lorsqu'il est exposé à l'air. Chimistes William Crookes et Claude-Auguste Lamy découvert thallium indépendamment en 1861, dans les résidus de l'acide sulfurique production. Les deux ont utilisé la méthode de la nouvellement développé spectroscopie de flamme, dans lequel le thallium produit une gamme spectrale verte notable. Thallium, du grec θαλλός, thallos, ce qui signifie «une pousse verte ou une brindille," a été nommé par Crookes. Il a été isolé par électrolyse un an plus tard, par Lamy.
Thallium tendance à se oxyder aux Etats 3 et une oxydation que les sels ioniques. L'état 3 ressemble à celle des autres éléments dans le groupe de thallium (bore, l'aluminium, le gallium, l'indium). Cependant, l'état 1, ce qui est beaucoup plus important dans le thallium que les éléments ci-dessus, il rappelle la chimie des métaux alcalins et le thallium (I) des ions se trouvent principalement dans géologiquement minerais à base de potassium, et (lorsqu'il est ingéré) sont traitées de nombreuses manières comme des ions potassium (K +) par des pompes ioniques dans les cellules vivantes.
Commercialement, cependant, le thallium ne est pas produit à partir de minerais de potassium, mais en tant que sous-produit du raffinage des minerais sulfurés de métaux lourds. Environ 60 à 70% de la production de thallium est utilisé dans le industrie de l'électronique, et le reste est utilisé dans le l'industrie pharmaceutique et dans la fabrication du verre . Il est également utilisé dans des détecteurs à infrarouge. Le radio-isotope du thallium-201 (comme le chlorure soluble TlCl) est utilisé en petites quantités, non toxiques en tant qu'agent de analyse de la médecine nucléaire, au cours d'un type de nucléaire Épreuve d'effort.
Sels de thallium solubles (dont beaucoup sont presque insipide) sont très toxiques en quantité, et ont été historiquement utilisé dans poisons rat et insecticides. L'utilisation de ces composés a été limité ou interdit dans de nombreux pays en raison de leur toxicité non sélective. empoisonnement au thallium résulte notamment de la perte de cheveux. En raison de sa popularité historique en tant que assassiner arme, le thallium a acquis une certaine notoriété comme «poison de l'empoisonneur» et «poudre de succession» (aux côtés de l'arsenic ).
Caractéristiques
Le thallium est extrêmement doux, malléable et assez sécable à découper avec un couteau à la température ambiante. Il a un éclat métallique qui, lorsqu'il est exposé à l'air, ternit rapidement à une teinte gris bleuté, ressemblant à plomb. Elle peut être conservée par immersion dans l'huile. Une épaisse couche d'oxyde se accumule sur le thallium se il est laissé dans l'air. En présence d'eau, le thallium hydroxyde est formé. Sulfurique et l'acide nitrique se dissoudre rapidement pour rendre le thallium sulfate et sels de nitrate, tandis acide chlorhydrique forme un insoluble thallium (I) couche de chlorure. Son potentiel d'électrode standard est -0,34, légèrement supérieur au potentiel de fer (à -0,44).
Isotopes
Le thallium a 25 isotopes qui ont masses atomiques allant de 184 à 210. 203 et 205 Tl Tl sont les seuls isotopes stables, et 204 Tl est le plus stable radio-isotope, avec une demi-vie de 3,78 ans.
202 Tl (demi-vie 12,23 jours) peut être faite dans un cyclotron, tandis que 204 Tl est faite par le activation neutronique de thallium stable dans un réacteur nucléaire.
201 Tl (demi-vie de 73 heures), se désintègre par capture d'électrons, émettant des rayons X Hg (~ 70-80 keV), et des photons de 135 et 167 keV dans 10% abondance totale; par conséquent, il a de bonnes caractéristiques d'imagerie sans dose excessive de rayonnement patient. Ce est l'isotope le plus couramment utilisé pour le nucléaire thallium tests de stress cardiaque.
Tl 208 (demi-vie 3,05 minutes) est généré dans le naturelle thorium chaîne de désintégration. Son éminent 2615 keV rayons gamma est la caractéristique dominante de haute énergie observée dans naturelle rayonnement de fond.
Chimie
Les deux principaux états d'oxydation de thallium sont 1 et 3. Dans l'état d'oxydation 1 la plupart des composés ressemblent étroitement aux correspondants de potassium ou d'argent composés (la rayon ionique de thallium (I) est de 1,47 Å tandis que celle de potassium est de 1,33 Å et celle de l'argent est de 1,26 A), qui était la raison pour laquelle le thallium était parfois considéré comme un métal alcalin dans l'Europe (mais pas dans l'Angleterre ) dans les années immédiatement après sa découverte. Par exemple, le soluble dans l'eau et très rudimentaire thallium (I) réagit avec de l'hydroxyde de dioxyde de carbone soluble dans l'eau formant le carbonate de thallium. Ce carbonate est le seul carbonate de métal lourd soluble dans l'eau. La similitude avec des composés d'argent est observée avec les composés halogénures, oxydes, sulfures et. Le thallium (I) de bromure est un composé photosensible jaune très similaire à la bromure d'argent, tandis que le noir thallium (I) de l'oxyde et thallium (I) sulfure sont très similaires à la l'oxyde d'argent et sulfure d'argent.
Les composés à l'état d'oxydation +3 ressemblent composés de l'aluminium (III) correspondant. Ce sont des agents oxydants modérément forts, comme l'illustre le potentiel de réduction de 0,72 volts pour Tl 3+ + 3 e - → Tl (s). L'oxyde de thallium (III) est un solide noir qui se décompose au-dessus de 800 ° C, formant le thallium (I) de l'oxyde et de l'oxygène.
Histoire
Thallium ( grec θαλλός, thallos, ce qui signifie «une pousse verte ou une brindille") a été découvert par spectroscopie de flamme en 1861. Le nom vient de thallium de lumineux spectrale verte raies d'émission.
Après la publication du procédé perfectionné de la spectroscopie de flamme par Robert Bunsen et Gustav Kirchhoff et la découverte de césium et le rubidium dans les années 1859-1860, la spectroscopie de flamme est devenu une méthode approuvée pour déterminer la composition des minéraux et des produits chimiques. William Crookes et Claude-Auguste Lamy fois commencé à utiliser la nouvelle méthode. William Crookes a utilisé pour faire des déterminations spectroscopiques pour le tellure de composés du sélénium déposés dans le chambre plomb d'une usine de production d'acide sulfurique à proximité Tilkerode dans le Montagnes du Harz. Il avait obtenu les échantillons pour ses recherches sur le sélénium cyanure provenant Août Hofmann ans plus tôt. En 1862, Crookes a pu isoler de petites quantités de nouvel élément et déterminer les propriétés de quelques composés. Claude-Auguste Lamy a utilisé un spectromètre qui était similaire à Crookes »pour déterminer la composition d'une substance contenant du sélénium qui a été déposé lors de la fabrication de l'acide sulfurique à partir de la pyrite . Il a également remarqué la nouvelle ligne verte dans les spectres et a conclu qu'un nouvel élément était présent. Lamy avait reçu ce matériel de l'usine d'acide sulfurique de son ami Fréd Kuhlmann et ce sous-produit est disponible en grandes quantités. Lamy a commencé à isoler l'élément nouveau de cette source. Le fait que Lamy a pu travailler de larges quantités de thallium lui a permis de déterminer les propriétés de plusieurs composés et en plus il a préparé un petit lingot d'thallium métallique qui il a préparé par refusion thallium il avait obtenu par électrolyse de sels de thallium.
Comme les deux scientifiques ont découvert le thallium indépendamment et une grande partie du travail, en particulier l'isolement du thallium métallique a été faite par M. Lamy, Crookes a essayé de sécuriser sa priorité sur le travail. Lamy a reçu une médaille à l'Exposition internationale de Londres 1862: Pour la découverte d'une nouvelle et abondante source de thallium et après des protestations lourde Crookes a également reçu une médaille:. Thallium, pour la découverte du nouvel élément La controverse entre les deux scientifiques a continué 1862 et 1863. travers plus de la discussion se est terminée après Crookes a été élu Fellow de la Royal Society en Juin 1863.
L'utilisation dominante du thallium était l'utilisation de poison pour rongeurs. Après plusieurs accidents l'utilisation de poison a été interdit aux États-Unis par le Décret présidentiel 11643 en Février 1972. Dans les années suivantes plusieurs autres pays ont également interdit l'utilisation.
Présence et la production
Bien que le thallium est un élément modeste abondant dans la croûte de la Terre, avec une concentration estimée à environ 0,7 mg / kg, la plupart du temps en association avec potassium à base de minéraux dans les argiles , sols et granites , le thallium ne est généralement pas économiquement récupérables à partir de ces sources. La principale source de thallium à des fins pratiques est le montant de la trace qui se trouve dans le cuivre , le plomb , le zinc , et d'autres lourds-métal sulfure minerais.

Le thallium se trouve dans les minerais crooksite TlCu 7 Se 4, hutchinsonite TlPbAs 5 S 9, et lorandite Tlass 2. Le thallium se produit également comme un oligo-élément dans la pyrite de fer , et du thallium est extrait en tant que sous-produit de la torréfaction de ce minéral pour la production d' acide sulfurique .
Le thallium peuvent également être obtenus à partir de la fusion de plomb et de zinc minerais. Les nodules de manganèse trouvés sur le fond de l'océan contient aussi quelques thallium, mais la collection de ces nodules a été et continue d'être prohibitif. Il ya aussi le potentiel de nuire à l'environnement des océans. En outre, plusieurs autres minéraux contenant du thallium, de 16% à 60% de thallium, se produisent dans la nature sous forme de complexes de sulfures ou séléniures contenant essentiellement de l'antimoine , l'arsenic , le cuivre, le plomb et / ou argent . Cependant, ces minéraux sont rares, et ils ne ont eu aucune importance commerciale comme sources de thallium. Le Allchar dépôt dans le sud de la Macédoine était le seul domaine où le thallium n'a jamais été exploitée activement. Ce dépôt contient encore un lâche estimés à 500 tonnes de thallium, et ce est une source de plusieurs minéraux rares thallium, par exemple lorandite.
Le United States Geological Survey (USGS) estime que la production mondiale annuelle de thallium est d'environ 10 tonnes métriques en tant que sous-produit de la fusion de cuivre, de zinc, et les minerais de plomb. Le thallium est soit extraite des poussières des cheminées de la fonderie ou de résidus tels que scories, qui sont collectées à la fin du processus de fusion. Les matières premières utilisées pour la production thallium contiennent de grandes quantités d'autres matières et par conséquent, une purification est la première étape. Le thallium est lixivié soit par l'utilisation d'une base ou de l'acide sulfurique à partir du matériau. Le thallium est plusieurs fois précipité de la solution et pour éliminer d'autres impuretés. A la fin il est converti en sulfate de thallium et le thallium est extrait par électrolyse sur platine ou plaques d'acier inoxydable. La production de thallium a diminué d'environ 33% dans la période 1995 à 2009 - d'environ 15 métrique tonnes à environ 10 tonnes. Comme il existe plusieurs petits dépôts de minerais ou de thallium à teneur relativement élevée, il serait possible d'augmenter la production de celui-ci si une nouvelle application, tel qu'un hypothétique contenant du thallium supraconducteur à haute température, devient pratique pour une utilisation répandue à l'extérieur du laboratoire.
Applications
Utilisations historiques
Le et inodore insipide le sulfate de thallium a été autrefois largement utilisé comme le poison à rat et la fourmi tueur. Depuis 1972, cette utilisation a été interdite dans le États-Unis en raison de problèmes de sécurité. Beaucoup d'autres pays ont suivi cet exemple dans les années suivantes. les sels de thallium ont été utilisés dans le traitement de la teigne, autre infections de la peau et de réduire le transpiration nocturne de tuberculose patients. Toutefois, cette utilisation a été limitée en raison de leur étroite index thérapeutique, et le développement de médicaments plus avancés pour ces conditions.
Optique
Le thallium (I) et le bromure de de thallium (I) d'iodure cristaux ont été utilisés comme matériaux optiques infrarouges, car ils sont plus durs que d'autres optiques infrarouges communs, et parce qu'ils ont sensiblement la transmission à des longueurs d'onde plus longues. Le nom commercial KRS-5 se réfère à ce matériau. Le thallium (I) de l'oxyde a été utilisé pour fabriquer des verres qui ont une forte indice de réfraction. Combiné avec du soufre ou du sélénium et arsenic , le thallium a été utilisé dans la production de haute densité verres qui ont de faibles points de fusion dans la gamme de 125 et 150 ° C . Ces verres ont des propriétés de température ambiante qui sont semblables à des lunettes ordinaires et sont durables, insoluble dans l'eau et ont uniques indices de réfraction.
Électronique

Le thallium (I) de sulfure conductivité électrique varie avec l'exposition à lumière infrarouge rendant ainsi ce composé utile dans photorésistances. Le séléniure de thallium a été utilisé dans un bolomètre pour la détection infrarouge. Le dopage des semi-conducteurs de sélénium au thallium améliore leurs performances, et il est donc utilisé en quantités infimes dans les redresseurs de sélénium. Une autre application de dopage est le thallium cristaux d'iodure de sodium dans dispositifs gamma de détection de rayonnement. Dans ces derniers, les cristaux d'iodure de sodium sont dopées avec une petite quantité de thallium d'améliorer leur efficacité en tant que générateurs de scintillation. Certaines des électrodes dans analyseurs d'oxygène dissous contiennent thallium.
La supraconductivité à haute température
L'activité de recherche au thallium est en cours pour développer à haute température supraconducteurs matériaux pour des applications telles que imagerie par résonance magnétique, le stockage de l'énergie magnétique, propulsion magnétique, et la production d'énergie électrique et de transmission. La recherche dans les applications commencé après la découverte du premier thallium calcium baryum supraconducteur à base d'oxyde de cuivre en 1988.
Médical
Avant l'application généralisée de technétium-99m en la médecine nucléaire, la isotope radioactif le thallium-201, avec une demi-vie de 73 heures, a été la principale substance pour la cardiographie nucléaire. Le nucléide est encore utilisé pour les tests de stress pour la stratification du risque chez les patients atteints la maladie coronarienne (CAD). Cet isotope du thallium peut être généré en utilisant un générateur transportable qui est similaire à la Générateur de technétium-99m. Le générateur contient plomb-201 (demi-vie 9,33 heures) qui se désintègre par capture d'électrons au thallium-201. Le plomb-201 peut être produit dans un cyclotron par le bombardement du thallium avec protons ou deutérons par le (p, 3n) et (D), 4n réactions.
Thallium stress test
Un test de stress au thallium est une forme de scintigraphie, où la quantité de thallium dans les tissus est en corrélation avec l'approvisionnement en sang des tissus. Cellules cardiaques viables ont normale Na + / K + des pompes ioniques de change. Le cation se lie pompes Tl + K + et est transporté dans les cellules. Exercice ou induit de dipyridamole (élargissement vasodilatation) des artères coronaires normales. Ce produit coronarienne voler dans des zones où les artères sont dilatées au maximum. Domaines d'infarctus ou tissu ischémique restera «à froid». Thallium pré- et post-stress peuvent indiquer les domaines qui bénéficieront de l'infarctus revascularisation. Redistribution indique l'existence de vol coronaire et la présence de ischémique maladie de l'artère coronaire.
D'autres utilisations
Un alliage mercure-thallium, qui forme un eutectique à 8,5% thallium, est rapporté à geler à -60 ° C, environ 20 ° C en dessous du point de congélation du mercure. Cet alliage est utilisé dans les thermomètres et les interrupteurs à basse température. En synthèse organique, thallium (III) des sels, comme le trinitrate de thallium ou de triacétate, sont des réactifs utiles dans la scène différentes transformations aromatiques, les cétones, les oléfines, entre autres. Le thallium est un constituant de l'alliage dans le plaques d'anode dans les batteries d'eau de mer de magnésium. Sels de thallium solubles sont ajoutés à bains de placage or pour augmenter la vitesse de placage et de réduire la taille des grains dans la couche d'or.
La solution saturée de parties égales de thallium (I) formiate (Tl (CHO 2)) et de thallium (I) malonate (Tl (C 3 H 3 O 4)) dans l'eau est connu sous le nom Solution Clerici. Ce est un liquide inodore mobile dont les changements de couleur jaunâtre à effacer sur la réduction de la concentration des sels de thallium. Avec la masse volumique de 4,25 g / cm 3 à 20 ° C une solution, Clerici est l'un des plus lourds de solutions aqueuses connues. Il a été utilisé dans le 20ème siècle pour mesurer la densité des minéraux par la méthode de flottation, mais l'utilisation est interrompu en raison de la toxicité élevée et la corrosivité de la solution.
L'iodure de thallium est utilisé comme additif à lampes aux halogénures de métal, souvent en compagnie d'une à deux halogénures d'autres métaux. Il permet d'optimiser le rendu de la température de la lampe et la couleur, et de décaler la sortie spectrale dans la région verte, qui est utile pour l'éclairage sous-marin.
Toxicité
Thallium et ses composés sont extrêmement toxiques, et doivent être manipulés avec beaucoup de soin. Il ya de nombreux cas enregistrés d'empoisonnement au thallium fatale. Contact avec la peau est dangereux, et une ventilation adéquate doit être fournie lors de la fusion de ce métal. Thallium (I) composés ont une solubilité aqueuse élevée et sont facilement absorbés par la peau. L'exposition à ces doit pas dépasser 0,1 mg par m 2 de peau dans une moyenne pondérée sur 8 heures (40 heures-semaine de travail). Thallium est un suspect humaine cancérogène. Pendant longtemps, les composés du thallium étaient facilement disponibles comme poison à rat. Ce fait et qu'il est soluble dans l'eau et presque insipide conduit à des intoxications fréquentes causées par accident ou intention criminelle.
Le traitement de décontamination interne et
L'une des principales méthodes d'élimination du thallium (à la fois radioactifs et normale) de l'homme est d'utiliser Bleu de Prusse, un matériau qui absorbe le thallium. Jusqu'à 20 g par jour de bleu de Prusse est alimenté par la bouche de la personne, et il passe par leur système digestif et sort dans la selles. L'hémodialyse et hémoperfusion sont également utilisés pour éliminer le thallium à partir du sérum du sang. Au stade ultérieur du traitement potassium supplémentaire est utilisé pour mobiliser le thallium à partir du tissu.
la pollution de thallium
Selon le United States Environmental Protection Agency (EPA), les sources de pollution de thallium artificielles comprennent des émissions gazeuses cimenteries, la combustion du charbon des centrales électriques, des égouts et de métal. La principale source de concentrations élevées de thallium dans l'eau est la lixiviation du thallium d'opérations de traitement de minerai.

