Enxofre
Você sabia ...
Crianças SOS produziu este website para as escolas, bem como este site de vídeo sobre a África . SOS Criança patrocínio é legal!
| Enxofre | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
16 S | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||
amarelo limão microcristais sinterizados  Linhas espectrais de enxofre | |||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | de enxofre, S, 16 | ||||||||||||||||||||||||||||||||||||
| Pronúncia | / s ʌ l f ər / SUL -fər | ||||||||||||||||||||||||||||||||||||
| Categoria elemento | metalóide | ||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 16 (Calcogênios), 3, p | ||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 32.06 (1) | ||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Ne ] 3s 2 3p 4 2, 8, 6 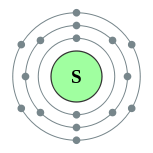 | ||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||
| Descoberta | Chinês (Antes de 2000 aC) | ||||||||||||||||||||||||||||||||||||
| Reconhecido como um elemento por | Antoine Lavoisier (1777) | ||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | (Alfa) 2,07 g cm -3 · | ||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | (Beta) 1,96 g cm -3 · | ||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | (Gama) 1,92 g cm -3 · | ||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 1.819 g cm -3 · | ||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 388,36 K , 115,21 ° C, 239,38 ° F | ||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | K 717,8, 444,6 ° C, 832,3 ° F | ||||||||||||||||||||||||||||||||||||
| Ponto crítico | 1,314 K, 20,7 MPa | ||||||||||||||||||||||||||||||||||||
| Calor de fusão | (Mono) 1,727 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||
| Calor de vaporização | (Mono) 45 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 22,75 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 6, 5, 4, 3, 2, 1, -1, -2 (Fortemente ácida óxido) | ||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 2,58 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 999,6 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| 2: 2252 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| 3: 3357 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| O raio de covalência | 105 ± 15:00 | ||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 180 pm | ||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | orthorhombic  | ||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | ||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) (amorfo) 2 × 10 15 Ω · m | ||||||||||||||||||||||||||||||||||||
| Condutividade térmica | (Amorfo) 0,205 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Massa de módulo | 7,7 GPa | ||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 2.0 | ||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7704-34-9 | ||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Os isótopos de enxofre | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Enxofre ou enxofre ( Inglês Britânico; ver abaixo ortografia ) é um elemento químico com o símbolo S e número atômico 16. É um abundante, multivalente não-metal. Sob condições normais, átomos de enxofre formar moléculas octatomic cíclicos com fórmula química S 8. O enxofre elementar é um amarelo brilhante cristalino sólido quando a temperatura ambiente. Quimicamente, o enxofre pode reagir quer como um ou oxidante agente redutor. Oxida a maioria dos metais e várias não-metais, incluindo o carbono, o que leva à sua carga negativa na maioria compostos organo, mas reduz a vários oxidantes fortes, tais como oxigénio e flúor .
O enxofre ocorre naturalmente como o elemento puro (enxofre nativo) e como sulfureto e minerais de sulfato. Cristais de enxofre elementar são comumente procurados por colecionadores minerais para suas distintas, brilhantemente coloridos poliedro formas. Sendo abundante em forma nativa, o enxofre era conhecido nos tempos antigos, mencionadas para as suas utilizações na antiga Grécia , China e Egito . Gases de enxofre foram utilizados como fumigantes, e foram utilizadas misturas medicamentosas contendo enxofre como bálsamos e antiparasitários. O enxofre é referenciado na Bíblia como enxofre (pedra queimadura) em Inglês , com este nome ainda usado em vários tomos não-científicas. Foi necessário para fazer a melhor qualidade de pólvora negra . Em 1777, Antoine Lavoisier ajudou a convencer a comunidade científica que o enxofre era um elemento básico, ao invés de um composto.
O enxofre elementar foi extraída uma vez de cúpulas salinas onde, por vezes, ocorre de forma quase puro, mas este método tem sido obsoleto desde o final do século 20. Hoje em dia, quase todo o enxofre elementar é produzido como um subproduto da remoção de contaminantes contendo enxofre, a partir de gás natural e do petróleo . Usos comerciais do elemento são principalmente em fertilizantes , por causa da relativamente elevada exigência de plantas para ele, e para o fabrico de ácido sulfúrico , um produto químico industrial primário. Outros usos conhecidos para o elemento está em partidas, inseticidas e fungicidas. Muitos compostos de enxofre são odorífera, eo cheiro de gás odorizado natural, cheiro de gambá, grapefruit, e alho é devido a compostos de enxofre. Sulfureto de hidrogénio produzido pelos organismos vivos confere o odor característico a ovos podres e outros processos biológicos.
O enxofre é um elemento essencial para toda a vida, e é amplamente utilizada em processos bioquímicos. Em reações metabólicas, compostos de enxofre servir como ambos os combustíveis e respiratórias (oxigênio alternativos) materiais para organismos simples. Enxofre na forma orgânica está presente nas vitaminas biotina e tiamina , sendo este último nomeado para a palavra grega para enxofre. O enxofre é uma parte importante de muitas enzimas e moléculas antioxidantes como e glutationa thioredoxin. Enxofre ligado organicamente é um componente de todas as proteínas, como os ácidos aminados e cisteína metionina. Pontes dissulfeto são em grande parte responsável pela resistência mecânica e insolubilidade da proteína queratina, encontrado no exterior da pele, cabelo, e as penas, e o elemento contribui para o seu odor pungente quando queimado.
Características

Propriedades físicas
Formas de enxofre moléculas poliatómicos com diferentes fórmulas químicas, com o allotrope mais conhecida-estar octasulfur, ciclo-S 8. Octasulfur é um suave, brilhante sólido amarelo, com apenas um ligeiro odor, semelhante ao de partidas. É funde a 115,21 ° C, entra em ebulição a 444,6 ° C e sublima facilmente. No 95,2 ° C, abaixo da sua temperatura de fusão, alterações ciclo-octasulfur de α-octasulfur ao β- polimorfo. A estrutura do anel S 8 é praticamente inalterada por este mudança de fase, o que afecta as interacções intermoleculares. Entre a sua fusão e temperaturas de ebulição, octasulfur muda sua allotrope novamente, virando-se de β-octasulfur a γ-enxofre, novamente acompanhado por uma densidade mais baixa, mas aumentou viscosidade devido à formação de polímeros. A temperaturas ainda mais altas, no entanto, a viscosidade diminui à medida que a despolimerização ocorre. Enxofre fundido assume uma cor vermelho escuro acima de 200 ° C. A densidade do enxofre é cerca de 2 g · cm -3, dependendo do alótropo; todos os seus allotropes estáveis são excelentes isolantes elétricos.
Propriedades químicas
Enxofre queima com uma chama azul concomitante com a formação de dióxido de enxofre, notável por sua sufocante odor peculiar. O enxofre é insolúvel em água mas solúvel em dissulfureto de carbono e, em menor grau, em outros solventes orgânicos não polares, tais como benzeno e tolueno . A primeira e a segunda energia de ionização de enxofre são 999,6 e 2252 kJ · mol -1, respectivamente. Apesar desses números, S 2+ é raro, S 4, 6 + sendo mais comum. Os quarto e sexto energias de ionização são 4556 e 8495,8 kJ · mol-1, a magnitude das figuras causados pela transferência de elétrons entre orbitais; estes estados são estáveis apenas com oxidantes fortes como flúor , oxigénio , e cloro .
Allotropes

Formas de enxofre mais de 30 sólidos allotropes , mais do que qualquer outro elemento. Além S 8, vários outros anéis são conhecidos. A remoção de um átomo de S a coroa dá 7, que é mais profundamente do que amarelo S 8. A análise por HPLC do "enxofre elementar" revela uma mistura de equilíbrio dos principalmente S 8, mas com 7 S e pequenas quantidades de S 6. Anéis maiores foram preparadas, incluindo S 12 e S 18.
Amorfo ou de enxofre "plástico" é produzido por arrefecimento rápido de exemplo para-enxofre fundido, vertendo-a em água fria. Estudos de cristalografia de raios-X mostram que a forma amorfa pode ter uma estrutura helicoidal com oito átomos por sua vez. As moléculas poliméricas longo enroladas fazer a substância acastanhado elástica, e em grandes quantidades desta forma tem a sensação de borracha em bruto. Este formulário é metaestável à temperatura ambiente gradualmente e reverte para alótropo cristalino molecular, que já não é elástica. Este processo acontece dentro de uma questão de horas ou dias, mas pode ser rapidamente catalisada.
Isótopos
Enxofre tem 25 conhecidos isótopos , quatro dos quais são estáveis: 32 S (95,02%), 33 S (0,75%), 34 S (4,21%), e 36 S (0,02%). Para além de 35S, com uma meia-vida de 87 dias, e formado em spallation raios cósmicos de 40 Ar , o isótopos radioativos de enxofre têm meias-vidas menos de 170 minutos.
Quando sulfetos são precipitados, equilíbrio isotópico entre sólidos e líquidos pode causar pequenas diferenças nas Ds-34 valores de minerais co-genética. As diferenças entre os minerais podem ser utilizados para estimar a temperatura de equilíbrio. O δ C -13 e Ds-34 de coexistência minerais carbonatos e sulfuretos pode ser utilizado para determinar o pH e oxigénio fugacidade do fluido de minério de rolamento durante a formação do minério.
Na maioria florestais ecossistemas, sulfato é derivado principalmente da atmosfera; intemperismo de minerais de minério e evaporites contribuir com algum enxofre. O enxofre com uma composição isotópica distintivo foi usado para identificar as fontes de poluição, e enxofre enriquecido foi adicionado como um marcador no hidrologia estudos. Diferenças na abundâncias naturais podem ser usados em sistemas onde há uma variação suficiente nos 34 S dos componentes dos ecossistemas. Rocky Mountain lagos pensado para ser dominada por fontes atmosféricas de sulfato foram encontrados para ter diferentes δ 34 S valores de lagos que se acredita ser dominado por bacia hidrográfica fontes de sulfato.
Ocorrência natural



32 S é criado no interior das estrelas maciças, a uma profundidade onde a temperatura excede 2,5 x 10 9 K, pela fusão de um núcleo de silício mais um núcleo de hélio. Como este é parte do alfa processo que produz elementos em abundância, o enxofre é o elemento mais comum no universo 10.
De enxofre, geralmente como sulfureto, está presente em muitos tipos de meteoritos. Condritos ordinários contêm, em média, 2,1% de enxofre, e condritos carbonáceos pode conter tanto quanto 6,6%. É normalmente presente como troilite (FES), mas há exceções, com condritos carbonáceos que contêm enxofre livre, sulfatos e outros compostos de enxofre. As cores distintivas de Jupiter 's vulcânica lua Io são atribuídos a diferentes formas de enxofre derretido, sólida e gasosa.
Na Terra, o enxofre elementar pode ser encontrado perto fontes termais e vulcânicas regiões em muitas partes do mundo, especialmente ao longo da Anel de Fogo do Pacífico; tais depósitos vulcânicos estão atualmente extraído na Indonésia , Chile e Japão. Esses depósitos são policristalinos, com o maior cristal único documentado medindo 22 × 16 × 11 cm. Historicamente, Sicília foi uma grande fonte de enxofre na Revolução Industrial .
Depósitos significativos de enxofre elementar, que se acredita ter sido (e ainda estão sendo) sintetizados por bactérias anaeróbicas em minerais de sulfato como gesso , existem em sal cúpulas ao longo da costa do Golfo do México , e em evaporites da Europa Oriental e Ásia ocidental. Enxofre nativo pode ser produzido por processos geológicos sozinho. Depósitos de enxofre fósseis de cúpulas salinas têm até recentemente sido a base para a produção comercial no Estados Unidos , Rússia , Turquemenistão e Ucrânia . Actualmente, a produção comercial é levada a cabo ainda na mina Osiek na Polónia . Tais fontes são agora de importância comercial secundária, e mais não são mais funcionou.
Compostos de enxofre que ocorrem naturalmente comuns incluem os sulfetos , como a pirita (sulfeto de ferro), cinábrio (sulfeto de mercúrio), galena (sulfeto de chumbo), esfalerite (sulfureto de zinco) e estibina (sulfureto de antimónio); e os sulfatos, tais como gesso (sulfato de cálcio), alunite (sulfato de alumínio e potássio), e barita (sulfato de bário). Na Terra, assim como em cima lua de Júpiter Io, enxofre elementar ocorre naturalmente nas emissões vulcânicas, incluindo as emissões de fontes hidrotermais.
Produção
O enxofre pode ser encontrada, por si só e historicamente foi geralmente obtida desta maneira, enquanto pirite tem sido uma fonte de enxofre por meio de ácido sulfúrico. Em regiões vulcânicas em Sicília, nos tempos antigos, foi encontrada na superfície da Terra, eo "processo siciliano" foi usado: depósitos de enxofre foram empilhados e empilhados em fornos de alvenaria construídas em encostas inclinadas, com espaços aéreos entre eles. Então, alguns de enxofre foi pulverizado, distribuídos ao longo do minério empilhados e inflamado, causando o enxofre livre para derreter as colinas. Eventualmente, os depósitos a cargo de superfície jogado fora, e os mineiros escavado veias que, em última análise pontilhavam a paisagem siciliana com minas labirínticas. Mining foi não mecanizada e de trabalho intensivo, com pickmen liberando o minério da rocha, e os meus meninos ou- carusi carregando cestos de minério para a superfície, muitas vezes através de uma milha ou mais dos túneis. Uma vez que o minério foi na superfície, foi reduzida e extraiu-se em fornos de fundição. As condições nas minas de enxofre sicilianos foram horríveis, alertando Booker T. Washington para escrever "Eu não estou preparado agora para dizer até que ponto eu acredito em um inferno físico no outro mundo, mas uma mina de enxofre na Sicília é a coisa mais próxima para o inferno que eu espero ver nesta vida . ". A difícil situação da carusi é um tema secundário na novela histórica O Senhora da roda, por Angelo F. Coniglio.
Produção de enxofre de hoje é como um produto secundário de outros processos industriais, tais como a refinação do petróleo; nestes processos, de enxofre, muitas vezes ocorre como compostos indesejados ou nocivos que são extraídos e convertido em enxofre elementar. Como um mineral, enxofre nativo sob cúpulas salinas é pensado para ser um recurso mineral fóssil, produzido pela ação de bactérias antigas sobre os depósitos de sulfato. Ele foi removido de tais minas de sal de cúpula principalmente pelo Processo Frasch. Neste método, a água sobreaquecido foi bombeada para um depósito de enxofre nativo para derreter o enxofre, e ar comprimido, em seguida, devolvido do produto fundido puro de 99,5% para a superfície. Ao longo do século 20 este procedimento produziu enxofre elementar que não requer purificação adicional. No entanto, devido a um número limitado de tais depósitos de enxofre e o alto custo de lhes trabalhar, este processo para a mineração de enxofre não tem sido empregue de uma forma significativa em qualquer parte do mundo, desde 2002.

Hoje, o enxofre é produzido a partir de petróleo, gás natural , e fontes fósseis relacionados, a partir do qual é obtido principalmente sulfeto de hidrogênio. Compostos organo, as impurezas indesejáveis no petróleo, podem ser melhoradas submetendo-os a hidrodessulfurização, que corta as ligações C-S:
- RSR + 2 H 2 2 → RH + H 2 S
O sulfureto de hidrogénio resultante deste processo, e também uma vez que ocorre no gás natural, é convertido em enxofre elementar pela Processo de Claus. Este processo envolve a oxidação de alguns sulfureto de hidrogénio em dióxido de enxofre e, em seguida, o comproporcionação dos dois:
- 3 O 2 + 2 H 2 S → 2 SO 2 + 2 H2O
- SO 2 + 2 H 2 S → 3 S + 2 H 2 O

Devido ao elevado conteúdo de enxofre do Athabasca Oil Sands, estoques de enxofre elementar deste processo agora existem em todo Alberta, Canadá. Outra maneira de armazenar enxofre é como um ligante para o betão, o produto resultante ter muitas propriedades desejáveis.
A produção mundial de enxofre em 2011 ascendeu a 69 milhões de toneladas (Mt), com mais de 15 países contribuindo com mais de 1 Mt cada. Países que produzem mais de 5 milhões de toneladas são a China (9,6), dos Estados Unidos (8,8), Canadá (7,1) e Rússia (7,1). Enquanto a produção tem vindo a aumentar lentamente 1900-2010, o preço foi muito menos estável, especialmente na década de 1980 e por volta de 2010.
Compostos
Comuns estados de oxidação de enxofre gama de -2 a +6. Enxofre forma compostos estáveis com todos os elementos exceto os gases nobres .
Sulfetos
Tratamento de enxofre com hidrogénio dá sulfeto de hidrogênio. Quando dissolvido em água, sulfeto de hidrogênio é levemente ácido:
- H 2 S
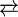 HS - + H +
HS - + H +
Gás de sulfureto de hidrogénio e o anião hidrogenossulfureto são extremamente tóxicos para os mamíferos, devido à sua inibição da capacidade de transporte de oxigénio da hemoglobina e determinada citocromos de uma maneira análoga à cianeto e azida (veja abaixo, com precauções).
Redução de enxofre elementar dá polissulfetos, que consistem em cadeias de átomos de enxofre terminados com S - centros:
- 2 Na + S 8 → Na2S 8
Esta reacção destaca sem dúvida o único imóvel mais distintiva de enxofre: sua capacidade de concatenar (ligam-se a si mesmo por formação de cadeias). A protonação destes aniões polissulfureto dá os polysulfanes, H 2 S x em que x = 2, 3, e 4. Em última análise a redução do enxofre dá sais de sulfureto:
- 16 Na + S 8 8 → Na2S
A interconversão destas espécies é explorado na bateria de enxofre de sódio. O ânion radical S 3 - dá a cor azul do mineral lápis lazúli.

Com oxidantes muito fortes, S 8 pode ser oxidado, por exemplo, para dar bicíclico S 8 2+.
Óxidos e oxiânions
Os principais são os óxidos de enxofre obtidos por queima de enxofre:
- S + O 2 → SO 2
- 2 SO 2 + O 2 → 2 SO 3
Outros óxidos são conhecidos, por exemplo, monóxido de enxofre e disulfur mono- e dióxidos, mas eles são instáveis.
Os óxidos de enxofre formam numerosos oxiânions com a fórmula SO 2- n. Dióxido de enxofre e sulfitos (SO 2-
3) estão relacionados com o ácido sulfuroso instável (H 2 SO 3). Trióxido de enxofre e sulfatos (SO 2
4) estão relacionados com o ácido sulfúrico . O ácido sulfúrico e SO 3 combinam-se para dar ácido sulfúrico fumante, uma solução de ácido pirossulfúrico (H 2 S 2 O 7) em ácido sulfúrico.
 Ácido Peroxydisulfuric
Ácido Peroxydisulfuric
Peróxidos converter enxofre na instável, como S 8 O, um sulfóxido. Ácido Peroxymonosulfuric (H 2 SO 5) e ácidos peroxydisulfuric (H 2 S 2 O 8), feitos a partir da acção de SO3 no concentrado H 2 O 2 e H 2 SO 4 concentrado em H 2 O 2, respectivamente.

4
Os sais de tiossulfato de (S 2 O 2-
3), por vezes referido como "hyposulfites", utilizados na fixação fotográfica (hipo) e como agentes redutores, apresentam enxofre em dois estados de oxidação. Ditionito de sódio, (S 2 O 2-
4), contém o anião ditionito mais altamente redutor. Ditionato de sódio (Na 2 S 2 O 6) é o primeiro membro do ácidos polythionic (H 2 S n S 6), em que n pode variar de 3 para muitos.
Halogenetos e oxi-
Os dois principais são fluoretos de enxofre hexafluoreto de enxofre, um gás denso utilizado como carburante não reactivo e não tóxico, e tetrafluoreto de enxofre, um reagente orgânico raramente usado que é altamente tóxico. Os análogos clorados são e dicloreto de enxofre monocloreto de enxofre. E cloreto de sulfurilo ácido clorossulfúrico são derivados de ácido sulfúrico; cloreto de tionilo (SOCl2) é um reagente em comum síntese orgânica.
Pnictides
Um importante composto S-N é a gaiola tetranitride tetrasulfur (S 4 N 4). Aquecimento este composto dá nitreto de enxofre polimérico ((SN) x), que tem propriedades metálicas ainda que não contém quaisquer metais átomos. Tiocianatos conter o SCN - grupo. A oxidação de tiocianato dá tiocianogénio, (SCN) 2 com a conectividade NCS-SCN. Sulfuretos de fósforo são numerosos, sendo a mais importante comercialmente o gaiolas P 4 S 10 e P 4 S 3.
Sulfuretos de metal
Os principais minérios de cobre, zinco, níquel, cobalto, molibdénio, e outros metais são sulfuretos. Estes materiais tendem a ser de cor escura semicondutores que não são facilmente atacados por água ou até mesmo muitos ácidos. Eles são formados, tanto geoquimicamente e, no laboratório, pela reacção do sulfureto de hidrogénio com sais de metal. O mineral galena (PbS) foi o primeiro demonstrados semicondutor e encontraram uma utilização como um sinal no retificador bigodes do gato de início rádios de cristal. O sulfeto de ferro chamado pirita , o chamado "ouro de tolo", tem a fórmula FeS2. A modernização destes minérios, geralmente por torrefação, é caro e prejudicial ao ambiente. Enxofre corrói muitos metais por meio do processo chamado manchando.
Compostos orgânicos
- Compostos organo ilustrativos

Alicina, o ingrediente activo no alho

R- cisteína, um aminoácido contendo um grupo tiol

A metionina, um aminoácido que contém um tioéter

Dissulfureto de difenilo, dissulfureto de um representante

Ácido perfluorooctano, um surfactante controversa

Dibenzotiofeno, um componente de óleo bruto

Penicilina
Algumas das principais classes de compostos orgânicos contendo enxofre, incluem o seguinte:
- Tióis ou mercaptanos (como eles são meros urers Cury capt como quelantes) são os análogos de enxofre de álcoois ; tratamento de tióis com a base dá iões tiolato.
- Os tioéteres são os análogos de enxofre dos éteres .
- Iões de sulfónio tem três grupos ligados a um centro de enxofre catiônica. Dimethylsulfoniopropionate (DMSP) é um desses compostos, importante na orgânico marinho ciclo do enxofre.
- E sulfóxidos sulfonas são tioéteres com um e dois átomos de oxigénio ligados ao átomo de enxofre, respectivamente. O sulfóxido mais simples, dimetil sulfóxido, é um solvente comum; uma sulfona é comum sulfolano.
- Os ácidos sulfónicos são usados em muitos detergentes.
Compostos com ligações carbono-enxofre são incomuns com a notável exceção de dissulfureto de carbono, um líquido incolor volátil que é estruturalmente semelhante ao dióxido de carbono. É usado como um reagente para fazer o polímero rayon e muitos compostos organossulfurados. Ao contrário de monóxido de carbono , monossulfureto de carbono só é estável como um gás diluído, como no meio interestelar.
Organosulfurados compostos são responsáveis pela alguns dos odores desagradáveis de matéria orgânica em decomposição. Eles são utilizados no odoração de gás natural e de fazer com que o odor de alho e skunk spray. Nem todos os compostos orgânicos de enxofre cheiro desagradável em todas as concentrações: o enxofre contendo monoterpenóide mercaptano de toranja em pequenas concentrações é responsável pelo cheiro característico de toranja, mas tem um odor tiol genérico em concentrações maiores. Mostarda de enxofre, um potente vesicant, foi usado na Primeira Guerra Mundial como um agente incapacitante.
Ligações enxofre-enxofre são um componente estrutural para endurecer de borracha, de um modo semelhante ao papel biológico de pontes dissulfureto para enrijecer as proteínas (ver abaixo biológica). No tipo mais comum de industrial "cura" ou endurecimento e reforço dos recursos naturais borracha , enxofre elementar é aquecida com a borracha até o ponto que as reações químicas formar pontes de dissulfureto entre unidades de isopreno do polímero. Este processo, patenteado em 1843, permitiu borracha para se tornar um importante produto industrial, especialmente pneus de automóvel. Por causa do calor e de enxofre, o processo foi nomeado vulcanização, após o deus romano da forja e vulcanismo.
História
Antiguidade

Sendo abundantemente disponível na forma nativa, enxofre ( Latin enxofre) era conhecida nos tempos antigos e é referido na Torá ( Genesis). Traduções inglesas da Bíblia comumente referido enxofre como "enxofre", dando origem ao nome de ' fogo e enxofre " sermões, em que os ouvintes são lembrados do destino de danação eterna que aguardam o incrédulo e impenitente. É a partir dessa parte da Bíblia que O inferno está implícita para "cheiro de enxofre" (provavelmente devido à sua associação com a atividade vulcânica). De acordo com Papiro de Ebers, uma pomada de enxofre foi utilizado no antigo Egito para tratar pálpebras granulares. Enxofre foi utilizado para a fumigação em pré-clássico Grécia ; esta é mencionada na Odisséia . Plínio, o Velho discute enxofre no livro 35 das suas História Natural, dizendo que a sua mais conhecida fonte é a ilha de Melos. Ele menciona a sua utilização para a fumigação, medicina e branqueamento pano.
Uma forma natural de enxofre conhecido como shiliuhuang era conhecido na China desde o século 6 aC e encontrada em Hanzhong. Por volta do século 3, os chineses descobriram que o enxofre poderia ser extraído de pirita . Chineses taoístas estavam interessados em inflamabilidade de enxofre e sua reatividade com certos metais, mas seus primeiros usos práticos foram encontrados em medicina tradicional chinesa. A Dinastia Song tratado militar de 1044 AD descritos diferentes fórmulas para o chinês pó preto , que é uma mistura de nitrato de potássio (KNO 3), carvão vegetal, e enxofre.
Os primeiros alquimistas deu enxofre seu próprio símbolo alquímico, um triângulo na parte superior de uma cruz. No tratamento tradicional pele antes da era moderna da medicina científica, enxofre elementar foi usado, principalmente em cremes, para aliviar as condições, tais como sarna, micose, a psoríase, o eczema , e acne . O mecanismo de acção é desconhecido, embora se oxidar o enxofre elementar lentamente a ácido sulfuroso, o que por sua vez (através da acção de sulfito) actua como um agente de redução suave e antibacteriana.
Tempos modernos

Em 1777, Antoine Lavoisier ajudou a convencer a comunidade científica que o enxofre era um elemento, não um composto. Com o enxofre da Sicília sendo controlada principalmente pelo mercado francês, um debate seguiu-se sobre a quantidade de enxofre França e Grã-Bretanha tem. Isso levou a um confronto sem derramamento de sangue entre os dois lados em 1840. Em 1867, o enxofre foi descoberto em depósitos subterrâneos em Louisiana e Texas. O grande sucesso Processo Frasch foi desenvolvido para extrair esse recurso.
No final do século 18, fabricantes de móveis usados enxofre derretido para produzir decorativo inlays em seu ofício. Por causa da dióxido de enxofre produzido durante o processo de fusão do enxofre, o ofício de inlays de enxofre foi logo abandonada. Enxofre fundido às vezes é ainda utilizada para a fixação de parafusos de aço em buracos perfurados de concreto onde a resistência elevada choque é desejada para os pontos de fixação montados equipamentos de piso. Enxofre em pó puro foi utilizado como um tónico medicinal e laxante. Com o advento da processo de contacto, a maior parte do enxofre é usado hoje para fazer ácido sulfúrico para uma ampla gama de utilizações, especialmente fertilizantes.
Ortografia e etimologia
Enxofre vem via francês antigo de enxofre Latina, que por sua vez é, aparentemente, formado em uma raiz que significa "queimar". O elemento foi tradicionalmente soletrado enxofre no Reino Unido (desde o século 14), a maior parte da Commonwealth , incluindo Austrália , Índia , Malásia , África do Sul e Hong Kong , juntamente com o resto do Caribe e Irlanda . O enxofre é usado nos Estados Unidos, enquanto ambas as grafias são utilizadas no Canadá e nos Filipinas .
No entanto, o IUPAC adotou o enxofre ortografia em 1990, assim como o Royal Society of Chemistry Comitê de Nomenclatura em 1992. O Qualificações e Curriculum Authority para a Inglaterra e País de Gales recomendado o seu uso em 2000, e agora aparece em exames de GCSE. O Oxford Dictionaries notar que "Em química ... a ortografia -F- é agora o formulário padrão em todas as palavras relacionadas no campo em ambos os contextos britânicos e norte-americanos."
Em latim, a palavra é variadamente escrito sulpur, enxofre, e enxofre (o Dicionário Oxford Latina lista as grafias nesta ordem). É um nome original em latim e não um grego clássico empréstimo, de modo a variante ph não denota a letra grega φ (phi). Enxofre em grego é tiona (θείον), de onde vem o prefixo tio-. A simplificação do da palavra latina p ou a um ph f parece ter ocorrido no final do período clássico.
Aplicações
Ácido sulfúrico
O enxofre elementar é usado principalmente como um precursor de outros produtos químicos. Aproximadamente 85% (1989) é convertido em ácido sulfúrico ( H 2 SO 4):
- 2 S + 3 O2 + 2 H2O → 2 H 2 SO 4
Com o ser ácido sulfúrico de importância central para a economias do mundo, a produção eo consumo é um indicador de desenvolvimento industrial de uma nação. Por exemplo, com 32,5 milhões de toneladas em 2010, os Estados Unidos produzem mais ácido sulfúrico a cada ano do que qualquer outro produto químico industrial inorgânico. A utilização principal para o ácido é a extracção de minérios de fosfato para a produção de fertilizantes de fabrico. Outras aplicações de ácido sulfúrico incluem refino de petróleo, processamento de águas residuais e de extração mineral.

Outros produtos químicos de enxofre em grande escala
O enxofre reage directamente com o metano para dar dissulfureto de carbono, que é usado para fabricar celofane e rayon. Um dos usos directos de enxofre está em vulcanização da borracha, onde polissulfuretos reticular polímeros orgânicos. Os sulfitos são muito utilizadas para alvejante papel e como conservantes em seco frutas . Muitos surfactantes e detergentes, por exemplo, sulfato de laurilo e sódio, são produzidos são derivados de sulfato. O sulfato de cálcio, gesso, (CaSO 4 · 2H 2 O) é extraído na escala de 100 milhões de toneladas por ano para utilização em Cimento e fertilizantes Portland.
Quando à base de prata fotografia foi generalizada, de sódio e de amónio tiossulfato foram amplamente utilizados como "agentes de fixação." O enxofre é um componente de pólvora .
Fertilizante
O enxofre é cada vez mais utilizado como componente de fertilizantes . A forma mais importante de enxofre para o fertilizante é o mineral sulfato de cálcio. O enxofre elementar é hidrofóbica (isto é, ela não é solúvel em água) e, portanto, não pode ser directamente utilizado pelas plantas. Ao longo do tempo, as bactérias do solo pode converter-se a derivados solúveis, que podem então ser utilizados pelas plantas. Enxofre melhora a eficiência do uso de outros nutrientes essenciais de plantas, particularmente nitrogênio e fósforo. Partículas de enxofre biologicamente produzidos são naturalmente hidrofílico, devido a um revestimento biopolímero. Este enxofre é, por conseguinte, mais fácil de dispersar sobre a terra (através de pulverização como uma pasta diluída), e resulta numa libertação mais rápida.
Exigências da planta para enxofre forem iguais ou excederem os de fósforo. É um dos nutrientes principais essenciais para o crescimento das plantas, a formação de nódulos de raiz de plantas leguminosas e mecanismos de protecção. Deficiência de enxofre tornou-se generalizada em muitos países da Europa. Como as entradas atmosféricas de enxofre continuam a diminuir, o déficit na entrada de enxofre / saída é susceptível de aumentar, a menos que os fertilizantes de enxofre são utilizados.
Química fina

Organosulfurados compostos são utilizados em produtos farmacêuticos, corantes, e agroquímicos. Muitos medicamentos contêm enxofre, sendo os exemplos adiantados antibacteriano sulfonamidas, conhecidos como medicamentos de sulfa. O enxofre é uma parte de muitas moléculas de defesa bacterianas. Mais antibióticos β-lactâmicos, incluindo o penicilinas, cefalosporinas e monolactams contêm enxofre.
O sulfato de magnésio, conhecidos como sais de Epsom, quando na forma de cristal hidratado, pode ser utilizado como um laxante, um aditivo de banho, uma esfoliante, magnésio suplemento para as plantas, ou (quando em forma desidratada) como um dessecante.
Fungicida e inseticida

O enxofre elementar é uma das mais antigas fungicidas e pesticidas. "Enxofre Sova," enxofre elementar em forma de pó, é um fungicida comum para as uvas, morango, muitos legumes e várias outras culturas. Tem uma boa eficácia contra uma larga gama de doenças de oídio, bem como o ponto preto. Na produção orgânica, o enxofre é o fungicida mais importante. É o único fungicida utilizado em organicamente viveiro de produção de maçã contra a doença principal sarna da macieira em condições mais frias. Biosulfur (enxofre elementar biologicamente produzido com características hidrófilas) pode ser utilizado também para estas aplicações.
Padrão-dusting formulação de enxofre é aplicado a culturas com um espanador de enxofre ou de um avião de poeira. Enxofre molhável é o nome comercial para a varredura de enxofre formulado com ingredientes adicionais para torná-lo água miscível. Ela tem aplicações semelhantes e é utilizado como um fungicida contra mofo e outros problemas relacionados com mofo com plantas e solo.
Pó de enxofre elementar é usado como um " orgânico "(ou seja," verde ") inseticida (na verdade, uma acaricida) contra carrapatos e ácaros. Um método comum de uso é a poeira roupa ou membros com enxofre em pó.
As soluções diluídas de calda sulfocálcica (feita por combinding hidróxido de cálcio com o enxofre elementar em água), são usadas como um molho para animais de estimação para destruir Micose (fungos), sarna e outras dermatoses e parasitas. Velas de enxofre consistem de quase puro enxofre em blocos ou pastilhas que são queimados para fumigar estruturas. Já não é utilizado no lar Devido à toxicidade dos produtos de combustão.
Bacteriocide na elaboração de vinhos e comida de preservação
Pequenas quantidades de adição de gás de dióxido de enxofre (ou equivalente metabissulfito de potássio adição) ao vinho fermentado para produzir traços de ácido sulfuroso (SO2 produzido quando reage com a água) e sua sais de sulfito na mistura, tem sido chamado de "a mais poderosa ferramenta na produção de vinho." Após a etapa de fermentação em levedura- vinificação, sulfites absorver oxigênio e inibir crescimento bacteriano aeróbio que de outra forma iria transformar o etanol em ácido acético, azedando o vinho. Sem este passo conservante, refrigeração indefinida do produto antes do consumo é geralmente necessária. Métodos similares voltar à antiguidade, mas histórica moderna menciona a prática de ir para o século XV. A prática é utilizada por grandes produtores de vinho industrial e pequenos produtores de vinho orgânico igualmente.
Dióxido de enxofre e sulfitos vários têm sido usados por suas propriedades conservantes antibacterianos antioxidantes em muitas outras partes da indústria de alimentos também. A prática tem diminuído desde relatórios de uma reacção de tipo alérgico de algumas pessoas para sulfitos em alimentos.
Papel biológico
Proteína e orgânicos cofatores
O enxofre é um componente essencial de todos os que vivem células . É o elemento mais abundante sétimo ou oitavo no corpo humano, em peso, sendo praticamente tão comum como potássio , e um pouco mais comum de sódio ou de cloro. De 70 kg corpo humano contém cerca de 140 gramas de enxofre.
Em plantas e animais , o aminoácidos e cisteína metionina conter a maior parte do enxofre. O elemento é assim, presente em todos os polipéptidos, proteínas e enzimas que contêm estes ácidos aminados. Nos seres humanos, a metionina é um aminoácido essencial que deve ser ingerido. No entanto, excepto para as vitaminas biotina e tiamina , cisteína e todos os compostos contendo enxofre no corpo humano pode ser sintetizado a partir de metionina.
As ligações dissulfureto (SS) ligações formadas entre resíduos de cisteína em cadeias peptídicas são muito importantes na montagem e na estrutura da proteína. Estas ligações covalentes entre cadeias peptídicas confere resistência extra e rigidez. Por exemplo, a elevada força de penas e de cabelo é em parte devido ao seu elevado teor de ligações SS e o seu elevado teor de cisteína e de enxofre. Os ovos são ricos em enxofre, porque grandes quantidades do elemento são necessárias para a formação de penas, e um odor característico a ovos podres é devido à sulfeto de hidrogênio. ligação de dissulfureto O teor elevado de cabelo e contribui para a sua penas indigestibilidade e ao seu odor característico desagradável quando queimado.
A homocisteína e taurina são outros ácidos contendo enxofre, que são semelhantes em estrutura, mas não codificado pelo ADN , e não fazem parte da estrutura primária de proteínas. Muitas enzimas celulares importantes usar grupos protéticos que terminam com unidades -SH para lidar com reações envolvendo compostos bioquímicos contendo acilo: dois exemplos comuns de metabolismo básico são coenzima A e ácido alfa-lipóico. Dois dos 13 vitaminas clássicas, biotina e tiamina contêm enxofre, com o último sendo nomeado para o seu teor de enxofre. Enxofre desempenha um papel importante, como um transportador de hidrogénio e reduzindo os seus electrões, para a reparação celular da oxidação. Reduzido glutationa, um tripéptido que contém enxofre, é um agente redutor através do seu grupo sulfidrilo (-SH) grupo derivado da cisteína. O tiorredoxinas, uma classe de pequena proteína essencial para toda a vida conhecida, utilizando pares de vizinhos de cisteínas reduzidas para agir proteína como agentes de redução geral, para efeito semelhante.
Methanogenesis, a rota a mais de metano do mundo, é uma transformação bioquímica de várias etapas de dióxido de carbono . Esta conversão requer vários cofatores organosulfurados. Estes incluem coenzima M, CH 3 SCH 2 CH 2 SO 3 - , o precursor imediato do metano .
Metaloproteínas e cofatores inorgânicos
Inorgânico de enxofre forma uma parte de ferro-enxofre, bem como muitas proteínas de cobre, níquel, e ferro. Mais difundido são os ferrodoxins, que servem como shuttles de elétrons nas células. Em bactérias, as importantes enzimas nitrogenase contém um conjunto de Fe-Mo-S, é um catalisador que executa a função importante de fixação de azoto , conversão de azoto atmosférico a amónia que pode ser usado pelos microrganismos e plantas para fazer proteínas, ADN, ARN, alcalóides e os outros compostos nitrogenados orgânicos necessários para a vida.
Metabolismo do enxofre e do ciclo do enxofre
O ciclo do enxofre foi o primeiro dos ciclos bioquímicos a ser descoberto. Na década de 1880, enquanto estudava Beggiatoa (uma bactéria que vive em um ambiente rico de enxofre), Sergei Winogradsky descobriu que ele oxidado sulfeto de hidrogênio (H 2 S) como fonte de energia, a formação de gotículas de enxofre intracelulares. Winogradsky refere a esta forma de metabolismo como inorgoxidation (oxidação de compostos inorgânicos). Ele continuou a estudá-lo em conjunto com Selman Waksman até a década de 1950.
Enxofre pode servir como fonte de energia (alimentos química) para bactérias que usam o sulfeto de hidrogênio (H 2 S) no lugar de água como o elétron doador em um primitivo fotossíntese processo -como em que o oxigênio é o receptor de elétrons. Os fotossintéticos chlorobi e bactérias roxas de enxofre e alguns chemolithotrophs usar oxigénio elementar para realizar tal oxidação de sulfeto de hidrogênio para produzir enxofre elementar (S 0 ), estado de oxidação = 0. bactérias primitivas que vivem em torno do oceano profundo respiradouros vulcânicos oxidar o sulfeto de hidrogênio neste forma com o oxigénio; ver Verme gigante para um exemplo de grandes organismos que usam o sulfeto de hidrogênio (via bactérias) como alimento a ser oxidado.
A chamada bactérias redutoras de sulfato, por contraste, "respirar sulfato" em vez de oxigénio. Eles usam enxofre como o receptor de elétrons, e reduzir vários compostos de enxofre oxidado volta em sulfeto, muitas vezes em sulfureto de hidrogénio. Elas podem crescer em um número de outros compostos de enxofre parcialmente oxidados (por exemplo, tiossulfatos, thionates, polissulfetos, sulfitos). O sulfureto de hidrogénio produzido por estas bactérias é responsável por algum do cheiro de gases intestinais ( flatos) e produtos de decomposição.
O enxofre é absorvida por plantas através das raízes do solo como o sulfato e transportado como um éster de fosfato. O sulfato é reduzida em sulfureto através de sulfito antes de ser incorporada na cisteína e outros compostos organossulfurados.
- SO4 2-SO →3 2-→ H2S → cisteína → metionina
Precauções

O enxofre elementar é não-tóxico, como são geralmente os solúveis em sulfato de sais, tais como sais de Epsom. Sais de sulfato solúveis são mal absorvidos e laxante. No entanto, quando injectados por via parentérica, eles são livremente filtrada pelos rins e eliminou com muito pouca toxicidade em quantidades multi-grama.
Quando queimaduras de enxofre no ar, que produz dióxido de enxofre. Em água, este gás produz ácido sulfuroso e sulfitos, que são antioxidantes, que inibem o crescimento de bactérias aeróbicas e permitem a sua utilização como um aditivo alimentar em pequenas quantidades. No entanto, em concentrações elevadas destes ácidos prejudicar os pulmões, olhos ou outras tecidos. Em organismos sem pulmões, tais como insectos ou plantas, que de outra forma impede a respiração em concentrações elevadas. trióxido de enxofre (feito por catálise de dióxido de enxofre) e o ácido sulfúrico são igualmente altamente corrosivo, devido os ácidos fortes que se formam em contacto com a água.
A queima de carvão e / ou petróleo pela indústria e pelas centrais de energia gera o dióxido de enxofre (SO 2 ), que reage com a água atmosférica e oxigênio para produzir ácido sulfúrico (H 2 SO 4 ) e ácido sulfuroso (H 2 SO 3 ). Esses ácidos são componentes da chuva ácida , que diminuem o pH do solo corpos e de água doce, às vezes resultando em danos significativos para o meio ambiente e química intemperismo de estátuas e estruturas. Padrões de combustível cada vez mais exigir que os produtores de combustíveis extrair enxofre de combustíveis fósseis para evitar a formação de chuva ácida. Este extraído e refinado de enxofre representa uma grande parte da produção de enxofre. Em usinas de energia movidas a carvão, gases de combustão são por vezes purificado. Mais usinas modernas, que utilizam gás de síntese extrair o enxofre antes de queimar o gás.
Sulfeto de hidrogênio é tão tóxico como o cianeto de hidrogénio , e mortes pelo mesmo mecanismo, embora sulfureto de hidrogénio é menos susceptível de causar envenenamento surpresa de pequenas quantidades inaladas, por causa do seu odor desagradável aviso. Embora pungente no início, no entanto, sulfeto de hidrogênio enfraquece rapidamente o sentido do olfato tão vítima pode respirar quantidades cada vez maiores e ter conhecimento da sua presença até que os sintomas graves ocorrem, o que pode levar rapidamente à morte. Dissolvido sulfureto e sais de hidrosulfureto também são tóxicos pelo mesmo mecanismo .