Glicose
Sobre este escolas selecção Wikipedia
Este conteúdo da Wikipedia foi escolhida pela SOS Children para adequação nas escolas de todo o mundo. Você quer saber sobre o patrocínio? Veja www.sponsorachild.org.uk
| D Glicose | |
|---|---|
 | |
 Glicose C6H12O6 | |
Nome IUPAC preferido D-glicose | |
(2R, 3S, 4R, 5R) -2,3,4,5,6-Pentahydroxyhexanal | |
Outros nomes Açúcar no sangue | |
| Identificadores | |
| Abreviações | Glc |
| Número CAS | 50-99-7 |
| PubChem | 5793 |
| ChemSpider | 5589 |
| UNII | 5SL0G7R0OK |
| Número da CE | 200-075-1 |
| KEGG | C00031 |
| MeSH | Glicose |
| Chebi | Chebi: 4167 |
| ChEMBL | CHEMBL1222250 |
| Número RTECS | LZ6600000 |
| Código ATC | B05 V04 CA02, V06 DC01 |
| Beilstein Referência | 1281604 |
| Gmelin Referência | 83.256 |
| 3DMet | B04623 |
| Imagens-jmol 3D | Imagem 1 Image 2 |
SMILES
| |
InChI
| |
| Propriedades | |
| Fórmula molecular | C 6 H 12 O 6 |
| Massa molar | 180,16 g mol-1 |
| Aparência | Pó branco |
| Densidade | 1,54 g / cm3 |
| Ponto de fusão | α- D -glucose: 146 ° C |
| Solubilidade em água | 91 g / 100 ml |
| Termoquímica | |
| Entalpia padrão de formação Δ f H | -1271 KJ / mol |
| Entalpia padrão de combustão Δ c H | -2805 KJ / mol |
| Molar padrão entropia S | 209,2 J K -1 -1 mol |
| Capacidade de calor específico, C | |
| Perigos | |
| MSDS | ICSC 0865 |
| Índice da UE | não listado |
| NFPA 704 |  1
0 0 |
Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
Glicose ( / ɡ l u k oʊ s / Ou / - k oʊ z /; C 6 H 12 O 6, também conhecido como D -glucose, dextrose, ou açúcar de uva) é um simples monossacárido encontrada nas plantas. É um dos três monos sacar idos alimentares, juntamente com e frutose galactose, que são absorvidos diretamente na corrente sanguínea durante a digestão. Um importante carboidrato em biologia , células usá-lo como fonte primária de energia e um intermediário metabólico. A glicose é um dos principais produtos da fotossíntese e combustíveis para respiração celular. Glucose existe em várias estruturas moleculares diferentes, mas todas estas estruturas podem ser divididos em duas famílias de imagens especulares ( estereoisómeros). Apenas um conjunto destes isómeros existe na natureza, os derivados do " forma destro "de glicose, denotado D -glucose. D -glucose é por vezes referido como dextrose, embora o uso desse nome é fortemente desencorajada. O termo é derivado da dextrose glucose dextrorrotatório. Este nome é, por conseguinte, confuso quando aplicado ao enantiómero, que roda a luz na direcção oposta. Amido e celulose são os polímeros derivados a partir da desidratação de D -glucose. O outro estereoisómero, chamada L -glucose, quase nunca é encontrado na natureza.
O nome "glicose" vem do grego palavra glukus (γλυκύς), que significa "doce". O sufixo " ose "denota um açúcar .
Função
Por glucose-e não outro monossacárido tal como frutose-se assim amplamente utilizados em organismos não está claramente entendido. Uma razão pode ser que a glucose tem uma tendência mais baixa, em relação à outra açúcares de hexoses, para reagir de forma não específica com os aminoácidos grupos de proteínas . Esta reacção ( glicação) reduz ou destrói a função de muitos enzimas. A baixa taxa de glicação é devido à preferência de glicose para o menos reactivo cíclico isômero. No entanto, muitas das complicações a longo prazo de diabetes (por exemplo, cegueira , insuficiência renal, e neuropatia periférica) são, provavelmente, devido à glicação de proteínas ou de lípidos. Em contraste, adição regulada por enzima de glicose às proteínas por a glicosilação é muitas vezes essencial para a sua função. Outro motivo para que a glicose é o mais comum de açúcar é que ele é mais estável conformacionalmente entre outras possibilidades.
Analito em exame de sangue médica
A glicose é um médico comum analito medido em amostras de sangue. Comer ou jejum antes de tomar uma amostra de sangue tem um efeito sobre o resultado. A glicose elevada em jejum nível de açúcar no sangue pode ser um sinal de pré-diabetes ou diabetes mellitus .
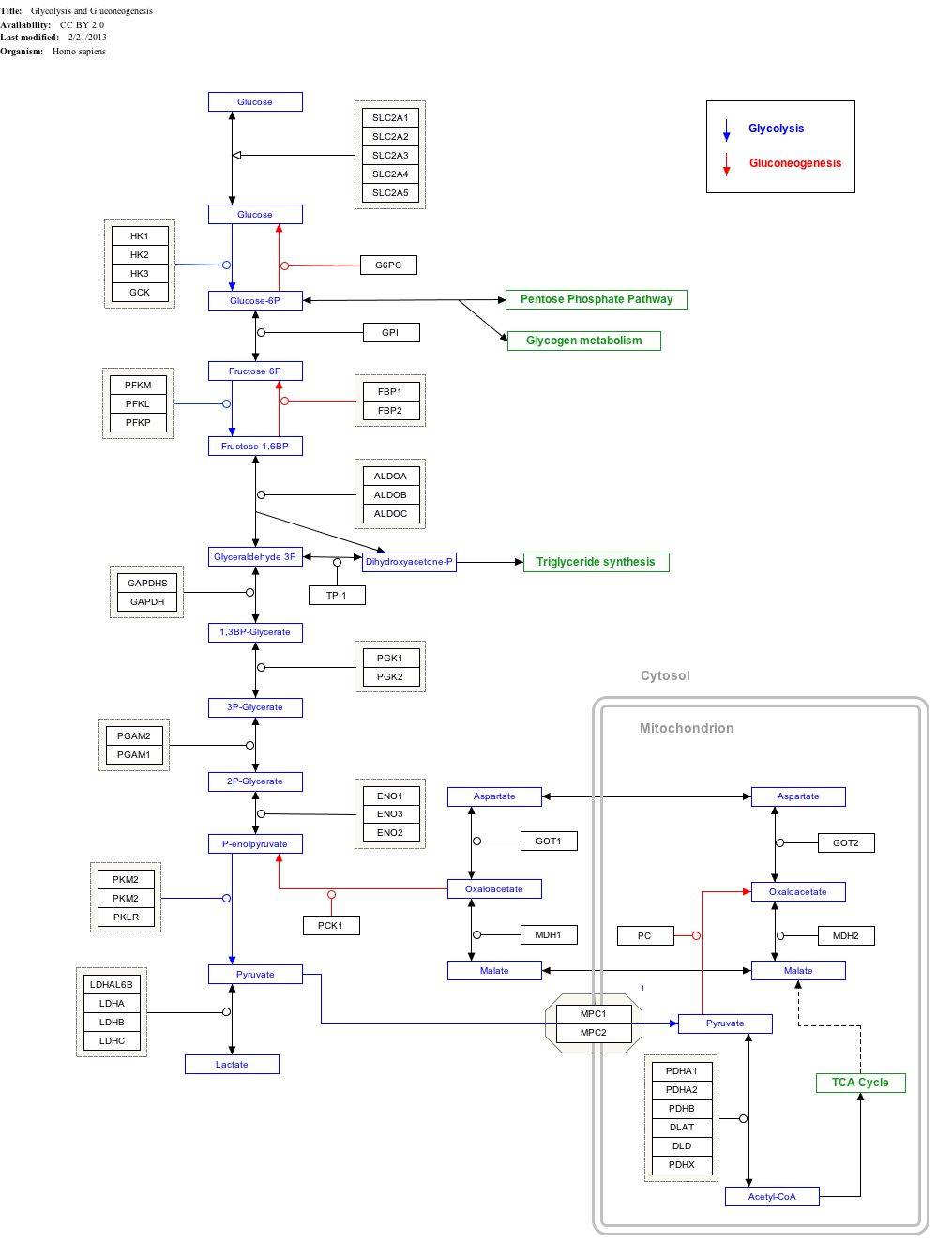
Glicólise
| ||||||||||||||||||||
| Composto C00031 em KEGG Caminho de banco de dados. Enzyme 2.7.1.1 no KEGG Caminho de banco de dados. Composto C00668 em KEGG Caminho de banco de dados. Reação R01786 na Banco de Dados KEGG Caminho. | ||||||||||||||||||||

Glicose-contendo compostos e formas isoméricas são digeridas e absorvidas pelo corpo no intestino, incluindo amido, glicogênio, e dissacáridos monossacáridos.
Glicose é armazenado principalmente no fígado e nos músculos como glicogénio.
-It É distribuído e utilizado em tecidos como a glucose livre.
Uso de glicose como fonte de energia nas células é através da respiração aeróbia ou anaeróbia. Ambos estes começam com os primeiros passos da glicólise via metabólica. O primeiro passo é o de este fosforilação de glicose por hexoquinase para prepará-lo para a avaria mais tarde para fornecer energia. A principal razão para a fosforilação imediata de glicose por uma hexoquinase é para evitar a difusão para fora da célula. A fosforilação adiciona uma carregada de modo que o grupo fosfato glicose-6-fosfato não pode facilmente atravessar a membrana celular. Irreversíveis primeiros passos de uma via metabólica são comuns para fins de regulamentação.
Em respiração anaeróbica uma molécula de glicose produz um ganho líquido de duas moléculas de ATP (quatro moléculas de ATP são produzidos durante a glicólise mas duas são obrigados por enzimas utilizadas, durante o processo). Na respiração aeróbia uma molécula de glicose é muito mais rentável em que um patrimônio líquido de 32 moléculas de ATP é gerado (34 bruta com dois sendo exigido no processo).
Clique em genes, proteínas e metabolitos abaixo o link para respectivos artigos.
- ^ O mapa interativo via pode ser editada em WikiPathways: "GlycolysisGluconeogenesis_WP534".
Precursor
Organismos utilizar glucose como um precursor para a síntese de outras substâncias importantes. Amido, celulose, e glicogênio ("amido animal") são a glicose comum (polímeros polissacarídeos). Alguns destes polímeros como amido ou glicogênio servir como depósitos de energia, enquanto outros como celulose e quitina (que é feita a partir de um derivado de glucose) tem funções estruturais. Oligossacarídeos de glicose, combinados com outros açúcares servem como lojas de energia importantes. Estes incluem , o açúcar lactose predominante no leite que um dissacárido de glucose-galactose e sacarose , outra dissacárido de glucose e frutose. A glucose também é adicionado para certas proteínas e lípidos em um processo chamado glicosilação. Isso é muitas vezes crucial para o seu funcionamento. As enzimas que se juntam glicose a outras moléculas normalmente usar glicose fosforilada para alimentar a formação da nova ligação por quebra da ligação de glucose-fosfato.
Para além do seu uso directo como um monómero, a glicose pode ser dividido para sintetizar uma ampla variedade de outras biomoléculas. Isto é importante como glucose serve tanto como um armazenamento de energia primária, mas também como uma fonte de carbono orgânico. A glicose pode ser dividido e convertido em lípidos. Também é um precursor para a síntese de outras moléculas importantes, como a vitamina C ( ácido ascórbico). Embora plantas e alguns micróbios podem criar todos os compostos que necessitam de glucose dada os minerais necessários, todos os animais e muitos micróbios não podem sintetizar algumas ou
Estrutura e nomenclatura
A glicose é um monos sacar ido com a fórmula C 6 H 12 O 6 ou H- (C = O) - (CHOH) 5 -H, cujos cinco grupos de hidroxila (OH) são dispostos de uma maneira específica ao longo de sua seis carbono backbone.
Forma de cadeia aberta

Na sua fugaz forma de cadeia aberta, a molécula de glicose tem um aberto (em oposição a cíclico) e não ramificado espinha dorsal de seis átomos de carbono, C-1 a C-6; em que C-1 é parte de um grupo aldeído H (C = O) -, e cada um dos outros cinco carbonos carrega um grupo hidroxilo -OH. O restante laços de carbonos backbone estão satisfeitos com hidrogênio átomos de -H. Portanto glicose é um hexose e de um de aldose, ou um aldohexose.
Cada um dos quatro átomos de carbono C-2 a C-5 é um estereocentro, o que significa que as suas quatro ligações para ligar quatro substituintes diferentes. (Carbono C-2, por exemplo, se conecta a - (C = O) H, -OH, -H, e - (CHOH) 4 H.) Em D -glucose, estas quatro partes devem estar numa específica tridimensional arranjo. Nomeadamente, quando a molécula é desenhada na De projecção de Fischer, os hidroxilos em C-2, C-4 e C-5 deve estar no lado direito, enquanto que, em C-3 deve estar do lado esquerdo.
As posições desses quatro hidroxilas são exatamente invertida no diagrama de Fischer . G D -glucose - -glucose e L são dois dos 16 possíveis aldohexoses; os outros 14 são alose, altrose, manose, gulose, idose, galactose, e talose, cada um com dois enantiómeros, "D -" e "L -".
Formas cíclicas
Em soluções, a forma de cadeia aberta da glucose (ou "D -" ou "L -") existe em equilíbrio com vários isómeros cíclicos , contendo cada um um anel de carbonos fechadas por um átomo de oxigénio. Em solução aquosa no entanto, mais do que 99% de moléculas de glicose, num dado momento, como existem piranose. A forma de cadeia aberta é limitada a cerca de 0,25% e de furanose existe em quantidades insignificantes. Os termos "glicose" e "D -glucose" são geralmente usados para estas formas cíclicas bem como. O anel surge a partir da forma de cadeia aberta por um reacção de adição nucleofílica entre o grupo aldeído - (C = O) H em C-1 e o grupo -OH hidroxilo em C-4 ou C-5, dando origem a um grupo hemiacetal -C (OH) HO-.
A reacção entre C-1 e C-5 cria uma molécula com um anel de seis membros, chamada piranose, após o éter cíclico pirano, a molécula mais simples com o mesmo anel de carbono-oxigénio. A reacção (muito mais rara) entre C-1 e C-4 cria uma molécula com um anel de cinco membros, chamada furanose, após o éter cíclico furano. Em ambos os casos, cada carbono no anel tem um átomo de hidrogénio e um grupo hidroxilo ligado, excepto para a última de carbono (C-4 ou C-5) em que o hidroxilo é substituído pelo restante da molécula aberto (que é - (C ( CH 2 OH) HOH) -H ou - (CHOH) -H, respectivamente).
A reacção de fecho do anel faz carbono C-1 quiral, também, uma vez que as suas quatro ligações levar a -H, a-OH, de carbono C-2, e para o oxigénio do anel. Estas quatro partes da molécula podem ser dispostas em torno de C-1 (o anomérica de carbono) de duas maneiras distintas, designadas pelos prefixos "α-" e "β-". Quando uma molécula de glucopiranose está desenhado na Projecção Haworth, a designação "α-" significa que o grupo hidroxilo ligado ao C-1 e o grupo OH -CH 2 em C-5 encontra-se em lados opostos do plano do anel (um arranjo trans), enquanto "β-" significa que eles estão no mesmo lado do plano (um arranjo cis).
Por conseguinte, o de cadeia aberta isómero D -glucose dá origem a quatro isómeros cíclicos distintas: -glucopyranose α- D, D -glucopyranose β-, -glucofuranose α- D, e D -glucofuranose β-; que são todos quiral.
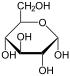 α- D - | 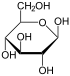 β- D - | 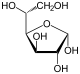 α- D - | 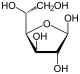 β- D - |

α- D -
Glucopyranose
β- D -
Glucopyranose
O outro isómero de cadeia aberta G -glucose semelhante dá origem a quatro diferentes formas cíclicas de L -glucose, cada imagem do espelho da -glucose D correspondente.
Os anéis não são planas, mas torcido em três dimensões. O anel glicopiranose (α ou β), pode assumir diversos formatos não-planares, análoga à "cadeira" e "barco" conformações de ciclo-hexano. Da mesma forma, o anel glucofuranose pode assumir diversos formatos, análogo ao "envelope" de conformações ciclopentano.
As formas de glucopiranose de glicose predominam em solução, e são as únicas formas observadas no estado sólido. Eles são sólidos cristalinos incolores, altamente solúveis em água e ácido acético , fracamente solúveis em metanol e etanol . Elas fundem a 146 ° C (295 ° F) (α) e 150 ° C (302 ° F) (β), e decompor a temperaturas mais elevadas em carbono e água.
Isómeros rotacionais
Cada isómero é sujeito a glicose isomerismo rotacional. Dentro da forma cíclica de glicose, a rotação pode ocorrer ao redor do ângulo de torção O6-C6-C5-O5, denominado o ω -angle, para formar três cambaleou conformações rotameros chamados gauche gauche - (gg), gauche - trans (gt) e trans - gauche (tg). Por metil α- D -glucopyranose em equilíbrio a proporção de moléculas em cada conformação rotâmero é relatado como 57: 38: 5 gg: gt: tg. Esta tendência para o -angle ω a preferir a adoptar uma conformação desajeitada é atribuído ao efeito gauche.
Propriedades físicas
Soluções

Todas as formas de glicose são incolores e facilmente solúvel em água, ácido acético , e vários outros solventes. Eles são apenas moderadamente solúvel em metanol e etanol .
A forma de cadeia aberta é termodinamicamente instável, e espontaneamente isomeriza para as formas cíclicas. (Embora a reacção de fecho do anel poderia, teoricamente, criar quatro ou três anéis de átomos, estes seriam altamente tensas e não são observados.) Em soluções a temperatura ambiente, os quatro isómeros cíclicos interconvert ao longo de um intervalo de tempo de horas, num processo denominado mutarrotação. A partir de quaisquer proporções, a mistura converge proporção estável de α: β 36:64. A razão seria α: β 11:89, se não fosse para a influência do efeito anomérico. Mutarrotação é consideravelmente mais lento em temperaturas próximas de 0 ° C.
Mutarrotação consiste de uma inversão temporária da reacção formadora de anel, que resulta na forma de cadeia aberta, seguido por uma re-formação do anel. O passo de fecho do anel pode utilizar um grupo -OH diferente daquele recriados por o passo de abertura (alternando-se assim entre as formas de piranose e furanose), e / ou o novo grupo hemiacetal criado em C-1 podem ter a mesma ou oposta lateralidade como o original (alternando-se assim entre o α e formas β). Assim, mesmo que a forma de cadeia aberta é apenas detectável em solução, que é um componente essencial do equilíbrio.
Estado sólido
Dependendo das condições, três principais formas sólidas de glicose pode ser cristalizado a partir de soluções de água: α-glucopiranose, β-glucopiranose, e hidrato de β-glucopiranose.
Actividade óptica
Se em água ou sob a forma sólida, é D -glucose dextrógiro, o que significa que ele gire na direcção da no sentido horário luz polarizada. O efeito é devido à quiralidade das moléculas, e de facto o isómero espelho-imagem, L -glucose, está levógiro (gira luz polarizada sentido anti-horário) no mesmo montante. A intensidade do efeito é diferente para cada um dos cinco tautómeros.
Note-se que o D - prefixo não se referem directamente para as propriedades ópticas do composto. Isto indica que o C-2 o centro quiral tem a mesma quiralidade que a do D -glyceraldehyde (que foi assim designada porque é dextrógiro). O facto de D -glucose é dextrógiro é um efeito combinado dos seus quatro centros quirais, não apenas de C-2; e de fato alguns dos outros -aldohexoses D são lev�iro.
Produção
| O metabolismo do comum monossacáridos e alguns reacções bioquímicas de glicose |
|---|
 |

Biossíntese
Em plantas e alguns procariotas, de glucose é um produto da fotossíntese. Em animais e fungos, resultados de glicose a partir da quebra de glicogénio, um processo conhecido como glicogenólise. Em plantas do substrato é repartição amido.
Em animais, a glucose é sintetizado do fígado e rins a partir de intermediários não-carboidratos, como piruvato, e lactato glicerol, por um processo conhecido como gliconeogênese.
Em alguns alto-mar bactérias , a glicose é produzida por chemosynthesis.
Comercial
A glicose é produzido comercialmente através da hidrólise enzimática do amido. Muitas culturas podem ser utilizadas como a fonte de amido. milho , arroz , trigo , mandioca, palha de milho e sagu são usados em várias partes do mundo. No Estados Unidos da América , amido de milho (de milho) é usado quase exclusivamente. A maior parte da glicose comercial ocorre como um componente de açúcar invertido, cerca de uma mistura 1: 1 de glicose e frutose. Em princípio, a celulose pode ser hidrolisada em glucose, mas este processo ainda não é comercialmente prática.
História
Como a glicose é uma necessidade básica de muitos organismos, uma correta compreensão da sua composição química e estrutura muito contribuiu para um avanço geral em química orgânica. Esse entendimento ocorreu em grande parte como resultado das investigações de Emil Fischer, um químico alemão que recebeu o 1902 Prêmio Nobel de Química , como resultado de suas descobertas. A síntese de glicose estabelecida a estrutura de material orgânico e, consequentemente, formada a primeira validação de definitivo Jacobus Henricus teorias de van't Hoff de cinética química e os arranjos de ligações químicas em moléculas portadoras de carbono. Entre 1891 e 1894, Fischer estabeleceu a configuração estereoquímica de todos os açúcares conhecidos e previu corretamente o possível isômeros, aplicando a teoria de átomos de carbono assimétricos de van't Hoff.