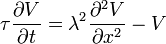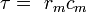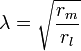potentiel d'action
À propos de ce écoles sélection Wikipedia
Cette sélection Wikipedia est déconnecté disponibles à partir enfants SOS pour la distribution dans le monde en développement. Avant de vous décider à propos de parrainer un enfant, pourquoi ne pas en apprendre davantage sur différents organismes de parrainage premier ?
En physiologie, un potentiel d'action est un événement de courte durée dans laquelle l'électrique le potentiel de membrane d'une cellule augmente rapidement et tombe, en suivant une trajectoire cohérente. Les potentiels d'action se produisent dans plusieurs types de cellules animales , appelés les cellules excitables, qui comprennent neurones, les cellules musculaires, et les cellules endocrines, ainsi que dans certaines cellules végétales . Dans les neurones, ils jouent un rôle central dans la communication de cellule à cellule. En d'autres types de cellules, leur principale fonction est d'activer les processus intracellulaires. Dans les cellules musculaires, par exemple, un potentiel d'action est la première étape dans la chaîne d'événements conduisant à la contraction. En les cellules bêta du du pancréas, elles provoquent la libération de l'insuline . Les potentiels d'action dans les neurones sont également connus comme "l'influx nerveux» ou «pointes», et la séquence temporelle des potentiels d'action générés par un neurone est appelé son «train de pointe". Un neurone qui émet un potentiel d'action est souvent dit «feu».
Les potentiels d'action sont générés par des types particuliers de les canaux ioniques voltage-dépendants noyées dans une cellule de membrane plasmique. Ces canaux sont fermés lorsque le potentiel de la membrane est proche de la potentiel de repos de la cellule, mais ils commencent rapidement à se ouvrir si la membrane augmente potentiels à une valeur de seuil définie avec précision. Lorsque les canaux ouverts, ils permettent un écoulement vers l'intérieur de sodium des ions, ce qui modifie le gradient électrochimique, qui produit à son tour une nouvelle augmentation du potentiel de membrane. Cela provoque alors plusieurs canaux d'ouverture, à produire un courant électrique plus grande, et ainsi de suite. Le processus passe de manière explosive jusqu'à ce que tous les canaux ioniques disponibles sont ouverts, ce qui entraîne une grande amélioration dans le potentiel de membrane. L'afflux rapide des ions sodium provoque la polarité de la membrane plasmique de marche arrière, et les canaux ioniques puis inactiver rapidement. Comme les canaux sodiques près, les ions sodium peuvent plus entrer dans le neurone, et ils sont activement transportés en dehors de la membrane plasmique. Potassium canaux sont ensuite activés, et il ya un courant sortant d'ions potassium, de retourner le gradient électrochimique à l'état de repos . Après un potentiel d'action a eu lieu, il ya un changement négatif transitoire, appelé afterhyperpolarization ou période réfractaire, en raison des courants de potassium supplémentaires. Ce est le mécanisme qui empêche un potentiel d'action du voyage de retour la façon dont il vient.
Dans les cellules animales, il ya deux principaux types de potentiels d'action, un type générés par les canaux sodiques voltage-dépendants, l'autre par voltage-dépendants calcium canaux. Potentiels d'action à base de sodium durent généralement moins d'un millième de seconde, alors que les potentiels d'action à base de calcium peuvent durer 100 millisecondes ou plus. Dans certains types de neurones, des pointes de calcium lents fournissent la force motrice pour une longue rafale de pointes de sodium émis rapidement. Dans les cellules du muscle cardiaque, d'autre part, un pic initial rapide de sodium fournit une «amorce» de provoquer l'apparition rapide d'un pic de calcium, ce qui produit alors une contraction musculaire.
Vue d'ensemble
Fonction
Presque toutes les cellules provenant d'animaux, de plantes et de champignons fonction que les piles, dans le sens où ils maintiennent une différence de tension entre l'intérieur et l'extérieur de la cellule, étant à l'intérieur au pôle négatif de la batterie. La tension de la cellule est généralement mesurée en millivolts (mV) ou millièmes de volts. Une tension typique pour une cellule animale est -65 mV environ un quinzième de un volt. Parce que les cellules sont si petits, des tensions de cette amplitude donnent lieu à de très fortes forces électriques à l'intérieur de la membrane cellulaire.
Dans la majorité des cellules, les variations de tension très peu au fil du temps. Il existe certains types de cellules, cependant, qui sont électriquement active dans le sens où leur tension fluctuent. Dans certains d'entre eux, les tensions montrent parfois des fluctuations très rapides de va-et-bas qui ont une forme stéréotypée: ces cycles de va-et-bas sont connus comme des potentiels d'action. Les durées des potentiels d'action varient dans une large gamme, et par conséquent ils sont signaux analogiques. Dans les cellules du cerveau des animaux, tout le va-et-bas du cycle peuvent avoir lieu dans moins d'un millième de seconde. En d'autres types de cellules, le cycle peut durer pendant plusieurs secondes.
Les propriétés électriques d'une cellule animale sont déterminées par la structure de la membrane qui l'entoure. Un membrane cellulaire consiste en une couche de lipides avec des molécules plus grosses molécules protéiques noyé dans la masse. La couche lipidique est très résistant à la circulation des ions chargés électriquement, de sorte qu'il fonctionne essentiellement comme un isolant. Les grosses molécules membranaires intégrées, en revanche, permettent canaux à travers lesquels peuvent passer des ions à travers la membrane, et certaines des grandes molécules sont capables de se déplacer activement des types spécifiques d'ions à partir d'un côté de la membrane à l'autre.
Procédé dans un neurone typique
Toutes les cellules dans les tissus corporels des animaux sont polarisés électriquement - en d'autres termes, ils maintiennent une différence de tension aux bornes de la cellule la membrane plasmique, connu sous le nom potentiel de membrane. Cette polarisation électrique résulte d'une interaction complexe entre les structures des protéines noyées dans la membrane appelée Pompes à ions et les canaux ioniques. Dans les neurones, les types de canaux ioniques dans la membrane varient habituellement entre différentes parties de la cellule, ce qui donne le dendrites, axone, et corps cellulaire des propriétés électriques différentes. En conséquence, certaines parties de la membrane d'un neurone peut être excitable (capable de générer des potentiels d'action), tandis que d'autres non. La partie la plus excitable d'un neurone est généralement le axone monticule (le point où l'axone quitte le corps cellulaire), mais le corps de l'axone et la cellule excitable sont également dans la plupart des cas.
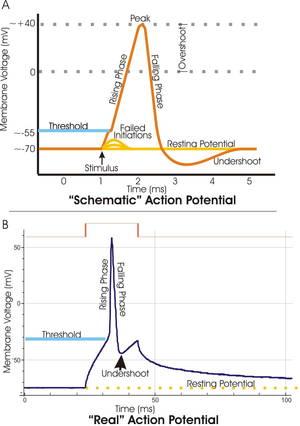
Chaque patch de membrane excitable a deux niveaux importants de potentiel de membrane: la potentiel, qui est la valeur du potentiel de membrane maintient tant que rien ne perturbe la cellule, et une valeur plus élevée dite de repos potentiel de seuil. A la butte de l'axone d'un neurone typique, le potentiel de repos est d'environ -70 millivolts (mV) et le potentiel de seuil est d'environ -55 mV. Entrées synaptiques à un neurone provoquent la membrane dépolariser ou hyperpolarisent; ce est, ils provoquent le potentiel de membrane pour augmenter ou diminuer. Les potentiels d'action sont déclenchés lorsque dépolarisation accumule suffisamment pour amener le potentiel de membrane à seuil. Quand un potentiel d'action est déclenché, le potentiel de membrane tire brutalement à la hausse, atteignant souvent aussi élevé que 100 mV, puis tire tout aussi brusquement de retour vers le bas, qui se termine souvent en dessous du niveau de repos, où il reste pendant une certaine période de temps. La forme du potentiel d'action est stéréotypé; ce est, l'ascension et la chute habituellement avoir approximativement la même amplitude et bien sûr de temps pour tous les potentiels d'action dans une cellule donnée. (Des exceptions sont abordés plus loin dans l'article.) Dans la plupart des neurones, l'ensemble du processus a lieu dans moins d'un millième de seconde. De nombreux types de neurones émettent des potentiels d'action en permanence à des taux allant jusqu'à 10 à 100 par seconde; certains types, cependant, sont beaucoup plus silencieux, et peuvent aller pour minutes ou plus sans émettre des potentiels d'action.
Base biophysique
Les potentiels d'action résultent de la présence dans la membrane de la cellule de types spéciaux de les canaux ioniques voltage-dépendants. Un canal ionique voltage-dépendant est un groupe de protéines noyées dans la membrane qui a trois propriétés essentielles:
- Il est capable d'assumer une conformation plus.
- Au moins l'une des conformations crée un canal à travers la membrane qui est perméable à des types spécifiques d'ions.
- La transition entre les conformations est influencée par le potentiel de membrane.
Ainsi, un canal ionique voltage-dépendant a tendance à être ouvert pour certaines valeurs du potentiel de membrane, et fermé pour les autres. Dans la plupart des cas, cependant, la relation entre le potentiel de membrane et de l'état de canal est probabiliste et implique un temps de retard. Les canaux ioniques basculer entre les conformations à des moments imprévisibles: Le potentiel de membrane détermine le taux de transitions et la probabilité par unité de temps de chaque type de transition.
Les canaux ioniques voltage-dépendants sont capables de produire des potentiels d'action, car ils peuvent donner lieu à boucles de rétroaction positive: Le potentiel de la membrane contrôle l'état des canaux ioniques, mais l'état des canaux ioniques commande le potentiel de membrane. Ainsi, dans certains cas, une augmentation du potentiel de membrane peut causer des canaux ioniques à ouverture, ce qui provoque une augmentation supplémentaire du potentiel de membrane. Un potentiel d'action se produit lorsque ce cycle de rétroaction positive procède explosive. L'heure et la trajectoire de l'amplitude du potentiel d'action sont déterminés par les propriétés biophysiques des canaux ioniques voltage-dépendants qui les produisent. Plusieurs types de canaux qui sont capables de produire la réaction positive nécessaire pour générer un potentiel d'action existent. Canaux sodiques voltage-dépendants sont responsables des potentiels d'action rapides impliqués dans la conduction nerveuse. Le ralentissement des potentiels d'action dans les cellules musculaires et certains types de neurones sont générés par les canaux calciques voltage-dépendants. Chacun de ces types est disponible en plusieurs variantes, avec une sensibilité de tension différente et différentes dynamiques temporelles.
Le type le plus intensivement étudié des canaux ioniques voltage-dépendant comprend les canaux sodiques rapides impliqués dans la conduction nerveuse. Ceux-ci sont parfois connues comme canaux sodiques Hodgkin-Huxley, car ils ont d'abord été caractérisées par Alan Hodgkin et Andrew Huxley dans leurs études de la biophysique du potentiel d'action lauréat du prix Nobel, mais peut être plus commodément dénommée canaux Na V. (Le "V" signifie "tension".) Un canal Na V a trois états possibles, connus sous le nom désactivé, activé et inactivé. Le canal ne est perméable aux ions sodium quand il est dans l'état activé. Lorsque le potentiel de membrane est faible, le canal passe la plupart de son temps dans l'état (fermé) désactivé. Si le potentiel de membrane est élevée au-dessus d'un certain niveau, le canal présente probabilité accrue de la transition vers la (ouverte) état activé. Plus le potentiel de membrane plus grande est la probabilité d'activation. Une fois qu'un canal a été activé, il finira par passer à l'état (fermé) inactivé. Il a alors tendance à rester inactivé pendant un certain temps, mais, si le potentiel de membrane devient faible encore, le canal sera finalement la transition de retour à l'état désactivé. Pendant un potentiel d'action, la plupart des chaînes de ce type passent par un cycle désactivé → → activ inactivé → désactivé. Ce ne est que le comportement moyen de la population, cependant - un canal individuel peut en principe faire une transition à tout moment. Toutefois, la probabilité de transition d'un canal à partir de l'état inactivé directement à l'état activé est très faible: un canal dans l'état inactivé est réfractaire jusqu'à ce qu'il a fait la transition à l'état désactivé.
Le résultat de tout cela est que la cinétique des canaux Na V sont régies par une matrice de transition dont les taux sont dépendant de la tension d'une manière compliquée. Depuis ces canaux eux-mêmes jouent un rôle majeur dans la détermination de la tension, la dynamique globale du système peuvent être très difficiles à résoudre. Hodgkin et Huxley abordé le problème en développant un ensemble de équations différentielles pour les paramètres qui régissent les états de canaux ioniques, connus sous le nom Équations Hodgkin-Huxley. Ces équations ont été largement modifiée par la recherche plus tard, mais constituer le point de départ de la plupart des études théoriques de la biophysique de potentiels d'action.
Comme le potentiel de la membrane est augmentée, les canaux ioniques de sodium ouvertes, ce qui permet l'entrée de sodium des ions dans la cellule. Ceci est suivi par l'ouverture de les canaux ioniques de potassium qui permettent la sortie de potassium ions de la cellule. L'écoulement vers l'intérieur des ions sodium augmente la concentration de charge positive cations dans la cellule et provoque la dépolarisation, où le potentiel de la cellule est supérieure à la cellule de potentiel de repos. Les canaux sodiques fermer au pic du potentiel d'action, tandis que le potassium continue de quitter la cellule. L'efflux d'ions potassium diminue le potentiel de membrane ou hyperpolarise la cellule. Pour de petites augmentations de la tension de repos, le courant de potassium dépasse le courant de sodium et la tension revient à sa valeur normale de repos, typiquement -70 mV. Toutefois, si la tension augmente depuis un seuil critique, typiquement 15 mV plus élevé que la valeur de repos, le courant de sodium domine. Il en résulte un état d'emballement de sorte que la rétroaction positive à partir du courant de sodium active encore plus de canaux sodiques. Ainsi, la cellule "feux", produisant un potentiel d'action.
Les courants produits par l'ouverture des canaux voltage-dépendants dans le cadre d'un potentiel d'action sont généralement beaucoup plus importante que le courant initial de stimulation. Ainsi, l'amplitude, la durée et la forme du potentiel d'action sont déterminées en grande partie par les propriétés de la membrane excitable et non l'amplitude ou la durée du stimulus. Cette établissement tout-ou-rien du potentiel d'action qui le distingue des des potentiels tels que classés les potentiels de récepteurs, électrotoniques potentiels, et potentiels synaptiques, qui balance avec l'ampleur de la relance. Une variété de types d'action potentiels existent dans de nombreux types de cellules et compartiments cellulaires tels que déterminés par les types de canaux voltage-dépendants, canaux de fuite, les distributions de canal, les concentrations ioniques, la capacité de la membrane, la température et d'autres facteurs.
Les principaux ions impliqués dans un potentiel d'action sont des cations sodium et potassium; des ions sodium entrent dans la cellule, et des ions potassium partent, rétablir l'équilibre. Relativement peu d'ions doivent traverser la membrane pour la tension de la membrane de changer radicalement. Les ions échangés pendant un potentiel d'action, donc, faire un changement négligeable dans les concentrations ioniques intérieurs et extérieurs. Les quelques ions qui ne se croisent sont pompés à nouveau par l'action continue de la pompe sodium-potassium, qui, avec d'autres transporteurs d'ions, maintient le rapport normal des concentrations d'ions à travers la membrane. Calcium cations et chlorure anions sont impliqués dans quelques types de potentiels d'action, comme le potentiel d'action cardiaque et du potentiel d'action dans la cellule unique algue Acetabularia, respectivement.
Bien que les potentiels d'action sont générés localement sur des plaques de membrane excitable, les courants qui en résultent peuvent déclencher des potentiels d'action sur les tronçons de membrane voisine, précipitant une propagation de domino. Contrairement à diffusion passive des potentiels électriques ( potentiel électrotonique), des potentiels d'action sont générés étendues nouveau long excitables de membrane et propager sans pourriture. Sections d'axones myélinisés sont pas excitables et ne produisent pas de potentiels d'action et le signal se propage passivement électrotonique potentiel. Régulièrement espacées correctifs amyéliniques, appelé nœuds de Ranvier, génèrent des potentiels d'action pour amplifier le signal. Connu comme saltatoire conduction, ce type de propagation du signal fournit un compromis favorable de la vitesse du signal et du diamètre de l'axone. Dépolarisation bornes axone, en général, déclenche la libération de neurotransmetteurs dans la fente synaptique . En outre, backpropagating potentiels d'action ont été enregistrés dans les dendrites de neurones pyramidaux, qui sont omniprésents dans le néocortex. Ceux-ci sont considérés comme ayant un rôle dans Plasticité fonction du temps d'occurrence des impulsions.
Neurotransmission
Anatomie d'un neurone
| Neuron |
|---|
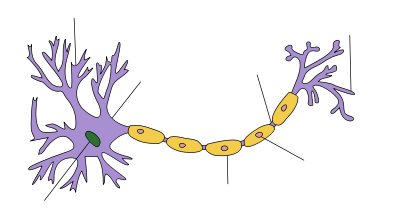 Dendrite Soma Axon Noyau Noeud de Ranvier Borne Axon Cellules de Schwann Gaine de myéline |
Plusieurs types de cellules soutenir un potentiel d'action, telles que des cellules végétales, des cellules musculaires et les cellules spécialisées du coeur (qui se produit dans la potentiel d'action cardiaque). Cependant, la principale cellule excitable est le neurone, qui a également le mécanisme le plus simple pour le potentiel d'action.
Les neurones sont des cellules excitables électriquement constitués, en général, d'un ou plusieurs dendrites, un seul soma, un seul axone et une ou plusieurs terminaisons axonales. La dendrite est l'un des deux types de synapses , les autres étant les boutons de terminaison axonale. Les dendrites forment des saillies en réponse aux boutons de terminaison axonale. Ces saillies, ou d'épines, sont conçus pour capturer les neurotransmetteurs libérés par le neurone présynaptique. Ils ont une forte concentration de canaux de ligand activé. Il est donc ici où deux de synapses des neurones communiquent entre eux. Ces épines ont un cou mince reliant une saillie en forme de bulbe à la dendrite principal. Cela garantit que les changements qui se produisent à l'intérieur de la colonne vertébrale sont moins susceptibles d'affecter les épines voisins. La colonne vertébrale dendritique peut, par conséquent, à de rares exceptions (voir LTP), agir comme une unité indépendante. Les dendrites connecter puis sur la soma. Les maisons de soma les noyau, qui agit en tant que régulateur pour le neurone. Contrairement aux épines, la surface du soma est peuplée de tension activé canaux ioniques. Ces canaux permet de transmettre les signaux générés par les dendrites. Émergeant du soma est le butte axone. Cette région est caractérisée par une concentration très élevée de canaux sodiques voltage-activated. En général, il est considéré comme étant la zone d'initiation de la pointe de potentiels d'action. Plusieurs signaux générés aux épines, et transmis par le soma convergent tous ici. Immédiatement après la butte de l'axone est le axone. Ce est une saillie tubulaire mince voyage loin de le soma. L'axone est isolé par un gaine de myéline. La myéline est composé de navigateur Les cellules de Schwann (dans le système nerveux périphérique) ou (oligodendrocytes dans le système nerveux central), les types de les cellules gliales. Bien que les cellules gliales ne sont pas impliqués dans la transmission de signaux électriques, ils communiquent et fournissent un appui biochimique important de neurones. Pour être plus précis, la myéline se enroule plusieurs fois autour du segment axonal, la formation d'une couche de graisse épaisse qui empêche les ions de pénétrer ou de se échapper de l'axone. Cette isolation empêche importante décroissance du signal ainsi que d'assurer une plus grande vitesse de signal. Cette isolation a cependant la restriction qu'aucune canaux peuvent être présents sur la surface de l'axone. Il existe, par conséquent, des plaques espacées régulièrement de membrane, qui ne ont aucune isolation. Ces nœuds de Ranvier peuvent être considérés comme des «mini monticules AXON ', que leur but est d'amplifier le signal afin d'éviter la décomposition importante du signal. A la fin le plus, l'axone perd son isolation et commence à se ramifier en plusieurs terminaisons axonales. Ces terminaisons axonales finissent alors sous la forme de la deuxième classe de synapses, des boutons de terminaison axonale. Ces boutons ont les canaux calciques voltage-activé, qui entrent en jeu lors de signalisation d'autres neurones.
Initiation
Avant d'examiner la propagation des potentiels d'action le long de axones et leur dissolution aux boutons synaptiques, il est utile d'examiner les méthodes par lesquelles les potentiels d'action peut être initiée à la butte axone. L'exigence de base est que la tension de la membrane à la butte être soulevée au-dessus du seuil de déclenchement. Il existe plusieurs moyens par lesquels cette dépolarisation peut se produire.
Dynamique
Les potentiels d'action sont le plus souvent initiées par les potentiels excitateurs post-synaptiques d'un neurone présynaptique. Typiquement, molécules de neurotransmetteurs sont libérés par le présynaptique neurone. Ces neurotransmetteurs se fixent alors aux récepteurs sur la cellule post-synaptique. Cette liaison se ouvre différents types de les canaux ioniques. Cette ouverture a en outre pour effet de modifier la perméabilité locale du membrane cellulaire et, par conséquent, le potentiel de membrane. Si la liaison augmente la tension (dépolarise la membrane), la synapse excitatrice est. Si, toutefois, la liaison diminue la tension (hyperpolarise la membrane), il est inhibitrice. Si la tension est augmentée ou diminuée, le changement se propage passivement à des régions voisines de la membrane (comme décrit par le équation de câble et ses raffinements). Typiquement, la tension de stimulation décroît exponentiellement avec la distance à partir de la synapse et avec le temps de la liaison du neurotransmetteur. Une fraction d'une tension d'excitation peut atteindre le axone monticule et peuvent (dans de rares cas) dépolariser la membrane suffit à provoquer un nouveau potentiel d'action. Plus généralement, les potentiels excitateurs de plusieurs synapses doit travailler ensemble à à peu près en même temps pour provoquer un nouveau potentiel d'action. Leurs efforts conjoints peuvent être contrariés, cependant, par l'antagoniste des potentiels postsynaptiques inhibiteurs.
Neurotransmission peut également se produire par synapses électriques. Grâce à la connexion directe entre les cellules excitables sous la forme de les jonctions communicantes, un potentiel d'action peuvent être transmis directement d'une cellule à l'autre dans les deux sens. La libre circulation des ions entre les cellules permet la transmission non-médiation chimique rapide. Canaux de redressement se assurer que les potentiels d'action se déplacent dans une seule direction à travers une synapse électrique. Synapses électriques se trouvent dans tous les systèmes nerveux, y compris le cerveau humain, mais ils sont une minorité distincte.
Principe «tout ou rien»
Le amplitude d'un potentiel d'action est indépendante de la quantité de courant qui l'a produit. En d'autres termes, les courants plus importants ne créent pas de plus grands potentiels d'action. Par conséquent, les potentiels d'action sont dits tout ou rien signaux, soit parce qu'elles se produisent en tout ou qu'ils ne se produisent pas du tout. Le la fréquence des potentiels d'action est en corrélation avec l'intensité d'un stimulus. Ceci est en contraste avec les potentiels de récepteurs, dont les amplitudes sont fonction de l'intensité d'un stimulus.
Les neurones sensoriels
En neurones sensoriels, un signal externe tels que la pression, la température, la lumière ou le son est couplé avec l'ouverture et la fermeture de les canaux ioniques, qui à leur tour modifient les perméabilités ioniques de la membrane et sa tension. Ces variations de tension peuvent être à nouveau excitateur (dépolarisation) ou inhibiteur (hyperpolarisant) et, dans certains neurones sensoriels, leurs effets combinés peuvent dépolariser suffisamment la butte axone de provoquer des potentiels d'action. Des exemples en comprennent les humains neurone récepteur olfactif et Corpuscule de Meissner, qui sont essentiels pour le sens de odeur et toucher, respectivement. Cependant, tous les neurones sensoriels convertissent leurs signaux externes dans des potentiels d'action; certains ne ont même pas un axone! Au lieu de cela, ils peuvent convertir le signal dans la libération d'un neurotransmetteur, ou en continu les potentiels gradués, dont chacun peut stimuler neurone (s) de cuisson ultérieure dans un potentiel d'action. À titre d'illustration, dans l'humain oreille, cellules ciliées convertissent le son entrant dans l'ouverture et la fermeture de fermée mécaniquement les canaux ioniques, qui peuvent causer molécules de neurotransmetteurs d'être libérés. Dans la même manière, dans l'humain rétine , l'initiale cellules photoréceptrices et l'autre couche de cellules (comprenant les cellules bipolaires et cellules horizontales) ne produisent pas de potentiels d'action; seule une partie les cellules amacrines et la troisième couche, la cellules ganglionnaires, produisent des potentiels d'action, qui se déplacent alors la nerf optique.
potentiels de stimulateurs cardiaques
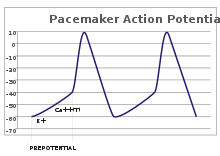
Dans les neurones sensoriels, les potentiels d'action résultent d'un stimulus externe. Cependant, certaines cellules excitables nécessitent pas de telles relance au feu: Ils dépolariser spontanément leurs axone monticule et d'action d'incendie potentiels à un rythme régulier, comme une horloge interne. Les traces de tension de telles cellules sont appelées potentiels de stimulateur cardiaque. Le cellules de stimulateur cardiaque de la nœud sino-auriculaire dans le coeur fournit un bon exemple. Bien que ces potentiels de stimulateur cardiaque ont un rythme naturel, il peut être ajusté par des stimuli externes; par exemple, fréquence cardiaque peut être modifiée par des produits pharmaceutiques, ainsi que des signaux provenant du sympathique et nerfs parasympathique. Les stimuli externes ne provoquent pas de tir répétitif de la cellule, mais simplement modifier sa distribution. Dans certains cas, la régulation de la fréquence peut être plus complexe, conduisant à des modèles de potentiels d'action, tels que éclatement.
Phases
Le cours du potentiel d'action peut être divisé en cinq parties: la phase ascendante, la phase de pointe, la phase de chute, la phase de dépassement négatif, et la période réfractaire. Au cours de la phase ascendante dépolarise les potentiels de membrane (devient plus positive). Le point qui se arrête de dépolarisation est appelé la phase de pointe. A ce stade, le potentiel de membrane atteint un maximum. Par la suite, il ya une phase de chute. Au cours de cette étape, les hyperpolarise potentiels de membrane (devient plus négatif). La phase undershoot est le point au cours de laquelle le potentiel de membrane devient temporairement chargé plus négativement que lorsqu'il est au repos. Enfin, le temps pendant lequel un potentiel d'action ultérieur est impossible ou difficile d'incendie est appelé le période réfractaire, qui peuvent se chevaucher avec les autres phases.
Le cours du potentiel d'action est déterminée par deux effets couplés. Tout d'abord, les canaux ioniques sensibles au voltage ouverture et de fermeture en réponse à des changements dans la la tension de membrane de V m. Cela modifie la perméabilité de la membrane aux ions. Deuxièmement, selon la Équation de Goldman, ce changement de changements de perméabilité dans le potentiel d'équilibre E m, et, par conséquent, la tension de membrane V m. Ainsi, le potentiel de membrane affecte la perméabilité, ce qui affecte alors plus le potentiel de membrane. Ceci met en place la possibilité pour rétroaction positive, qui est un élément clé de la phase ascendante du potentiel d'action. Un facteur de complication est qu'un canal ionique unique peut avoir plusieurs "portes" internes qui répondent aux changements dans V m de façons opposées, ou à des taux différents. Par exemple, bien que soulevant V m ouvre la plupart des portes dans le canal sodique voltage-sensibles, il ferme également "la porte d'inactivation" de la chaîne, bien que plus lentement. Ainsi, lorsque V m est soulevée tout à coup, les canaux sodiques ouvrent d'abord, mais ensuite tout près en raison de la lente inactivation.
Les tensions et les courants du potentiel d'action dans toutes ses phases ont été modélisés de façon précise par Alan Lloyd Hodgkin et Andrew Huxley en 1952, pour lequel ils ont reçu le Prix Nobel de physiologie ou médecine en 1963. Cependant, leur modèle considère que deux types de canaux ioniques sensibles à la tension, et fait plusieurs hypothèses à leur sujet, par exemple, que leurs portes internes ouvrent et se ferment indépendamment l'un de l'autre. En réalité, il existe de nombreux types de canaux ioniques, et ils ne sont pas toujours ouvrir et fermer de façon indépendante.
Stimulation et phase ascendante
Un potentiel d'action typique commence à la axone butte avec une dépolarisation suffisamment fort, par exemple, un stimulant qui augmente V m. Cette dépolarisation est souvent causée par l'injection de sodium d'appoint cations dans la cellule; ces cations peuvent provenir d'une grande variété de sources, telles que les synapses chimiques , neurones sensoriels ou potentiels de stimulateur cardiaque.
Pour un neurone au repos, il existe une concentration élevée d'ions de sodium et de chlore dans le fluide extracellulaire par rapport à la fluide intracellulaire se il existe une forte concentration d'ions potassium dans le liquide intracellulaire par rapport au fluide extracellulaire. Ce gradient de concentration avec canaux présents sur la membrane d'étanchéité de potassium du neurone provoque une efflux d'ions potassium rend le potentiel de repos proche de E K ≈ -75 mV. La dépolarisation se ouvre à la fois le sodium et le potassium dans les canaux de la membrane, ce qui permet aux ions de se écouler dans et hors de l'axone, respectivement. Si la dépolarisation est petite (par exemple, l'augmentation de V m à partir de -70 mV à -60 mV), le courant potassique sortant submerge le courant de sodium vers l'intérieur et la membrane repolarizes à son potentiel de repos normale autour de -70 mV. Cependant, si la dépolarisation est suffisamment grand, les sels de sodium vers l'intérieur le courant augmente plus que le courant potassique sortant et un état d'emballement ( feedback) des résultats positifs: plus il est courant entrant, plus V m augmente, ce qui à son tour augmente encore le courant vers l'intérieur. Une dépolarisation suffisamment forte (augmentation de V m) amène les canaux sodiques sensibles à la tension pour l'ouvrir; augmenter la perméabilité de sodium entraîne V m plus proche de la tension d'équilibre de sodium Na E de 55 mV. La tension croissante à son tour provoque encore plus de canaux sodiques à ouvrir, qui pousse V m encore vers E Na. Cette rétroaction positive se poursuit jusqu'à ce que les canaux sodiques sont complètement ouvertes et V m est proche de E Na. La forte hausse des V m et la perméabilité de sodium correspond à la phase ascendante du potentiel d'action.
La tension de seuil critique pour ce emballement est généralement autour de -45 mV, mais il dépend de l'activité récente de l'axone. Une membrane qui vient tiré un potentiel d'action ne peut pas tirer immédiatement une autre, puisque les canaux ioniques ne sont pas retournés à leur état habituel. La période pendant laquelle aucun nouveau potentiel d'action peut être tiré est appelée la période réfractaire absolue. A des temps plus longs, après certains, mais pas tous les canaux ioniques sont remis, l'axone peut être stimulée pour produire un autre potentiel d'action, mais seulement avec une dépolarisation beaucoup plus forte, par exemple de -30 mV. La période pendant laquelle les potentiels d'action sont particulièrement difficiles à évoquer est appelée la période réfractaire relative.
Peak et la chute de phase
La rétroaction positive de la phase ascendante ralentit et vient à une halte comme les canaux ioniques de sodium deviennent ouverte au maximum. Au sommet du potentiel d'action, la perméabilité de sodium est maximisée et la tension de membrane V m est à peu près égale à la tension d'équilibre sodium E N / A . Cependant, la même tension soulevée qui a ouvert les canaux sodiques initialement aussi les ferme lentement, en fermant leurs pores; les canaux sodiques deviennent inactivées . Cela permet de réduire la perméabilité de la membrane par rapport à de sodium au potassium, de conduire la tension de la membrane en direction de la valeur de repos. Dans le même temps, la tension relevée ouvre les canaux potassiques sensibles à la tension; l'augmentation de potassium les lecteurs de perméabilité de la membrane V m vers E K . Ensemble, ces changements de perméabilité cause sodium et potassium V m à baisser rapidement, repolarisation de la membrane et la production de la "phase de chute" de potentiel d'action.
Afterhyperpolarization
La tension soulevée ouvert beaucoup plus de canaux de potassium que d'habitude, et certains de ceux-ci ne ferme pas tout de suite quand les membrane revient à sa tension de repos normal. En outre, autres canaux potassiques ouverts en réponse à l'afflux d'ions calcium pendant le potentiel d'action. La perméabilité de potassium de la membrane est de manière transitoire anormalement élevé, conduisant la tension de membrane V m encore plus proche de la tension d'équilibre du potassium E K . Par conséquent, il ya un sous-dépassement ou hyperpolarisation, appeler une afterhyperpolarization en langage technique, qui persiste jusqu'à ce que la membrane de potassium perméabilité revient à sa valeur habituelle.
Période réfractaire
Chaque potentiel d'action est suivie d'une période réfractaire, qui peut être divisé en une période réfractaire absolue , au cours de laquelle il est impossible d'évoquer un autre potentiel d'action, puis une période réfractaire relative , au cours de laquelle un stimulus plus fort que d'habitude est nécessaire. Ces deux périodes réfractaires sont causés par des changements dans l'état de molécules de sodium et de canaux de potassium. Lors de la fermeture après un potentiel d'action, les canaux de sodium entrent dans un état "inactivé", dans lequel ils ne peuvent pas être faits pour ouvrir indépendamment du potentiel de membrane-ce qui donne lieu à la période réfractaire absolue. Même après un nombre suffisant de canaux sodiques sommes passés à leur état de repos, il arrive souvent qu'une fraction des canaux potassiques reste ouverte, ce qui rend difficile pour le potentiel de membrane à dépolariser, et donnant ainsi naissance à la période réfractaire relative. Étant donné que la densité et la sous-types de canaux potassiques peuvent varier considérablement entre les différents types de neurones, la durée de la période réfractaire relative est très variable.
Une fois un potentiel d'action a eu lieu à un patch de la membrane, la pièce de membrane a besoin de temps pour récupérer avant de pouvoir tirer à nouveau. Au niveau moléculaire, cette période réfractaire absolue correspond au temps nécessaire pour que les canaux sodiques voltage-activated à récupérer à partir de l'inactivation, à savoir, pour revenir à leur état fermé. Il existe de nombreux types de canaux potassiques voltage-actif dans les neurones, certaines d'entre elles inactiver les courants rapides (de type A) et certains d'entre eux inactivent lentement ou pas du tout inactiver; cette variabilité garantit qu'il y aura toujours une source de courant pour la repolarisation disponible, même si certains des canaux potassiques sont inactivé en raison de la dépolarisation précédent. D'autre part, tous les canaux de tension activé neuronales sodium inactivent au sein de plusieurs millisecondes pendant forte dépolarisation, rendant ainsi la dépolarisation suivante impossible jusqu'à une fraction substantielle des canaux sodiques sont retournés à leur état fermé. Bien que cela limite la fréquence de mise à feu, la période réfractaire absolue assure que les potentiels d'action se déplace dans une seule direction le long d'un axone. Les courants circulant dans raison d'un potentiel d'action se propager dans les deux directions le long de l'axone. Toutefois, seule la partie non cuite de l'axone peut répondre avec un potentiel d'action; la partie qui vient est tiré répondre jusqu'à ce que le potentiel d'action est en toute sécurité hors de portée et ne peut pas restimuler cette partie. Dans l'habituel conduction orthodromique, le potentiel d'action se propage de la butte de l'axone vers les boutons synaptiques (la terminaisons axonales); propagation dans la direction opposée, connu sous le nom antidromique conduction est très rare. Toutefois, si un axone de laboratoire est stimulée en son milieu, les deux moitiés de l'axone sont «frais», à savoir, non cuite; puis deux potentiels d'action seront générés, un voyage vers la butte axone et l'autre voyageant vers les boutons synaptiques.
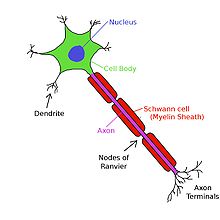
Myéline et la conduction saltatoire
Afin de permettre la transduction rapide et efficace des signaux électriques dans le système nerveux, certains axones neuronaux sont recouverts de gaines de myéline. La myéline est une membrane qui enveloppe multilamellaire l'axone dans des segments séparés par des intervalles connus comme nœuds de Ranvier. Elle est produite par des cellules spécialisées: les cellules de Schwann exclusivement dans le système nerveux périphérique, et oligodendrocytes exclusivement dans la système nerveux central. gaine de myéline réduit la capacité de la membrane et augmente la résistance de la membrane dans les intervalles entre-noeuds, permettant ainsi, un mouvement saltatoire rapide de potentiels d'action de noeud à noeud. La myélinisation se trouve principalement dans les vertébrés , mais un système analogue a été découvert dans quelques invertébrés, comme certaines espèces de crevettes. Tous les neurones de vertébrés ne sont pas myélinisées; par exemple, les axones des neurones constituant le système nerveux autonome ne sont pas, en général, myélinisé.
Myéline empêche les ions d'entrer ou de quitter l'axone long segments myélinisés. En règle générale, la myélinisation augmente la vitesse de conduction des potentiels d'action et les rend plus économe en énergie. Que saltatoire ou non, la vitesse moyenne de conduction d'une action gammes possibles de 1 m / s à plus de 100 m / s, et, en général, augmente avec le diamètre axonal.
Les potentiels d'action ne peuvent pas se propager à travers la membrane dans les segments myélinisés de l'axone. Cependant, le courant est transporté par le cytoplasme, ce qui est suffisant pour dépolariser la première ou deuxième ultérieur noeud de Ranvier. Au lieu de cela, le courant ionique à partir d'un potentiel d'action à un noeud de Ranvier provoque un autre potentiel d'action à l'autre noeud; cette apparente "saut" du potentiel d'action d'un nœud à est connu comme la conduction saltatoire. Bien que le mécanisme de la conduction saltatoire a été proposé en 1925 par Ralph Lillie, la première preuve expérimentale pour la conduction saltatoire venu de Ichiji Tasaki et Taiji Takeuchi et d' Andrew Huxley et Robert Stämpfli. En revanche, dans les axones amyéliniques, le potentiel d'action provoque une autre dans la membrane immédiatement adjacente, et se déplace en continu long de l'axone comme une vague.
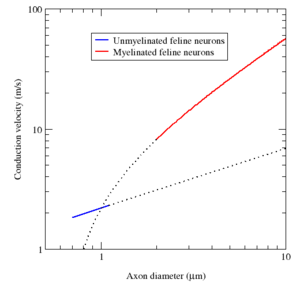
Myéline présente deux avantages importants: la vitesse de conduction rapide et l'efficacité énergétique. Pour axones plus grand qu'un diamètre minimum (environ 1 micromètre), la myélinisation augmente la vitesse de conduction du potentiel d'action, typiquement dix fois. Inversement, pour une vitesse de conduction donné, fibres myélinisées sont plus petits que leurs homologues amyéliniques. Par exemple, les potentiels d'action se déplacer à peu près à la même vitesse (25 m / s) dans un axone de grenouille myélinisées et une amyéliniques calmar géant axone, mais l'axone de grenouille a une zone plus petite section transversale à peu près 30 fois plus petit diamètre et 1000 fois . En outre, puisque les courants ioniques sont limités aux nœuds de Ranvier, beaucoup moins ions "fuite" à travers la membrane, économies d'énergie métabolique. Cette économie est un important avantage sélectif , puisque le système nerveux humain utilise environ 20% de l'énergie métabolique de l'organisme.
La longueur des segments de myéline des axones est important pour le succès de la conduction saltatoire. Ils devraient être aussi longue que possible afin de maximiser la vitesse de conduction, mais pas aussi longtemps que le signal arrivant est trop faible pour provoquer un potentiel d'action à la prochaine nœud de Ranvier. Dans la nature, les segments myélinisés sont généralement assez longtemps pour que le signal se propage passivement à voyager pendant au moins deux noeuds tout en conservant suffisamment d'amplitude pour tirer un potentiel d'action à la deuxième ou troisième noeud. Ainsi, le facteur de la conduction saltatoire de sécurité est élevé, permettant la transmission aux noeuds de dérivation en cas de blessure. Cependant, les potentiels d'action peuvent finir prématurément en certains endroits où le facteur de sécurité est faible, même dans les neurones amyéliniques; un exemple courant est le point d'un axone, où elle se divise en deux axones branche.
Certaines maladies dégradent la myéline et altèrent saltatoire conduction, ce qui réduit la vitesse de conduction des potentiels d'action. Le plus connu d'entre eux est la sclérose en plaques , dans laquelle la répartition de la myéline altère mouvement coordonné.
Théorie câble
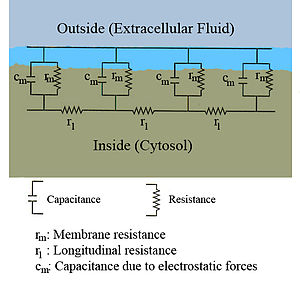
L'écoulement des courants à l'intérieur d'un axone peut être décrit quantitativement par la théorie de câble et de ses élaborations, tels que le modèle compartimental. La théorie de câble a été développée en 1855 par Lord Kelvin pour modéliser le câble télégraphique transatlantique et a été montré pour être pertinent pour les neurones par Hodgkin et Rushton en 1946. En théorie simple câble, le neurone est traité comme un câble de transmission électriquement passif, parfaitement cylindrique, qui peut être décrit par une équation aux dérivées partielles
où V (x, t) est la tension à travers la membrane à un moment t et une position x le long de la longueur du neurone, et où λ et τ sont des échelles de longueur et de temps caractéristiques sur lesquelles ces tensions désintégration en réponse à un stimulus . En se référant au schéma de circuit ci-dessus, ces échelles peuvent être déterminées à partir des résistances et capacités linéiques
Ces heure et la durée des échelles peuvent être utilisés pour comprendre la dépendance de la vitesse de conduction du diamètre du neurone en fibres non myélinisées. Par exemple, l'échelle de temps τ augmente à la fois la résistance de la membrane r m et la capacité c m . Comme la capacité augmente, plus la charge doit être transféré pour produire une tension transmembranaire donnée (par l'équation Q = CV ); que la résistance augmente, moins la charge est transférée par unité de temps, ce qui rend la mise en équilibre plus lentement. De manière similaire, si la résistance interne par unité de longueur r je est inférieure à une axone que dans un autre (par exemple, parce que le rayon de la première est plus grande), la longueur de décroissance spatiale λ devient plus longue et la vitesse de conduction du potentiel d'action devrait accroître . Si la résistance transmembranaire r m est augmentée, qui abaisse la "fuite" courant moyen à travers la membrane, ce qui provoque également λ devienne plus, l'augmentation de la vitesse de conduction.
Résiliation
Synapses chimiques
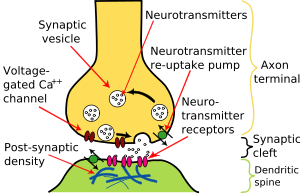
En général, les potentiels d'action qui atteignent les boutons synaptiques provoquent un neurotransmetteur à être libéré dans la fente synaptique. Les neurotransmetteurs sont des petites molécules qui peuvent ouvrir des canaux ioniques dans la cellule post-synaptique; la plupart des axones ont le même neurotransmetteur du tout de leurs extrémités. L'arrivée du potentiel d'action ouvre des canaux calciques voltage-sensibles dans la membrane présynaptique; l'afflux de calcium provoque des vésicules remplies de neurotransmetteur à migrer vers la surface de la cellule et libérer leur contenu dans la fente synaptique . Ce processus complexe est inhibée par les neurotoxines tétanospasmine et la toxine botulique, qui sont responsables pour le tétanos et le botulisme, respectivement.
Synapses électriques
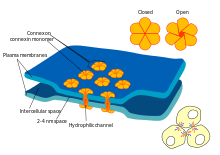
Certains dispensent synapses avec le «intermédiaire» du neurotransmetteur, et relient les cellules présynaptiques et post-synaptiques ensemble. Quand un potentiel d'action atteint un tel synapse, les courants ioniques qui se jettent dans la cellule présynaptique peuvent traverser la barrière des deux membranes cellulaires et entrer dans la cellule post-synaptique à travers les pores appelés connexons. Ainsi, les courants ioniques du potentiel d'action présynaptique peuvent stimuler directement la cellule post-synaptique. Synapses électriques permettent une transmission plus rapide, car ils ne nécessitent pas la lente diffusion des neurotransmetteurs à travers la fente synaptique. Par conséquent, les synapses électriques sont utilisés chaque fois une réponse rapide et la coordination de synchronisation sont essentielles, comme dans les réflexes de repli, la rétine des vertébrés , et le coeur .
Jonctions neuromusculaires
Un cas particulier d'une synapse chimique est la jonction neuromusculaire, dans lequel l' axone d'un neurone moteur se termine sur une fibre musculaire. Dans de tels cas, le neurotransmetteur libéré est l'acétylcholine, qui se lie au récepteur de l'acétylcholine, une protéine membranaire intégrale dans la membrane (le sarcolemme ) de la fibre musculaire. Cependant, l'acétylcholine ne reste pas lié; plutôt, il se dissocie et est hydrolysé par l'enzyme, l'acétylcholinestérase, situé dans la synapse. Cette enzyme permet de réduire rapidement la stimulation du muscle, ce qui permet la mesure et le moment de la contraction musculaire à régler délicatement. Certains poisons inactivent acétylcholinestérase pour éviter ce contrôle, tels que les agents neurotoxiques sarin et tabun et le insecticides diazinon et le malathion.
D'autres types de cellules
Potentiels d'action cardiaques
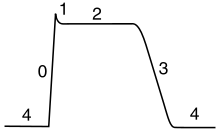
Le potentiel d'action cardiaque diffère du potentiel d'action des neurones en ayant un plateau étendu, dans lequel la membrane est maintenue à une haute tension de quelques centaines de millisecondes avant d'être repolarisé par le courant de potassium comme d'habitude. Ce plateau est due à l'action de plus lentes calcium canaux d'ouverture et la tenue de la tension de la membrane près de leur potentiel d'équilibre, même après les canaux sodiques ont inactivé.
Le potentiel d'action cardiaque joue un rôle important dans la coordination de la contraction du coeur. Les cellules cardiaques du nœud sino-auriculaire fournissent le potentiel de stimulateur qui synchronise le cœur. Les potentiels d'action se propagent de ces cellules et à travers le noeud auriculo-ventriculaire (nœud AV), qui est normalement la seule voie de conduction entre les oreillettes et les ventricules. Potentiels d'action AV Voyage de noeud à travers le faisceau de His et de là vers les fibres de Purkinje. Inversement, des anomalies dans l'action cardiaque potentiel qu'elle soit due à une mutation congénitale ou blessure peut conduire à des pathologies humaines, en particulier les arythmies. Plusieurs médicaments anti-arythmie agissent sur le potentiel d'action cardiaque, tels que la quinidine, la lidocaïne, les bêta-bloquants, et le verapamil.
Potentiels d'action musculaires
Le potentiel d'action dans une cellule de muscle squelettique normale est similaire au potentiel d'action dans les neurones. Les potentiels d'action résultent de la dépolarisation de la membrane cellulaire (le sarcolemme), ce qui ouvre les canaux sodiques sensibles à la tension; ceux-ci deviennent inactivées et la membrane est repolarisé vers l'extérieur à travers le courant d'ions potassium. Le potentiel de repos avant le potentiel d'action est typiquement -90mV, un peu plus négatif que les neurones typiques. Le potentiel d'action musculaire dure environ 2-4 ms, la période réfractaire absolue est d'environ 1-3 ms, et la vitesse de conduction le long du muscle est d'environ 5 m / s. Le potentiel d'action libère calcium ions qui libèrent la tropomyosine et permettent la contraction musculaire. potentiels d'action musculaire sont provoquées par l'arrivée d'un potentiel d'action neuronale pré-synaptique à la jonction neuromusculaire, qui est un objectif commun pour les neurotoxines.
potentiels d'action des plantes
Plante et les cellules fongiques sont également électriquement excitable. La différence fondamentale de potentiels d'action des animaux est que la dépolarisation dans des cellules végétales est réalisée par pas d'une absorption d'ions sodium positifs, mais négatifs par libération de chlorure ions. Avec la libération suivante d'ions potassium positifs, qui est commun à des potentiels de plantes et d'action contre les animaux, le potentiel d'action dans les plantes en déduit, par conséquent, une perte osmotique de sel (KCl), tandis que le potentiel d'action des animaux est osmotiquement neutre, lorsque des quantités égales d'entrer dans le sodium et le potassium annuler laissant l'autre osmotique. L'interaction des relations électriques et osmotiques dans les cellules végétales indique une fonction osmotique de l'excitabilité électrique dans les, les ancêtres unicellulaires communes de plantes et d'animaux dans des conditions changeantes de salinité, tandis que la fonction actuelle de la transmission du signal rapide est considéré comme un jeune accomplissement de métazoaires cellules dans un environnement plus stable osmotique. Il faut supposer que la fonction de signalisation familier de potentiels d'action dans certaines plantes vasculaires (par exemple Mimosa pudica ), a surgi indépendamment de celle dans les cellules excitables métazoaires.
La distribution taxonomique et avantages évolutifs
Les potentiels d'action se retrouvent partout dans les organismes multicellulaires, y compris les plantes , les invertébrés tels que les insectes et les vertébrés tels que les reptiles et les mammifères . éponges semblent être la principale phylum des multicellulaires eucaryotes qui ne transmettent pas les potentiels d'action, bien que certaines études ont suggéré que ces organismes ont une forme de signalisation électrique, aussi. Le potentiel de repos, ainsi que la taille et la durée du potentiel d'action, ont peu varié avec l'évolution, bien que la vitesse de conduction varie considérablement avec le diamètre et la myélinisation des axones.
| Animal | Type de cellule | Potentiel de repos (mV) | Augmentation AP (mV) | AP durée (ms) | vitesse de conduction (m / s) |
|---|---|---|---|---|---|
| Squid (Loligo) | Axone géant | -60 | 120 | 0,75 | 35 |
| Earthworm (Lumbricus) | Fibre géant médian | -70 | 100 | 1.0 | 30 |
| Cockroach (Periplaneta) | Fibres Géant | -70 | 80-104 | 0,4 | 10 |
| Frog (Rana) | Axone du nerf sciatique | -60 À -80 | 110-130 | 1.0 | 7-30 |
| Chat (Felis) | Neurone moteur spinal | -55 À -80 | 80-110 | 1-1,5 | 30-120 |
Compte tenu de sa conservation à travers l'évolution, le potentiel d'action semble conférer des avantages évolutifs. Une fonction de potentiels d'action est rapide, la signalisation à longue distance dans l'organisme; la vitesse de conduction peut être supérieure à 110 m / s, ce qui est un tiers du vitesse du son. titre de comparaison, une molécule d'hormone dans le sang transporté se déplace à environ 8 m / s dans les grandes artères. Une partie de cette fonction est la coordination serré d'événements mécaniques, telles que la contraction du coeur. Une deuxième fonction est le calcul associée à sa génération. Étant un signal tout-ou-rien qui ne se dégrade pas avec la distance de transmission, le potentiel d'action présente des avantages similaires à l'électronique numérique. L'intégration des différents signaux dendritiques à la butte de l'axone et son seuil pour former un train complexe de potentiels d'action est une autre forme de calcul, celui qui a été exploitée biologiquement pour former générateurs de motifs centraux et imité dans les réseaux de neurones artificiels.
Méthodes expérimentales

L'étude des potentiels d'action a nécessité le développement de nouvelles méthodes expérimentales. Le travail initial, avant 1955, axée sur trois objectifs: isoler les signaux de neurones ou axones simples, en développement rapide, électroniques sensibles, et rétrécissement assez que la tension à l'intérieur d'une seule cellule pourrait être enregistré électrodes.
Le premier problème a été résolu par l'étude des axones géants trouvés dans les neurones du genre calmar Loligo . Ces axones sont si grand diamètre (environ 1 mm, ou 100 fois plus grand qu'un neurone typique) qu'ils peuvent être vus à l'oeil nu, ce qui les rend faciles à extraire et à manipuler. Cependant, les Loligo axones ne sont pas représentatifs de toutes les cellules excitables, et de nombreux autres systèmes avec des potentiels d'action ont été étudiés.
Le deuxième problème a été traité avec le développement crucial de la pince de tension, ce qui a permis expérimentateurs d'étudier les courants ioniques qui sous-tendent un potentiel d'action dans l'isolement, et a éliminé une source importante de bruit électronique, le courant I C associée à la capacité C de la membrane. Comme le courant est égal à C fois le taux de variation de la tension transmembranaire V m , la solution était de concevoir un circuit qui maintient V m fixe (au taux de changement de zéro), indépendamment des courants circulant à travers la membrane. Ainsi, le courant nécessaire pour maintenir V m à une valeur fixe est le reflet direct du courant circulant à travers la membrane. D'autres avancées électroniques inclus l'utilisation de cages de Faraday et de l'électronique à haute impédance d'entrée, de sorte que la mesure elle-même n'a pas d'incidence sur la tension mesurée.
Le troisième problème, celui d'obtenir suffisamment petites électrodes pour enregistrer des tensions au sein d'un seul axone sans perturber elle, a été résolu en 1949 avec l'invention de l'électrode de micropipette de verre, qui a été rapidement adopté par d'autres chercheurs. Raffinements de cette méthode sont capables de produire des conseils d'électrodes qui sont aussi fine que 100 Å (10 nm), ce qui confère aussi haute impédance d'entrée. Les potentiels d'action peuvent également être enregistrés avec de petites électrodes métalliques placées juste à côté d'un neurone, avec neuropuces contenant EOSFETs ou optiquement avec des colorants qui sont sensibles au Ca 2+ ou de tension.

Alors que les électrodes de micropipette de verre mesurent la somme des courants passant à travers de nombreux canaux ioniques, qui étudient les propriétés électriques d'un canal ionique unique est devenue possible dans les années 1970 avec le développement de la pince de patch par Erwin Neher et Bert Sakmann. Pour cela, ils ont reçu le prix Nobel de physiologie ou médecine en 1991. Patch-serrage vérifié que les canaux ioniques ont états discrets de la conductance, comme ouvert, fermé et inactivé.
Technologies d'imagerie optique ont été développés au cours des dernières années pour mesurer les potentiels d'action, que ce soit via des enregistrements simultanés ou multisites avec une résolution ultra-spatiale. Utilisation colorants sensibles à la tension, des potentiels d'action ont été optiquement enregistrées à partir d'un petit morceau demembrane de cardiomyocytes.
Neurotoxines

Plusieurs neurotoxines, à la fois naturels et synthétiques, sont conçus pour bloquer le potentiel d'action. tétrodotoxine du poisson-globe et saxitoxine du Gonyaulax (le du genre responsable "de dinoflagellés marées rouges ") potentiels d'action de bloc en inhibant le canal sodique voltage-sensibles; de même, dendrotoxin du mamba noir serpent inhibe le canal potassique sensible à la tension. Ces inhibiteurs de canaux ioniques servent un objectif de recherche important, en permettant aux scientifiques de "désactiver" des canaux spécifiques à volonté, isolant ainsi les contributions des autres canaux; ils peuvent également être utiles dans la purification des canaux ioniques par chromatographie d'affinité ou en dosant leur concentration. Cependant, de tels inhibiteurs font aussi neurotoxines efficaces, et ont été considérés pour une utilisation comme armes chimiques. neurotoxines visant à les canaux ioniques d'insectes ont été efficaces insecticides; un exemple est la synthèse de la perméthrine, ce qui prolonge l'activation des canaux sodiques impliqués dans des potentiels d'action. Les canaux ioniques d'insectes sont suffisamment différents de leurs homologues humains qu'il existe peu d'effets secondaires chez l'homme. Beaucoup d'autres neurotoxines interfèrent avec la transmission des effets de la potentiels d'action au niveau des synapses , en particulier à la jonction neuromusculaire.
Histoire
Le rôle de l'électricité dans les systèmes nerveux des animaux a été observé la première fois en disséquésgrenouillesparLuigi Galvani, qui étudia de 1791 à 1797. Résultats de Galvani stimuléAlessandro Volta pour développer lapile de Volta-le plus tôt connubatterie avec électrique qui il a étudié électricité animale (commeles anguilles électriques) et les réponses physiologiques à appliquésà couranttensions.
Les scientifiques du 19ème siècle ont étudié la propagation des signaux électriques dans entières nerfs (ie, des faisceaux de neurones) et a démontré que le tissu nerveux est composé de cellules , à la place d'un réseau interconnecté de tubes (un réticulum ). Carlo Matteucci suivi des études de Galvani et a démontré que les membranes cellulaires avaient une tension entre eux et pourraient produire un courant continu. Le travail de Matteucci a inspiré le physiologiste allemand, Emil du Bois-Reymond, qui a découvert le potentiel d'action en 1848. La vitesse de conduction des potentiels d'action a été d'abord mesuré en 1850 par l'ami de du Bois-Reymond, Hermann von Helmholtz. Pour établir que le tissu nerveux est constitué de cellules discrètes, le médecin espagnol Santiago Ramón y Cajal et ses étudiants ont utilisé une tache développé par Camillo Golgi pour révéler les formes innombrables de neurones, dont ils rendaient minutieusement. Pour leurs découvertes, Golgi et Ramón y Cajal ont reçu le 1906 Prix Nobel de physiologie. Leur travail a résolu une controverse de longue date dans la neuroanatomie du 19ème siècle; Golgi avait lui-même plaidé pour le modèle de réseau du système nerveux.
Le 20e siècle a été un âge d'or pour l'électrophysiologie. En 1902 et de nouveau en 1912, Julius Bernstein a avancé l'hypothèse que le potentiel d'action résulte d'un changement dans la perméabilité de la membrane des axones à ions. L'hypothèse de Bernstein a été confirmée par Ken Cole et Howard Curtis, qui a montré que les augmentations de conductance membranaire pendant un potentiel d'action. En 1907, Louis Lapicque a suggéré que le potentiel d'action a été généré comme un seuil a été franchi, ce qui serait plus tard montré comme un produit des systèmes dynamiques de conductances ioniques. En 1949, Alan Hodgkin et Bernard Katz affiné l'hypothèse de Bernstein en considérant que la membrane axonale pourrait avoir des perméabilités différentes à différents ions; en particulier, ils ont démontré le rôle crucial de la perméabilité de sodium pour le potentiel d'action. Cet axe de recherche a culminé dans les cinq 1,952 papiers de Hodgkin, Katz et Andrew Huxley, dans laquelle ils ont appliqué la technique de blocage de tension pour déterminer la dépendance des perméabilités de la membrane axonale aux ions de sodium et de potassium sur la tension et le temps, à partir de laquelle ils ont pu à reconstruire le potentiel d'action quantitativement. Hodgkin et Huxley corrélés les propriétés de leur modèle mathématique avec discrètes canaux ioniques qui pourraient exister dans plusieurs états différents, y compris "ouvert", "fermé", et "inactivé". Leurs hypothèses ont été confirmées dans les milieu des années 1970 et 1980 par Erwin Neher et Bert Sakmann, qui a développé la technique de patch clamp pour examiner les états de conductance des canaux ioniques individuels. Au 21e siècle, les chercheurs commencent à comprendre la base structurelle de ces états de conductance et de la sélectivité des canaux pour leurs espèces d'ions, à travers les atomique résolution structures cristallines, des mesures de distance de la fluorescence et études de cryo-microscopie électronique.
Julius Bernstein a également été le premier à introduire l' équation de Nernst pour potentiel à travers la membrane de repos; cela a été généralisé par David E. Goldman à l'éponyme équation Goldman en 1943. La pompe sodium-potassium a été identifié en 1957 et ses propriétés progressivement élucidé, culminant dans la détermination de sa structure atomique résolution par cristallographie aux rayons X. Les structures cristallines de pompes ioniques connexes ont également été résolus, ce qui donne une vision plus large de la façon dont ces machines moléculaires travaillent.
Les modèles quantitatifs

Les modèles mathématiques et informatiques sont essentielles pour comprendre le potentiel d'action, et offrent des prédictions qui peuvent être testés contre les données expérimentales, fournissant un critère strict d'une théorie. Le plus important et précis de ces modèles est le modèle de Hodgkin-Huxley, qui décrit le potentiel d'action par un ensemble couplé de quatre équations différentielles ordinaires (EDO). Bien que le modèle de Hodgkin-Huxley peut être une simplification d'une membrane nerveuse réaliste telle qu'elle existe dans la nature, sa complexité a inspiré plusieurs modèles encore plus-simplifiés, comme le modèle Morris-Lecar et le modèle FitzHugh-Nagumo, qui tous deux avoir seulement deux équations différentielles couplées. Les propriétés des modèles de Hodgkin-Huxley et FitzHugh-Nagumo et leurs proches, tels que le modèle der Pol Bonhoeffer-van, ont été bien étudiés dans les mathématiques, le calcul et l'électronique. Plus la recherche moderne a mis l'accent sur des systèmes plus vastes et plus intégrés; en se joignant à des modèles d'action potentiel des modèles d'autres parties du système nerveux (telles que les dendrites et les synapses), les recherches peuvent étudier calcul et de simples neurones réflexes, comme les réflexes d'échappement et autres contrôlées par générateurs de motifs centraux.