
Osmium
Contexte des écoles Wikipédia
SOS Enfants, qui se déroule près de 200 sos écoles dans le monde en développement, a organisé cette sélection. Voir http://www.soschildren.org/sponsor-a-child pour connaître le parrainage d'enfants.
| Osmium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
76 Os | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
teinte argentée, bleue  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | osmium, Os, 76 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / ɒ z m Je ə m / -Əm de OZ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | métal de transition | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 8, 6, ré | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 190,23 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 14 5d 6 6s 2 2, 8, 18, 32, 14, 2 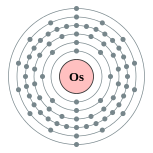 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Smithson Tennant (1803) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Smithson Tennant (1803) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 22,59 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 20 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 3306 K , 3033 ° C, 5491 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 5285 K, 5012 ° C, 9054 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 57,85 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 738 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 24,7 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 8, 7, 6, 5, 4, 3, 2, 1, 0, -1, -2 (Légèrement acide oxyde) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 2,2 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1e: 840 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1600 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 135 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 144 ± 16 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (0 ° C) 81,2 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 87,6 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 5,1 pm · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 4,940 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 222 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 462 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 7.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 3920 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-04-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Les isotopes d'osmium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Osmium est un élément chimique avec le symbole Os et de numéro atomique 76. Ce est un dur, cassant, blanc bleuté métal de transition dans le la famille du platine et est l'élément le plus dense d'origine naturelle, avec une densité de 22,59 g / cm 3. On le trouve dans la nature sous forme d'alliage, principalement dans les minerais de platine; son alliages avec le platine , l'iridium et d'autres métaux du groupe du platine sont utilisés en conseils de fontaine stylo, contacts électriques, et d'autres applications où la durabilité extrême et la dureté sont nécessaires.
Caractéristiques
Propriétés physiques

Osmium a une teinte bleu-gris et est la plus dense élément stable, légèrement plus dense que l' iridium . Calculs de la densité de la Les données de diffraction des rayons X peuvent produire les données les plus fiables pour ces éléments, ce qui donne une valeur de 22,562 ± 0,009 g / cm 3 pour l'iridium par rapport à 22,587 ± 0,009 g / cm 3 pour l'osmium. La densité élevée de l'osmium est une conséquence de la contraction lanthanide.
Osmium est un dur mais fragile métal qui reste lustré même à des températures élevées. Il a une très faible compressibilité. En conséquence, son module de masse est extrêmement élevé, a rapporté entre 395 et 462 GPa, qui rivalise avec celle de diamant (443 GPa). La dureté de l'osmium est modérément élevé à 4 GPa. En raison de sa la dureté, la fragilité, la faible pression de vapeur (le plus bas des métaux du groupe du platine), et le point de fusion très élevé (le quatrième rang de tous les éléments), l'osmium solide est difficile à usiner, la forme ou au travail.
Propriétés chimiques
| États d'oxydation de l'osmium | |
|---|---|
| -2 | Na 2 [Os (CO) 4] |
| -1 | Na 2 [Os 4 (CO) 13] |
| 0 | Os 3 (CO) 12 |
| 1 | OSI |
| 2 | OSI 2 |
| 3 | OSBR 3 |
| 4 | OSO 2, OsCl 4 |
| 5 | OsF 5 |
| 6 | OsF 6 |
| 7 | OSOF 5, 7 OsF |
| 8 | OsO 4, Os (NCH 3) 4 |
Osmium forme des composés avec des états d'oxydation allant de -2 à 8. Les états d'oxydation les plus courants sont 2, 3, 4 et 8. L'état d'oxydation 8 est connu pour être le plus haut atteint par un élément chimique, et en dehors de l'osmium, ne se rencontre que dans le xénon , le ruthénium , hassium , l'iridium et le plutonium (instable). Les états d'oxydation -1 et -2 représentés par les deux composés réactifs Na 2 [Os 4 (CO) 13] et Na 2 [Os (CO) 4] sont utilisés dans la synthèse de l'osmium composés munitions.
Le composé le plus commun présentant l'état d'oxydation est 8 tétroxyde d'osmium. Ce composé toxique est formé lorsque l'osmium en poudre est exposée à l'air, et est un solide avec une forte odeur cristallin très volatile, soluble dans l'eau, jaune pâle,. poudre de Osmium a l'odeur caractéristique de tétroxyde d'osmium. Osmium formes de tétroxyde osmates rouges OsO 4 (OH) 2-
2 par réaction avec une base. Avec de l'ammoniac, il forme les nitrido-osmates OSO 3 N -. Le tétroxyde d'osmium bout à 130 ° C et est un puissant agent oxydant. Par contre, le dioxyde d'osmium (OSO 2) est noir, non-volatile, et beaucoup moins réactif et toxique.
Seuls deux composés d'osmium ont des applications majeures: tétroxyde d'osmium pour tissus coloration dans microscopie électronique et pour l'oxydation d' alcènes en synthèse organique, et les osmates non volatile pour réactions d'oxydation organiques.
Osmium heptafluorure (OSF 7) et le pentafluorure d'osmium (OsF 5) sont connus, mais trifluorure osmium (OsF 3) n'a pas encore été synthétisés. Les états d'oxydation inférieurs sont stabilisés par les halogènes plus grandes, de sorte que le trichlorure, le tribromure, le triiodure, et même le diiodure sont connus. L'état d'oxydation 1 est connue seulement pour l'osmium iodure (OSI), alors que plusieurs complexes carbonyles de l'osmium, comme Dodécacarbonyle de triosmium (Os 3 (CO) 12), représente l'état d'oxydation 0.
En général, les états d'oxydation inférieurs d'osmium sont stabilisés par ligands qui sont de bons σ-donateurs (tels que des amines ) et π-accepteurs ( des hétérocycles contenant de l'azote ). Les états d'oxydation supérieurs sont stabilisées par une forte σ- et π-bailleurs de fonds, tels que O 2 et N 3.
Isotopes
Osmium a sept naturellement isotopes , dont six sont stables: 184 Os, Os 187, 188 Os, Os 189, 190 Os, et (le plus abondant) 192 186 Os Os subit. désintégration alpha avec une telle une longue demi-vie ((2,0 ± 1,1) × 10 15 années) que pour des raisons pratiques, il peut être considéré comme stable. Désintégration alpha est prévue pour tous les sept isotopes naturels, mais en raison de très longues demi-vies, il a été observé que pour 186 Os. Il est prévu que 184 192 OS et OS peut subir la double désintégration bêta, mais cette radioactivité n'a pas encore été observé.
187 S est la fille de 187 Re (demi-vie 4,56 × 10 10 années) et est largement utilisé dans la datation terrestre ainsi que météoriques roches (voir datant de rhénium-osmium). Il a également été utilisé pour mesurer l'intensité de l'altération continentale cours des temps géologiques et de fixer un âge minimum pour la stabilisation de la racines manteau de Continental cratons . Cette décroissance est une raison pour laquelle les minéraux de rhénium riche sont anormalement riche en 187 Os. Cependant, l'application la plus notable de Os dans la datation a été en conjonction avec l'iridium, d'analyser la couche de quartz choqué le long de la Crétacé-Paléogène frontière qui marque l'extinction des dinosaures il ya 65 millions d'années.
Histoire
Osmium (du grec osme (ὀσμή) signifie «odeur») a été découvert en 1803 par Smithson Tennant et William Hyde Wollaston dans Londres , Angleterre . La découverte de l'osmium est intimement liée à celle du platine et les autres métaux de la groupe du platine. Platinum a atteint l'Europe comme le platine («petit argent»), d'abord rencontré dans la fin du 17e siècle dans les mines d'argent à travers le Le département du Chocó, en Colombie . La découverte que ce métal ne était pas un alliage, mais un nouvel élément distinct, a été publié en 1748. Les chimistes qui ont étudié le platine dissous dans eau régale (mélange d' chlorhydrique et l'acide nitrique ) pour créer des sels solubles. Ils ont toujours observé une petite quantité d'un résidu insoluble sombre. Joseph Louis Proust pensait que le résidu était graphite. Victor Collet-Descotils, Antoine-François Fourcroy, et Louis Nicolas Vauquelin a également observé le résidu noir en 1803, mais n'a pas obtenu suffisamment de matériel pour d'autres expériences.
En 1803, Smithson Tennant a analysé le résidu insoluble et a conclu qu'il doit contenir un nouveau métal. Vauquelin traité la poudre en alternance avec alcalins et acides et a obtenu un nouveau oxyde volatil, qu'il croyait être qu'il nomma ptene, du mot grec πτηνος (ptènos) pour cette nouvelle ailes laquelle le métal. Cependant, Tennant, qui avait l'avantage d'une plus grande quantité de résidus, a poursuivi ses recherches et a identifié deux éléments précédemment non découvertes dans le résidu noir, l'iridium et l'osmium. Il a obtenu une solution jaune (probablement de cis - [Os (OH) 2 O 4] 2-) par des réactions avec de l'hydroxyde de sodium à feu rouge. Après acidification il était capable de distiller le OsO formé quatre. Il a nommé l'osmium après grecque sens de osme "une odeur", à cause de l'odeur de cendre et de fumée de la volatile tétroxyde d'osmium. Découverte des nouveaux éléments a été documentée dans une lettre à la Royal Society le 21 Juin, 1804.
Uranium et l'osmium ont été les premiers catalyseurs de succès dans le Procédé Haber, la fixation de l'azote réaction de l'azote et de l'hydrogène pour produire de l'ammoniac , donnant assez de rendement pour rendre le procédé économiquement réussie. À l'époque, un groupe au Dirigé par BASF Carl Bosch a acheté la plupart de l'approvisionnement mondial de l'osmium à utiliser comme un catalyseur. Peu de temps après, en 1908, moins coûteux catalyseurs à base de fer et oxydes de fer ont été introduits par le même groupe pour les premières installations pilotes, supprimant la nécessité pour l'osmium coûteux et rares.
Aujourd'hui l'osmium est obtenue principalement de la transformation de platine et de nickel de minerais.
Occurrence

L'osmium est le moins abondante dans élément stable de la Terre la croûte avec une fraction de la masse moyenne de 0,05 ppb dans la croûte continentale .
L'osmium est présent dans la nature en tant qu'élément non combiné ou dans naturel alliages; en particulier les alliages d'iridium osmium, osmiridium (osmium riche), et iridiosmium (iridium riche). Dans les nickel et cuivre dépôts, des métaux du groupe du platine se produisent en tant que sulfures (ce est à dire, (Pt, Pd) S)), tellurures (par exemple, PtBiTe), antimoniures (par exemple, PDSB), et arséniures (par exemple, 2 PTAS); dans tous ces composés du platine est échangée par une petite quantité d'iridium et l'osmium. Comme avec tous les métaux du groupe du platine, de l'osmium peut être naturellement présent dans les alliages de nickel ou cuivre.
Dans la croûte de la Terre, l'osmium, comme l'iridium, se trouve à des concentrations plus élevées dans trois types de structure géologique: dépôts ignées (intrusions de la croûte de ci-dessous), des cratères d'impact, et les dépôts remaniés de l'une des anciennes structures. Les plus grandes réserves connues primaires sont dans le Complexe igné du Bushveld en Afrique du Sud , bien que les grands gisements de cuivre-nickel près de Norilsk en Russie , et de la Bassin de Sudbury dans le Canada sont également des sources importantes de l'osmium. Les petites réserves peuvent être trouvés dans les États-Unis. Le alluvions utilisés par les pré-colombiennes dans le Le département du Chocó, en Colombie sont toujours une source pour les métaux du groupe du platine. Le deuxième grand dépôt alluvial a été trouvé dans le Oural, la Russie, qui est encore minées.
Production

Osmium est obtenu dans le commerce comme un sous-produit de nickel et de cuivre extraction et de traitement. Pendant électroraffinage du cuivre et du nickel, des métaux nobles tels que l'argent, l'or et les métaux du groupe du platine, ainsi que des éléments non métalliques tels que le sélénium et le tellure se déposent au fond de la cellule sous forme de boue d'anode, qui forme la matière de départ pour leur extraction. Pour séparer les métaux, ils doivent d'abord être mis en solution. Plusieurs méthodes sont disponibles selon le procédé de séparation et la composition du mélange; deux procédés représentatifs sont fusion avec le peroxyde de sodium, puis par dissolution dans l'eau régale, et la dissolution dans un mélange de chlore avec de l'acide chlorhydrique . L'osmium, le ruthénium, le rhodium et l'iridium peuvent être séparés du platine, de l'or et les métaux de base par leur insolubilité dans l'eau régale, laissant un résidu solide. Le rhodium peut être séparé du résidu fondu par traitement avec le bisulfate de sodium. Le résidu insoluble, contenant Ru, Os et Ir, est traitée avec oxyde de sodium, dans lequel est insoluble Ir, Ru et Os produire des sels solubles dans l'eau. Après oxydation des oxydes volatils, RuO 4 est séparée de OsO 4 par précipitation de (NH 4) 3 RuCl 6 avec du chlorure d'ammonium.
Après dissolution, de l'osmium est séparé des autres métaux du groupe du platine par distillation ou extraction avec des solvants organiques du tétroxyde d'osmium volatil. La première méthode est similaire à la procédure utilisée par Tennant et Wollaston. Les deux méthodes sont adaptés à la production industrielle à grande échelle. Dans les deux cas, le produit est réduit avec de l'hydrogène, ce qui donne la forme d'une poudre métallique ou une éponge qui peut être traité en utilisant des techniques de métallurgie des poudres.
Ni les producteurs, ni l'United States Geological Survey publiés les montants de production pour l'osmium. Les estimations de la date de la consommation aux États-Unis publié de 1971, qui donne une consommation aux États-Unis 2000 onces troy (62 kg), donne à penser que la production est toujours inférieure à 1 tonne par an.
Applications
En raison de la volatilité et de la toxicité extrême de son oxyde, l'osmium est rarement utilisé à l'état pur, et est plutôt souvent allié avec d'autres métaux. Ces alliages sont utilisés dans les applications de haute usure. Alliages tels que l'osmium osmiridium sont très dur et, avec d'autres métaux du groupe du platine, sont utilisés dans les conseils de stylos, pivots de l'instrument, et des contacts électriques, car ils peuvent résister à l'usure du fonctionnement fréquent. Ils ont également été utilisés pour les conseils de phonographe stylets à la fin du 78 rpm et au début " LP "et" 45 «ère enregistrement, circa 1945 à 1955. Bien que très durable par rapport aux points de l'acier et de chrome aiguilles, pointes en alliage d'osmium portait sur beaucoup plus rapidement que la concurrence, mais plus coûteux saphir et diamants conseils et ont été abandonnées.
Le tétroxyde d'osmium est utilisé en détection d'empreinte digitale et dans la coloration tissus adipeux pour optique et microscopie électronique. Comme un oxydant puissant, il réticule les lipides principalement par réaction avec des liaisons carbone-carbone insaturés, et ainsi les deux corrections des membranes biologiques en place dans des échantillons de tissus et simultanément les taches. Parce que les atomes d'osmium sont extrêmement denses aux électrons, l'osmium coloration améliore grandement contraste de l'image en La microscopie électronique à transmission (TEM) des études de matériaux biologiques. Ces matériaux de carbone ont par ailleurs très faible contraste de TEM (voir image). Un autre composé de l'osmium, de l'osmium ferricyanure (OsFeCN), présente fixation similaire et l'action de coloration.
Le tétroxyde et un composé apparenté, osmate de potassium, sont des oxydants importants pour la synthèse chimique, en dépit d'être très toxique. Pour le Dihydroxylation asymétrique de Sharpless d', qui utilise osmiate pour la conversion d'un double liaison dans un vicinal diol, K. Barry Sharpless a remporté le prix Nobel de chimie en 2001. Apparemment, OsO 4 est très cher pour cette utilisation, afin KMnO 4 est souvent utilisé à la place, même si les rendements sont moins pour ce réactif chimique moins cher.
En 1898, un chimiste autrichien, Auer von Welsbach, a développé le Oslamp avec un filament fait d'osmium, qu'il introduit commercialement en 1902. Après seulement quelques années, l'osmium a été remplacé par le métal plus stable de tungstène . Le tungstène a le point de fusion le plus élevé de tous les métaux, et de l'utiliser dans les ampoules électriques augmente l'efficacité lumineuse et la vie des lampes à incandescence.
Le fabricant d'ampoules Osram (fondée en 1906, lorsque trois entreprises allemandes, Auer-Gesellschaft, AEG et Siemens & Halske, ont combiné leurs installations de production de la lampe) tire son nom des éléments de prime os et Wolf RAM (ce dernier est allemand pour le tungstène).
Comme le palladium, l'osmium poudre absorbe efficacement des atomes d'hydrogène. Cela pourrait faire osmium un candidat potentiel à une électrode de la batterie à hydrure métallique. Cependant, l'osmium est coûteux et réagirait avec de l'hydroxyde de potassium, l'électrolyte de la batterie la plus courante.
Osmium a une réflectivité élevée dans l' ultraviolet de la plage spectre électromagnétique; par exemple, à 600 Å osmium a une réflectivité de deux fois celle de l'or. Cette réflectivité élevée est souhaitable dans l'espace base- spectromètres UV qui ont réduit la taille des miroirs en raison du manque d'espace. miroirs de Osmium enduit ont été transportés dans plusieurs missions spatiales à bord du Navette spatiale, mais il est vite devenu évident que les radicaux d'oxygène dans le orbite basse sont assez abondantes pour détériorer sensiblement la couche d'osmium.
L'utilisation clinique seulement connu d'osmium semble être pour synovectomie chez les patients arthritiques en Scandinavie. Il se agit de l'administration locale de tétroxyde d'osmium (OsO 4) qui est un composé hautement toxique. L'absence de rapports d'effets secondaires à long terme suggèrent que l'osmium lui-même peut être biocompatible, bien que cela dépende du composé d'osmium administré. En 2011, l'osmium (VI) et l'osmium (II) composés ont été signalés à montrer une activité anticancéreuse in vivo, il a indiqué un avenir prometteur pour l'utilisation de composés d'osmium comme médicaments anticancéreux.

Au microscope électronique (organique) tissus de la plante sans (en haut) et (bas) OsO 4 coloration
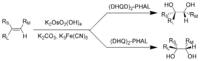
La dihydroxylation Sharpless:
R L = la plus grande substituant; R M = substituant de taille moyenne; R S = petit substituant
Après le vol apparition de miroirs Os, Ag et Au du panneau arrière de la navette spatiale avant (images de gauche) et. Noircissement révèle l'oxydation due à l'irradiation par des atomes d'oxygène.
Précautions
Osmium métallique finement divisée est pyrophore. Osmium réagit avec l'oxygène à température ambiante formant le tétroxyde d'osmium volatil. Certains composés d'osmium sont également convertis en tétroxyde si l'oxygène est présent. Cela rend le tétroxyde d'osmium la source principale de contact avec l'environnement.
Tétroxyde d'osmium est très volatil et pénètre la peau facilement, et est très toxique par inhalation, ingestion et contact avec la peau. De faibles concentrations atmosphériques de vapeur osmium tétroxyde peuvent causer congestion pulmonaire et peau ou lésions oculaires, et doit donc être utilisé dans une hotte. Le tétroxyde d'osmium est rapidement réduite à des composés relativement inertes par des huiles végétales polyinsaturées telles que l'huile de maïs .
Prix
L'osmium est généralement vendu sous forme de poudre pure à 99%. Comme d'autres métaux précieux, elle est mesurée par poids troy et en g. Son prix en 2010 était d'environ 400 $ l'once troy (ou environ 13 $ le gramme), en fonction de la quantité et son fournisseur.

