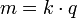Électrolyse
À propos de ce écoles sélection Wikipedia
SOS Enfants a essayé de rendre le contenu plus accessible Wikipedia par cette sélection des écoles. Visitez le site Web d'enfants SOS au http://www.soschildren.org/
Dans la chimie et la fabrication , l'électrolyse est un procédé d'utilisation d'un direct courant électrique continu (CC) à conduire une réaction chimique spontanée autrement non. L'électrolyse est très importante dans le commerce comme une étape dans la séparation d' éléments à partir de sources naturelles, telles que minerais utilisant un cellule électrolytique.
Histoire
Le mot vient de l'électrolyse grec ἤλεκτρον [Ɛ̌ːlektron] "orange" et λύσις [Lyse] «dissolution».
- 1785 - Générateur électrostatique de van Marum Martinus a été utilisé pour réduire l'étain , le zinc et l'antimoine à partir de leurs sels à l'aide de l'électrolyse.
- 1800 - William Nicholson et Johann Ritter décompose l'eau en hydrogène et oxygène .
- 1807 - de potassium , de sodium , de baryum , de calcium et de magnésium ont été découverts par Sir Humphry Davy utilisant l'électrolyse.
- 1875 - Paul Émile Lecoq de Boisbaudran découvert gallium utilisant l'électrolyse.
- 1886 - Fluor a été découvert par Henri Moissan par électrolyse.
- 1886 - Procédé Hall-Héroult développé pour faire l'aluminium
- 1890 - Processus Castner-Kellner développé pour faire de l'hydroxyde de sodium
Vue d'ensemble
L'électrolyse est le passage d'un direct un courant électrique à travers ionique substance qui est soit fondu ou dissous dans un solvant approprié, ce qui entraîne des réactions chimiques au niveau des électrodes et la séparation des matières.
Les principaux composants nécessaires pour réaliser l'électrolyse sont les suivantes:
- Une électrolyte: un gratuits substance contenant des ions qui sont les porteurs de courant électrique dans le électrolyte. Si les ions ne sont pas mobiles, comme dans un sel solide peut ensuite électrolyse se produit pas.
- Un courant continu (CC) approvisionnement direct: fournit l' énergie nécessaire pour créer ou décharger les ions dans le électrolyte. Le courant électrique est transporté par les électrons dans le circuit externe.
- Deux électrodes: un conducteur électrique qui assure l'interface physique entre la le circuit électrique fournissant l'énergie et le électrolyte
Les électrodes de métal , et graphite semi-conducteur matériau sont largement utilisés. Choix de la chaîne de mesure appropriée dépend de la réactivité chimique entre l'électrode et l'électrolyte et le coût de fabrication.
Procédé de l'électrolyse
Le processus de l'électrolyse clé est l'échange d'atomes et d'ions par l'élimination ou l'addition d'électrons provenant du circuit externe. Les produits de l'électrolyse sont requises dans un état physique différent de l'électrolyte et peuvent être éliminés par des processus physiques. Par exemple, dans l'électrolyse de saumure pour produire de l'hydrogène et du chlore, les produits sont gazeux. Ces produits gazeux bulle de l'électrolyte et sont collectées.
- 2 NaCl + H 2 O 2 → 2 NaOH + H 2 + Cl 2
Un liquide contenant des ions mobiles (électrolyte) est produit par:
- La solvatation ou une réaction de composé ionique avec un solvant (tel que l'eau) pour produire des ions mobiles
- Un composé ionique est fondu (fusionné) par chauffage
Un potentiel électrique est appliqué à travers une paire de des électrodes immergées dans l'électrolyte.
Chaque électrode attire les ions qui sont le contraire de la charge . Ions chargés positivement ( cations ) se déplacer vers le (négatif) cathode électronique fournissant, alors que les ions chargés négativement ( anions ) se déplacent vers l'anode positive.
Au niveau des électrodes, des électrons sont absorbés ou libérés par les atomes et ions. Ces atomes qui gagnent ou perdent des électrons pour devenir des ions chargés passent dans l'électrolyte. Ces ions qui gagnent ou perdent des électrons pour devenir atomes non chargés séparent de l'électrolyte. La formation d'atomes non chargés d'ions est appelé décharge.
L'énergie nécessaire pour amener les ions à migrer vers les électrodes, et l'énergie nécessaire pour provoquer le changement d'état ionique, sont fournies par la source externe de potentiel électrique.
L'oxydation et la réduction au niveau des électrodes
L'oxydation des ions ou des molécules neutres se produit à la anode, et la réduction des ions ou des molécules neutres se produit à la cathode. Par exemple, il est possible d'oxyder les ions ferreux en ions ferriques à l'anode:
- Fe 2+
aq → Fe 3+
aq + e -
Il est également possible de réduire ions ferricyanure à ions ferrocyanure à la cathode:
- Fe (CN) 3-
6 + e - → Fe (CN) 4-
6
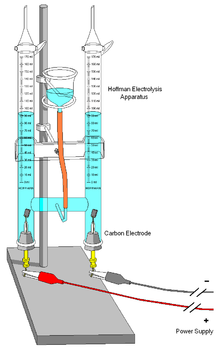
Molécules neutres peuvent aussi réagir à chaque électrode. Par exemple: p-benzoquinone peut être réduite à l'hydroquinone à la cathode:
![]() + 2 e - + 2 H + →
+ 2 e - + 2 H + → 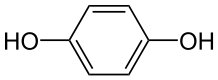
Dans le dernier exemple, les ions H + (ions d'hydrogène) prennent également part à la réaction, et sont fournies par un acide dans la solution, elle-même ou le solvant (eau, méthanol, etc.). réactions d'électrolyse impliquant des ions H + sont assez fréquentes dans les solutions acides. Dans des solutions aqueuses alcalines, les réactions impliquant OH - (ions hydroxyde) sont communs.
Les substances oxydées ou réduites peuvent aussi être le solvant (habituellement de l'eau) ou les électrodes. Il est possible d'avoir des gaz d'électrolyse comportant.
changements de l'énergie au cours de l'électrolyse
La quantité d'énergie électrique qui doit être ajoutée est égale à la variation de l'énergie libre de Gibbs de la réaction ainsi que les pertes dans le système. Les pertes peuvent (en théorie) être arbitrairement proche de zéro, de sorte que le maximum de thermodynamique efficacité est égale à la enthalpie changement divisée par la variation de l'énergie libre de la réaction. Dans la plupart des cas, l'entrée électrique est supérieure à la variation d'enthalpie de la réaction, de sorte que de l'énergie est libérée sous forme de chaleur. Dans certains cas, par exemple, dans l'électrolyse de la vapeur en hydrogène et en oxygène à haute température, le contraire est vrai. La chaleur est absorbée à partir de l'environnement, et la pouvoir calorifique de l'hydrogène produit est plus élevé que l'entrée électrique.
Techniques connexes
Les techniques suivantes sont liées à l'électrolyse:
- Les cellules électrochimiques, y compris de l'hydrogène pile à combustible, utiliser les différences de Potentiel d'électrode standard afin de générer un potentiel électrique à partir de laquelle la puissance utile peut être extraite. Bien que liés par l'interaction des ions et des électrodes, l'électrolyse et le fonctionnement des cellules électrochimiques sont tout à fait distincts. Une cellule chimique ne devrait pas être considéré comme exécutant "l'électrolyse à l'envers».
Lois de Faraday
Première loi de l'électrolyse
En 1832, Michael Faraday a indiqué que la quantité d'éléments séparés en faisant passer un courant électrique à travers un fondu ou dissous sel est proportionnelle à la quantité de charge électrique passée à travers le circuit. Ce est devenu la base de la première loi de l'électrolyse:
Deuxième loi de l'électrolyse
Faraday a découvert que, lorsque la même quantité d'électricité passe à travers différents électrolytes connectés en série, la masse de substance libérée / déposé sur les électrodes est directement proportionnel à leurs poids équivalents.
Les utilisations industrielles
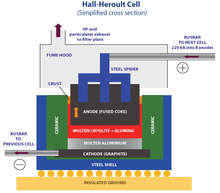
- La production d' aluminium , lithium , sodium , potassium , magnésium , calcium
- Coulométriques techniques peuvent être utilisées pour déterminer la quantité de matière transformée au cours de l'électrolyse en mesurant la quantité d'électricité nécessaire pour effectuer l'électrolyse
- La production de chlore et d'hydroxyde de sodium
- La production de le chlorate de sodium et chlorate de potassium
- La production de composés organiques perfluorés, tels que l'acide trifluoroacétique
- La production de électrolytique de cuivre en tant que cathode, de raffiné cuivre de pureté inférieure comme une anode.
L'électrolyse a beaucoup d'autres utilisations:
- Electrometallurgy est le processus de réduction des métaux à partir de composés métalliques pour obtenir la forme pure de métal par électrolyse. Par exemple, l'hydroxyde de sodium sous sa forme fondue est séparé par électrolyse en sodium et l'oxygène, qui ont tous deux utilisations importantes de produits chimiques. (L'eau est produite en même temps).
- L'anodisation est un procédé électrolytique qui rend la surface des métaux résistant à la corrosion . Par exemple, les navires sont enregistrés d'être corrodé par l'oxygène dans l'eau par ce procédé. Le procédé est également utilisé pour décorer des surfaces.
- Un batterie fonctionne par le processus inverse à l'électrolyse.
- La production d' oxygène pour engins spatiaux et sous-marins nucléaires.
- Galvanoplastie est utilisé dans la superposition des métaux pour les fortifier. Galvanoplastie est utilisé dans de nombreuses industries à des fins fonctionnelles ou décoratives, comme dans les carrosseries de véhicules et pièces de nickel.
- La production de l'hydrogène comme combustible, en utilisant une source d'énergie électrique pas cher.
- Gravure électrolytique de surfaces métalliques comme des outils ou des couteaux avec une marque permanente ou un logo.
L'électrolyse est également utilisé dans le nettoyage et la conservation d'objets anciens. Parce que le processus sépare les particules non métalliques de ceux métalliques, il est très utile pour le nettoyage des vieilles pièces de monnaie et même des objets plus grands.
La concurrence demi-réactions en solution électrolyse
Utilisation d'une cellule contenant des électrodes en platine inertes, l'électrolyse de solutions aqueuses de certains sels conduit à la réduction des cations (par exemple, le dépôt de métal avec, par exemple, des sels de zinc) et à l'oxydation des anions (par exemple, l'évolution de brome avec des bromures). Cependant, avec des sels de certains métaux (par exemple sodium) de l'hydrogène se dégage à la cathode, et des sels contenant des anions (par exemple, sulfate SO 4 2-) de l'oxygène se dégage à l'anode. Dans les deux cas, cela est dû à l'eau étant réduite pour former de l'hydrogène ou oxydé pour former de l'oxygène. En principe, la tension nécessaire pour électrolyser une solution de sel peut être dérivé de la potentiel d'électrode standard pour les réactions à l'anode et la cathode. Le potentiel d'électrode standard est directement liée à l' énergie libre de Gibbs , Ag, pour les réactions à chaque électrode et se réfère à une électrode sans courant. Un extrait du table des potentiels d'électrode standard est indiqué ci-dessous.
| Demi-réaction | E ° (V) | Ref. |
|---|---|---|
| Na + + e - | -2,71 | |
| Zn 2+ + 2 e - | -0,7618 | |
| 2H + + 2 e - | ≡ 0 | |
| Br 2 (aq) + 2 e - | 1,0873 | |
| O 2 (g) + 4H + + 4 e - | 1,23 | |
| Cl 2 (g) + 2 e - | 1,36 | |
| S 2 O 2 8 + 2 e - 4 | 2,07 |
En termes de l'électrolyse, ce tableau doit être interprétée comme suit
- espèces oxydées (souvent de cations) près du haut de la table sont plus difficiles à réduire que les espèces oxydées plus bas. Par exemple, il est plus difficile de réduire l'ion de métal de sodium de sodium que de réduire l'ion zinc en zinc métal.
- espèces réduites (souvent un anion) à proximité du bas de la table est plus difficile à oxyder que les espèces réduites plus haut. Par exemple, il est plus difficile à oxyder que anions sulfate, il est destiné à oxyder les anions bromure.
En utilisant le L'équation de Nernst potentiel d'électrode peut être calculée pour une concentration donnée d'ions, la température et le nombre d'électrons impliqués. Pour l'eau pure ( pH 7):
- le potentiel de l'électrode pour produire la réduction de l'hydrogène est -0,41 V
- le potentiel de l'électrode d'oxydation de l'oxygène de production est 0,82 V.
Chiffres comparables calculées de la même manière, pour 1M le bromure de zinc, ZnBr 2, sont -0,76 V pour la réduction de Zn métallique et 1,10 V pour la production de brome de l'oxydation. La conclusion de ces chiffres est que l'hydrogène devrait être produit à la cathode et de l'oxygène à l'anode de l'électrolyse de l'eau qui est en contradiction avec l'observation expérimentale que le zinc métal est déposé et le brome est produit. L'explication est que ces potentiels calculés indiquent seulement la réaction thermodynamiquement préféré. En pratique, de nombreux autres facteurs doivent être pris en considération, tels que la cinétique de certaines des étapes de réaction impliquées. Ces facteurs signifient ensemble qu'un potentiel plus élevé est nécessaire pour la réduction et l'oxydation de l'eau que prévu, et ceux-ci sont appelés surtensions. Expérimentalement, on sait que surtensions dépendent de la conception de la cellule et de la nature des électrodes.
Pour l'électrolyse d'un neutre (pH 7) une solution de chlorure de sodium, la réduction de l'ion sodium est thermodynamiquement très difficile et de l'eau est réduite à dégagement d'hydrogène en laissant des ions hydroxyde en solution. A l'anode de l'oxydation est observé chlore plutôt que l'oxydation de l'eau depuis la surtension pour l'oxydation de chlorure de chlore est inférieure à la surtension pour l'oxydation de l'eau à l'oxygène . Les ions hydroxyde et dissous le chlore gazeux réagissent en outre à former l'acide hypochloreux. Les solutions aqueuses résultant de ce processus est appelé électrolyser l'eau et est utilisé comme agent de nettoyage et désinfectant.
Électrolyse de l'eau
Une utilisation importante de l'électrolyse de l'eau est de produire de l'hydrogène .
- 2 H 2 O (l) → 2 H 2 (g) + O 2 (g); E 0 = -1,229 V
L'hydrogène peut être utilisé comme combustible pour alimenter moteurs à combustion interne par combustion ou des moteurs électriques par l'intermédiaire de piles à combustible d'hydrogène (voir Véhicule à hydrogène). Ceci a été suggéré comme une approche de passer les économies du monde à partir de l'état actuel de dépendance quasi-totale sur les hydrocarbures pour l'énergie (Voir économie de l'hydrogène).
Le l'efficacité énergétique de l'électrolyse de l'eau est très variable. L'efficacité de l'électrolyseur est une mesure de l'enthalpie contenue dans l'hydrogène (sous combustion à feu avec de l'oxygène, ou une autre réaction ultérieure), par rapport à l'énergie électrique d'entrée. Chaleur / valeurs d'enthalpie pour l'hydrogène sont bien publiés en sciences et en génie textes, que 144 MJ / kg. Notez que les piles à combustible (et non les électrolyseurs) ne peut pas utiliser ce montant total de la chaleur / enthalpie, qui a conduit à une certaine confusion lors du calcul des valeurs de rendement pour les deux types de technologie. Dans la réaction, de l'énergie est perdue sous forme de chaleur, un sous-produit inutile. Certains rapports mentionnent l'efficacité entre 50% et 70% pour les électrolyseurs alcalins; Cependant, l'efficacité pratique beaucoup plus élevées sont disponibles à l'utilisation de la technologie PEM et catalytique, tel que 95% d'efficacité. Aux États-Unis il ya encore une tendance erronée occasionnelle d'utiliser le «pouvoir calorifique inférieur» pour l'efficacité. Cette valeur (obsolescence) ne représente pas la quantité totale d'énergie au sein de l'hydrogène, par conséquent, l'efficacité semble plus faible que lorsqu'on utilise les valeurs définies plus précisément. Le maximum théorique estime la quantité totale d'énergie nécessaire à la formation de l'hydrogène et de l'oxygène de l'eau. Notez que (dans des contextes plus larges de l'efficacité énergétique), ces valeurs se réfèrent uniquement à l'efficacité de conversion de l'énergie électrique en énergie chimique de l'hydrogène; l'énergie perdue pour générer de l'électricité ne est pas incluse.
NREL estime que 1 kg d'hydrogène (à peu près équivalente à 3 kg, ou 4 L, du pétrole en termes d'énergie) pourraient être produites par le vent alimenté électrolyse pour entre $ 5,55 à court terme et de 2,27 $ dans le long terme.
Environ 4% de gaz hydrogène produit dans le monde est créé par électrolyse, et normalement utilisée sur place. L'hydrogène est utilisé pour la création de l'ammoniac pour engrais via le Procédé Haber, et la conversion de sources pétrolières lourdes en fractions plus légères via hydrocraquage.
Électrocristallisation
Une application spécialisée de l'électrolyse implique la croissance de cristaux de conducteurs sur l'une des électrodes à partir d'espèces oxydées ou réduites qui sont générés in situ. La technique a été utilisée pour obtenir des monocristaux de conducteurs électriques faibles dimensions, tels que sels de transfert de charge.
Expérimentateurs
Pionniers scientifiques de l'électrolyse comprennent:
- Antoine Lavoisier
- Robert Bunsen
- Humphry Davy
- Michael Faraday
- Paul Héroult
- Svante Arrhenius
- Adolph Wilhelm Hermann Kolbe
- William Nicholson
- Louis Joseph Gay-Lussac
- Alexander von Humboldt
- Johann Wilhelm Hittorf
Pionniers de batteries:
- Alessandro Volta
- Gaston Planté
Plus récemment, l'électrolyse de eau lourde a été réalisée par Fleischmann et Pons en leur célèbre expérience, ce qui entraîne la production de chaleur anormale et la demande discréditée de la fusion froide.