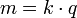Eletrólise
Sobre este escolas selecção Wikipedia
Crianças SOS tentou tornar o conteúdo mais acessível Wikipedia por esta selecção escolas. Visite o site da SOS Children at http://www.soschildren.org/
Em química e de fabrico , a electrólise é um método de utilização de um direto corrente eléctrica (DC) para conduzir uma reacção química de outra forma não-espontânea. A electrólise é comercialmente muito importante como uma etapa na separação de elementos a partir de fontes que ocorrem naturalmente, tais como minérios utilizando um célula electrolítica.
História
A palavra vem da eletrólise grego ἤλεκτρον [Ɛ̌ːlektron] "amber" e λύσις [Lise] "dissolução".
- 1785 - Electrostático gerador de Martinus van Marum foi usada para reduzir o estanho , o zinco , e antimónio partir dos seus sais, usando electrólise.
- 1800 - William Nicholson e Johann Ritter decomposto água em hidrogênio e oxigênio .
- 1807 - potássio , sódio , bário , cálcio e magnésio foram descobertos por Humphry Davy usando electrólise.
- 1875 - Paul Émile Lecoq de Boisbaudran descoberto gálio usando eletrólise.
- 1886 - Flúor foi descoberto por Henri Moissan usando eletrólise.
- 1886 - Processo de Hall-Héroult desenvolvido para fazer alumínio
- 1890 - Processo Castner-Kellner desenvolvido para fazer o hidróxido de sódio
Visão global
Eletrólise é a passagem de uma direto corrente eléctrica através de um iónica substância que é quer fundido ou dissolvido num solvente adequado, resultando em reacções químicas com os eléctrodos e a separação de materiais.
Os principais componentes necessários para alcançar electrólise são:
- Um electrólito: a a substância que contem livres iões que são os portadores de corrente elétrica no electrólito. Se os iões não são móveis, como em um sal sólido , em seguida, a electrólise pode não ocorrer.
- A corrente contínua (DC) fornecimento directo: fornece a energia necessária para criar ou descarregar os íons no electrólito. A corrente eléctrica é transportada por electrões no circuito externo.
- Dois eléctrodos: um condutor eléctrico que fornece a interface físico entre o circuito elétrico fornecendo a energia eo eletrólito
Eletrodos de metais , grafite e semicondutores materiais são amplamente utilizados. Escolha do eléctrodo adequado depende reactividade química entre o eléctrodo e o electrólito e custo de fabrico.
Processo de electrólise
O processo de eletrólise chave é o intercâmbio de átomos e íons pela remoção ou adição de elétrons do circuito externo. Os produtos de electrólise são necessários em algum estado físico diferente a partir do electrólito e podem ser removidos por alguns processos físicos. Por exemplo, na electrólise de salmoura para produzir hidrogénio e cloro, os produtos são gasosos. Estes produtos gasosos bolha do electrólito e são recolhidos.
- 2 NaCI + 2 H2O → 2 NaOH + H + 2 Cl 2
Um líquido contendo iões móveis (electrólito) é produzido por:
- Solvatação ou reacção de um composto iónico com um solvente (tal como água) para produzir iões móveis
- Um composto iónico é derretido (fundidos) por aquecimento
Um potencial eléctrico é aplicado através de um par de eléctrodos mergulhados no electrólito.
Cada eléctrodo atrai iões que estão em frente da carga . Íons carregados positivamente ( cátions ) avançar para o catodo (negativo) fornecendo elétrons, enquanto íons com carga negativa ( ânions ) mover em direção ao ânodo positivo.
Nos eléctrodos, os elétrons são absorvidos ou liberada pelos átomos e íons. Esses átomos que ganhar ou perder elétrons para se tornar íons carregados passam para o eletrólito. Esses íons que ganhar ou perder elétrons para se tornar átomos carregados separar do eletrólito. A formação de átomos sem carga de iões é chamado de descarga.
A energia necessária para fazer com que os iões migrem para os eléctrodos, e a energia para causar a mudança de estado iónico, é fornecida pela fonte externa de potencial eléctrico.
Oxidação e redução nos eléctrodos
A oxidação de iões ou moléculas neutras ocorre no ânodo, eo redução de iões ou moléculas neutras ocorre no cátodo. Por exemplo, é possível oxidar os iões ferrosos a iões férricos no ânodo:
- Fe 2+
aq → Fe 3+
aq + e -
É também possível reduzir íons ferricianeto para iões de ferrocianeto no cátodo:
- Fe (CN) 3-
6 + e - → Fe (CN) 4-
6
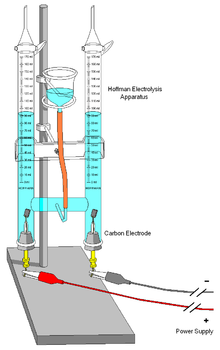
Moléculas neutras também podem reagir em cada eléctrodo. Por exemplo: p-benzoquinona pode ser reduzida a hidroquinona no cátodo:
![]() 2 e + - + 2 H + →
2 e + - + 2 H + → 
No último exemplo, os iões de H + (iões de hidrogénio) também tomar parte na reacção, e são fornecidos através de um ácido na solução, ou o próprio solvente (água, metanol, etc.). Reações de eletrólise envolvendo íons H + são bastante comuns em soluções ácidas. Em soluções aquosas alcalinas, reacções envolvendo OH - (iões hidróxido) são comuns.
As substâncias oxidados ou reduzidos podem também ser o solvente (usualmente água) ou os eléctrodos. É possível ter eletrólise envolvendo gases.
Mudanças de energia durante a eletrólise
A quantidade de energia eléctrica que deve ser adicionada é igual a mudança na energia livre de Gibbs da reacção, mais as perdas no sistema. As perdas podem (em teoria) ser arbitrariamente próximo de zero, de modo que o máximo termodinâmico eficiência igual a entalpia mudança dividida pela variação de energia livre da reacção. Na maioria dos casos, a entrada eléctrica é maior do que a variação de entalpia da reacção, assim alguma energia é libertada na forma de calor. Em alguns casos, por exemplo, na electrólise de vapor em hidrogênio e oxigênio a alta temperatura, o oposto é verdadeiro. O calor é absorvido a partir do ambiente, e o calorífico do hidrogénio produzido é maior do que a entrada eléctrica.
Técnicas relacionadas
As técnicas seguintes são relacionadas a electrólise:
- As células electroquímicas, incluindo o hidrogénio de célula de combustível, utilizar as diferenças em Potencial de eléctrodo padrão, a fim de gerar um potencial eléctrico a partir do qual energia pode ser extraída útil. Embora relacionado através da interação de íons e eletrodos, eletrólise e do funcionamento de células eletroquímicas são bastante distintos. Uma célula químico não deve ser pensado como executar "eletrólise às avessas".
Leis de Faraday da eletrólise
Primeira lei de eletrólise
Em 1832, Michael Faraday relatado que a quantidade de elementos separados por passagem de uma corrente eléctrica através de um fundido ou dissolvido sal é proporcional à quantidade de carga eléctrica passada através do circuito. Esta se tornou a base da primeira lei de eletrólise:
Segunda lei da eletrólise
Faraday descobriu que quando a mesma quantidade de electricidade é passada através de electrólitos diferentes ligados em série, a massa de substância libertada / depositado nos eléctrodos é directamente proporcional aos seus pesos equivalentes.
Utilizações industriais
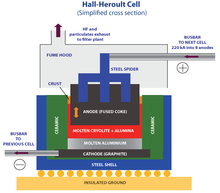
- Produção de alumínio , de lítio , sódio , potássio , magnésio , cálcio
- Coulométricos técnicas podem ser usadas para determinar a quantidade de matéria transformada durante a electrólise através da medição da quantidade de energia necessária para realizar a electrólise
- A produção de cloro e hidróxido de sódio
- Produção de O clorato de sódio e clorato de potássio
- A produção de compostos orgânicos, tais como perfluorados ácido trifluoroacético
- Produção de cobre electrolítico como um cátodo, de refinado de cobre de menor pureza como um ânodo.
Eletrólise tem muitos outros usos:
- Eletrometalurgia é o processo de redução de metais a partir de compostos metálicos para obter a forma pura de metais por electrólise. Por exemplo, hidróxido de sódio, na sua forma fundida é separada por electrólise em sódio e oxigénio, sendo que ambos têm usos químicos importantes. (A água é produzida ao mesmo tempo).
- A anodização é um processo electrolítico que faz com que a superfície de metais resistentes à corrosão . Por exemplo, os navios são salvou de ser corroído por oxigênio na água por este processo. O processo também é utilizado para decorar superfícies.
- A bateria funciona o processo inverso para eletrólise.
- Produção de oxigênio para naves espaciais e submarinos nucleares.
- Galvanoplastia é usado em camadas metais para fortalecê-los. Galvanoplastia é usado em muitas indústrias para fins funcionais ou decorativos, como em carroçarias de veículos e moedas de níquel.
- Produção de hidrogênio para combustível, usando uma fonte barata de energia elétrica.
- Ataque eletrolítico de superfícies metálicas como ferramentas ou facas com uma marca permanente ou logotipo.
A electrólise é também utilizada na limpeza e conservação de artefactos de idade. Uma vez que o processo separa as partículas não metálicas de os metálicos, é muito útil para a limpeza de moedas antigas e objectos ainda maiores.
Competir semi-reações em solução de eletrólise
Usando uma célula contendo eléctrodos de platina inertes, a electrólise de soluções aquosas de alguns sais conduz a redução dos catiões (por exemplo, deposição de metal com, por exemplo, sais de zinco) e de oxidação dos aniões (por exemplo a evolução de bromo com brometos). No entanto, com alguns sais de metais de hidrogénio (por exemplo, de sódio) é libertado no cátodo, e para os sais que contêm alguns aniões (por exemplo, sulfato de SO 4 2-) oxigénio é libertado no ânodo. Em ambos os casos, isto é, devido à água ser reduzido para formar hidrogénio ou oxidado para formar oxigénio. Em princípio, a tensão necessária para electrolyze uma solução de sal pode ser derivado a partir da potencial do eléctrodo padrão para as reacções no ânodo e cátodo. O potencial padrão de eletrodo é diretamente relacionado com a energia livre de Gibbs , ΔG, para as reacções em cada eletrodo e refere-se a um eléctrodo sem fluxo de corrente. Um extrato da tabela de potenciais de eléctrodo padrão é mostrado abaixo.
| Half-reação | ° E (V) | Ref. |
|---|---|---|
| Na + + e - | -2,71 | |
| Zn 2+ + 2 e - | -0,7618 | |
| 2H + + 2 e - | ≡ 0 | |
| Br 2 (aq) + 2 e - | 1,0873 | |
| O 2 (g) + 4H + + 4e - | 1,23 | |
| Cl 2 (g) + 2 e - | 1,36 | |
| S 2 O 2- 8 + 2 e - 4 | 2,07 |
Em termos de electrólise, este quadro devem ser interpretados como se segue
- espécies oxidadas (muitas vezes um catião) mais próximas do topo da mesa são mais difíceis de reduzir de espécies oxidadas na parte inferior. Por exemplo, é mais difícil de reduzir iões de sódio e de metal de sódio que é para reduzir o ião de zinco para zinco metálico.
- espécies reduzidas (muitas vezes um ânion) perto da parte inferior da tabela são mais difíceis de oxidar do que as espécies reduzidas mais acima. Por exemplo, é mais difícil de oxidar aniões sulfato que é para oxidar aniões brometo.
Usando o A equação de Nernst potencial de eléctrodo pode ser calculado para uma concentração específica de iões, a temperatura e o número de electrões implicados. Para a água pura ( pH 7):
- o potencial do eletrodo para a produção de hidrogénio redução é -0,41 V
- o potencial de eléctrodo para a produção de oxigénio oxidação é 0,82 V.
Os valores comparáveis calculadas de forma semelhante, para 1M brometo de zinco, ZnBr2, são -0,76 V para a redução de Zn metálico e 1,10 V para produzir o bromo oxidação. A conclusão a partir desses números é que o hidrogênio deve ser produzido no cátodo e oxigénio no ânodo da eletrólise da água que está em desacordo com a observação experimental de que o zinco metal é depositado e bromo é produzido. A explicação é que estes potenciais calculados apenas indicar a reacção termodinamicamente preferida. Na prática, muitos outros factores têm de ser tomados em conta, tais como a cinética de alguns dos passos da reacção envolvidos. Estes factores em conjunto significa que um potencial mais elevado é necessário para a redução e oxidação da água do que o previsto, e estes são denominados sobrepotenciais. Experimentalmente sabe-se que sobrepotenciais depende da concepção da célula e da natureza dos eléctrodos.
Para a electrólise de uma solução de cloreto de sódio neutro (pH 7), a redução de iões de sódio é termodinamicamente muito difícil e a água é reduzida em evolução de hidrogénio deixando iões hidróxido em solução. No ânodo a oxidação de cloro é observado, em vez de a oxidação da água desde o sobrepotencial para a oxidação de cloreto de cloro é menor do que o sobrepotencial para a oxidação da água de oxigénio . Os iões hidróxido e dissolvido cloro gás reagir ainda mais para formar ácido hipocloroso. As soluções aquosas resultantes desse processo é chamado água electrolisada e é usado como um agente desinfectante e de limpeza.
Eletrólise da água
Um importante uso de eletrólise da água é produzir hidrogênio .
- 2 H2O (l) → 2 H 2 (g) + O 2 (g); E 0 = -1,229 V
O hidrogénio pode ser utilizado como combustível para alimentar motores de combustão interna por motores de combustão ou elétricos através de células de combustível de hidrogénio (ver Veículo de hidrogênio). Este tem sido sugerida como uma abordagem para mudar economias do mundo a partir do estado atual de dependência quase completa sobre hidrocarbonetos para a energia (Veja economia do hidrogênio.)
O eficiência energética de eletrólise da água varia muito. A eficiência de um electrolisador é uma medida da entalpia contido no hidrogénio (sob a combustão com o oxigénio ir, ou alguma outra reacção posterior), em comparação com a energia eléctrica consumida. Calor / valores de entalpia para hidrogénio são bem publicados em textos de ciência e engenharia, como 144 MJ / kg. Note-se que as células de combustível (não eletrolisadores) não pode utilizar esse montante total de calor / entalpia, o que levou a alguma confusão ao calcular valores de eficiência para ambos os tipos de tecnologia. Na reacção, alguma energia é perdida na forma de calor, um subproduto inútil. Alguns relatórios citar eficiência entre 50% e 70% para electrolisadores alcalinos; no entanto, muito mais elevadas eficiências prática estão disponíveis com a utilização de PEM e tecnologia catalítica, tais como eficiência de 95%. Em os EUA ainda há uma tendência errada ocasional a usar o 'calorífico inferior "para a eficiência. Este valor (se tornando obsoleto) não representa a quantidade total de energia dentro do hidrogénio, daí a eficiência parece menor do que quando se usa os valores definidos com mais precisão. O máximo teórico considera a quantidade total de energia necessária para a formação do hidrogénio e de oxigénio da água. Note que (em contextos mais mais amplas de eficiência energética), estes valores referem-se apenas à eficiência de conversão de energia elétrica em energia química do hidrogênio; a energia perdida na geração de energia eléctrica não está incluído.
NREL estimou que 1 kg de hidrogênio (aproximadamente equivalente a 3 kg, ou 4 L, do petróleo em termos de energia) poderiam ser produzida pelo vento alimentado eletrólise para entre $ 5,55 no curto prazo e 2,27 dólares a longo prazo.
Cerca de 4% de gás hidrogênio produzido no mundo é criado por eletrólise, e normalmente utilizado no local. O hidrogénio é usado para a criação de amoníaco para o fertilizante através Processo Haber, e convertendo as fontes de petróleo pesado para frações mais leves via hidrocraqueamento.
Eletrocristalização
A aplicação especializada de electrólise envolve o crescimento de cristais de condutores em um dos eléctrodos a partir de espécies oxidadas ou reduzidas que são geradas in situ. A técnica tem sido utilizada para se obterem cristais individuais de condutores eléctricos de baixa-dimensional, tal como sais de transferência de carga.
Experimentadores
Pioneiros científicos de eletrólise incluem:
- Antoine Lavoisier
- Robert Bunsen
- Humphry Davy
- Michael Faraday
- Paul Héroult
- Svante Arrhenius
- Adolph Wilhelm Hermann Kolbe
- William Nicholson
- Joseph Louis Gay-Lussac
- Alexander von Humboldt
- Johann Wilhelm Hittorf
Pioneiros de baterias:
- Alessandro Volta
- Gaston Planté
Mais recentemente, a electrólise de água pesada foi realizada por Fleischmann e Pons em seu famoso experimento, resultando em geração de calor anômala ea reivindicação desacreditado de a fusão a frio.