
Potássio
Fundo para as escolas Wikipédia
Crianças SOS, uma instituição de caridade educação , organizou esta selecção. Todas as crianças disponíveis para apadrinhamento de crianças de Crianças SOS são cuidadas em uma casa de família pela caridade. Leia mais ...
| Potássio | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
19 K | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||
cinza prateado  Pérolas de potássio sob óleo de parafina. O grande pérola mede 0,5 cm. Abaixo: linhas espectrais de potássio | |||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||
| Nome, símbolo, número | de potássio, K, 19 | ||||||||||||||||||||||||||||||
| Pronúncia | / p ɵ t æ s Eu ə m / po- TAS -ee-əm | ||||||||||||||||||||||||||||||
| Categoria elemento | metal alcalino | ||||||||||||||||||||||||||||||
| Grupo, período, bloco | (1) metais alcalinos , 4, s | ||||||||||||||||||||||||||||||
| Peso atômico padrão | 39,0983 (1) | ||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Ar ] 4s 1 2, 8, 8, 1 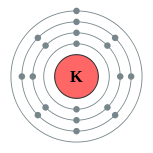 | ||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||
| Descoberta | Humphry Davy (1807) | ||||||||||||||||||||||||||||||
| Primeiro isolamento | Humphry Davy (1807) | ||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||
| Densidade (perto RT) | 0,862 g · cm -3 | ||||||||||||||||||||||||||||||
| Líquido densidade no pf | 0,828 g · cm -3 | ||||||||||||||||||||||||||||||
| Ponto de fusão | 336,53 K , 63,38 ° C, 146,08 ° F | ||||||||||||||||||||||||||||||
| Ponto de ebulição | 1,032 K, 759 ° C, 1398 ° F | ||||||||||||||||||||||||||||||
| Ponto Triplo | 336,35 K (63 ° C), kPa | ||||||||||||||||||||||||||||||
| Calor de fusão | 2.33 kJ mol -1 · | ||||||||||||||||||||||||||||||
| Calor de vaporização | 76,9 kJ · mol -1 | ||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 29,6 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||
| Estados de oxidação | 1 (Fortemente óxido de base) | ||||||||||||||||||||||||||||||
| Eletronegatividade | 0,82 (escala de Pauling) | ||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 418,8 kJ · mol -1 | ||||||||||||||||||||||||||||||
| 2: 3052 kJ · mol -1 | |||||||||||||||||||||||||||||||
| 3: 4420 kJ · mol -1 | |||||||||||||||||||||||||||||||
| Raio atômico | 227 pm | ||||||||||||||||||||||||||||||
| O raio de covalência | 203 ± 12:00 | ||||||||||||||||||||||||||||||
| Van der Waals raio | 275 pm | ||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbica de corpo centrado  | ||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | ||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 72 Nco · m | ||||||||||||||||||||||||||||||
| Condutividade térmica | 102,5 W · m -1 · K -1 | ||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 83,3 pM · · K -1 m -1 | ||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 2.000 m · s -1 | ||||||||||||||||||||||||||||||
| O módulo de Young | 3,53 GPa | ||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 1.3 GPa | ||||||||||||||||||||||||||||||
| Massa de módulo | 3.1 GPa | ||||||||||||||||||||||||||||||
| Dureza de Mohs | 0,4 | ||||||||||||||||||||||||||||||
| Dureza Brinell | 0,363 MPa | ||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-09-7 | ||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de potássio | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
O potássio é um elemento químico com o símbolo K (de Neo-Latina kalium) e número atômico 19. Potássio elementar é um branco prateado suave de metal alcalino que oxida rapidamente no ar e é muito reactivo com a água , gerando calor suficiente para inflamar o hidrogénio emitido na reacção e arde com uma chama lilás.
Como o potássio e de sódio são quimicamente muito semelhante, os seus sais não foram em primeiro diferenciadas. A existência de múltiplos elementos nos seus sais era suspeito de 1702, e esta foi comprovada em 1807 quando o potássio e de sódio foram isolados individualmente a partir de diferentes sais por electrólise . Potássio na natureza ocorre apenas em sais iónicos. Como tal, encontra-se dissolvido em água do mar (que é 0,04%, em peso, de potássio), e faz parte de muitos minerais .
A maioria das aplicações químicas industriais de potássio empregar relativamente elevada solubilidade em água de compostos de potássio, tais como potássio sabonetes. Potássio metal tem apenas algumas aplicações especiais, sendo substituído na maioria das reações químicas com sódio metálico.
Os iões de potássio são necessários para a função de todas as células vivas. Difusão de iões de potássio é um mecanismo-chave na transmissão nervosa, e depleção de potássio em animais, incluindo os seres humanos, os resultados de várias disfunções cardíacas. Potássio acumula nas células vegetais, e frutas e legumes frescos, portanto, são uma boa fonte alimentar dela. Por outro lado, a maioria das plantas com excepção especialista halophytes são intolerantes de sal e sódio está presente neles apenas em baixa concentração. Isto resultou em potássio ser isolado pela primeira vez a partir de potassa, as cinzas de plantas, dando o elemento o seu nome. Pela mesma razão, a produção de culturas agrícolas esgota rapidamente solos de potássio, fertilizantes agrícolas e consumir 95% da produção mundial de potássio química.
Propriedades
Físico

Tem 19 átomos de potássio electrões, que é mais um do que a configuração extremamente estável de árgon. Um átomo de potássio é, portanto, muito mais propensos a perder o elétron "extra" do que para ganhar um; no entanto, o íons alkalide, K -, são conhecidos. Devido ao baixo primeira energia de ionização (418,8 kJ / mol) o átomo de potássio facilmente perde um electrão e oxida para o catião monopositive, K +. Este processo exige tão pouca energia que o potássio é facilmente oxidado pelo oxigénio atmosférico. Em contraste, a segunda energia de ionização é muito elevado (3052 kJ / mol), por remoção de dois electrões quebra a configuração electrónica do gás nobre estável. De potássio, por conseguinte, não formam facilmente compostos com o estado de oxidação de duas (ou mais elevado).
O potássio é o segundo menos densa de metal depois de lítio . É um sólido macio que tem um baixo ponto de fusão e pode ser facilmente cortada com uma faca. Potássio recém-cortada é prateado na aparência, mas ele começa a manchar direção cinza imediatamente depois de ser exposto ao ar. Em um teste de chama, potássio e seus compostos emitem uma cor lilás com um comprimento de onda de emissão de pico de 766,5 nm (ver filme abaixo ).
Químico
O potássio é um metal extremamente ativo, que reage violentamente com oxigênio e água no ar. Com o oxigênio, ele converte para peróxido de potássio e com água hidróxido de potássio. A reacção de potássio com água é perigoso por causa do seu carácter exotérmica violenta e a produção de hidrogénio gás. O hidrogénio reage de novo com o oxigénio atmosférico, produzindo água, que reage com o restante de potássio. Esta reacção necessita apenas vestígios de água; Devido a isso, de potássio e suas ligas com líquido de sódio - NaK - são potentes dessecantes que podem ser usadas para secar os solventes antes de destilação.
Devido à sensibilidade de potássio à água e ao ar, as reacções são possíveis apenas em atmosfera inerte, tal como árgon gás usando técnicas de livre-ar. O potássio não reagem com a maioria dos hidrocarbonetos, tais como óleo mineral ou querosene. Ela dissolve-se prontamente em líquido de amoníaco , até 480 g por 1000 g de amónia a 0 ° C. Dependendo da concentração, as soluções de amoníaco são azul para amarelo, e a sua condutividade eléctrica é semelhante ao de metais líquidos. Em uma solução pura, potássio reage lentamente com amoníaco para formar KNH 2, mas esta reacção é acelerada por pequenas quantidades de sais de metais de transição. Pode reduzir o sais para o metal; de potássio é muitas vezes utilizado como o agente redutor na preparação de metais finamente divididos a partir dos seus sais por o Método de Rieke. Por exemplo, a preparação de Rieke magnésio emprega de potássio como o redutor:
- MgCl 2 + 2 K → Mg + 2 KCl
Compostos
O único estado de oxidação comum para o potássio é um. Potássio metálico é um poderoso agente de redução que é facilmente oxidado para o monopositive catião , K +. Uma vez oxidado, que é muito estável e difícil de reduzir de volta para o metal.
O hidróxido de potássio reage prontamente com dióxido de carbono para produzir carbonato de potássio, e é usado para remover vestígios de gás a partir do ar. Em geral, os compostos de potássio tem excelente solubilidade em água, devido à elevada energia de hidratação do ião K +. O ião potássio é incolor em água e é muito difícil precipitar; possíveis métodos de precipitação incluem reações com tetrafenilborato de sódio, ácido hexacloroplatínico, e cobaltinitrite de sódio.
Potássio oxida mais rapidamente do que a maioria dos metais e formas óxidos com títulos de oxigênio de oxigênio, assim como todos os metais alcalinos, exceto lítio. Três espécies são formadas durante a reacção: óxido de potássio, peróxido de potássio, e superóxido de potássio, que contém três iões à base de oxigénio diferentes: óxido de (S 2-), peróxido (O 2-
2), e superóxido (O -
2). As duas últimas espécies, especialmente o dismutase, são raros e são formadas apenas em reacção com muito eletropositivos metais; estas espécies contêm ligações oxigênio-oxigênio. Todos os compostos binários de potássio de oxigênio são conhecidos por reagir violentamente com a água, formando hidróxido de potássio. Este composto é um álcali forte, e 1,21 kg de ele possa dissolver tanto como um litro de água.
 Estrutura de superóxido de potássio sólido (KO 2).
Estrutura de superóxido de potássio sólido (KO 2).
Em solução aquosa
Os compostos de potássio são normalmente altamente iónico e, assim, a maior parte deles são solúveis em água. As principais espécies em água são os complexos aquo [K (H 2 O) n] +, em que N = 6 e 7. Alguns dos poucos sais que são fracamente solúveis incluem tetrafenilborato de potássio, hexacloroplatinato de potássio, e cobaltinitrite potássio.
Isótopos
Existem 24 conhecidos isótopos de potássio, três dos quais ocorrem naturalmente: 39 K (93,3%), 40 K (0,0117%), e 41 K (6,7%). 40 K de ocorrência natural tem uma meia-vida de 1,250 × 10 9 anos. Ele decai para estável 40 Ar por captura de elétrons ou emissão de pósitrons (11,2%) ou para estável 40 Ca por decaimento beta (88,8%). O decaimento do 40 K para 40 Ar permite um método comumente usado para datar rochas. O convencional Método de datação K-Ar depende da suposição de que as pedras não continha árgon, no momento da formação e que todos os árgon radiogênico subsequente (ou seja, 40 Ar) foi quantitativamente retido. Os minerais são datados por medição da concentração de potássio e a quantidade radiogenic de 40 Ar acumulado. Os minerais que são mais adequados para encontros incluem biotita, moscovite, metamórfico hornblenda, e vulcânica feldspato ; amostras de rocha total de derrames vulcânicos e rasas instrusives também pode ser datada se eles estão inalterados. Fora do namoro, os isótopos de potássio têm sido usados como marcadores em estudos de intemperismo e para estudos de ciclagem de nutrientes porque o potássio é um macronutriente necessário para a vida .
40 K ocorre em potássio natural (e, assim, em alguns substitutos do sal comercial) em quantidade suficiente para que grandes sacos desses substitutos podem ser utilizados como uma fonte radioactiva para demonstrações da sala de aula. Em animais saudáveis e pessoas, 40 K representa a maior fonte de radioactividade, ainda maior do que 14 C. Em um corpo humano de 70 kg de massa, cerca de 4.400 núcleos de 40 K decadência por segundo. A atividade de potássio natural é 31 Bq / g.
Criação e ocorrência

O potássio é formado no universo pela nucleossíntese dos átomos mais leves. A forma estável de potássio é criado em supernovas através do explosivo processo de queima de oxigênio.
Potássio elementar não ocorre na natureza porque ele reage violentamente com a água (ver Precauções seção abaixo). Como vários compostos, potássio torna-se cerca de 2,6% do peso da crosta terrestre e é o sétimo elemento mais abundante, semelhante em abundância de sódio em cerca de 1,8% da massa. Na água do mar, de potássio a 0,39 g / l (0,039% p / v) é muito menos abundante do que o de sódio a 10,8 g / L (1,08% p / v).
Ortoclase (feldspato de potássio) é um mineral formador de rocha comum. Granito , por exemplo, contém 5% de potássio, que é bem acima da média na crosta da Terra. Silvite (KCl), carnallite (KCl · · MgCl2 6 (H2O)), cainite (MgSO4 · · KCl 3H 2 O) e langbeinite (MgSO4 · K 2 SO 4)) são os minerais encontrados em grande evaporite depósitos em todo o mundo. Os depósitos muitas vezes mostram camadas começando com o menos solúvel na parte inferior e o mais solúvel em cima. Depósitos de nitro ( nitrato de potássio ) são formados por decomposição do material orgânico em contacto com a atmosfera, na sua maioria em cavernas; por causa da boa solubilidade em água de nitro a formação de depósitos maiores requer condições ambientais especiais.
História
Nem sais de potássio nem elementares de potássio (como entidades separadas de outros sais) eram conhecidas na romanas vezes, e o nome latino do elemento não é Latim clássico, mas sim neo-latina. O nome latino kalium foi feita a partir da palavra " alcalino ", que por sua vez veio do árabe : al-القليه qalyah ". cinzas de plantas" O termo de som semelhante Inglês alcalino é a partir desta mesma raiz (potássio em Modern Standard árabe é بوتاسيوم būtāsyūm).
O nome em Inglês para o potássio elemento vem da palavra " potassa ", referindo-se ao método através do qual foi obtida a potassa -. lixiviação da cinza de folhas de árvores de madeira ou queimados e evaporando a solução em uma panela potássio é principalmente uma mistura de sais de potássio porque as plantas têm pouco ou nenhum teor de sódio, e o resto do conteúdo mineral importante de uma planta consiste em sais de cálcio de relativamente baixa solubilidade em água. Enquanto o potássio tem sido usado desde os tempos antigos, ele não foi compreendido por maioria de sua história para ser uma substância fundamentalmente diferente de sais minerais de sódio. Georg Ernst Stahl obtido evidências experimentais de que o levou a sugerir a diferença fundamental de sais de sódio e potássio em 1702, e Henri Louis Duhamel du Monceau foi capaz de provar que esta diferença de 1736. A composição química exacta de compostos de potássio e de sódio, e o estado como elemento químico de potássio e de sódio, não era conhecida, em seguida, e, assim, Antoine Lavoisier não incluem o álcali em sua lista de elementos químicos em 1789.
Potássio metal foi isolado pela primeira vez em 1807 na Inglaterra por Sir Humphry Davy , que deriva-lo de potassa cáustica (KOH), através da utilização de electrólise do sal fundido com o recentemente descoberto pilha de volta. O potássio foi o primeiro metal que foi isolado por meio de electrólise. Mais tarde, no mesmo ano, Davy relatado extracção do metal de sódio a partir de um derivado de mineral ( soda cáustica , NaOH, ou soda cáustica), em vez de um sal de planta, por uma técnica semelhante, demonstrando que os elementos e, assim, os seus sais, são diferentes. Embora a produção de potássio e sódio metálico deveria ter mostrado que ambos são elementos, levou algum tempo antes que este ponto de vista foi universalmente aceito.
Por um longo tempo as únicas aplicações significativas para a potassa foram a produção de vidro, água sanitária, e sabão. Sabões de potássio a partir de gorduras animais e de óleos vegetais eram especialmente apreciadas, uma vez que tendem a ser mais solúveis em água e de textura mais suave, e eram conhecidos como suave sabonetes. A descoberta por Justus Liebig em 1840 que o potássio é um elemento necessário para as plantas e que a maioria dos tipos de solo falta de potássio provocou um aumento acentuado da procura de sais de potássio. Wood-cinza do abeto foi inicialmente utilizada como uma fonte de sal de potássio para fertilizantes, mas, com a descoberta em 1868 de depósitos minerais que contêm cloreto de potássio perto Staßfurt, Alemanha, a produção de fertilizantes que contenham potássio começaram a uma escala industrial. Outros depósitos de potássio foram descobertos, e na década de 1960 o Canadá se tornou o produtor dominante.
A produção comercial

Os sais de potássio tais como carnalite, langbeinite, polyhalite, e extensos depósitos de formulário silvinita na antiga lago e fundos marinhos, fazendo a extracção de sais de potássio nestes ambientes comercialmente viáveis. A principal fonte de potássio - potássio - é extraído em Canadá , Rússia , Bielorrússia , Alemanha , Israel , Estados Unidos , Jordânia e em outros lugares ao redor do mundo. Os depósitos primeiro minadas foram localizados perto Staßfurt, Alemanha, mas os depósitos vão desde a Grã-Bretanha sobre a Alemanha para a Polónia. Eles estão localizados na Zechstein e foram depositados no meio eo final do Permiano . Os maiores depósitos já encontrado mentira 1.000 metros (3.000 pés) abaixo da superfície da província canadense de Saskatchewan. Os depósitos estão localizados no Elk Point Grupo produzido no Devoniano Médio . Saskatchewan, onde várias minas grandes têm operado desde os anos 1960, foi pioneiro no uso de congelamento de areias molhadas (a formação Blairmore), a fim de conduzir poços de minas através deles. A principal empresa de mineração de potassa em Saskatchewan é a Potash Corporation of Saskatchewan. A água do Mar Morto é usado por Israel e Jordânia como fonte de potássio, enquanto que a concentração nos oceanos normais é demasiado baixo para a produção comercial a preços correntes.

Vários métodos são aplicados para separar os sais de potássio dos presentes compostos de sódio e de magnésio. O método mais utilizado é a precipitar alguns compostos que dependem da diferença de solubilidade dos sais em diferentes temperaturas. Separação electrostática da mistura de sal de solo também é utilizado em algumas minas. Os resíduos de sódio e magnésio resultante ou é armazenada no subsolo ou empilhados em escombreiras. A maioria dos minerais de potássio minadas acabar como cloreto de potássio após o processamento. A indústria mineral refere-se ao cloreto de potássio ou cloreto de potássio, cloreto de potássio, ou simplesmente MOP.
De metal de potássio puro pode ser isolado por meio de electrólise do seu hidróxido em um processo que pouco mudou desde Davy . Embora o processo de electrólise foi desenvolvido e utilizado em escala industrial, em 1920 o método térmico por reacção de sódio com cloreto de potássio em uma reacção de equilíbrio químico tornou-se o método dominante na década de 1950. A produção de ligas de sódio-potássio é possível alterando o tempo de reacção e a quantidade de sódio utilizado na reacção. O processo Griesheimer empregando a reacção de com fluoreto de potássio carboneto de cálcio também foi usada para produzir potássio.
- Na + KCl → NaCl + K (método térmica)
- 2 KF + CaC 2 → 2K + CaF 2 + 2 C (processo Griesheimer)
Custo de metal de potássio de grau reagente sobre $ 10,00 / libra (US $ 22 / kg ) em 2010, quando comprado em quantidades tonelada. Menor pureza do metal é consideravelmente mais barato. O mercado é volátil devido à dificuldade de o armazenamento a longo prazo do metal. Ele deve ser armazenado sob uma seco atmosfera de gás inerte ou anidro óleo mineral para evitar a formação de uma camada superficial de superóxido de potássio. Esta é uma superóxido sensível à pressão explosivo que irá detonar quando riscado. A explosão resultante normalmente irá iniciar um incêndio que é difícil de se extinguir.
Papel biológico
Função bioquímica

O potássio é o elemento mais comum VIII ou IX por massa (0,2%) no corpo humano, de modo que um adulto 60 kg contém um total de cerca de 120 g de potássio. O corpo tem aproximadamente tanto de potássio como enxofre e cloro, e apenas o principal minerais cálcio e fósforo são mais abundantes.
Potássio catiões são importantes em neurónio ( cérebro e a função do nervo), e em influenciar o equilíbrio osmótico entre as células e o fluido intersticial, com a sua distribuição mediada em todos os animais (mas não em todas as plantas) pela chamada Na + / K + -ATPase bomba. Este bomba de iões utiliza ATP para bombear três iões de sódio para fora da célula e dois iões potássio para dentro da célula, criando assim um gradiente electroquímico através da membrana celular. Além disso, o altamente selectiva canais iônicos de potássio (que são tetrâmeros) são cruciais para o hiperpolarização, por exemplo, em neurônios, depois de um potencial de ação é acionado. O canal de íons de potássio mais recentemente resolvido é KirBac3.1, o que dá um total de cinco canais de íons de potássio (KCSA, KirBac1.1, KirBac3.1, KvAP, e MthK) com uma estrutura determinada. Todos os cinco são de espécies procariotas.
O potássio pode ser detectado pelo gosto porque provoca três dos cinco tipos de sabores, de acordo com a concentração. As soluções diluídas de iões de potássio sabor doce, permitindo que concentrações moderadas de leite e sumos, enquanto que as concentrações mais elevadas tornam-se cada vez mais amargo / alcalino, e finalmente também para o sabor salgado. A amargura combinada e salinidade de soluções de alto potássio faz com que a suplementação de altas doses de potássio por bebidas líquidas um desafio palatabilidade.
Membrana polarização
O potássio também é importante na prevenção contracção do músculo e o envio de impulsos nervosos em todos os animais por meio de potenciais de acção . Por natureza da sua electrostática e propriedades químicas, os iões K + são maiores do que os iões de Na + e canais de iões e bombas nas membranas celulares podem distinguir entre os dois tipos de iões, que permite bombear activamente ou um dos dois iões de passar passivamente, enquanto bloqueando o outro.
A falta de potássio nos fluidos corporais pode causar uma condição potencialmente fatal conhecido como hipocalemia, tipicamente resultante de vômito, diarréia e / ou aumento da diurese. Os sintomas de deficiência incluem fraqueza muscular, íleo paralítico, alterações eletrocardiográficas, diminuição da resposta reflexa e, em casos graves de paralisia respiratória, alcalose e arritmia cardíaca.
A filtração e a excreção
O potássio é um elemento essencial macromineral na alimentação humana; é o principal catião (ião positivo) dentro de células de animais, e é, portanto, importante na manutenção de fluidos e equilíbrio de eletrólitos no corpo. Sódio torna-se a maior parte dos cátions de plasma sanguíneo numa gama de referência de cerca de 145 mmol / L (3,345 g) (1 mmol / L = 1mEq / L), e potássio torna-se a maior parte do células catiões de fluido a cerca de 150 mmol / L (4,8 g). O plasma é filtrado através do glomérulos dos rins em enormes quantidades, cerca de 180 litros por dia. Assim, 602 g de sódio e 33 g de potássio são filtrados cada dia. Todos mas a 1-10 g de sódio e a 1-4 g de potássio susceptível de ser na dieta tem de ser reabsorvido. De sódio deve ser reabsorvida de forma a manter o volume de sangue exactamente à direita e a pressão osmótica correcta; de potássio deve ser reabsorvida de forma a manter a concentração no soro tão próximo quanto possível para 4,8 mmol / L (cerca de 0,190 g / L). Bombas de sódio nos rins devem sempre operar para conservar sódio. O potássio tem de ser conservada, por vezes, também, mas, como a quantidade de potássio no plasma sanguíneo é muito pequeno e a piscina de potássio nas células é de cerca de trinta vezes tão grande, a situação não é tão crítico para o potássio. Uma vez que o potássio é movida passivamente, em contra fluxo ao sódio em resposta a uma aparente (mas não real) Equilíbrio de Donnan, a urina nunca pode afundar abaixo da concentração de potássio no soro, excepto por vezes excretando activamente água no final do processamento. O potássio é secretado duas vezes e reabsorvido três vezes antes de urina atinge os túbulos coletores. Nesse ponto, ele geralmente tem aproximadamente a mesma concentração de potássio como plasma. No final do tratamento, o potássio é segregada mais uma vez, se os níveis séricos são demasiado elevados.
Se de potássio foram retirados da dieta, se-á um mínimo obrigatório excreção renal de cerca de 200 mg por dia em que o soro diminui a 3,0-3,5 mmol / L em cerca de uma semana, e nunca pode ser cortado completamente, resultando em hipocalemia e até mesmo a morte.
O potássio move de forma passiva através de poros na membrana celular. Quando os iões de se mover através de bombas há um portão nas bombas de ambos os lados da membrana celular e só uma porta pode ser aberta de uma só vez. Como um resultado, cerca de 100 iões são forçados através por segundo. Poros têm apenas um portão, e há apenas um tipo de íon pode transmitir através de, em 10 a 100 milhões de íons por segundo. Os poros necessitam de cálcio, a fim de abrir embora se pense que o cálcio funciona em sentido inverso através do bloqueio, pelo menos, um dos poros. Os grupos carbonilo no interior do poro em aminoácidos imitar a hidratação da água que tem lugar em solução aquosa pela natureza das cargas electrostáticas em quatro grupos carbonilo no interior do poro.
Na dieta
A ingestão adequada
A ingestão de potássio suficiente para suportar a vida em geral pode ser garantida por comer uma variedade de alimentos. Casos claros de deficiência de potássio (como definido pelos sintomas, sinais e um nível de sangue abaixo do normal do elemento) são raros em indivíduos saudáveis. Os alimentos ricos em potássio incluem salsa , secos damascos , leite em pó, chocolates , várias nozes (especialmente amêndoas e pistachios), batatas , brotos de bambu, bananas , abacates , feijões de soja e farelo , embora também está presente em quantidades suficientes na maioria das frutas, legumes, carne e peixe.
Ingestão ideal
Estudos epidemiológicos e em estudos em animais sujeitos a hipertensão indicam que dietas ricas em potássio pode reduzir o risco de hipertensão e, possivelmente, acidente vascular cerebral (por um mecanismo independente da pressão sanguínea ), e uma deficiência de potássio combinados com um inadequada tiamina ingestão produziu doença cardíaca em ratos . Há algum debate sobre a quantidade ideal de potássio na dieta. Por exemplo, as orientações do 2004 Instituto de Medicina especificar um DRI de 4.000 mg de potássio (100 mEq), embora a maioria dos americanos consomem apenas metade desse montante por dia, que iria fazê-los formalmente deficiente no que se refere a presente recomendação particular. Da mesma forma, na União Europeia , em particular na Alemanha e Itália , ingestão insuficiente de potássio é um pouco comum. Pesquisadores italianos relataram em um 2011 meta-análise de que uma ingestão mais elevada de 1,64 g por dia de potássio foi associada com um risco 21% inferior de acidente vascular cerebral.
Suplementação médica e doença
Os suplementos de potássio em medicina são os mais amplamente utilizados em conjunção com diuréticos de alça e tiazidas, classes de diuréticos que livrar o corpo de sódio e água, mas têm o efeito secundário de também causar a perda de potássio na urina. Uma variedade de suplementos médicos e não-médicos estão disponíveis. Os sais de potássio, tais como cloreto de potássio pode ser dissolvido em água, mas o sabor salgado / amargo de elevadas concentrações de ião potássio tornar alta concentração suplementos líquidos palatáveis difícil de formular. Doses suplementares médicos típicos variam de 10 mmol (400 mg, aproximadamente igual a um copo de leite ou US 6 fl oz (180 ml). De sumo de laranja) e 20 mmol (800 mg) por dose. Os sais de potássio são também disponíveis na forma de comprimidos ou cápsulas, que para fins terapêuticos são formulados para permitir a lixiviação de potássio lentamente para fora de uma matriz, como muito elevadas concentrações de ião potássio (que pode ocorrer ao lado de uma pastilha sólida de cloreto de potássio) pode matar o tecido , e causar lesões na mucosa gástrica ou intestinal. Por esta razão, não sujeitos a receita pílulas suplemento de potássio são limitadas por lei em os EUA para apenas 99 mg de potássio.
Indivíduos que sofrem de renais doenças podem sofrer efeitos adversos para a saúde de consumir grandes quantidades de potássio na dieta. Pacientes terminais, com insuficiência renal submetidos à terapia por diálise renal devem observar limites estritos da dieta sobre o consumo de potássio, como a excreção de potássio controle rins e acúmulo de concentrações sanguíneas de potássio ( hipercalemia) pode provocar arritmias cardíacas fatais.
Aplicações
Fertilizante

Íons de potássio são um componente essencial da planta de nutrição e são encontrados na maioria dos solos tipos. Eles são utilizados como um fertilizante em agricultura , horticultura, e cultura hidropónica, sob a forma de cloreto de (KCl), sulfato de (K 2 SO 4), ou nitrato de (KNO 3). Os fertilizantes agrícolas consumir 95% da produção mundial de potássio química, e cerca de 90% deste potássio é fornecida na forma de KCl. O teor de potássio da maioria das plantas variam de 0,5% a 2% do peso das culturas colhidas, convencionalmente expressa como a quantidade de K2O. Alto moderno agricultura rendimento depende de fertilizantes para substituir o potássio perdido na colheita. A maioria dos fertilizantes agrícolas conter cloreto de potássio, sulfato de potássio, enquanto é utilizado para culturas sensíveis a cloreto ou culturas que necessitam de maior teor de enxofre. O sulfato é produzido principalmente por decomposição dos sais minerais complexos cainite (MgSO4 · · KCl 3H 2 O) e langbeinite (MgSO4 · K 2 SO 4). Somente alguns poucos fertilizantes contêm nitrato de potássio. Em 2005, cerca de 93% da produção de potássio mundo era consumido pela indústria de fertilizantes.
Comida
O cátion potássio é um nutriente necessário para a vida humana e da saúde. O cloreto de potássio é utilizado como um substituto para o o sal de mesa por aqueles que procuram para reduzir a ingestão de sódio, de modo a controlar a hipertensão . O Listas do USDA pasta de tomate, suco de laranja, folhas de beterraba , feijão branco, batatas , bananas e muitas outras boas fontes alimentares de potássio, classificados em ordem decrescente de acordo com o teor de potássio.
Tartarato de sódio e potássio (KNAC 4 H 4 O 6, Sal de Rochelle) é o principal constituinte do fermento em pó; é também utilizado no prateando de espelhos. Bromato de potássio (KBrO 3) é um oxidante forte (E924), utilizado para melhorar a força e massa subir altura. Bissulfito de potássio (KHSO 3) é utilizada como um conservante de alimentos, por exemplo no vinho e cerveja -Tornando (mas não em carnes). É também usado para têxteis branqueamento e palha, e no curtimento de couros.
Industrial
Os principais produtos químicos são de potássio hidróxido de potássio, carbonato de potássio, sulfato de potássio, e cloreto de potássio. Megatons de estes compostos são produzidos anualmente.
O hidróxido de potássio KOH é uma base forte, que é usado na indústria para neutralizar fortes e fracos ácidos , para controle pH e de potássio para a fabricação de sais . É também usado para saponificar gorduras e óleos, em produtos de limpeza industriais, e em reacções de hidrólise, por exemplo de ésteres.
O nitrato de potássio (KNO3) ou salitre é obtido a partir de fontes naturais, tais como guano e evaporites ou fabricado através da Processo Haber; é o oxidante em pólvora ( pó preto ) e um importante fertilizante agrícola. Cianeto de potássio (KCN) é utilizada industrialmente para dissolver o cobre e metais preciosos, em particular de prata e de ouro , por formando complexos. Suas aplicações incluem mineração de ouro, galvanoplastia, e electroforming destes metais ; é também utilizado em síntese orgânica para fazer nitrilos. Carbonato de potássio (K 2 CO 3 ou potássio) é utilizado na fabricação de vidro, sabão, tubos de televisão a cores, lâmpadas fluorescentes, corantes têxteis e pigmentos. O permanganato de potássio (KMnO4) é um oxidante, de branqueamento e purificação substância e é usado para a produção de sacarina. Clorato de potássio (KClO 3) é adicionado à partidas e explosivos. Brometo de potássio (KBr) foi anteriormente utilizada como um sedativo e em fotografia.
Cromato de potássio (K 2 CrO 4) é usado em tintas, corantes, (manchas de cor amarelada-vermelho brilhante); em explosivos e fogos de artifício; no curtimento de couro, em papel e voar fósforos de segurança, mas todas essas utilizações são devidos às propriedades de contenção ião cromato, em vez de iões de potássio.
Nicho usos
Compostos de potássio são tão difundida que milhares de pequenos usos estão no lugar. O superóxido KO 2 é um sólido cor de laranja, que actua como uma fonte portátil de oxigénio e um absorvente de dióxido de carbono. É amplamente utilizada em sistemas de respiração em minas, submarinos e naves espaciais, uma vez que leva menos volume do que o oxigênio gasoso.
- 4 KO 2 + 2 CO 2 → 2 K 2 CO 3 + 3 O2
Cobaltinitrite potássio K 3 [Co (NO 2) 6] é utilizado como pigmento de artista sob o nome de Aureolin ou Cobalt amarelo.
Utilizações laboratoriais
Um ligas de sódio e de potássio, NaK é um líquido usado como um meio de transferência de calor e um dessecante para a produção solventes secos e sem ar. Ele também pode ser usado em destilação reactiva. A liga ternária de 12% de Na, 47% K e 41% de CS tem o ponto de fusão mais baixo de -78 ° C de qualquer composto metálico.
Potássio metálico é usado em vários tipos de magnetômetros.
Precauções
Potássio reage muito violentamente com a produção de água hidróxido de potássio (KOH) e hidrogénio gás.
- K 2 (s) + 2H 2 O (l) → 2 KOH (aq) + H 2 ↑ (g)
Esta reacção é exotérmica e libera calor suficiente para inflamar o hidrogênio resultante. É por sua vez podem explodir na presença de oxigénio. O hidróxido de potássio é um forte alcalino que causa queimaduras na pele. Finamente dividido potássio vai inflamar em ar à temperatura ambiente. O metal a granel vai inflamar no ar se aquecido. Devido sua densidade é de 0,89 g / cm3, de potássio queima flutua na água que expõe ao oxigénio atmosférico. Muitos agentes de extinção de incêndio comum, incluindo a água, ou são ineficazes ou fazer uma fogueira de potássio pior. nitrogênio , argônio , cloreto de sódio (sal de mesa), carbonato de sódio (cinza de soda), e dióxido de silício (areia) são eficazes se eles são secos. Alguns Classe D extintores de pó químico seco projetado para incêndios com metal também são eficazes. Estes agentes privar o fogo de oxigênio e resfriar o metal de potássio.
Potássio reage violentamente com halogéneos e detonará na presença de bromo . É também reage explosivamente com ácido sulfúrico . Durante a combustão de potássio forma peróxidos e superóxidos. Estes peróxidos pode reagir violentamente com compostos orgânicos tais como óleos. Ambos os peróxidos e superóxidos pode reagir explosivamente com potássio metálico.
Como o potássio reage com o vapor de água presente no ar, que é normalmente armazenado sob óleo mineral anidro ou querosene. Ao contrário de lítio e de sódio, no entanto, de potássio não deve ser armazenado sob óleo durante mais de 6 meses, a menos numa atmosfera (oxigénio livre) inerte ou sob vácuo. Após o armazenamento prolongado em ar peróxidos sensível ao choque perigosas pode formar sobre o metal e por baixo da tampa do recipiente, e podem detonar em cima da abertura.
Devido à natureza altamente reativo de potássio metálico, deve ser tratado com muito cuidado, com pele integral e proteção para os olhos e, de preferência uma barreira resistente à explosão entre o usuário eo metal. A ingestão de grandes quantidades de compostos de potássio pode levar a hipercalemia influenciar fortemente o sistema cardiovascular. O cloreto de potássio é utilizado no Estados Unidos para execuções através injeção letal.

