
Cálcio
Fundo para as escolas Wikipédia
Esta seleção Escolas foi originalmente escolhido pelo SOS Children para as escolas no mundo em desenvolvimento sem acesso à internet. Ele está disponível como um download intranet. Todas as crianças disponíveis para apadrinhamento de crianças de Crianças SOS são cuidadas em uma casa de família pela caridade. Leia mais ...
| Cálcio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
20 Ca | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
maçante cinza, prata  Linhas espectrais de cálcio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | cálcio, Ca, 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / k æ l s Eu ə m / KAL -veja-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria Metallic | metal alcalino-terroso | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | (2) de metais alcalino-terrosos , 4, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 40,078 (4) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Ar ] 4s 2 2, 8, 8, 2 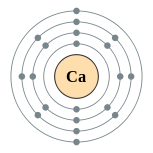 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 1,55 g cm -3 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 1.378 g cm -3 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1,115 K , 842 ° C, 1548 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 1757 K, 1484 ° C, 2703 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 8,54 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 154,7 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 25,929 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 2, uma (Fortemente óxido de base) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,00 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 589,8 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2: 1145,4 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 4912,4 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 197 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 176 ± 22:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 231 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbica de face centrada  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 33,6 Nco · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 201 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 22,3 pM · · K -1 m -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 3810 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | 20 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 7,4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | 17 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0.31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 1.75 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 167 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-70-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de cálcio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O cálcio é o elemento químico com símbolo do Ca e número atômico 20. O cálcio é um suave cinzento metal alcalino-terroso , e é a elemento quinto mais abundante em massa na Terra 's crosta . O cálcio também é o quinto mais abundante-ion dissolvido em água do mar por ambos molaridade e massa, depois de sódio , cloreto, magnésio , e sulfato .
O cálcio é essencial para a vida de organismos , em particular em células fisiologia, onde o movimento do cálcio ião Ca2 + para dentro e para fora do funções citoplasma como um sinal para muitos processos celulares. Como um dos principais materiais utilizados na mineralização de osso, dentes e conchas, o cálcio é o mais abundante de metal em massa em muitos animais .
Características notáveis

Em termos químicos, o cálcio é reactivo e macio para um metal (embora mais difícil do que o chumbo, que pode ser cortado com uma faca com dificuldade). É um elemento metálico prateado que deve ser extraído por electrólise a partir de um fundido de sal como o cloreto de cálcio . Uma vez produzido, que rapidamente forma um cinzento-branca e óxido de revestimento de nitreto quando exposta ao ar. A granel (tipicamente como batatas fritas ou "voltas"), o metal é um pouco difícil de inflamar, mais ainda do que os chips de magnésio; mas, quando aceso, o metal queima no ar com uma luz laranja-vermelho brilhante de alta intensidade. Cálcio metal reage com a água , gerando hidrogénio gasoso a uma velocidade suficientemente rápida para ser notada, mas não é suficientemente rápida a temperatura ambiente para gerar a quantidade de calor, tornando-o útil para a geração de hidrogénio. Na forma de pó, no entanto, a reacção com água é extremamente rápida, como o aumento da área de superfície do pó acelera a reacção com a água. Parte da lentidão dos resultados da reação de cálcio em água do metal a ser parcialmente protegido por branco insolúvel hidróxido de cálcio. Em soluções aquosas de ácidos, onde este sal é solúvel, cálcio reage vigorosamente.
O cálcio, com uma densidade de 1,55 g / cm3, é o mais leve dos metais alcalino-terrosos; magnésio ( gravidade específica 1,74) e berílio (1,84) são mais densa, embora mais leves em massa atômica. A partir de estrôncio em diante, os metais alcalino-terrosos tornar-se mais densa com o aumento da massa atómica.
Tem duas formas alotrópicas .
O cálcio tem uma resistividade eléctrica mais elevada do que o cobre ou de alumínio , mas de peso-para-peso, devido à sua densidade muito mais baixa, que é um condutor muito melhor do que qualquer um. No entanto, a sua utilização em aplicações terrestres é geralmente limitada pela sua alta reatividade com o ar.
Os sais de cálcio são incolores a partir de qualquer contribuição do cálcio, e soluções iónicas de cálcio (Ca2 +) são incolores bem. Tal como acontece com magnésio e sais de outros sais de metais alcalino-terrosos, sais de cálcio são frequentemente bastante solúvel em água. As exceções notáveis incluem o hidróxido, o sulfato de (incomum para os sais de sulfato), o carbonato e o fosfatos. Com a excepção do sulfato, mesmo os insolúveis enumerados são em geral mais solúveis do que os seus metais de transição homólogos. Quando em solução, o íon cálcio ao gosto humano varia notavelmente, sendo classificado como levemente salgado, azedo, "mineral como" ou mesmo "calmante". É evidente que muitos animais podem provar, ou desenvolver um gosto, para o cálcio, e usar este sentido de detectar o mineral salinas ou outras fontes. Em alimentação humana, sais de cálcio solúveis podem ser adicionados a sumos tart sem grande efeito ao paladar média.
O cálcio é o quinto elemento mais abundante em massa no corpo humano, onde é um mensageiro iónico celular comum com muitas funções, e serve também como um elemento estrutural no osso. É o cálcio relativamente elevado número atómico-no esqueleto ósseo que provoca a ser rádio-opaca. De componentes sólidos do corpo humano após secagem e queima de materiais orgânicos (como por exemplo, depois cremação), cerca de um terço da massa total "mineral" restante, é a aproximadamente um quilograma de cálcio que compõe o esqueleto médio (sendo o restante principalmente fósforo e oxigênio).
Linhas H e K
Espectros visível de muitas estrelas, incluindo a Sun , exibem forte linhas de absorção de cálcio isoladamente ionizado. Entre estes são o H-line em 3.968,5 Å ea linha K em 3.933,7 Å de cálcio isoladamente ionizado, ou Ca II. Para o Sol e as estrelas com baixas temperaturas, o destaque das linhas H e K pode ser uma indicação de forte atividade magnética na cromosfera. Medição das variações periódicas destas regiões activas também podem ser utilizados para deduzir os períodos de rotação destas estrelas.
Compostos
O cálcio, combinado com fosfato para formar hidroxilapatite, é a porção de mineral dos ossos e dos dentes humanos e animais. A porção de algum mineral corais também pode ser transformado em hidroxilapatite.
O hidróxido de cálcio (cal apagada) é usado em muitos processos de refinaria química e é feita por aquecimento calcário a temperatura elevada (acima de 825 ° C) e, em seguida, adicionando cuidadosamente água a ele. Quando cal é misturada com areia, que endurece em um argamassa e é transformado em gesso por dióxido de carbono captação. Mistura com outros compostos, cal constitui uma parte importante da Cimento Portland.
O carbonato de cálcio (CaCO3) é um dos compostos comuns de cálcio. Ela é aquecida para formar cal viva (CaO), o qual é, em seguida, adicionada a água (H2O). Isto forma um outro material conhecido como cal apagada (Ca (OH) 2), que é um material barato base utilizada em toda a indústria química. Giz, mármore, calcário e são todas as formas de carbonato de cálcio.
Quando a água se infiltra através calcário ou outros solúveis de carbonato de rochas, dissolve-se parcialmente a rocha e provoca a formação de caverna e característica estalactites e estalagmites e também formas água dura. Outros compostos importantes de cálcio são nitrato de cálcio, sulfureto de cálcio, cloreto de cálcio , carboneto de cálcio, cianamida de cálcio e o hipoclorito de cálcio.
Alguns compostos de cálcio no estado de oxidação 1, também têm sido recentemente investigados.
Isótopos
O cálcio tem quatro estáveis isótopos (40 Ca, 42 CA, 43 de Ca e 44 Ca), além de mais dois isótopos (46 Ca e 48 Ca) que têm tais longa semi-vidas que para todos os efeitos práticos, também pode ser considerada estável. A gama de 20% em massa relativo entre isótopos de cálcio que ocorrem naturalmente é maior do que para qualquer elemento excepto hidrogénio e hélio. O cálcio também tem um isótopo cosmogênico, 41 Ca radioactivos, que tem uma semi-vida de 103 mil anos. Ao contrário cosmogênicos isótopos que são produzidos na atmosfera , Ca 41 é produzido por neutrões de activação de 40 Ca. A maior parte de sua produção é no medidor superior ou assim da coluna de solo, onde o fluxo de nêutrons cosmogênico ainda é suficientemente forte. 41 Ca tem recebido muita atenção em estudos estelares porque ele decai para 41 K, um indicador crítico de anomalias do sistema solar, .
Noventa e sete por cento de cálcio de ocorrência natural está na forma de 40 cerca de 40 Ca é um dos produtos de filha de 40 K de decaimento, juntamente com 40 Ar. Enquanto K-Ar namoro tem sido amplamente utilizado nas geológicos ciências, a prevalência de 40 Ca na natureza tem impedido sua utilização em namoro. Técnicas usando a espectrometria de massa e uma diluição duplo pico de isótopos têm sido usados para K -Ca idade namoro.
O isótopo mais abundante, 40 Ca, tem um núcleo de 20 prótons e 20 nêutrons . Este é o mais pesado isótopo estável de qualquer elemento que tem o mesmo número de prótons e nêutrons. Em supernovas, o cálcio é formado a partir da reacção do carbono com vários números de partículas alfa (núcleos de hélio), até que o isótopo mais comum de cálcio (contendo 10 núcleos de hélio) foi sintetizado.
Isotope fraccionamento
Tal como acontece com os isótopos de outros elementos, uma variedade de processos de fraccionar, ou alterar a abundância relativa de, isótopos de cálcio. O melhor estudado destes processos é dependente da massa fraccionamento de isótopos de cálcio que acompanha a precipitação de minerais de cálcio, tais como a calcite , aragonita e apatite, a partir da solução. Isotopicamente leve de cálcio é preferencialmente incorporada minerais, deixando a solução a partir da qual o mineral precipitado enriquecido isotopicamente pesado em cálcio. À temperatura ambiente a magnitude desse fracionamento é de aproximadamente 0,25 ‰ (0,025%) por unidade de massa atômica (AMU). Diferenças dependentes da massa na composição isotópica de cálcio convencionalmente são expressos a relação de dois isótopos (geralmente 44 Ca / 40 Ca) numa amostra em comparação com a mesma proporção de um material de referência padrão. 44 Ca / Ca 40 varia de cerca de 1% entre comum materiais de terras.
Cálcio fraccionamento isotópico durante a formação mineral levou a várias aplicações de isótopos de cálcio. Em particular, a observação de 1997, por Skulan e DePaolo que os minerais cálcio são isotopicamente leve do que as soluções a partir dos quais os minerais precipitado é a base de aplicações análogas em medicina e em paleooceanography. Em animais com esqueletos mineralizadas com cálcio do cálcio composição isotópica de tecidos moles reflecte a taxa relativa da formação e dissolução do mineral esquelético. Nos seres humanos alterações no cálcio composição isotópica de urina ter sido mostrado estar relacionada com alterações no equilíbrio mineral óssea. Quando a taxa de formação do osso excede a taxa de reabsorção do osso, do tecido mole 44 Ca / Ca 40 sobe. Tecidos moles 44 Ca / 40 Ca cai quando a reabsorção óssea excede a formação óssea. Devido a esta relação, medições isotópicas de cálcio na urina ou no sangue pode ser útil na detecção precoce de doenças ósseas metabólicas, como osteoporose.
Um sistema semelhante existe no oceano, onde a água do mar 44 Ca / 40 Ca tende a subir quando a taxa de remoção de Ca 2+ da água do mar por precipitação mineral excede a entrada de novos cálcio para o oceano, e cair quando a entrada de cálcio excede a precipitação mineral . Segue-se que o aumento de 44 Ca / 40 Ca corresponde a queda de água do mar concentração de Ca2 +, e caindo 44 Ca / 40 Ca corresponde ao aumento Ca 2+ de água do mar. Em 1997 Skulan e DePaolo apresentou a primeira evidência de mudança na água do mar 44 Ca / 40 Ca ao longo do tempo geológico, juntamente com uma explicação teórica dessas mudanças. Documentos mais recentes confirmaram esta observação, demonstrando que o Ca 2+ concentração de água do mar não é constante, e que o oceano é provavelmente nunca em "estado estável" no que diz respeito à sua entrada e saída de cálcio. Isto tem implicações climatológicas importantes, como o ciclo de cálcio marinho está intimamente ligada à ciclo de carbono (ver abaixo).
Ciclagem geoquímica
O cálcio fornece uma ligação importante entre tectônica, climática e do ciclo do carbono. Em termos mais simples, elevação de montanhas expõe Ca-rolamento rochas ao intemperismo químico e libera Ca2 + nas águas de superfície. Esta Ca 2+ eventualmente é transportada para o mar, onde ele reage com o CO 2 dissolvido para formar calcário. Alguns deste calcário liquida para o fundo do mar onde é incorporado em novas rochas. CO2 dissolvido, juntamente com carbonato e iões de bicarbonato, são referidos como carbono inorgânico dissolvido (DIC).

A reacção real é mais complicado e envolve o ião de bicarbonato (HCO 3 -) que se forma quando o CO2 reage com a água na água do mar pH:
- Ca 2+ + HCO 2 -
3 → CaCO3 (pedra calcária) + CO2 + H2O
Note-se que o pH no oceano a maior parte do CO 2 produzido nesta reacção é imediatamente convertido novamente em HCO -
3. Os resultados da reacção em um transporte líquido de uma molécula de CO 2 a partir do oceano / atmosfera na litosfera.
O resultado é que cada Ca 2+ liberado pelo intemperismo químico, em última análise remove uma molécula de CO 2 a partir do sistema surficial (atmosfera, oceano, solos e organismos vivos), armazenando-o em rochas carbonáticas onde é provável que fique para centenas de milhões de anos. O intemperismo de cálcio de rochas, assim, esfrega CO 2 do oceano e atmosfera, exercendo um forte efeito de longo prazo sobre o clima. Análogas que envolvam ciclos de magnésio, e, em muito menor extensão de estrôncio e de bário, tem o mesmo efeito.
Como o desgaste de calcário (CaCO3) liberta quantidades equimolares de Ca 2+ e CO 2, não tem nenhum efeito líquido sobre o teor de CO 2 da atmosfera e do oceano. O intemperismo de rochas de silicato como granito , por outro lado, é um líquido de CO 2 pia porque produz Ca 2+ abundante, mas muito pouco CO2.
História
Lime como material de construção foi utilizada desde tempos pré-históricos indo tão longe para trás como 7000-14000 BC. O primeiro datada forno de cal remonta a 2500 aC e foi encontrado em Khafajah mesopotâmia . Cálcio (do latim calx, Calcis genitivo, que significa "cal") era conhecido tão cedo quanto o primeiro século, quando os romanos antigos preparado como cal óxido de cálcio. Literatura que remonta a 975 dC notas que gesso de Paris (sulfato de cálcio), é útil para definir ossos quebrados. Ele não foi isolado até 1808 na Inglaterra , quando Sir Humphry Davy eletrolisada uma mistura de cal e óxido de mercúrio. Davy estava tentando isolar cálcio; quando soube que o químico sueco Jöns Jakob Berzelius e Pontin preparado amálgama de cálcio por electrólise de cal em mercúrio, ele tentou fazê-lo ele mesmo. Ele trabalhou com eletrólise ao longo de sua vida e também descobriu / isolado de sódio , potássio , magnésio , boro e bário . O cálcio-metal não estava disponível em larga escala até o início do século 20.
Ocorrência
O cálcio não é naturalmente encontrado no seu estado elementar. O cálcio ocorre mais comumente em rochas sedimentares na minerais calcita , dolomita e gesso . Também ocorre em ígneas e metamórficas principalmente no silicatos minerais: plagioclásios, anfibólios, piroxênios e granadas.
Aplicações
O cálcio é usado
- como uma agente redutor na extracção de outros metais, tais como urânio , zircónio e tório .
- como um desoxidante, desulfurizer, ou decarbonizer para vários ferrosos e não ferrosos ligas.
- como um agente de liga usados na produção de alumínio , berílio , cobre , chumbo , e magnésio ligas.
- na tomada de cimentos e argamassas para ser utilizado em construção.
- no fabrico de queijo , onde o cálcio iões de influenciar a actividade de renina em trazer sobre o coagulação do leite.
Compostos de cálcio
- O carbonato de cálcio (CaCO3) é utilizado na fabricação cimento e argamassa, Lima, calcário (normalmente usado na indústria siderúrgica) e auxilia na produção na indústria do vidro. Ele também tem utilizações químicos e ópticos como minerais em espécimes pastas de dentes, por exemplo.
- Solução de hidróxido de cálcio (Ca (OH) 2) (também conhecido como água de cal) é usado para detectar a presença de dióxido de carbono ao ser feito borbulhar através de uma solução. Acontece nublado onde CO 2 está presente.
- Arseniato de cálcio (Ca 3 (ASO 4) 2) é utilizado em insecticidas.
- O carboneto de cálcio (CaC 2) é usado para fazer acetileno gás (para uso em acetileno tochas para soldagem ) e na fabricação de plásticos .
- O cloreto de cálcio (CaCl2) é usado em gelo e remoção controle de poeira em estradas de terra, no condicionador para concreto, como um aditivo em conservas tomates, e para fornecer corpo para automóvel pneus.
- Ciclamato de cálcio (Ca (C 6 H 11 NHSO 3) 2) foi usado como um agente edulcorante, mas já não está autorizado para utilização por causa da suspeita de propriedades causadoras de cancro.
- Gluconato de cálcio (Ca (C 6 H 11 O 7) 2) é utilizado como um aditivo alimentar e em vitamina pílulas.
- O hipoclorito de cálcio (Ca (OCl) 2) é utilizado como um piscina desinfectante, como um agente de branqueamento, como um ingrediente em desodorizante, e em algicida e fungicida.
- Permanganato de cálcio (Ca (MnO 4) 2) é usado em foguete de combustível líquido, têxtil produção, como um agente de esterilização da água e em procedimentos dentários.
- O fosfato de cálcio (Ca 3 (PO 4 2)) é usado como um suplemento para animais de alimentação, fertilizante , na produção comercial de de massa e levedura produtos, no fabrico de vidro , e em produtos dentários.
- Fosforeto de cálcio (Ca 3 2 P) é utilizado em fogos de artifício, rodenticida, torpedos e flares.
- Estearato de cálcio (Ca (C 18 H 35 O 2) 2) é utilizado no fabrico de cera lápis de cor, cimentos, certos tipos de plásticos e cosméticos, como um aditivo alimentar, na produção de materiais resistentes à água e na produção de tintas.
- O sulfato de cálcio (CaSO4 · 2H 2 O) é usado como giz comum, bem como, na sua forma hemi-hidrato mais conhecido como gesso de Paris.
- Tungstato de cálcio (CaWO 4) é usado em luminosa tintas, lâmpadas fluorescentes e em Estudos de raios-X.
- Hidroxilapatite (Ca 5 (PO 4) 3 (OH), mas é normalmente escrito Ca 10 (PO 4) 6 (OH) 2) faz-se setenta por cento de osso. Também carbonatada de cálcio hidroxiapatita deficiente é o principal mineral do qual o esmalte dental e dentina são compostas.
Nutrição
| Idade | Cálcio (mg / dia) |
|---|---|
| 0-6 meses | 200 |
| 7-12 meses | 260 |
| 13 anos | 700 |
| 4-8 anos | 1000 |
| 9-18 anos | 1300 |
| 19-50 anos | 1000 |
| 51-70 anos (sexo masculino) | 1000 |
| 51-70 anos (feminino) | 1200 |
| 71+ anos | 1200 |
O cálcio é um componente importante de uma dieta saudável e um mineral necessário para a vida. O Fundação Nacional de Osteoporose diz, "O cálcio desempenha um papel importante na construção de fortes ossos mais densos, cedo na vida e manter os ossos fortes e saudáveis mais tarde na vida." Aproximadamente 99 por cento do cálcio do corpo está armazenado nos ossos e dentes. O resto do cálcio no organismo tem outras utilizações importantes, tais como alguns exocitose, especialmente a libertação de neurotransmissores , e contracção do músculo. No sistema de condução eléctrica do coração, de cálcio substitui o sódio como o mineral que despolariza a célula, proliferação do potencial de acção. Em músculo cardíaco, influxo de sódio começa um potencial de acção, mas durante a exalação de potássio, a miócitos cardíacos experimenta o influxo de cálcio, prolongar o potencial de acção e a criação de uma fase de plateau de equilíbrio dinâmico. A longo prazo deficiência de cálcio pode levar ao raquitismo e uma má coagulação e no caso de uma mulher na menopausa, que pode levar a osteoporose, em que o osso se deteriora e não há um aumento do risco de fracturas. Enquanto um défice ao longo da vida pode afetar óssea e formação dos dentes, o excesso de retenção pode causar hipercalcemia (níveis de cálcio elevados no sangue), insuficiência renal e diminuiu a absorção de outros minerais. Várias fontes sugerem uma correlação entre a ingestão de cálcio elevado (2000 mg por dia, ou duas vezes os EUA dose diária recomendada, o equivalente a seis ou mais copos de leite por dia) e cancro da próstata. Alta ingestão de cálcio ou de alta absorção de cálcio foram previamente pensado para contribuir para o desenvolvimento de pedras nos rins. No entanto, uma elevada ingestão de cálcio tem sido associada a um risco mais baixo de pedras nos rins em investigação mais recente. A vitamina D é necessária para absorver o cálcio.
Os produtos lácteos, como leite e queijo, são uma fonte bem conhecida de cálcio. Algumas pessoas são alérgicas aos produtos lácteos e ainda mais pessoas, em especial os da descida do não indo-europeia, são intolerantes à lactose, deixando-os incapazes de consumir produtos não fermentados lácteos em quantidades maiores do que cerca de meio litro por porção. Outros, como vegans, evitar os produtos lácteos por razões éticas e de saúde.
Muitas boas fontes vegetais de cálcio existir, incluindo algas, tais como alga marinha, wakame e hijiki; nozes e sementes como amêndoas , avelãs, gergelim , pistache; blackstrap melaço; feijão (especialmente feijão de soja ); figos; quinoa; quiabo; rutabaga; ; brócolis dente de leão folhas; couve. Além disso, para algumas bebidas (como leite de soja ou sumo de laranja) é típico para ser fortificado com cálcio.
Numerosos produtos hortícolas, designadamente espinafre, acelga e ruibarbo têm um alto teor de cálcio, mas também podem conter quantidades variáveis de ácido oxálico, que se liga de cálcio e reduz a sua absorção. O mesmo problema pode, até um grau afectar a absorção de cálcio a partir de amaranto, couve, verdes chicória. Este processo pode também estar relacionada com a geração de oxalato de cálcio.
Uma fonte de cálcio é negligenciado casca de ovo, que podem ser moídos em um pó e misturado no alimento ou um copo de água.
O teor de cálcio da maioria dos alimentos pode ser encontrado na base de dados USDA National Nutrient.
Os suplementos dietéticos de cálcio

Suplementos de cálcio são usados para prevenir e tratar deficiências de cálcio. A maioria dos especialistas recomendam que os suplementos ser tomado com comida e que há mais de 600 mg deve ser tomado em um tempo porque a porcentagem de cálcio absorvida diminui conforme a quantidade de cálcio no suplemento aumenta. Recomenda-se a espalhar doses ao longo do dia. Ingestão de cálcio diária recomendada para adultos varia 1000-1500 mg. Recomenda-se tomar suplementos com alimentos para ajudar na absorção.
A vitamina D é adicionada a cerca de suplementos de cálcio. Estado apropriado da vitamina D é importante porque a vitamina D é convertida para uma hormona no corpo, o que induz a síntese das proteínas responsáveis pela absorção intestinal de cálcio.
- A absorção de cálcio a partir de mais alimentos e suplementos alimentares vulgarmente utilizados é muito semelhante. Isto é contrário ao que muitos fabricantes de suplementos de cálcio afirmam em seus materiais promocionais.
- O leite é uma excelente fonte de cálcio da dieta para aqueles cujos corpos tolerar porque tem uma elevada concentração de cálcio e o cálcio no leite é excelentemente absorvida.
- Leite de soja e outros leites vegetais são normalmente vendidos com adição de cálcio, de modo que a sua concentração de cálcio é tão elevada como no leite.
- Também diferente tipo de sucos impulsionados com cálcio são amplamente disponíveis.
- O carbonato de cálcio é o suplemento mais comum e menos caro de cálcio. Ele deve ser tomado com comida. Depende de baixos níveis de pH para uma boa absorção no intestino. Alguns estudos sugerem que a absorção de cálcio a partir de carbonato de cálcio é semelhante para a absorção de cálcio a partir de leite. Enquanto a maioria das pessoas digerir carbonato de cálcio muito bem, alguns podem desenvolver desconforto gastrointestinal ou gás. Tomar magnésio com ele pode ajudar a evitar a constipação. O carbonato de cálcio é de 40% de cálcio elementar. 1000 mg irá fornecer 400 mg de cálcio. No entanto, os rótulos de suplementos normalmente irá indicar quanto cálcio está presente em cada dose, não a quantidade de carbonato de cálcio está presente.
- Os antiácidos frequentemente contêm carbonato de cálcio, e são, de um suplemento de cálcio baratos, normalmente usados.
- Coral cálcio é um sal de cálcio derivado de recifes de corais fossilizados. O cálcio coral é composto de carbonato de cálcio e minerais.
- O citrato de cálcio pode ser tomado sem alimentos e é o suplemento de escolha para indivíduos com acloridria ou que estão tomando histamina-2 bloqueadores ou inibidores da bomba de prótons. O citrato de cálcio é de cerca de 21% de cálcio elementar. 1000 mg irá fornecer 210 mg de cálcio. É mais caro do que o carbonato de cálcio e mais de que devem ser tomadas para obter a mesma quantidade de cálcio.
- O fosfato de cálcio custa mais do que o carbonato de cálcio, mas menos do que o citrato de cálcio. A hidroxiapatite microcristalina (MH) é uma das várias formas de fosfato de cálcio utilizados como um suplemento dietético. A hidroxiapatita é cerca de 40% de cálcio.
- Lactato de cálcio tem absorção similar como carbonato de cálcio, mas é mais caro. Lactato de cálcio e gluconato de cálcio são formas menos concentradas de cálcio e não são práticos suplementos orais.
- Cálcio quelatos são compostos sintéticos de cálcio, com o cálcio ligado a uma molécula orgânica, tais como malato, aspartato, ou fumarato. Estas formas de cálcio pode ser melhor absorvido com o estômago vazio. No entanto, em geral, eles são absorvidos de forma semelhante à de carbonato de cálcio e outros suplementos de cálcio comum quando tomado com a comida. Os imitadores "quelar" a acção que executa alimentares naturais, mantendo o cálcio solúvel no intestino. Assim, com o estômago vazio, em alguns indivíduos, quelatos pode, em teoria, ser melhor absorvidos.
Um estudo investiga os efeitos do uso de suplementos de cálcio pessoal sobre o risco cardiovascular nos Feminina cálcio Health Initiative / vitamina D Estudo de Suplementação (WHI Estudo DAC) encontraram um risco moderadamente aumentado de eventos cardiovasculares, infarto do miocárdio particularmente em mulheres na pós-menopausa. Uma ampla recomendação de cálcio / vitamina D suplementos, portanto, não se justifica.
Prevenção de fraturas devido à osteoporose
Tais estudos muitas vezes não testar cálcio sozinho, mas sim combinações de cálcio e vitamina D. Ensaios clínicos randomizados encontraram efeitos positivos e negativos. Os diferentes resultados podem ser explicados por doses de cálcio e taxas subjacentes da suplementação de cálcio nos grupos de controlo. No entanto, é claro que o aumento da ingestão de cálcio promove a deposição de cálcio nos ossos, onde ela é mais benéfica na prevenção de fracturas de compressão resultantes do desbaste da osteoporose web dendrítica dos corpos das vértebras, do que é a prevenção mais grave As fraturas de osso cortical que acontecem no quadril e pulso.
Prevenção do câncer possível
A meta-análise pelo internacional Colaboração Cochrane de dois ensaios clínicos randomizados descobriu que o cálcio "pode contribuir para um grau moderado para a prevenção de adenomatosa pólipos do cólon ".
Estudos mais recentes foram conflitantes, e que foi positivo para o efeito (Lappe, et al.) Fez o controle para um possível efeito anti-cancerígeno de vitamina D , que foi encontrado para ser uma influência positiva independente do cálcio-alone no risco de câncer ( segundo estudo ver abaixo).
- A ensaio controlado randomizado descobriram que 1000 mg de cálcio elementar e 400 UI de vitamina D 3 não teve nenhum efeito sobre o cancro colo-rectal.
- A randomizado controlado constatou que 1400-1500 mg de cálcio suplementar e 1.100 UI de vitamina D 3 reduzida cancros agregados com um risco relativo de 0,402.
- Observacional estudo de coorte descobriram que a ingestão elevada de cálcio e vitamina D foi associada com "menor risco de desenvolver câncer de mama antes da menopausa."
Perigos e toxicidade
Em comparação com outros metais, o ião de cálcio e a maioria dos compostos de cálcio tem baixa toxicidade. Isto não é surpreendente, dada a elevada abundância natural de compostos de cálcio no ambiente e nos organismos. Cálcio coloca alguns problemas ambientais graves, com pedras nos rins o efeito colateral mais comum em estudos clínicos. O envenenamento agudo cálcio é rara e difícil de alcançar, a menos que os compostos de cálcio são administradas por via intravenosa. Por exemplo, a fase oral dose letal média (DL50) nos ratos para o carbonato de cálcio e cloreto de cálcio são 6,45 e 1,4 g / kg, respectivamente.
O cálcio-metal é perigoso por causa de suas reações, por vezes violentas com água e ácidos. O cálcio-metal é encontrado em alguns desentupidores, onde ele funciona para gerar calor e hidróxido de cálcio que saponifies as gorduras e as proteínas liquefaz (por exemplo, cabelo) que drena bloco. Quando o metal de cálcio ingerido tem o mesmo efeito sobre a boca, esófago e do estômago, e pode ser fatal.
O consumo excessivo de antiácidos de carbonato de cálcio / suplementos nutricionais (tais como Tums) ao longo de um período de semanas ou meses pode causar leite e álcalis síndrome, com sintomas que variam de hipercalcemia potencialmente fatal insuficiência renal. O que constitui um consumo "excessivo" não é bem conhecida e, presume-se, varia muito de pessoa para pessoa. As pessoas que consomem mais de 10 gramas / dia de CaCO 3 (= 4 g de Ca) estão em risco de desenvolvimento de síndrome de leite e de produtos alcalinos, mas a condição tem sido relatada em, pelo menos, uma pessoa que consome apenas 2,5 gramas / dia de CaCO 3 (1 = g Ca), um montante geralmente considerada moderada e segura.
Suplementos orais de cálcio diminuir a absorção de tiroxina quando tomado dentro de quatro a seis horas um do outro. Assim, pessoas que tomam cálcio e de tiroxina corre o risco de inadequada reposição de hormônio tireoidiano e daí hipotireoidismo se eles levá-los simultaneamente ou quase simultaneamente.
