
Gálio
Informações de fundo
Crianças SOS têm produzido uma seleção de artigos da Wikipedia para escolas desde 2005. SOS Criança patrocínio é legal!
| Gálio | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
31 Ga | |||||||||||||||||||
| |||||||||||||||||||
| Aparência | |||||||||||||||||||
branco-prata  | |||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||
| Nome, símbolo, número | gálio, Ga, 31 | ||||||||||||||||||
| Pronúncia | / ɡ æ l Eu ə m / GAL -ee-əm | ||||||||||||||||||
| Categoria elemento | metais de transição pós- | ||||||||||||||||||
| Grupo, período, bloco | 13, 4, p | ||||||||||||||||||
| Peso atômico padrão | 69,723 (1) | ||||||||||||||||||
| Configuração eletrônica | [ Ar ] 4s 2 3d 10 4p 1 2, 8, 18, 3 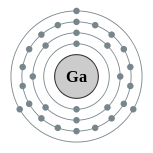 | ||||||||||||||||||
| História | |||||||||||||||||||
| Predição | Dmitri Mendeleev (1871) | ||||||||||||||||||
| Descoberta | Lecoq de Boisbaudran (1875) | ||||||||||||||||||
| Primeiro isolamento | Lecoq de Boisbaudran (1875) | ||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||
| Fase | sólido | ||||||||||||||||||
| Densidade (perto RT) | 5,91 g cm -3 · | ||||||||||||||||||
| Líquido densidade no pf | 6,095 g · cm -3 | ||||||||||||||||||
| Ponto de fusão | 302.9146 K , 29,7646 ° C, 85,5763 ° F | ||||||||||||||||||
| Ponto de ebulição | 2477 K, 2204 ° C, 3999 ° F | ||||||||||||||||||
| Calor de fusão | 5.59 kJ mol -1 · | ||||||||||||||||||
| Calor de vaporização | 254 kJ mol -1 · | ||||||||||||||||||
| Capacidade calorífica molar | 25,86 J · · mol -1 K -1 | ||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||
| |||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||
| Estados de oxidação | 3, 2, 1 ( óxido anfotérico) | ||||||||||||||||||
| Eletronegatividade | 1,81 (escala de Pauling) | ||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 578,8 kJ · mol -1 | ||||||||||||||||||
| 2: 1979,3 kJ · mol -1 | |||||||||||||||||||
| 3: 2963 kJ · mol -1 | |||||||||||||||||||
| Raio atômico | 135 pm | ||||||||||||||||||
| O raio de covalência | 122 ± 15:00 | ||||||||||||||||||
| Van der Waals raio | 187 pm | ||||||||||||||||||
| Miscelânea | |||||||||||||||||||
| A estrutura de cristal | orthorhombic 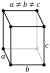 | ||||||||||||||||||
| Ordenamento magnético | diamagnetic | ||||||||||||||||||
| Resistividade elétrica | (20 ° C) 270 Nco · m | ||||||||||||||||||
| Condutividade térmica | 40,6 W · m -1 · K -1 | ||||||||||||||||||
| Expansão térmica | (25 ° C) 18 uM · · K -1 m -1 | ||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 2.740 m · s -1 | ||||||||||||||||||
| O módulo de Young | 9.8 GPa | ||||||||||||||||||
| Rácio de Poisson | 0.47 | ||||||||||||||||||
| Dureza de Mohs | 1,5 | ||||||||||||||||||
| Dureza Brinell | 60 MPa | ||||||||||||||||||
| Número de registo CAS | 7440-55-3 | ||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||
| Ver artigo principal: Isótopos de gálio | |||||||||||||||||||
| |||||||||||||||||||
Gálio é um elemento químico com o símbolo Ga e número atômico 31. Gálio Elemental não ocorre na natureza, mas como o gálio compostos (III) em quantidades vestigiais na bauxita e zinco minérios. Um metálico prateado suave pobre de metal, gálio elementar é um sólido quebradiço a baixas temperaturas. Realizada por tempo suficiente, gálio vai derreter na mão, uma vez que liquefaz a uma temperatura de 29,76 ° C (85,57 ° F) (ligeiramente acima temperatura ambiente). O seu ponto de fusão é utilizado como um ponto de referência de temperatura. A liga Galinstan (68,5% Ga, 21,5% Na , 10% de Sn ) possui um ponto de fusão ainda mais baixas de -19 ° C (-2 ° C), bem abaixo do ponto de congelação da água. Desde a sua descoberta em 1875 até a era de semicondutores, gálio foi usado primeiramente como um agente para fazer ligas de baixo ponto de fusão.
Hoje em dia, quase todos gálio é usado para microelectrónica. Arsenieto de gálio, o uso principal do gálio, é usado em circuitos de microondas e aplicações de infravermelhos. Nitreto de gálio e nitreto de índio gálio, minoria utiliza semicondutores, produzir azul e violeta diodos emissores de luz (LEDs) e lasers de diodo.
Gálio não tem nenhum papel conhecido na biologia. Porque gálio (III) e férricos sais comportam de forma semelhante em sistemas biológicos, íons de gálio muitas vezes imitam íons de ferro em aplicações médicas. Contendo gálio produtos farmacêuticos e radiofármacos têm sido desenvolvidos.
Propriedades físicas

Gálio elementar não é encontrado na natureza, mas que é facilmente obtida pela fundição. Muito puro gálio metal tem uma cor prateada brilhante e suas fraturas de metal sólido conchoidally como vidro . Gálio de metal expande 3,1% quando se solidifica, e, por conseguinte, armazenamento em recipientes de vidro ou de metal é evitado, devido à possibilidade de ruptura recipiente com congelação. Partes de gálio o estado líquido de maior densidade com apenas alguns materiais tais como silício , germânio , bismuto e água .
Gálio ataques mais outros metais por difundir-se o seu metal Malha. Gálio, por exemplo, difunde-se para o limites de grão de Al / Zn ligas ou aço , tornando-os muito frágeis. Gálio facilmente ligas com muitos metais, e é usado em pequenas quantidades como uma liga de plutónio-gálio no plutônio núcleos de bombas nucleares, para ajudar a estabilizar a estrutura de cristal plutônio.
O ponto de fusão de 302.9146 K (29,7646 ° C, 85,5763 ° F) é próxima da temperatura ambiente, sobre as temperaturas médias de tempo de verão. Ponto de fusão de gálio (mp) é um dos pontos de referência formais temperatura no Escala Internacional de Temperatura de 1990 (ITS-90), criado pelo BIPM. O ponto triplo de gálio de 302.9166 K (29,7666 ° C, 85,5799 ° F), está sendo usado por NIST em preferência ao ponto de fusão de gálio.
O ponto de fusão único de gálio permite a sua fusão em de um lado, e, em seguida, voltar a congelar se removido. Esse metal tem uma forte tendência para supercool abaixo do seu ponto de fusão / ponto de congelamento . Semeando com um cristal ajuda a iniciar o congelamento. Gálio é um dos metais (com césio , rubídio , mercúrio e provável frâncio ) que são líquidos à ou próximo da temperatura ambiente normal, e pode, portanto, ser utilizado em alta temperatura do metal, de vidro termômetros. Também é notável por ter uma das maiores gamas de um metal líquido, e (ao contrário de mercúrio) para ter um baixo pressão de vapor a temperaturas elevadas. Ponto de ebulição de gálio, 2477 K, é mais de oito vezes superior ao seu ponto de fusão na escala absoluta , tornando-se a maior relação entre ponto de fusão e ponto de qualquer elemento de ebulição. Ao contrário de mercúrio, líquido de gálio de metal molha vidro e da pele, tornando-o mecanicamente mais difícil de manusear (mesmo que é substancialmente menos tóxica e requer muito menos precauções). Por esta razão, bem como os problemas de contaminação de metal e de congelação-expansão, as amostras de gálio de metal são normalmente fornecidos em sacos de polietileno dentro de outros recipientes.
| Propriedade | um | b | c |
|---|---|---|---|
| α (~ 25 ° C, um / m) | 16 | 11 | 31 |
| ρ (29,7 ° C, Nco · m) | 543 | 174 | 81 |
| ρ (0 ° C, Nco · m) | 480 | 154 | 71,6 |
| ρ (77 K, Nco · m) | 101 | 30,8 | 14,3 |
| ρ (4,2 K, pΩ · m) | 13,8 | 6.8 | 1.6 |
O gálio não cristalizam em qualquer um dos simples estruturas cristalinas. A fase estável sob condições normais é ortorrômbica com 8 átomos no convencional célula unitária. Cada átomo tem apenas um vizinho mais próximo (a uma distância de 244 pm) e seis outros vizinhos dentro de adicional de 39 pm. Muitos estável e fases metaestáveis são encontrados como função da temperatura e pressão.
A ligação entre os dois vizinhos mais próximos é covalente, portanto, Ga 2 dímeros são vistos como os blocos de construção fundamentais do cristal. Isto explica a queda do ponto de fusão em comparação com o seu vizinho elementos alumínio e índio.
As propriedades físicas de gálio são altamente anisotrópica, isto é, têm valores diferentes ao longo dos eixos dos três principais cristalográfico a, b e c (ver tabela); Por esta razão, há uma diferença significativa entre o linear (α) eo volume coeficientes de expansão térmica. As propriedades de gálio também são fortemente dependentes da temperatura, especialmente perto do ponto de fusão. Por exemplo, o coeficiente de expansão térmica aumenta em várias centenas por cento durante a fusão.
Propriedades químicas
Gálio é encontrado principalmente no 3 estado de oxidação . A oxidação também é um atestado em alguns compostos, embora tendam a desproporcional em gálio elementar e compostos de gálio (III). O que são muitas vezes referidos como compostos de gálio (II) são realmente compostos estado misto-oxidação contendo tanto gálio (I) e gálio (III).
Compostos Calcogênio
À temperatura ambiente, gálio metal é não reactiva para com o ar ea água devido à formação de uma camada de óxido passivo, protectora. A temperaturas mais elevadas, no entanto, ele reage com o oxigénio do ar para formar óxido de gálio (III), Ga 2 O 3. Reduzindo Ga 2 O 3 com gálio elementar em vácuo a 500 ° C a 700 ° C produz o marrom escuro gálio (I) óxido, Ga 2 O. Ga 2 O é um muito forte agente de redução, capaz de reduzir de H 2 SO 4 a H2S. Ele disproportionates a 800 ° C de volta ao gálio e Ga 2 O 3.
Sulfeto de gálio, Ga 2 S 3, tem 3 possíveis modificações de cristal. Ela pode ser feita por meio da reacção de gálio com sulfureto de hidrogénio (H2S) a 950 ° C. Alternativamente, Ga (OH) 3 pode também ser usada em 747 ° C:
- 2 Ga (OH) 3 + 3 H 2 S → Ga 2 S 3 + 6 H2O
Fazer reagir uma mistura de carbonatos de metais alcalinos e Ga 2 O 3 com H 2 S, conduz à formação de thiogallates contendo o [S 2 Ga 4] 2- anião. Ácidos fortes decompor estes sais, libertando H 2 S no processo. O sal de mercúrio, HgGa 2 S 4, pode ser utilizado como um fósforo.
Gálio também forma sulfuretos nos estados de oxidação mais baixos, tal como gálio (II) sulfureto eo verde gálio (I) sulfureto, o último dos quais é produzido a partir da anterior por meio de aquecimento a 1000 ° C sob uma corrente de azoto.
Os outros chalcogenides binários, Ga 2 Se 3 e Ga 2 Te 3, têm estrutura zincblende. Eles são todos os semicondutores, mas são facilmente hidrolisado, limitando a sua utilidade.
Química aquosa
Ácidos fortes dissolver gálio, formando gálio (III), tais como sais Ga 2 (SO 4) 3 e Ga (NO3) 3. As soluções aquosas de sais de gálio (III) contêm o ião gálio hidratado, [Ga (H2O) 6] 3+. Gálio (III) hidróxido, Ga (OH) 3, pode ser precipitado a partir de soluções de gálio (III) pela adição de amoníaco . Desidratação Ga (OH) 3 a 100 ° C produz hidróxido de óxido de gálio, Gao (OH).
Alcalinas de hidróxido de soluções dissolver gálio, formar sais que contêm o galato Ga (OH) -
4 anião. Hidróxido de gálio, que é anfotérico, também se dissolve em alcali para formar sais de galato. Embora trabalhos anteriores sugeriram Ga (OH) 3-
6 como outra possível ânion galato, esta espécie não foi encontrado no trabalho posterior.
Compostos grupo do nitrogênio
Gálio reage com amónia a 1050 ° C, para formar nitreto de gálio, GaN. Gálio também forma compostos binários com fósforo , arsênico e antimônio : fosfeto de gálio (BPA), arseneto de gálio (GaAs), e antimonide gálio (GaSb). Estes compostos têm a mesma estrutura como ZnS, e tem importantes semicondutores propriedades. Gap, GaAs, e GaSb pode ser sintetizado por reacção directa de gálio com fósforo elementar, arsénio, antimónio ou. Eles exibem maior condutividade eléctrica de GaN. LAcunA também pode ser sintetizado pela reacção de Ga 2 O com fósforo a baixas temperaturas.
Gálio também forma nitretos ternárias; por exemplo:
- Li 3 Ga + N 2 → 3 Li 2 GaN
Compostos similares com fósforo eo arsênico também existem: Li 3 GaP 2 e 3 Li GaAs 2. Estes compostos são facilmente hidrolisado por ácidos diluídos e água.
Halides
Óxido de gálio (III) reage com agentes de fluoração tais como o HF ou F2 para formar gálio (III) de flúor, GAF 3. Ele é um composto iónico fortemente insolúvel em água. No entanto, não se dissolvem em ácido fluorídrico, na qual se forma um aducto com água, GAF 3 · 3H 2 S. A tentativa de desidratar este aduto vez faz GAF 2 OH · n H2O. O aducto reage com amónia para formar 3 GAF · 3NH 3, que pode então ser aquecido para formar anidro GAF 3.
Tricloreto de gálio é formada pela reacção do metal com gálio cloro gás. Ao contrário do trifluoreto de gálio (III) cloreto de existir como moléculas diméricas, Ga 2 Cl 6, com um ponto de fusão de 78 ° C. Este é também o caso para o brometo e iodeto, Ga 2 Br 6 e Ga 2 I 6.
Como o outro grupo 13 trialogenetos, gálio halogenetos (III) são Ácidos de Lewis, a reacção de halogeneto como aceitadores com halogenetos de metal alcalino para formar sais contendo GAX -
4 aniões, onde X é um halogéneo. Eles também reagem com halogenetos de alquilo para formar carbocátions e GAX -
4.
Quando aquecida a uma temperatura elevada, halogenetos de gálio (III) reagem com gálio elementar para formar os respectivos gálio (I) halogenetos. Por exemplo, GACL 3 reage com Ga para formar GACL:
- 2 Ga + GACL 3
 3 GACL (g)
3 GACL (g)
Em temperaturas mais baixas, o equilíbrio se desloca para a esquerda e GACL disproportionates volta para gálio elementar e GACL 3. GACL também podem ser feitas pela reacção de Ga com HCl a 950 ° C; ele pode então ser condensado como um sólido vermelho.
Gálio (i) compostos podem ser estabilizadas através da formação de aductos com ácidos de Lewis. Por exemplo:
- GACL + AlCl3 → Ga + [AlCl 4] -
Os chamados "gálio (II)", halogenetos de GAX 2, são realmente os aductos de gálio (I) com o respectivo halogenetos de gálio (III), halogenetos, possuindo a estrutura Ga + [GAX 4] -. Por exemplo:
- GACL + GACL 3 → Ga + [GACL 4] -
Compostos de hidrogênio
Tal como alumínio , gálio também forma um hidreto, GAH 3, conhecido como gallane, que pode ser obtido pela reacção de gallanate lítio (LiGaH 4) com cloreto de gálio (III) à temperatura de -30 ° C:
- 3 LiGaH 4 + GACL 3 → 3 LiCl + 4 Gah 3
Na presença de éter dimetílico como solvente, Gah 3 polimeriza para (Gah 3) n. Se não se utiliza solvente, o dímero Ga 2 H 6 ( digallane) é formado como um gás. A sua estrutura é semelhante a diborano, tendo dois átomos de hidrogênio ponte entre os dois centros de gálio, ao contrário de α- AIH3 em que o alumínio tem um número de coordenação de seis.
Gallane é instável acima de -10 ° C, decomposição de gálio elementar e hidrogênio.
História
Em 1871, a existência de gálio foi previsto pela primeira vez pelo químico russo Dmitri Mendeleev , que o denominou " eka-alumínio ", com base em sua posição em sua tabela periódica . Ele também previu várias propriedades do elemento, que correspondem de perto às propriedades de gálio reais, tais como densidade , ponto de fusão , caráter e óxido de ligação em cloreto.
Gálio foi descoberto espectroscopicamente pelo químico francês Paul Emile Lecoq de Boisbaudran em 1875 por seu espectro característico (dois linhas violeta), uma análise de um sphalerite amostra. Mais tarde nesse ano, Lecoq obtido o metal livre por eletrólise da sua hidróxido em solução de hidróxido de potássio. Ele nomeou o elemento "gallia", do latim significado Gallia Gália, depois de sua terra natal, a França. Mais tarde, foi afirmado que, em um dos multilingue trocadilhos tão amado dos homens de ciência no século 19, ele também tinha nomeado gálio depois de si mesmo, como seu nome, "Le coq", é o francês para " galo ", eo Latin para "galo" é "gallus", no entanto, em um artigo 1877 Lecoq negou esta suposição (Cf. a nomeação da. J / ψ e méson o planeta anão Plutão .)
Desde a sua descoberta em 1875 até a era de semicondutores, seus usos primários foram em aplicações termométricas de alta temperatura e na preparação de ligas metálicas com propriedades incomuns de estabilidade, ou a facilidade de fusão; algum ser líquido à temperatura ambiente ou abaixo. O desenvolvimento de arseneto de gálio como um semicondutor gap direto na década de 1960 inaugurou a fase mais importante nas aplicações de gálio.
Ocorrência
O gálio não existir na forma livre na natureza, e as poucas minerais de alta gálio tal como gallite CuGaS (2) são muito raras para servir como uma fonte primária de o elemento ou os seus compostos. Sua abundância na crosta da Terra é de aproximadamente 16,9 ppm. Gálio é encontrada e extraiu-se como um componente de rastreio no bauxite e numa pequena extensão a partir de sphalerite. A quantidade extraída a partir de carvão , diaspore e germanite em que o gálio está presente também é negligenciável. O United States Geological Survey ( USGS) estima reservas de gálio para exceder 1 milhão toneladas, com base em 50 ppm de concentração de peso em reservas conhecidas de bauxita e minério de zinco. Alguns fumeiro poeiras de queima do carvão têm sido mostrados para conter pequenas quantidades de gálio, tipicamente menos de 1% em peso.
Produção

Gálio é um subproduto da produção de alumínio e zinco. Considerando que a esfalerite para a produção de zinco é a fonte menor. Mais gálio é extraído o produto bruto solução de hidróxido de alumínio da Processo da Bayer para a produção de alumina e alumínio. Um mercúrio célula de electrólise e hidrólise do amálgama com hidróxido de sódio conduz a galato de sódio. Eletrólise, em seguida, dá gálio metal. Para semicondutores utilização, a purificação adicional é levada a cabo usando fusão zona, ou extração de cristal único outro a partir de uma fusão ( Processo Czochralski). Purezas de 99,9999% são rotineiramente conseguido comercialmente e largamente disponíveis.
Em 1986, a produção foi estimada em 40 toneladas. Em 2007, a produção de gálio foi de 184 toneladas, com menos de 100 toneladas de mineração eo resto a partir da reciclagem de sucata. Até 2011, a produção mundial de gálio foi estimada em 216 toneladas métricas.
Aplicações
As aplicações de semicondutores dominar o uso comercial de gálio, respondendo por 98% dos pedidos. A próxima grande aplicação é para granadas gadolínio gálio.
Semiconductors

Devido a esta aplicação, extremamente alta pureza (99,9999% +) gálio está disponível comercialmente. Arsenieto de gálio (GaAs) e nitreto de gálio (GaN) utilizado em componentes electrónicos representado cerca de 98% do consumo de gálio nos Estados Unidos em 2007. Cerca de 66% de gálio semicondutor é usado em os EUA em circuitos integrados (arseneto de gálio principalmente), tais como o fabrico de ultra- -High chips lógicos velocidade e MESFETs para pré-amplificadores de microondas de baixo ruído em telefones celulares. Cerca de 20% é utilizado em optoeletrônica. No mundo inteiro, o arseneto de gálio compõe 95% do consumo anual de gálio global.
Arsenieto de gálio é usado na optoelectrónica em uma variedade de aplicações de infravermelhos. Arsenieto de gálio de alumínio (AlGaAs) é usado em díodos de alta potência de laser de infravermelhos. Como um componente de semicondutores nitreto de gálio e índio e de nitreto de gálio, gálio é utilizado para produzir dispositivos optoelectrónicos de azul e violeta, principalmente diodos laser e diodos emissores de luz. Por exemplo, de nitreto de gálio lasers de diodo 405 nm são utilizados como uma fonte de luz violeta e de maior densidade de disco compacto de armazenamento de dados, no Blu-ray Disc padrão.
Células fotovoltaicas multijunction, desenvolvido para aplicações de energia por satélite, são feitas por epitaxia de feixe molecular ou metalorgânicos epitaxia de fase vapor de filmes finos de arsenieto de gálio, fosfeto de índio gálio ou arsenide.The índio gálio Mars Exploration Rovers e vários satélites usar triplo arsenieto de gálio de junção em células de germânio. Gálio é também um componente em compostos fotovoltaicas (tais como sulfureto de cobre, índio selénio gálio ou Cu (In, Ga) (Se, S) 2) para o uso em painéis solares como uma alternativa eficiente em termos de custo para silício cristalino.
Galinstan e outras ligas
Gálio prontamente ligas com a maioria dos metais, e tem sido utilizado como um componente em ligas de baixo ponto de fusão. A quase liga eutéctica de gálio, índio e estanho é um líquido à temperatura ambiente que está disponível em termómetros médicos. Esta liga, com o nome comercial Galinstan (com o "stan" referindo-se à lata), tem um baixo ponto de congelação de -19 ° C (-2,2 ° C). Tem sido sugerido que esta família de ligas, também poderia ser utilizada para arrefecer os chips de computador, em vez de água. Ligas de gálio foram avaliadas em substituição do mercúrio amálgamas dentárias, mas estes materiais ainda tenho que ver uma ampla aceitação.
Porque gálio molha vidro ou porcelana, gálio pode ser usado para criar brilhante espelhos. Quando a acção de humedecimento de gálio-ligas não é desejada (como em Galinstan termómetros de vidro), o vidro deve ser protegida com uma camada transparente de óxido de gálio (III).
O plutónio utilizado em poços de armas nucleares é usinado por liga com gálio para estabilizar a sua fase δ.
Gálio adicionado em quantidades até 2% em comum soldas pode ajudar características de umedecimento e fluxo.
As ligas de Al e Ga foram avaliadas quanto produção de hidrogênio.
É usado como elemento de liga no liga com memória de forma magnética Ni-Mn-Ga.
Aplicações biomédicas
Apesar de gálio tem nenhum papel conhecido na biologia, ele imita ferro (III), o ião de gálio se localiza e interage com muitos processos no organismo nos quais o ferro (III) é manipulada. Como estes processos incluem inflamação, que é um marcador para muitos estados de doença, vários sais de gálio são utilizados, ou estão em desenvolvimento, como ambos produtos farmacêuticos e radiofármacos em medicina. Quando íons de gálio são erroneamente tomadas por bactérias como a Pseudomonas, a capacidade das bactérias para respirar é interferido com as bactérias e morrer. O mecanismo por trás disto é que o ferro é redox activo, o que permite a transferência dos electrões durante a respiração, mas gálio é redox inactivo.
Nitrato de gálio (marca Ganite) tem sido utilizado como um produto farmacêutico por via intravenosa para tratar hipercalcemia associada com o tumor metástases dos ossos. Gálio é pensado para interferir com função dos osteoclastos. Pode ser eficaz quando outros tratamentos para a hipercalcemia associada-maligancy não são.
- Maltolate gálio, uma forma absorvível por via oral de gálio (III) de iões, está em ensaios clínicos e pré-clínicos como um tratamento potencial para um número de tipos de cancro, doenças infecciosas, e doenças inflamatórias.
Um complexo de amina - fenol Ga (III) composto MR045 foi encontrado para ser selectivamente tóxicos para os parasitas que desenvolveram resistência aos cloroquina, uma droga comum contra a malária . Tanto o Ga (III), complexo de cloroquina e actuam inibindo a cristalização de hemozoína, um produto de eliminação formado a partir da digestão de sangue pelos parasitas.
Sais Radiogallium
Gálio-67 sais, tais como gálio citrato de gálio e nitrato são usados como Os radiofármacos em um procedimento de imagiologia medicina nuclear comumente referido como um verificação de gálio. A forma de sal ou de gálio não é importante. Para estas aplicações, o isótopo radioactivo Ga 67 é usado. O corpo lida com Ga 3+, em muitos aspectos, como se fosse de ferro, e, portanto, ele é obrigado (e concentrados) em áreas de inflamação, tais como infecção, e também áreas de rápida divisão celular. Isso permite que esses sites a ser trabalhada por meio de técnicas de verificação nucleares. Este uso tem sido amplamente substituído pelo fluorodeoxyglucose (FDG) para A tomografia por emissão de pósitrons, "pet" varreduras de leucócitos marcados digitalização e índio-111. No entanto, a localização de gálio no corpo tem algumas propriedades que a tornam única, em algumas circunstâncias de modalidades concorrentes utilizando outros radioisótopos.
Gálio-68, um emissor de positrões com uma semi-vida de 68 min., É agora usado como um radionuclídeo de diagnóstico em PET-CT quando ligada a preparações farmacêuticas, tais como DOTATOC, uma análogo da somatostatina utilizado para Tumores Neuroendócrinos investigação, e DOTA-TATE, um mais novo, usado para neuroendócrino metástase do câncer pulmonar e neuroendócrino, tais como certos tipos de microcitoma. Preparação de Galium-68 como um produto farmacêutico é química e o radionuclido é extraído por eluição a partir de germânio-68, uma radioisótopo sintético de germânio , em gálio-68 geradores.
Outros usos
- Magnésio galato contendo impurezas (tais como Mn 2+), está a começar a ser usado no ultravioleta -activated fósforo em pó.
- Detecção de neutrinos. Possivelmente a maior quantidade de gálio puro sempre coletados em um único local é o telescópio de neutrinos Gálio-germânio utilizado pelo SAGE experiência no Observatório de Neutrinos Baksan na Rússia. Este detector contém 55-57 toneladas de gálio líquido. Outro experimento foi o Detector de neutrinos GALLEX operada no início de 1990, em um túnel de montanha italiano. O detector continha 12,2 toneladas de regada gálio-71. Neutrinos solares causaram alguns átomos de 71 Ga para se tornar radioativo 71 Ge , que foram detectados. O fluxo de neutrinos solares deduzida foi encontrado para ter um déficit de 40% da teoria. Este não foi explicado até melhores detectores de neutrinos solares e teorias foram construídos (ver SNO).
- Como uma fonte de iões de metal líquido para uma feixe de íons focalizados. Por exemplo, um feixe focalizado-gálio-ion foi usada para criar o menor livro do mundo, Teeny Ted de nabo Town.
- Em uma brincadeira clássico, os cientistas formaria colheres de gálio e servir chá aos convidados desavisados. As colheres derreter no chá quente.
- Como aditivo na cera deslize para skiis, e outros materiais de superfície de baixa fricção. US 5069803, Sugimura, Kentaro; Shoji Hasimoto & Takayuki Ono, "Utilização de uma composição de resina sintética que contém partículas de gálio no material de revestimento deslize de esquis e outras aplicações", concedida em 1995
Precauções
O Ga (III), ião de gálio sais solúveis tende a formar o hidróxido insolúvel quando injectado em grandes quantidades, e em animais de precipitação isso resultou em toxicidade renal. Em doses inferiores, de gálio solúvel é bem tolerado, e não se acumula como um veneno.
Enquanto gálio metálico não é considerado tóxico, os dados são inconclusivos. Algumas fontes sugerem que ele pode causar dermatite de exposição prolongada; outros testes não ter causado uma reação positiva. Como a maioria dos metais, gálio finamente dividido perde o seu brilho e gálio em pó aparece cinza. Assim, quando gálio é tratado directamente com as mãos, o extremamente fina dispersão de gotículas líquidas de gálio, que resulta de molhar a pele com o metal, pode aparecer como uma mancha a pele cinzenta.
