
Lítio
Informações de fundo
Crianças SOS, uma instituição de caridade educação , organizou esta selecção. Antes de decidir sobre o patrocínio de uma criança, por que não aprender sobre as diferentes instituições de caridade de patrocínio primeiro ?
| Lítio | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
3 Li | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||
branco-prateado (mostrado flutuante em óleo)  Linhas espectrais de lítio | |||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||
| Nome, símbolo, número | lítio, Li, 3 | ||||||||||||||||||||||||
| Pronúncia | / l ɪ θ Eu ə m / LI -thee-əm | ||||||||||||||||||||||||
| Categoria elemento | metal alcalino | ||||||||||||||||||||||||
| Grupo, período, bloco | (1) metais alcalinos , 2, s | ||||||||||||||||||||||||
| Peso atômico padrão | 6,94 (1) | ||||||||||||||||||||||||
| Configuração eletrônica | [Ele] 2s 1 2, 1 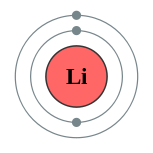 | ||||||||||||||||||||||||
| História | |||||||||||||||||||||||||
| Descoberta | Johan agosto Arfwedson (1817) | ||||||||||||||||||||||||
| Primeiro isolamento | William Thomas Brande (1821) | ||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||
| Densidade (perto RT) | 0,534 g · cm -3 | ||||||||||||||||||||||||
| Líquido densidade no pf | 0,512 g · cm -3 | ||||||||||||||||||||||||
| Ponto de fusão | 453,69 K , 180,54 ° C, 356,97 ° F | ||||||||||||||||||||||||
| Ponto de ebulição | 1615 K, 1342 ° C, 2448 ° F | ||||||||||||||||||||||||
| Ponto crítico | (Extrapolada) 3223 K, 67 MPa | ||||||||||||||||||||||||
| Calor de fusão | 3.00 kJ mol -1 · | ||||||||||||||||||||||||
| Calor de vaporização | 147,1 kJ mol -1 · | ||||||||||||||||||||||||
| Capacidade calorífica molar | 24,860 J · · mol -1 K -1 | ||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||
| Estados de oxidação | +1 (Fortemente óxido de base) | ||||||||||||||||||||||||
| Eletronegatividade | 0,98 (escala de Pauling) | ||||||||||||||||||||||||
| Energias de ionização | 1º: 520,2 kJ · mol -1 | ||||||||||||||||||||||||
| 2: 7298,1 kJ · mol -1 | |||||||||||||||||||||||||
| 3: 11.815,0 kJ · mol -1 | |||||||||||||||||||||||||
| Raio atômico | 152 pm | ||||||||||||||||||||||||
| O raio de covalência | 128 ± 19:00 | ||||||||||||||||||||||||
| Van der Waals raio | 182 pm | ||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||
| A estrutura de cristal | cúbica de corpo centrado  | ||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | ||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 92,8 Nco · m | ||||||||||||||||||||||||
| Condutividade térmica | 84,8 W · m -1 · K -1 | ||||||||||||||||||||||||
| Expansão térmica | (25 ° C) 46 uM · · K -1 m -1 | ||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 6000 m · s -1 | ||||||||||||||||||||||||
| O módulo de Young | 4.9 GPa | ||||||||||||||||||||||||
| Módulo de cisalhamento | 4.2 GPa | ||||||||||||||||||||||||
| Massa de módulo | 11 GPa | ||||||||||||||||||||||||
| Dureza de Mohs | 0,6 | ||||||||||||||||||||||||
| Número de registo CAS | 7439-93-2 | ||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||
| Ver artigo principal: Isótopos de lítio | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Lítio (de lithos gregas "pedra") é um pano macio, branco-prateada de metal com símbolo Li e número atômico 3. Pertence ao metal alcalino grupo de elementos químicos . Sob condições padrão é o metal mais leve e o elemento sólido menos denso. Como todos os metais alcalinos, o lítio é altamente reativo e inflamável. Por esta razão, é normalmente armazenado em óleo mineral. Quando cortado, o lítio apresenta uma metálico brilho, mas o contato com o ar úmido corrói a superfície rapidamente para um cinzento prateado sem brilho, em seguida, manchas pretas. Devido à sua alta reactividade, lítio nunca ocorre livremente na natureza, e em vez disso, só aparece em compostos , que são geralmente iónico. Lítio ocorre num número de pegmatíticas minerais, mas, devido à sua solubilidade como um ião está presente na água do mar e é comummente obtido a partir de salmouras e argilas . Numa escala comercial, o lítio é isolado electroliticamente a partir de uma mistura de e cloreto de lítio cloreto de potássio.
Os núcleos de beira de lítio em instabilidade, pois os dois lítio estáveis isótopos encontrados na natureza tem um dos mais baixos energias de ligação por nucleon de todos os estável nuclídeos. Por causa de sua instabilidade nuclear relativa, o lítio é menos comum no sistema solar do que 25 dos primeiros 32 elementos químicos, embora os núcleos são muito leves no peso atômico. Por razões relacionadas, o lítio tem links importantes para a física nuclear . O transmutação de átomos de lítio para hélio em 1932 foi o primeiro totalmente feito homem- reação nuclear, e lítio-6 deuteride serve como um combustível de fusão em encenado armas termonucleares.
De lítio e os seus compostos têm várias aplicações industriais, incluindo o vidro e resistentes ao calor cerâmica, de alta resistência-peso ligas utilizadas em aeronaves, baterias de lítio e baterias de lítio-íon. Estas utilizações consumir mais do que metade da produção de lítio.
Quantidades vestigiais de lítio estão presentes em todos os organismos. O elemento não tem nenhuma função biológica vital aparente, uma vez que animais e plantas sobreviver em boa saúde sem ele. Funções não vitais não foram descartadas. O lítio de iões Li + administrado como qualquer um dos vários lítio sais tem-se revelado útil como um modo de estabilização da droga no tratamento de transtorno bipolar, devido ao neurológica efeitos do ião no corpo humano.
Propriedades
Atômica e física


Tal como os outros metais alcalinos , lítio tem uma única electrão de valência que é facilmente determinada de modo a formar um catião . Devido a isso, é um bom condutor de calor e de electricidade, bem como um elemento altamente reactivo, embora o menos reactivo dos metais alcalinos. Baixa reatividade de lítio em comparação com outros metais alcalinos, é devido à proximidade da sua electrões de valência ao seu núcleo (os restantes dois electrões são em lítio de 1s orbital e são muito mais baixos em energia e, portanto, eles não participam de ligações químicas).
De metal de lítio é suave o suficiente para ser cortado com uma faca. Ao corte, possui uma cor branco-prateado que rapidamente muda para cinza devido à oxidação. Embora tenha um dos Os pontos de fusão mais baixo entre todos os metais (180 ° C), que tem o maior ponto de fusão e pontos de ebulição dos metais alcalinos.
É o metal mais leve da tabela periódica, de modo que a luz pode flutuar na água e, mesmo em óleo, e é um dos três metais que podem (os outros dois são sódio e potássio ). Tem uma densidade muito baixa, de cerca de 0,534 g / cm3, o que dá varas de metal um peso semelhante ao buchas de madeira de densidade média, como o pinus. Ele flutua sobre a água, mas também reage com ele.

É o menos densa de todos os elementos que não são gases à temperatura ambiente. O elemento seguinte é mais leve mais de 60% mais densa (de potássio, a 0,862 g / cm 3). Além disso, além de hélio e hidrogénio , que é o elemento menos denso no estado sólido ou líquido, sendo apenas 2/3 da densidade do azoto líquido (0,808 g / cm 3).
Lítio de coeficiente de expansão térmica é duas vezes o de alumínio e cerca de quatro vezes maior que a do ferro. Ele tem a maior capacidade de calor específica de qualquer elemento sólido. O lítio é supercondutor abaixo de 400 μK à pressão normal e a temperaturas mais elevadas (mais de 9 K) a pressões muito elevadas (> 20 GPa) a temperaturas inferiores a 70 K, de lítio, como o sódio, sofre diffusionless transformações mudança de fase. Em 4,2 K tem um sistema de cristal rhombohedral (com uma repetição espaçamento de nove camadas); a temperaturas mais elevadas que a transforma cúbico e, em seguida, centrada no rosto cúbica de corpo centrado. Em temperaturas de hélio líquido (4 K) a estrutura romboédrica é a mais prevalente. Várias formas alotrópicas têm sido relatados para o lítio a altas pressões.
Devido à sua capacidade de calor específico, a mais elevada de todos os sólidos, lítio metálico é muitas vezes utilizado em refrigerantes para aplicações de transferência de calor.
Química e compostos
Lítio reage com a água facilmente, mas com visivelmente menos energia do que outros metais alcalinos fazer. A reacção forma de hidrogénio e gás hidróxido de lítio em solução aquosa. Por causa de sua reatividade com água, lítio é normalmente armazenado sob a cobertura de um hidrocarboneto viscoso, muitas vezes vaselina. Embora os metais alcalinos mais pesados pode ser armazenada em substâncias menos densas, tais como óleo mineral, de lítio não é suficientemente denso para ser totalmente submersa nestes líquidos. No ar húmido, o lítio mancha rapidamente para formar um revestimento preto de hidróxido de lítio (LiOH e LiOH-H 2 O), nitreto de lítio (Li 3 N) e carbonato de lítio (Li 2 CO 3, o resultado de uma reacção secundária entre LiOH e CO 2 ).

Quando colocado sobre uma chama, compostos de lítio emitem uma cor carmesim impressionante, mas quando se queima fortemente a chama se torna uma prata brilhante. Lítio vai inflamar e queimar em oxigênio quando expostos a água ou água vapores. O lítio é inflamável, e é potencialmente explosivo quando exposto ao ar e à água, especialmente, embora menos do que os outros metais alcalinos . A reação de lítio-água a temperaturas normais é estimulante, mas não violento, o hidrogênio produzido não vai inflamar por conta própria. Tal como acontece com todos os metais alcalinos, fogos de lítio são difíceis de extinguir, exigindo extintores de pó seco, especificamente tipo Classe D (ver Tipos de agentes de extinção). O lítio é o único metal que reage com azoto sob condições normais.
Lítio tem uma relacionamento com diagonal de magnésio , um elemento de atômica similar e raio iónico. Semelhanças químicas entre os dois metais incluem a formação de um nitreto por reacção com N 2, a formação de um óxido (Li 2 O) e peróxido (Li 2 O 2) quando queimado em O 2, sais semelhantes com solubilidades e à instabilidade térmica dos carbonatos e nitretos. O metal reage com hidrogénio gasoso a temperaturas elevadas para produzir o hidreto de lítio (LiH).
Outro conhecido compostos binários incluem o halogenetos de ( LiF, LiCl, LiBr, Lil), eo sulfureto de ( Li 2 S), o superóxido ( LiO 2), carboneto ( Li 2 C 2). Muitos outros compostos inorgânicos são conhecidos, onde o lítio combina com aniões para formar vários sais: boratos, amidas, carbonato, nitrato, ou borohidreto ( LiBH4). Múltiplo Os reagentes de organo-lítio são conhecidos onde existe uma relação directa vínculo entre carbono e átomos de lítio efetivamente criando uma carbanion. Estes são extremamente poderoso bases e nucleófilos. Em muitos destes compostos de organolítio, os iões de lítio tendem a agregar-se em aglomerados de alta simetria por si, o que é relativamente comum para catiões alcalinos.
Isótopos
De ocorrência natural de lítio é composto de duas estáveis isótopos , 6 e 7 Li Li, sendo este último o mais abundante (92,5% abundância natural). Os dois isótopos naturais têm anormalmente baixo energia de ligação por nucleão nuclear em comparação com o próximo mais leves e mais pesados elementos, hélio e berílio , o que significa que só entre elementos leves estáveis, o lítio pode produzir energia líquida através de fissão nuclear . Os dois núcleos de lítio têm energias de ligação mais baixas por nucleon do que qualquer outros nuclídeos estáveis que não seja deutério e hélio-3. Como um resultado disso, embora muito leve em peso atómico, o lítio é menos comum do sistema solar de 25 dos primeiros 32 elementos químicos. Sete radioisótopos foram identificados, sendo os mais estáveis 8 Li com uma semi-vida de 838 MS e 9 Li com uma semi-vida de 178 ms. Todos os restantes isótopos radioativos possuem meias-vidas que são mais curtos do que 8,6 ms. O isótopo de vida mais curta de lítio é de 4 Li, que decai através emissão de protões e tem uma semi-vida de 7,6 x 10 -23 s.
7 Li é um dos elementos primordiais (ou, mais corretamente, primordial nuclídeos) produzidos em Nucleossíntese do Big Bang. Uma pequena quantidade de ambos 6 e 7 Li Li são produzidos em estrelas, mas pensa-se serem queimados tão rápido quanto produzido. Pequenas quantidades adicionais de lítio de ambos 6 e 7 Li Li pode ser gerada a partir do vento solar, raios cósmicos bater átomos mais pesados, e de início do sistema solar 7 Be e Be 10 decaimento radioativo. Enquanto lítio é criado em estrelas durante o Nucleossíntese estelar, é ainda mais queimado. 7 Li também pode ser gerado em Estrelas de carbono.
Isótopos de lítio fraccionar substancialmente durante uma ampla variedade de processos naturais, incluindo a formação de minerais (precipitação química), metabolismo, e de permuta iónica. Íons lítio substituto para magnésio e ferro em sítios octaédricos em argila minerais, onde 6 Li é o preferido para 7 Li, resultando em enriquecimento do isótopo leve em processos de hyperfiltration e alteração rock. O exótico 11 Li é conhecido por exibir uma auréola nuclear. O processo conhecido como separação isotópica por laser pode ser utilizada para separar isótopos de lítio.
Fabricação de armas nucleares e de outras aplicações de física nuclear são uma importante fonte de fracionamento de lítio artificial, com o isótopo leve 6 Li sendo retidos pela indústria e estoques militares, de tal forma como para um pouco, mas mensurável mudar a 6 e 7 Li Li, mesmo em proporções naturais fontes, tais como rios. Isto levou a incerteza incomum no padronizada peso atómico de lítio, uma vez que esta quantidade depende das proporções abundância natural destas que ocorrem naturalmente, isótopos estáveis de lítio, uma vez que estão disponíveis em fontes comerciais lítio minerais.
Ocorrência
Astronômico
Segundo a teoria cosmológica moderna, de lítio-como tanto de seu estábulo isótopos de lítio-6 e lítio-7-estava entre os três elementos sintetizado no Big Bang . Embora a quantidade de lítio gerado in Nucleossíntese do Big Bang é dependente do número de fótons por baryon, por valores aceitos a abundância de lítio pode ser calculada, e há uma "discrepância de lítio cosmológica" no Universo: estrelas mais velhas parecem ter menos de lítio do que deveriam, e algumas estrelas mais jovens têm muito mais. A falta de lítio em estrelas mais velhos é, aparentemente, causada por a "mistura" de lítio para o interior de estrelas, onde é destruído. Além disso, o lítio é produzido em estrelas mais jovens. Embora transmuta em dois átomos de hélio , devido à colisão com um próton em temperaturas acima de 2,4 milhões de graus Celsius (a maioria das estrelas atingir facilmente esta temperatura em seus interiores), o lítio é mais abundante do que o previsto em posteriores geração estrelas, por causas ainda não completamente entendido.
Apesar de ter sido um dos primeiros três elementos (em conjunto com hélio e hidrogénio) a ser sintetizado no Big Bang, lítio, em conjunto com berílio e boro são nitidamente menos abundante do que outros elementos próximos. Este é um resultado da baixa temperatura necessária para destruir de lítio, e uma falta de processos comuns para produzi-lo.
O lítio também é encontrada em marrom objetos subestelar anões e certas estrelas alaranjadas anômalos. Porque o lítio está presente em mais frias, menos maciças anãs castanhas, mas é destruído em mais quentes anãs vermelhas estrelas, a sua presença no espectro das estrelas podem ser usados no "teste de lítio" para diferenciar os dois, como ambos são menores do que o Sol . Certos estrelas laranja também pode conter uma elevada concentração de lítio. Estas estrelas laranja encontrados a ter uma maior concentração do que o habitual de lítio (tal como Centaurus-4 X) órbita enorme estrelas objetos-neutrões ou buracos negros cujas-gravidade puxa evidentemente mais pesado de lítio para a superfície de uma estrela de hidrogênio em hélio, causando mais de lítio para ser observado.
Terrestre
| País | Produção | Reservas |
|---|---|---|
| | 3.200 | 850.000 |
| | 9260 | 970.000 |
| | 160 | 64.000 |
| | 480 | 180.000 |
| | 12.600 | 7500000 |
| | 5200 | 3500000 |
| 820 | 10.000 | |
| | 470 | 23.000 |
| Total mundial | 34.000 | 13000000 |
Embora lítio é amplamente distribuída na Terra, que não ocorre naturalmente na forma elementar, devido à sua elevada reactividade. O teor total de lítio da água do mar é muito grande e é estimada como 230.000.000.000 toneladas, em que o elemento existe numa concentração relativamente constante de 0,14-0,25 partes por milhão (ppm), ou 25 micromolar; concentrações mais elevadas que se aproximam 7 ppm são encontrados perto fontes hidrotermais.
As estimativas para crustal gama de conteúdo 20-70 ppm por peso. Em consonância com o seu nome, o lítio constitui uma parte menor de rochas ígneas , com as maiores concentrações nos granitos . Granítico pegmatitos também fornecem a maior abundância de minerais contendo lítio, com spodumene e petalita sendo as fontes mais viáveis comercialmente. Outro mineral de lítio é significativa lepidolite. Uma fonte mais recente para o lítio é argila hectorite, o único desenvolvimento ativo do que vem pela Ocidental Lithium Corporation nos Estados Unidos. Aos 20 mg por kg de lítio da crosta terrestre, o lítio é o elemento mais abundante 25.
De acordo com o Manual de lítio e cálcio Natural, "Lithium é um elemento relativamente raro, embora seja encontrado em muitas rochas e algumas salmouras, mas sempre em concentrações muito baixas. Há um número bastante grande de ambos os depósitos minerais e de salmoura de lítio, mas única comparativamente alguns deles são de valor comercial, real ou potencial. Muitos são muito pequenos, outros são muito baixos em série. "
Uma das maiores reservas de lítio está no Área Salar de Uyuni da Bolívia , que tem 5,4 milhões de toneladas. US Geological Survey, estima que em 2010 o Chile teve as maiores reservas de longe (7,5 milhões de toneladas) ea produção máxima anual (8800 toneladas). Outros fornecedores importantes incluem a Austrália, Argentina e China.
Em junho de 2010, o New York Times informou que os geólogos americanos estavam realizando levantamentos de solo no seca lagos de sal no oeste do Afeganistão acreditando que grandes depósitos de lítio estão localizadas ali. "Autoridades do Pentágono disseram que sua análise inicial em um local em Província de Ghazni mostrou o potencial de depósitos de lítio tão grande daqueles da Bolívia, que agora tem as maiores reservas de lítio conhecidas no mundo. "Estas estimativas são" baseados principalmente em dados antigos, que foram coletadas principalmente pelos soviéticos durante a ocupação do Afeganistão a partir de 1979 -1989 "e" Stephen Peters, chefe do Afeganistão Minerals Projeto do USGS, disse que ele não tinha conhecimento de Envolvimento USGS em qualquer novo levantamento de minerais no Afeganistão nos últimos dois anos. "Nós não temos conhecimento de qualquer descobertas de lítio", disse ele. "
Biológico
O lítio é encontrado em quantidade traço em numerosas plantas, plâncton e invertebrados, em concentrações de 69 a 5760 partes por bilhão (ppb). Em vertebrados, a concentração é ligeiramente menor, e quase todos os tecidos dos vertebrados e fluidos corporais foram encontrados para conter lítio variando 21-763 ppb. Os organismos marinhos tendem a bioacumulação de lítio mais do que os terrestres. Não se sabe se o lítio tem um papel fisiológico em qualquer um destes organismos, mas estudos nutricionais em mamíferos têm indicado a sua importância para a saúde, o que leva a uma sugestão de que ser classificado como um elemento vestigial essencial com um RDA de 1 mg / dia. Estudos observacionais no Japão, relatadas em 2011, sugeriu que ocorre naturalmente de lítio em água potável pode aumentar a longevidade humana.
História da descoberta eo uso

Petalite (LiAlSi 4 O 10) foi descoberto em 1800 pelo brasileiro químico e estadista José Bonifácio de Andrada e Silva em uma mina na ilha de Utö, Suécia. No entanto, não foi até 1817 que Johan agosto Arfwedson, que então trabalhava no laboratório do químico Jöns Jakob Berzelius, detectou a presença de um novo elemento ao analisar minério petalita. Este elemento de compostos semelhantes aos da forma de sódio e de potássio , embora a sua e carbonato hidróxido foram menos solúveis em água e mais alcalino. Berzelius deu o material alcalino o nome "Lithion / lithina", do grego palavra λιθoς (transliterado como lithos, que significa "pedra"), de modo a reflectir a sua descoberta em um mineral sólido, ao contrário de potássio, que tinha sido descoberto em cinzas de plantas , e de sódio, que foi, em parte, conhecidos pela sua elevada abundância no sangue dos animais. Ele nomeou o metal dentro do "lítio" material.
Arfwedson posterior mostrou que esta mesma elemento estava presente nos minerais spodumene e lepidolite. Em 1818, Christian Gmelin foi o primeiro a observar que os sais de lítio dão uma cor vermelha brilhante a chama. No entanto, ambos Arfwedson e Gmelin tentou e não conseguiu isolar o elemento puro de seus sais. Ele não foi isolado até 1821, quando William Thomas Brande obteve por eletrólise de óxido de lítio, um processo que tinha sido anteriormente utilizado pelo químico Sir Humphry Davy para isolar o potássio os metais alcalinos e de sódio. Brande também descritos alguns sais puros de lítio, tais como o cloreto, e, estimando-se que lithia ( óxido de lítio) continha cerca de 55% de metal, estima o peso atômico de lítio para ser em torno de 9,8 g / mol (valor moderno ~ 6,94 g / mol). Em 1855, grandes quantidades de lítio foram produzidas através da eletrólise da cloreto de lítio por Robert Bunsen e Augustus Matthiessen. A descoberta deste procedimento doravante conduziu à produção comercial de lítio, a partir de 1923, pela empresa alemã Metallgesellschaft AG, que efectuou uma electrólise de uma mistura líquida de cloreto de lítio e cloreto de potássio.
A produção eo uso de lítio sofreu várias mudanças drásticas na história. A primeira grande aplicação de lítio foi em alta temperatura lítio graxas para motores de aeronaves ou aplicações semelhantes em II Guerra Mundial e, pouco depois. Este uso foi apoiada pelo fato de que, com base de lítio- sabões têm um ponto de fusão mais elevado do que outros sabões alcalinos, e são menos corrosivos do que os sabões à base de cálcio. O pequeno mercado para os sabões de lítio e as graxas lubrificantes baseados neles foi apoiada por várias operações de pequena mineração principalmente nos Estados Unidos.
A demanda por lítio aumentou dramaticamente durante a Guerra Fria com a produção de armas de fusão nuclear. Ambos produzem lítio-6 e lítio-7 trítio quando irradiado por neutrões, e por isso são úteis para a produção de trítio, por si só, bem como uma forma de combustível sólido de fusão utilizado no interior bombas de hidrogénio sob a forma de deutereto de lítio . Os Estados Unidos tornaram-se o principal produtor de lítio no período entre o final dos anos 1950 e meados dos anos 1980. No final, o estoque de lítio foi de aproximadamente 42.000 toneladas de hidróxido de lítio. O lítio estocadas foi esgotada em lítio-6 em 75%, o que foi suficiente para afetar a medida peso atômico de lítio em muitos produtos químicos padronizados, e até mesmo o peso atômico do lítio em algumas "fontes naturais" de iões de lítio, que tinha sido "contaminadas" por sais de lítio descarregados a partir de instalações de separação de isótopos, que tinha encontrado o seu caminho em águas subterrâneas.
Lítio foi utilizado para diminuir a temperatura de fusão do vidro e para melhorar o comportamento à fusão do óxido de alumínio quando se utiliza o Processo Hall-Héroult. Estes dois usos dominou o mercado até meados da década de 1990. Após o final do corrida de armas nucleares a demanda por lítio diminuiu ea venda do Departamento de estoques de energia no mercado livre, os preços ainda mais reduzidos. Mas em meados da década de 1990, várias empresas começaram a extrair lítio salmoura, que provou ser um método menos caro do que a mineração subterrânea ou mesmo a céu aberto. A maioria das minas fechadas ou mudaram seu foco para outros materiais como só o minério de pegmatitos zoneadas pode ser extraído por um preço competitivo. Por exemplo, as minas norte-americanas perto Kings Mountain, Carolina do Norte fechou antes da virada do século 21.
A utilização de baterias de iões de lítio aumentou a demanda por lítio e tornou-se o uso dominante em 2007. Com o aumento da demanda de lítio em baterias na década de 2000, novas empresas têm se expandido esforços de extração de salmoura para atender a crescente demanda.
Produção


Desde o fim da II Guerra Mundial a produção de lítio tem aumentado bastante. O metal é separado de outros elementos minerais ígneas , tais como aqueles acima. Os sais de lítio são extraídos a partir da água de nascentes de água mineral, piscinas salmoura e depósitos de salmoura. O metal é produzido electroliticamente a partir de uma mistura fundida de 55% cloreto de lítio e 45% cloreto de potássio em cerca de 450 o C. Em 1998 foi cerca de 95 US $ / kg (ou 43 US $ / libra).
Reservas mundiais identificados de lítio em 2008 foram estimadas pela US Geological Survey como 13 milhões toneladas. Depósitos de lítio são encontrados na América do Sul durante todo o Andes cadeia de montanhas. Chile é o maior produtor de lítio líder, seguido por Argentina . Ambos os países recuperar o lítio de piscinas de água salgada. No lítio Estados Unidos é recuperado a partir de misturas em salmoura Nevada. No entanto, metade das reservas conhecidas do mundo estão localizados na Bolívia , uma nação que senta-se ao longo da encosta oriental central dos Andes. Em 2009 Bolívia estava negociando com o japonês, francês, e as empresas coreanas para começar a extração. De acordo com US Geological Survey, da Bolívia Uyuni Deserto tem 5,4 milhões de toneladas de lítio.
Uma fonte potencial é poços geotérmicos. Os fluidos geotérmicos transportar lixiviados para a superfície; recuperação de lítio foi demonstrado no domínio. À medida que o lítio é separado por técnicas de filtração simples, o processo e os custos ambientais que são principalmente do geotérmico já operando bem; impactos ambientais relativas podem, assim, ser positiva.
De acordo com um estudo realizado em 2011 Lawrence Berkeley National Laboratory e da University of California Berkeley, a base de incidência estimada atualmente de lítio não deve ser um fator limitante para a produção de baterias de grande escala para veículos eléctricos, como o estudo estimou que na ordem de 1 bilhão 40 baterias à base de Li kWh poderia ser construído com reservas atuais. Outro estudo de 2011 por pesquisadores da Universidade de Michigan e Ford Motor Company descobriu que há recursos de lítio suficientes para apoiar a demanda global até 2100, incluindo o lítio necessário para o potencial uso generalizado de elétrico híbrido, plug-in híbridos e elétricos bateria veículos elétricos. O estudo estima reservas de lítio globais em 39 milhões de toneladas, e demanda total de lítio durante o período de 90 anos analisado no intervalo de 12-20 milhões de toneladas, dependendo dos cenários em relação ao crescimento econômico e taxas de reciclagem.
Aplicações

Cerâmica e vidro
Óxido de lítio é um fluxo amplamente utilizado para o processamento de sílica , reduzindo o ponto de fusão e viscosidade do material e levando a esmaltes de propriedades físicas melhoradas incluindo baixos coeficientes de expansão térmica. Óxidos de lítio são um componente de loiça. Em todo o mundo, este é o maior uso único para compostos de lítio (ver gráfico). O carbonato de lítio (Li 2 CO 3) é geralmente utilizado neste pedido: quando aquecido, converte-se o óxido.
Elétrica e eletrônica
Nos últimos anos do século 20 tornou-se lítio importante como material do ânodo. Usado em baterias de íon lítio por causa de sua alta potencial electroquímico, uma célula típica pode gerar cerca de 3 volts , em comparação com 2,1 volts durante chumbo / ácido ou 1,5 volts durante células de zinco-carbono. Devido à sua baixa massa atômica, ele também tem um alto exigível e relação potência-peso. As baterias de lítio são descartável ( primária) baterias com lítio ou de seus compostos como um ânodo. As baterias de lítio não devem ser confundidos com baterias de lítio-íon, que são de alta densidade de energia baterias recarregáveis. Outros incluem a baterias recarregáveis bateria de polímero de lítio-íon, lítio ferro fosfato de bateria, ea bateria nanofio.
As graxas lubrificantes
O terceiro uso mais comum de lítio está em graxas. De hidróxido de lítio é um forte base e, quando aquecido com uma gordura, produz um sabão de lítio feita estearato. De sabão de lítio tem a capacidade de espessar óleos, e que é utilizado para a fabricação de todos os fins, de alta temperatura graxas lubrificantes.
Alloys
Quando utilizado como um fluxos para soldagem ou solda, lítio metálico promove a fusão dos metais durante o processo e elimina a formação de óxidos de absorção de impurezas. A sua qualidade de fusão também é importante como um fluxo para a produção cerâmicas, esmaltes e vidro. As ligas do metal com alumínio, cádmio , cobre e manganês são usados para fazer peças de aeronaves de alto desempenho (ver também Ligas de lítio-alumínio). Compostos de lítio também são utilizados como corantes de pirotecnia e oxidantes em vermelho fogos de artifício e flares.
Outra química e usos industriais

Purificação do ar
O cloreto de lítio e brometo de lítio são higroscópico e são utilizados como dessecantes para correntes de gás. E hidróxido de lítio peróxido de lítio são os sais mais utilizados em áreas confinadas, como a bordo naves espaciais e submarinos , para a remoção de dióxido de carbono e purificação do ar. Hidróxido de lítio absorve o dióxido de carbono a partir do ar através da formação de carbonato de lítio, e é preferível a outros hidróxidos alcalinos para seu baixo peso.
Peróxido de lítio (Li 2 O 2) na presença de humidade não só absorve o dióxido de carbono para formar o carbonato de lítio, mas também liberta oxigénio. Por exemplo:
- 2 Li 2 O 2 + 2 CO 2 → 2 Li 2 CO 3 + O 2.
Alguns dos compostos acima mencionados, assim como clorato de lítio, são utilizados em velas de oxigênio que fornecem submarinos com oxigênio .
Ótica
Fluoreto de lítio, cresceram artificialmente como cristal , é claro e transparente e, muitas vezes usado em ótica especialista para IR, UV e VUV ( UV vácuo ) aplicações. Ele tem um dos mais baixos índices de refração e da faixa de transmissão mais distante no profundo UV da maioria dos materiais comuns. Finamente dividido fluoreto de lítio em pó tem sido usado para dosimetria radiação termoluminescência (TLD): quando uma amostra de tais é exposto a radiação, que se acumula defeitos nos cristais que, quando aquecida, por meio de resolver a libertação de luz azulada cuja intensidade é proporcional à dose absorvida, permitindo assim que esta a ser quantificado. Fluoreto de lítio é usado às vezes em lentes focais de telescópios .
A alta não-linearidade de niobato de lítio também faz com que seja útil em aplicações ópticas não-lineares. Ele é usado extensivamente em produtos de telecomunicações, como telefones celulares e moduladores ópticos, para componentes como cristais ressonante. Aplicações de lítio são utilizados em mais do que 60% dos telefones móveis.
Compostos de lítio em química orgânica e dos polímeros
Compostos de organolítio são amplamente utilizados na produção de polímeros e de produtos químicos finos. Na indústria de polímero, que é o consumidor dominante destes reagentes, compostos alquil-litio são os catalisadores / iniciadores. em polimerização aniónica de não funcionalizados olefinas . Para a produção de produtos químicos finos, compostos de organolítio funcionar como bases fortes e como reagentes para a formação de ligações carbono-carbono. Composto de organo-lítio são preparados a partir de lítio metálico e halogenetos de alquilo.
Muitos outros compostos de lítio são usadas como reagentes para preparar os compostos orgânicos. Alguns compostos populares incluem hidreto de alumínio e lítio (LiAlH4), trietilboro-hidreto de lítio (LiBH (C 2 H 5) 3).
Aplicações militares
Lítio metálico e do seu complexo hidretos, tais como Li [AlH 4] , são utilizados como aditivos de alta energia para Os propulsores de foguetes.

O Mark 50 Torpedo sistema de propulsão a energia química armazenada (SCEPS) usa um pequeno tanque de gás hexafluoreto de enxofre, que é pulverizada sobre um bloco de lítio sólido. A reacção gera calor que é utilizado para gerar vapor. O vapor impele o torpedo num fechado Ciclo de Rankine.
Nuclear
Lítio-6 é valorizada como fonte de materiais para produção de trítio e como absorvedor de nêutrons em fusão nuclear. Lítio natural contém cerca de 7,5% de lítio-6 a partir do qual grandes quantidades de lítio-6 foram produzidos por de separação de isótopos para uso em armas nucleares . Lítio-7 ganhou interesse para utilização em reator nuclear refrigerantes.

Deuteride lítio foi o combustível de fusão de escolha em versões mais antigas do bomba de hidrogênio . Quando bombardeado por nêutrons , ambos 6 e 7 Li Li produzir trítio - esta reacção, o qual não foi totalmente compreendido quando bombas de hidrogênio foram testados, foi responsável pelo rendimento do fugitivo do Castelo Bravo teste nuclear. Trítio funde com deutério numa reacção de fusão que é relativamente fácil de conseguir. Embora os detalhes permanecem em segredo, lítio-6 deuteride ainda aparentemente desempenha um papel na modernas armas nucleares , como um material de fusão.
Fluoreto de lítio, quando altamente enriquecido em isótopo lítio-7, forma o componente básico da mistura de sal de fluoreto LiF- BeF 2 utilizado em reactores nucleares de flúor líquidos. Fluoreto de lítio é excepcionalmente estável quimicamente e LIF-BeF duas misturas têm pontos de fusão baixos. Além disso, 7 Li, Be, e F estão entre os poucos nuclides com baixa o suficiente secções transversais captura de neutrões térmicos para não envenenar as reações de fissão dentro de um reator de fissão nuclear.
Em nuclear conceituada centrais eléctricas de fusão, de lítio será usado para produzir trítio nas reatores magneticamente confinados usando deutério e trítio, como o combustível. Que ocorre naturalmente trítio é extremamente rara, e deve ser produzido sinteticamente através de reacção em torno do plasma com uma "cobertura" que contém lítio onde neutrões a partir da reacção de deutério e de trítio no plasma irá fissão de lítio para produzir mais trítio:
- 6 Li + n → 4 He + 3 T.
O lítio também é usado como uma fonte para partículas alfa, ou hélio núcleos. Quando 7 Li é bombardeado por acelerados prótons 8 Ser é formada, que sofre fissão para formar duas partículas alfa. Essa façanha, chamado de "dividir o átomo" na época, foi o primeiro totalmente feito homem- reação nuclear. Foi produzido pela Cockroft e Walton em 1932. (As reações nucleares e humano-dirigido transmutação havia sido realizado tão cedo quanto 1917, mas usando bombardeio radioativo natural compartículas alfa).
Medicina
No tratamento de transtorno bipolar, compostos de lítio continuam a ser o padrão contra o qual novos medicamentos são medidos. Os sais de lítio podem também ser úteis para diagnósticos relacionados, tais como transtorno esquizoafetivo e cíclico depressão maior. O princípio activo nestes sais é o lítio íon Li + , embora os mecanismos detalhados são debatidas.
Precauções
| NFPA 704 |
|---|
 0 3 2 |
| O signo de fogo perigo diamante para o metal de lítio |
O lítio é corrosivo e requer um tratamento especial para evitar contato com a pele. A respiração de poeira lítio ou compostos de lítio (que são muitas vezes alcalina) inicialmente irritar o nariz e garganta, enquanto a exposição maior pode causar um acúmulo de líquido nos pulmões, levando a edema pulmonar. O metal em si é um risco, porque a manipulação do hidróxido cáustico produzido quando está em contacto com a humidade. Lítio é armazenado de forma segura em compostos não reactivos, tais como nafta.
Houve sugestões de aumento do risco de desenvolvimento deanomalia de Ebstein cardíaca em crianças nascidas de mulheres que tomam lítio durante o primeiro trimestre da gravidez.
Regulação
Algumas jurisdições limitar a venda de baterias de lítio, que são a fonte mais prontamente disponível de lítio para os consumidores comuns. Lítio pode ser usado para reduzir a pseudoefedrina e efedrina de metanfetamina no método de redução de Birch, que emprega soluções de metais alcalinos dissolvidos em anidro amoníaco . Transporte e embarque de alguns tipos de baterias de lítio podem ser proibidos a bordo de certos tipos de transporte (particularmente aeronaves) por causa da capacidade da maioria dos tipos de baterias de lítio para descarregar completamente muito rapidamente quando em curto-circuito, levando ao superaquecimento e possível explosão em um processo chamado fuga térmica. A maioria das baterias de lítio consumidor tem proteção de sobrecarga térmica embutida para evitar este tipo de incidente, ou seu projeto limita inerentemente correntes de curto-circuito. Shorts internas têm sido conhecida a desenvolver devido a defeitos de fabricação ou danos às baterias que podem levar à fuga térmica espontânea.

