
Níquel
Antecedentes de las escuelas de Wikipedia
SOS ofrecen una descarga completa de esta selección para las escuelas para su uso en escuelas intranets. patrocinio SOS Niño es cool!
| Níquel | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
28 Ni | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||||||||||||||
brillante, metálico, y la plata con un tinte de oro  | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | níquel, Ni, 28 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / n ɪ k əl / NIK -əl | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | metal de transición | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 10, 4, d | ||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 58,6934 (4) (2) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Ar ] 4s 2 3d 8 o [ Ar ] 4s 3d 1 9 (ver texto) 2, 8, 16, 2 o 2, 8, 17, 1 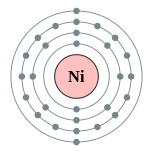 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Axel Fredrik Cronstedt (1751) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Axel Fredrik Cronstedt (1751) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 8,908 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 7,81 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1728 K , 1455 ° C, 2651 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 3186 K, 2913 ° C, 5275 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 17.48 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 377.5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 26.07 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 4, 3, 2, 1, -1 (Levemente óxido básico) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,91 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 737.1 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1753,0 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 3395 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 124 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 124 ± 16:00 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radio | 163 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | cara cúbica centrada  | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | ferromagnético | ||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 69,3 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 90,9 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 13,4 m · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | ( rt) 4900 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | 200 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | 76 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 180 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Relación de Poisson | 0.31 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 4.0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 638 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 700 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-02-0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de níquel | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
El níquel es un elemento químico con el símbolo químico Ni y número atómico 28. Es un lustroso blanco plateado de metal con un ligero matiz dorado. Níquel pertenece a los metales de transición y es duro y dúctil. El níquel puro muestra una actividad química significativa que se puede observar cuando el níquel es polvo para maximizar la expuesta en el que puede ocurrir reacciones área de superficie, pero las piezas más grandes del metal son lentos para reaccionar con el aire a condiciones ambientales debido a la formación de una superficie de óxido protectora. Incluso entonces, el níquel es lo suficientemente reactivo con oxígeno para que níquel nativa rara vez se encuentra en la superficie de la Tierra, que se limita principalmente a los interiores de mayor meteoritos de níquel-hierro que fueron protegidos de la oxidación durante su tiempo en el espacio. En la Tierra, como el níquel nativa se encuentra siempre en combinación con el hierro, un reflejo de origen esos elementos "como los principales productos finales de nucleosíntesis supernova. Una mezcla de hierro y níquel se cree que componen la Tierra núcleo interno.
El uso de níquel (como naturales meteórica aleación de níquel-hierro) se ha trazado ya en 3500 antes de Cristo. El níquel se aisló y se clasifica como un elemento químico en 1751 por primera Axel Fredrik Cronstedt, que inicialmente confundió su de mineral para un mineral de cobre. El nombre del elemento viene de un sprite travieso de la mitología de los mineros alemanes, Níquel (similar a Old Nick), que personificaba el hecho de que los minerales de cobre-níquel resistieron refinamiento en cobre. Una fuente de la importancia económica de níquel es el hierro mineral limonita, que a menudo contiene 1-2% de níquel. Otros minerales de mineral de níquel importantes incluyen garnierita, y pentlandita. Principales centros de producción incluyen Región de Sudbury en Canadá (que se cree que es de origen meteórico), Nueva Caledonia , en el Pacífico y Norilsk en Rusia.
Debido a ritmo lento de níquel de la oxidación a temperatura ambiente, se considera resistente a la corrosión. Históricamente esto ha llevado a su uso para metales enchapado tales como hierro y latón, para su uso para aparatos químicos, y su uso en ciertas aleaciones que retienen un alto brillo plateado, tales como Plata alemana. Alrededor del 6% de la producción mundial de níquel todavía se utiliza para resistente a la corrosión de recubrimiento de níquel puro. Níquel fue una vez un componente común de las monedas, pero ha sido reemplazado por el hierro más barato para este propósito, sobre todo porque el metal es una piel alergénico para algunas personas.
El níquel es uno de los cuatro elementos que son ferromagnético alrededor de la temperatura ambiente. Alnico imanes permanentes basados en parte en níquel son de fuerza intermedia entre los imanes permanentes a base de hierro y imanes de tierras raras. El metal es principalmente valioso en el mundo moderno de la aleaciones que forma; aproximadamente el 60% de la producción mundial se utiliza en níquel-aceros (en particular acero inoxidable). Otras aleaciones comunes, así como algunos de los nuevos superaleaciones, constituyen la mayor parte del resto de su uso mundial de níquel, con utiliza químicos para los compuestos de níquel que consumen menos del 3% de la producción. Como un compuesto, níquel tiene un número de usos de fabricación nicho químicos, tales como una catalizador para la hidrogenación. Las enzimas de algunos microorganismos y plantas contienen níquel como una sitio activo, lo que hace que el metal un nutriente esencial para ellos.
Características
Propiedades atómicas y físicas
El níquel es un metal blanco plateado con un ligero matiz dorado que tiene un buen pulido. Es uno de los cuatro elementos que son magnético en o cerca de la temperatura ambiente, los otros son el hierro, el cobalto y el gadolinio . Su Temperatura de Curie es de 355 ° C, lo que significa que el níquel mayor es no magnético por encima de esta temperatura. La celda unitaria de níquel es una cara del cubo centrado con el parámetro de red de 0.352 nm dando una radio atómico de 0.124 nm. Níquel pertenece a los metales de transición y es duro y dúctil.
Disputa configuración electrónica
El átomo de níquel tiene dos configuraciones electrónicas, [Ar] 4s 2 3d 8 y [Ar] 4s 3d 1 9, que están muy cerca de la energía, donde el símbolo [Ar] se refiere al argón estructura central -como. Hay un cierto desacuerdo en cuanto a que se debe considerar la configuración de energía más bajo. Los libros de texto de química citan la configuración electrónica de níquel como [Ar] 4s 2 3d 8, o equivalentemente como [Ar] 3d 8 4s 2. Esta configuración está de acuerdo con el Regla de ordenación energética Madelung, que predice que 4s se llena antes de 3d. Se apoya en el hecho experimental de que el estado de energía más bajo del átomo de níquel es un nivel de energía 4s 2 3d 8, específicamente el 3d 8 (3 F) 4s 2 3 F, J = 4 nivel.
Sin embargo cada uno de estos dos configuraciones de hecho da lugar a un conjunto de estados en diferentes energías. Los dos conjuntos de energías se superponen, y la energía media de los estados que tienen configuración [Ar] 4s 3d 1 9 es de hecho menor que la energía media de los estados que tienen configuración [Ar] 4s 2 3d 8. Por esta razón, la literatura de investigación sobre cálculos atómicos cita a la configuración del estado fundamental del níquel como 4s 3d 1 9.
Isótopos
Naturalmente níquel ocurre se compone de 5 estables isótopos ; 58 Ni, 60 Ni, Ni 61, 62 y 64 de Ni Ni con 58 Ni siendo el más abundante (68,077% abundancia natural). 62 Ni es el nucleido más estable de todos los elementos existentes, con energía de enlace mayor que tanto 56 Fe, a menudo incorrectamente citarse como más estable, y 58 Fe. 18 radioisótopos se han caracterizado por ser el más estable 59 Ni con una vida media de 76.000 años, 63 de Ni, con una vida media de 100,1 años, y 56 Ni con una vida media de 6,077 días. Todos los restantes isótopos radiactivos tienen vidas medias que son menos de 60 horas y la mayoría de ellos tienen vidas medias que son menos de 30 segundos. Este elemento también tiene uno estado meta.
Níquel-56 se produce por la proceso de grabación de silicio y posteriormente puesto en libertad en grandes cantidades durante tipo Ia supernovas . La forma de la curva de luz de estas supernovas en intermedia y finales de los tiempos corresponde a la decadencia a través de captura de electrones de níquel-56 al cobalto -56 y en última instancia al hierro-56. Níquel-59 es una larga vida cosmogénico radionucleidos con una vida media de 76.000 años. 59 Ni ha encontrado muchas aplicaciones en isótopo geología. 59 Ni se ha utilizado hasta la fecha la edad terrestre de meteoritos y determinar la abundancia de polvo extraterrestre en hielo y sedimentos . Níquel-60 es el producto de la hija del radionúclido extinto 60 Fe, que se desintegra con una vida media de 2,6 millones de años. Porque 60 Fe tiene una vida media tan larga, su persistencia en los materiales en el sistema solar en concentraciones suficientemente altas puede haber generado variaciones observables en la composición isotópica de 60 Ni. Por lo tanto, la abundancia de 60 Ni presente en material extraterrestre puede ayudar a determinar el origen del sistema solar y su historia temprana. Níquel-62 tiene el mayor energía de enlace por nucleón de cualquier isótopo de cualquier elemento (8,7946 MeV / nucleón). Isótopos más pesados que el 62 Ni no se puede formar por la fusión nuclear sin perder energía. 48 Ni, descubierto en 1999, es el elemento más isótopo pesado rico en protones conocido. Con 28 protones y 20 neutrones 48 Ni es " doble mágica "(como 208 Pb ) y por lo tanto inusualmente estable.
Los isótopos del rango de níquel en peso atómico de 48 u (48 NI) a 78 u (78 Ni). La vida media de níquel-78 se midió recientemente en 110 milisegundos, y se cree un isótopo importante en nucleosíntesis supernova de elementos más pesados que el hierro.
Aparición

En la Tierra, el níquel se produce más a menudo en combinación con azufre y hierro en pentlandita, con azufre en millerite, con arsénico en el mineral nickeline, y con el arsénico y azufre en níquel galena. El níquel se encuentra comúnmente en meteoritos de hierro como las aleaciones kamacite y taenite.
La mayor parte del níquel extraído proviene de dos tipos de depósitos de mineral. Los primeros son lateritas donde los principales minerales de mena son niquelífero limonita: (Fe, Ni) O (OH) y garnierita (un silicato de níquel hidratado): (Ni, Mg) 3 Si 2 O 5 (OH) 4. El segundo son los depósitos de sulfuros magmáticos donde el mineral principal mineral es pentlandita: (Ni, Fe) 9 S 8.
Australia y Nueva Caledonia tienen las reservas más grandes de estimación (45% en conjunto).
En términos de los Recursos Mundiales, recursos terrestres identificadas promedio de 1% de níquel o mayor contienen al menos 130 millones de toneladas de níquel (alrededor del doble de las reservas conocidas). Alrededor del 60% se encuentra en lateritas y el 40% está en depósitos de sulfuro.
Basado en evidencia geofísica, la mayor parte del níquel en la Tierra se postula a concentrarse en la de la Tierra núcleo externo y núcleo interno. Kamacite y taenite están ocurriendo de forma natural aleaciones de hierro y níquel. Para kamacite la aleación es por lo general en la proporción de 90:10 a 95: 5, aunque impurezas tales como cobalto o de carbono pueden estar presentes, mientras que para taenite el contenido de níquel está entre 20% y 65%. Kamacite y taenite ocurren en meteoritos de hierro níquel.
Compuestos
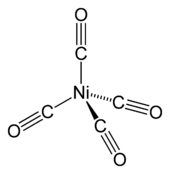
El más común estado de oxidación del níquel es 2, pero los compuestos de Ni 0, Ni +, y Ni 3+ son bien conocidos, y Ni 4+ ha sido demostrada.
Níquel (0)
Tetracarbonylnickel (Ni (CO) 4), descubierto por Ludwig Mond, es un líquido volátil, altamente tóxico a temperatura ambiente. Con el calentamiento, el complejo se descompone de nuevo a níquel y monóxido de carbono:
- Ni (CO) 4
 Ni + 4 CO
Ni + 4 CO
Este comportamiento es explotada en el Mond proceso para la purificación de níquel, como se describe anteriormente. El níquel relacionados (0) complejo bis (ciclooctadieno) níquel (0) es un catalizador útil en química organoníquel debido a los desplazados fácilmente ligandos de bacalao.
Níquel (I)
Níquel (i) compuestos y complejos son raros. El rojo oscuro K diamagnético 4 [2 Ni (CN) 6] es un ejemplo representativo de Ni (I). Se prepara por reducción de 2 K [2 Ni (CN) 6] utilizando amalgama de sodio. Este compuesto es inestable y libera H 2 gas de agua.
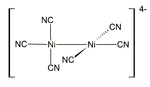
Níquel (II)


Níquel (II) forma compuestos con todos los aniones comunes, es decir, el sulfuro, sulfato, carbonato, hidróxido, carboxilatos y haluros. Níquel (II) sulfato se produce en grandes cantidades por disolución de metal de níquel u óxidos en ácido sulfúrico. Existe como la vez un hexa y heptahydrates. Este compuesto es útil para níquel galvanoplastia.
Los cuatro halógenos forman compuestos de níquel, todos los cuales adoptan geometrías octaédricos. Níquel (II) de cloruro es más común, y su comportamiento es ilustrativa de los otros haluros. Níquel (II) cloruro se produce disolviendo los residuos de níquel en ácido clorhídrico. El dicloruro se encuentra generalmente como el hexahidrato de verde, pero puede ser deshidratado para dar el NiCl anhidro amarilla 2. Algunos complejos de níquel tetracoordinado (II) forman ambas geometrías planas tetraédricos y cuadrados. Los complejos son tetraédricos complejos paramagnéticos y la plaza son planas diamagnético. Este equilibrio, así como la formación de complejos octaédricos contrasta con el comportamiento de los complejos divalentes de los más pesados grupo de 10 metales, paladio (II) y platino (II), que tienden a adoptar sólo complejos de cuadrados planas.
Niqueloceno se conoce; que tiene un recuento de electrones de 20, por lo que es relativamente inestable.

Níquel (III) y (IV)
Para los compuestos simples, níquel (III) y níquel (IV) se produce sólo con flúor y óxidos, con la excepción de KNiIO 6, que puede ser considerado como una sal formal de la [IO 6] 5- iones. Ni (IV) está presente en el óxido mixto banio 3, mientras que Ni (III) está presente en óxido de níquel (III), que se utiliza como el cátodo en muchos baterías recargables, incluyendo níquel-cadmio, de níquel-hierro, de hidrógeno de níquel, y hidruro de níquel-metal, y utilizado por algunos fabricantes en Baterías de ion-litio. Níquel (III) puede ser estabilizado por ligandos σ-donantes, tales como tioles y fosfinas.
Historia
Debido a que los minerales de níquel se confunden fácilmente con los minerales de plata, la comprensión de este metal y su uso data de tiempos relativamente recientes. Sin embargo, el uso intencional de níquel es antigua y se remonta tan lejos como 3500 AC. Bronces de lo que hoy es Siria había contenido hasta un 2% de níquel. Además, hay manuscritos chinos sugieren que "cobre blanco" ( cuproníquel, conocido como Baitong) se utilizó allí entre 1700 y 1400 antes de Cristo. Este cobre blanco Paktong se exportó a Inglaterra, ya desde el siglo 17, pero el contenido de níquel de esta aleación no fue descubierto hasta 1822.
En Alemania medieval, un mineral de color rojo se encuentra en el Erzgebirge (Montes Metálicos) que se asemejaba mineral de cobre. Sin embargo, cuando los mineros no pudieron extraer cualquier cobre de ella, culpaban un sprite travieso de la mitología alemana, Níquel (similar a Old Nick), por que vive el cobre. Llamaron a este mineral Kupfernickel del Kupfer alemán para el cobre. Este mineral se sabe ahora nickeline o niccolite, un níquel arseniuro. En 1751, el barón Axel Fredrik Cronstedt estaba tratando de extraer el cobre de kupfernickel-y en su lugar produce un metal blanco que lleva el nombre del espíritu que había dado su nombre al mineral, níquel. En alemán moderno, Kupfernickel o Kupfer-Níquel designa la aleación cuproníquel.
Después de su descubrimiento, la única fuente de níquel era la rara Kupfernickel pero, desde 1824 en adelante, el níquel se obtuvo como un subproducto de producción de azul cobalto. El primer productor a gran escala de níquel fue Noruega, que explotaba rica en níquel pirrotita a partir de 1848 en. La introducción de níquel en la producción de acero en 1889 aumentó la demanda de níquel, y los depósitos de níquel de Nueva Caledonia , que fueron descubiertos en 1865, proporcionó la mayor parte de la oferta mundial entre 1875 y 1915. El descubrimiento de los grandes depósitos en el Cuenca de Sudbury, Canadá, en 1883, en Norilsk-Talnakh, Rusia en 1920, y en el Merensky Arrecife, Sudáfrica, en 1924 hizo que la producción a gran escala de níquel posible.

El níquel ha sido un componente de monedas desde el siglo de mid-19th. En los Estados Unidos, el término "níquel" o "nick" originalmente aplicado a la de cobre-níquel Volar ciento Eagle, que sustituyó el cobre con el 12% de níquel 1857-1858, el Indian Head ciento de la misma aleación 1859 a 1.864. Aún más tarde, en 1865, el término designa el níquel de tres ciento, con el níquel aumentó a 25%. En 1866, la níquel de cinco centavos escudo (25% de níquel, 75% de cobre) se apropió de la designación. Junto con la proporción de la aleación, este término se ha utilizado para la presente en los Estados Unidos. Monedas de níquel casi puro se utilizaron por primera vez en 1881 en Suiza, y más notablemente 99.9% de níquel monedas de cinco centavos fueron acuñadas en Canadá (el mayor productor de níquel del mundo en ese momento), durante años no son de guerra desde 1.922 hasta 1.981, y su composición metálica hicieron estas monedas magnético. Durante el período de guerra 1942-1945, más o todo el níquel fue retirado de monedas de Canadá y Estados Unidos, debido al uso de la guerra crítico de níquel en armadura. Canadá cambió de nuevo para aleaciones de acero chapado durante el Guerra de Corea, pero se vio obligado a dejar de hacer "centavos" puros de níquel en 1981, reservando la aleación de níquel puro 99,9% después de 1968 sólo a sus monedas de mayor valor. Por último, en el siglo 21, con el aumento de los precios del níquel, la mayoría de los países que antes se utilizaban níquel en sus monedas han abandonado el metal por razones de costo, y los EE.UU. cinco centavos sigue siendo una de las pocas monedas que aún utiliza el metal para que no sea nada exterior chapado.
La producción mundial
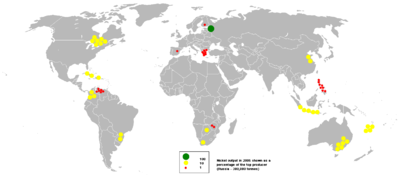
| La producción y las reservas de la mina | 2010 | 2011 | Reservas |
|---|---|---|---|
| Australia | 170000 | 180000 | 24000000 |
| Botswana | 28000 | 32000 | 490000 |
| Brasil | 59100 | 83000 | 8700000 |
| Canadá | 158000 | 200000 | 3300000 |
| China | 79000 | 80000 | 3000000 |
| Colombia | 72000 | 72000 | 720000 |
| Cuba | 70000 | 74000 | 5500000 |
| República Dominicana | 0 | 14000 | 1000000 |
| Indonesia | 232000 | 230000 | 3900000 |
| Madagascar | 15000 | 25000 | 1600000 |
| Nueva Caledonia | 130000 | 140000 | 12000000 |
| Filipinas | 173000 | 230000 | 1100000 |
| Rusia | 269000 | 280000 | 6000000 |
| Sudáfrica | 40000 | 42000 | 3700000 |
| Otros países | 99000 | 100000 | 4600000 |
| Total mundial (toneladas métricas, redondeadas) | 1590000 | 1800000 | 80000000 |
En 2011, Rusia fue el mayor productor de níquel con aproximadamente una quinta mundo comparten seguido de cerca por Canadá, Australia e Indonesia y Filipinas, según ha informado el Servicio Geológico de los Estados Unidos. Los mayores yacimientos de níquel en Europa no rusa se encuentran en Finlandia y el segundo más grande de Grecia. Un depósito de níquel en el oeste de Turquía había sido explotada, con esta ubicación ya que está especialmente conveniente para las fundiciones europeas, siderúrgicas y fábricas.
Recursos terrestres identificadas promedio de 1% de níquel o mayor contienen al menos 130 millones de toneladas de níquel. Alrededor del 60% se encuentra en lateritas y el 40% se encuentra en depósitos de sulfuros. Además, gran cantidad de recursos de aguas profundas de níquel están en costras y nódulos de manganeso que cubren grandes áreas del suelo marino, en particular en el Océano Pacífico.
La única localidad en los Estados Unidos, donde el níquel se extraía comercialmente es Riddle, Oregon, donde se encuentran varios kilómetros cuadrados de níquel que devengan los depósitos superficiales garnierita. La mina se cerró en 1987. El Proyecto de la mina Eagle es una nueva mina de níquel propuesta en Michigan península superior.
Extracción y purificación
El níquel se recupera a través de metalurgia extractiva. El níquel se extrae de sus minerales por procesos de tostación y reducción convencionales que producen un metal de más de 75% de pureza. En muchos aplicaciones de acero inoxidable, 75% de níquel puro pueden ser utilizados sin purificación adicional, dependiendo de la composición de las impurezas.
La mayoría de los minerales de sulfuro tradicionalmente han sido procesados utilizando técnicas pirometalúrgicos para producir una mate para su posterior refinación. Los recientes avances en hidrometalurgia haber resultado en la purificación de níquel significativa utilizando estos procesos. La mayoría de los depósitos de sulfuro tradicionalmente han sido procesados por concentración a través de una proceso de flotación por espuma seguido de extracción pirometalúrgica. En los procesos hidrometalúrgicos, minerales de sulfuro de níquel se someten a flotación (flotación diferencial si la relación Ni / Fe es demasiado bajo) y luego fundido. Después de producir el níquel mate, ulterior elaboración se realiza a través de la Proceso Sherritt-Gordon. En primer lugar, el cobre se elimina mediante la adición de sulfuro de hidrógeno, dejando un concentrado de sólo cobalto y níquel. Entonces, la extracción de disolvente se utiliza para separar el cobalto y níquel, con la concentración final de níquel superior a 99%.

Electrorefinación
Una segunda forma más común de refino implica la lixiviación del metal mate en una solución de sal de níquel, seguido por la electro-obtención del níquel de la solución en placas que sobre un cátodo como el níquel electrolítico.
Proceso Mond

Purificación de óxidos de níquel para obtener el metal puro se lleva a cabo a través de la Proceso Mond, lo que aumenta el concentrado de níquel a más de 99,99% de pureza. Este proceso fue patentado por L. Mond y ha estado en uso industrial desde antes del comienzo del siglo 20a. En el proceso, el níquel se hace reaccionar con monóxido de carbono en alrededor de 40-80 ° C para formar carbonilo de níquel en presencia de un catalizador de azufre. Hierro da pentacarbonilo de hierro también, pero esta reacción es lenta. Si es necesario, se puede separar por destilación. Dicobaltooctacarbonilo también se forma en este proceso, pero se descompone a dodecacarbonilo tetracobalt a la temperatura de reacción para dar un sólido no volátil.
El níquel se re-obtiene a partir del carbonilo de níquel en uno de los dos procesos. Se puede pasar a través de una cámara grande a altas temperaturas en la que decenas de miles de esferas de níquel, llamados gránulos, se agitan constantemente. A continuación se descompone el depósito de níquel puro sobre las esferas de níquel. Alternativamente, el carbonilo de níquel se puede descomponer en una cámara más pequeña a 230 ° C para crear polvo de níquel bien. El monóxido de carbono resultante se recircula y se reutiliza en el proceso. El níquel de alta pureza producido por este proceso se conoce como "níquel carbonilo".
Valor del metal
El precio de mercado del níquel subió a lo largo de 2006 y los primeros meses de 2007; desde el 5 de abril de 2007, el metal se negociaba a 52.300 USD / tonelada o 1,47 USD / oz. El precio posteriormente cayó dramáticamente de estos picos, y desde el 19 de enero de 2009 el de metal se negociaba a 10.880 dólares / tonelada.
La EEUU moneda de níquel contiene 0,04 oz (1,25 g) de níquel, que al precio abril 2007 valía 6,5 centavos, junto con 3,75 gramos de cobre por valor de unos 3 centavos, por lo que el valor de metal de más de 9 centavos. Dado que el valor nominal de una moneda es de 5 centavos, lo que lo hacía un blanco atractivo para la fusión por personas que quieren vender los metales en un beneficio. Sin embargo, el United States Mint, en previsión de esta práctica, implementó nuevas normas provisionales el 14 de diciembre de 2006, con sujeción a los comentarios del público durante 30 días, que penalizan la fusión y la exportación de monedas de cinco centavos y. Los infractores pueden ser castigados con una multa de hasta $ 10,000 y / o prisión por un máximo de cinco años.
Al 16 de septiembre del 2011, el valor de la masa fundida de una moneda estadounidense es 0,0600409 dólares, que es 20% más alto que el valor nominal.
Aplicaciones

La fracción de la producción mundial de níquel que se utilizan actualmente para diversas aplicaciones es el siguiente: 46% para la fabricación de aceros al níquel; 34% en no ferrosos aleaciones y superaleaciones; 14% galvanoplastia, y 6% en otros usos.
El níquel se utiliza en muchos productos industriales y de consumo específicas y reconocibles, incluyendo acero inoxidable, imanes de alnico, invención, baterías recargables, cuerdas de guitarra eléctrica, cápsulas de micrófono, y aleaciones especiales. También se utiliza para el recubrimiento y como un tinte verde en el vidrio. El níquel es preeminentemente una aleación de metal, y su uso principal es en los aceros al níquel y hierro fundido de níquel, de las cuales hay muchas variedades. También se utiliza ampliamente en muchas otras aleaciones, tales como latones y bronces, níquel y aleaciones con cobre, cromo, aluminio, plomo, cobalto, plata, y oro ( Inconel, Incoloy, Monel, Nimonic).

Debido a su resistencia a la corrosión, el níquel ha sido ocasionalmente utilizado históricamente como un sustituto para la plata decorativo. El níquel también se utiliza ocasionalmente en algunos países después de 1859 como un metal monedas barato (véase más arriba), pero a partir de los últimos años del siglo 20 ha sustituido en gran medida por el más barato acero inoxidable (es decir, aleaciones de hierro), excepto en particular en los Estados Unidos.
El níquel es un agente de aleación excelente para ciertos otros metales preciosos, y lo utiliza en la llamada ensayo de fuego, como un colector de elementos del grupo del platino (PGE). Como tal, el níquel es capaz de colección completa de todos los elementos 6 de PGE a partir de minerales, en adición a la colección parcial de oro. Minas de níquel-alto rendimiento también pueden participar en la recuperación PGE (principalmente platino y paladio ); ejemplos son Norilsk en Rusia y la cuenca de Sudbury en Canadá.
Espuma de níquel o níquel se utiliza en la malla electrodos de difusión de gas para pilas de combustible alcalinas.
Níquel y sus aleaciones se utilizan frecuentemente como catalizadores para hidrogenación reacciones. Níquel Raney, una aleación de níquel-aluminio finamente dividido, es una forma común, sin embargo catalizadores relacionados también se utilizan a menudo, incluyendo catalizadores relacionada 'de tipo Raney'.
El níquel es un material magnetoestrictivo, naturalmente, lo que significa que, en presencia de una campo magnético, el material se somete a un pequeño cambio en la longitud. En el caso del níquel, este cambio en la longitud es negativa (la contracción del material), que se conoce como negativo magnetostricción y es del orden de 50 ppm.
El níquel se utiliza como un aglutinante en el cementado carburo de tungsteno o de la industria de metal duro y se utiliza en proporciones de seis a 12% en peso. El níquel puede hacer que el carburo de tungsteno magnético y añade propiedades resistentes a la corrosión a las piezas de carburo de tungsteno cementado, aunque la dureza es inferior a las de las piezas hechas con aglutinante de cobalto.
Papel biológico
Aunque no es reconocido hasta la década de 1970, el níquel desempeña un papel importante en la biología de los microorganismos y plantas. La enzima de la planta ureasa (una enzima que ayuda en la hidrólisis de la urea ) contiene níquel. El NiFe- hidrogenasas contienen níquel además de racimos de hierro-azufre. Tal [NiFe] -hydrogenases característicamente oxidan H 2. Una coenzima níquel-tetrapirrol, Cofactor F430, está presente en la metilo reductasa coenzima M, que los poderes metanogénica arqueas. Una de las enzimas deshidrogenasa de monóxido de carbono consta de un clúster de Fe-Ni-S. Otras enzimas que contienen níquel incluyen una clase bacteriana atípica de superóxido dismutasa y glyoxalase I enzimas en bacterias y eucariotas varios parasitaria parásitos tripanosomas (esta enzima en los organismos superiores, incluyendo levaduras y mamíferos, usos divalente zinc , Zn 2+).
Toxicidad
En los EE.UU., el nivel de riesgo mínimo de níquel y sus compuestos se establece en 0,2 mg / m 3 para la inhalación durante 15 a 364 días. Humo de sulfuro de níquel y el polvo se cree otros compuestos de níquel cancerígenos, y varias pueden ser también. El carbonilo de níquel, [Ni (CO) 4], es un gas extremadamente tóxico. La toxicidad de los carbonilos metálicos es una función tanto de la toxicidad del metal, así como la capacidad del carbonilo para dar fuera altamente tóxico monóxido de carbono gas, y esto no es una excepción; carbonilo de níquel también es explosiva con el aire. Personas sensibilizadas pueden mostrar una alergia al níquel, que afecta a la piel, también conocidos como dermatitis. La sensibilidad al níquel también puede estar presente en pacientes con pompholyx. El níquel es una causa importante de alergia de contacto, en parte debido a su uso en joyería destinada a orejas perforadas. La alergia al níquel que afectan a las orejas perforadas a menudo se caracterizan por enrojecimiento de la piel con picazón. Muchos pendientes ahora se hacen sin níquel debido a este problema. La cantidad de níquel permitido en los productos que entran en contacto con la piel humana está regulada por la Unión Europea . En 2002, los investigadores encontraron cantidades de níquel siendo emitidos por 1 y 2 monedas de euro muy por encima de esas normas. Esto se cree debido a una reacción galvánica.
Níquel fue votado Alérgenos del Año en 2008 por la American Contact Dermatitis Sociedad.
Los informes también mostraron que tanto la activación inducida de níquel-del factor inducible por hipoxia (HIF-1) y la regulación de genes inducibles por hipoxia son debido a los niveles intracelulares de ascorbato agotados. La adición de ascorbato al medio de cultivo aumentó el nivel de ascorbato intracelular y se invierte tanto la estabilización metal inducida de HIF-1 y la expresión del gen HIF-1α-dependiente.

