Antimoine
Saviez-vous ...
Enfants SOS bénévoles ont aidé à choisir des articles et faites autre matériel de programme Cliquez ici pour plus d'informations sur les enfants SOS.
| Antimoine | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
51 Sb | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||
gris argenté brillant  | |||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||
| Nom, symbole, nombre | antimoine, Sb, 51 | ||||||||||||||||||||||||
| Prononciation | Royaume-Uni / æ n t ɨ m ə n Je / UN ti-mə-nee; États-Unis / æ n t ɨ m oʊ n Je / AN-moh-nee -ti | ||||||||||||||||||||||||
| Catégorie Metallic | métalloïde | ||||||||||||||||||||||||
| Groupe, période, bloc | 15 (pnictogens), 5, p | ||||||||||||||||||||||||
| Poids atomique standard | 121,760 (1) | ||||||||||||||||||||||||
| Configuration électronique | [ Kr ] 4d 10 5s 2 5p 3 2, 8, 18, 18, 5 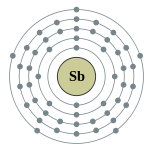 | ||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||
| Découverte | 3000 BC | ||||||||||||||||||||||||
| Premier isolement | Vannoccio Biringuccio (1540) | ||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||
| Densité (à proximité rt) | 6,697 g · cm -3 | ||||||||||||||||||||||||
| Liquid densité au mp | 6,53 g · cm -3 | ||||||||||||||||||||||||
| Point de fusion | 903,78 K , 630,63 ° C, 1167,13 ° F | ||||||||||||||||||||||||
| Point d'ébullition | 1860 K, 1587 ° C, 2889 ° F | ||||||||||||||||||||||||
| La chaleur de fusion | 19,79 kJ · mol -1 | ||||||||||||||||||||||||
| Chaleur de vaporisation | 193,43 kJ · mol -1 | ||||||||||||||||||||||||
| Capacité thermique molaire | 25,23 J · mol -1 · K -1 | ||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||
| États d'oxydation | 5, 3, -3 | ||||||||||||||||||||||||
| Électronégativité | 2,05 (échelle de Pauling) | ||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 834 kJ · mol -1 | ||||||||||||||||||||||||
| 2ème: 1594,9 kJ · mol -1 | |||||||||||||||||||||||||
| 3ème: 2440 kJ · mol -1 | |||||||||||||||||||||||||
| Rayon atomique | 140 h | ||||||||||||||||||||||||
| Rayon covalente | 139 ± 17 heures | ||||||||||||||||||||||||
| Rayon de Van der Waals | 206 h | ||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||
| Crystal structure | simples trigonal  | ||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | ||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 417 nΩ · m | ||||||||||||||||||||||||
| Conductivité thermique | 24,4 W · m -1 · K -1 | ||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 11 um · m -1 · K -1 | ||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 3,420 m · s -1 | ||||||||||||||||||||||||
| Le module d'Young | 55 GPa | ||||||||||||||||||||||||
| Module de cisaillement | 20 GPa | ||||||||||||||||||||||||
| Module Bulk | 42 GPa | ||||||||||||||||||||||||
| Dureté Mohs | 3.0 | ||||||||||||||||||||||||
| Dureté Brinell | 294 MPa | ||||||||||||||||||||||||
| Numéro de registre CAS | 7440-36-0 | ||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||
| Article détaillé: Isotopes d'antimoine | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Antimoine ( latine : stibium) est un élément chimique avec le symbole Sb et de numéro atomique 51. Un gris lustré métalloïdes, il existe dans la nature principalement sous la sulfure minérale stibine (Sb 2 S 3). composés d'antimoine ont été connus depuis l'antiquité et ont été utilisés pour les cosmétiques; antimoine métallique était aussi connu, mais il a été à tort identifié comme le plomb . Il a été créé pour être un élément autour du 17ème siècle.
Depuis quelque temps, la Chine a été le plus grand producteur d'antimoine et de ses composés, la plupart provenant de la production Mine Xikuangshan dans Hunan. Les méthodes industrielles pour produire de l'antimoine sont torréfaction et réduction carbothermique ultérieure ou réduction directe des stibnite avec le fer.
Les plus grandes applications pour antimoine métallique sont comme matériau d'alliage pour le plomb et l'étain et l'antimoine pour les plaques de plomb dans batteries plomb-acide. Alliage de plomb et d'étain avec de l'antimoine améliore les propriétés des alliages qui sont utilisés dans soudures, balles et paliers lisses. composés d'antimoine sont des additifs importants pour chlore et le brome contenant ignifuges trouvés dans de nombreux produits commerciaux et domestiques. Une application émergente est l'utilisation d'antimoine dans microélectronique.
Caractéristiques
Propriétés



L'antimoine est dans la groupe d'azote (groupe 15) et a une électronégativité de 2,05. Comme prévu par les tendances périodiques, il est plus électronégatif que l'étain ou de bismuth , et moins électronégatif que le tellure ou de l'arsenic . L'antimoine est stable dans l'air à la température ambiante, mais réagit avec l'oxygène pour former en cas de chauffage le trioxyde d'antimoine, Sb 2 O 3.
L'antimoine est un métal gris, brillant argenté qui possède une échelle de Mohs dureté de 3. Par conséquent, l'antimoine pur ne est pas utilisé pour faire des objets durs: pièces faites d'antimoine ont été émises en Chine La province du Guizhou en 1931, mais en raison de leur usure rapide, leur frappe a été abandonnée. L'antimoine est résistant à l'attaque par les acides.
Quatre allotropes d'antimoine sont connus: une forme métallique stable et trois formes métastables (explosifs, noir et jaune). Antimoine métallique est un cassants, métal brillant blanc argenté. Lorsque antimoine fondu est refroidi lentement, de l'antimoine métallique cristallise dans un trigonal cellule, isomorphe avec celle de la forme allotropique de gris de l'arsenic . Une forme rare explosive d'antimoine peut être formé à partir de l'électrolyse de le trichlorure d'antimoine. Si on gratte avec mettre en œuvre une forte, une réaction exothermique se produit et fumées blanches sont émis comme l'antimoine métallique est formée; quand on le frotte avec un pilon dans un mortier, une détonation forte se produit. Antimoine noire est formée lors du refroidissement rapide de la vapeur provenant de l'antimoine métallique. Il a la même structure cristalline que phosphore rouge et l'arsenic noir, il se oxyde à l'air et peut se enflammer spontanément. A 100 ° C, il se transforme peu à peu en la forme stable. Le allotrope jaune d'antimoine est le plus instable. Il a seulement été généré par l'oxydation de stibine (SbH 3) à -90 ° C. Au-dessus de cette température et à la lumière ambiante, ce allotrope métastable se transforme en noir allotrope plus stable.
Antimoine métallique adopte une structure en couches ( espace groupe R 3 m n ° 166) dans lequel les couches sont constituées de ébouriffées des cycles à six chaînons condensés. Les proches-plus proches voisins et forment un complexe octaédrique déformée, avec les trois atomes dans le même double-couche étant un peu plus près que les trois atomes dans le prochain. Ce garnissage relativement proche conduit à une forte densité de 6,697 g / cm 3, mais la faible liaison entre les couches conduit à une faible dureté et la fragilité de l'antimoine.
Isotopes
Antimoine existe que deux isotopes stables, 121 Sb avec une abondance naturelle de 57,36% et 123 Sb avec une abondance naturelle de 42,64%. Il a également 35 radio-isotopes, dont la plus longue durée de vie est de 125 Sb avec une demi-vie de 2,75 ans. De plus, 29 états métastables ont été caractérisés. La plupart d'entre eux est stable 124 Sb avec une demi-vie de 60,20 jours, qui trouve une application dans certaines les sources de neutrons. Isotopes plus légers que l'écurie 123 Sb ont tendance à pourrir par β + décroissance, et ceux qui sont plus lourds ont tendance à pourrir par β - décroissance, à quelques exceptions près.
Occurrence

L'abondance de l'antimoine dans la terre croûte est estimée à 0,2 à 0,5 parties par million, comparables à thallium à 0,5 parties par million et de l'argent à 0,07 ppm. Même si cet élément ne est pas abondante, il se trouve dans plus de 100 minéraux espèces. Antimoine est parfois trouvé nativement, mais le plus souvent il se trouve dans le sulfure stibine (Sb 2 S 3) qui est le minerai prédominant minéral .
Composés
les composés d'antimoine sont souvent classées en celles de Sb (III) et Sb (V). Par rapport à son congénère l'arsenic , le 5 état d'oxydation est plus stable.
Oxydes et hydroxydes
Le trioxyde d'antimoine (Sb 4 O 6) est formé lorsque l'antimoine est brûlé dans l'air. Dans la phase gazeuse, ce composé existe sous forme de Sb 4 O 6, mais il se polymérisé à condensation. Pentoxyde d'antimoine (Sb 10 O 4) ne peut être formée par oxydation de concentré acide nitrique . Antimoine constitue également un oxyde mixte-valence, tétroxyde d'antimoine (Sb 2 O 4), qui comprend à la fois Sb (III) et Sb (V). Contrairement phosphore et l'arsenic , ces différents oxydes sont amphotère, ne font pas bien définie oxoacides et réagissent avec les acides pour former des sels d'antimoine.
L'acide antimonous Sb (OH) 3 est inconnu, mais le antimonite base conjuguée de sodium ([Na 3 SbO 3] 4) formes sur la fusion oxyde de sodium et Sb 4 O 6. antimonites de métaux de transition sont également connus. Acide antimonique ne existe que tant que l'hydrate HSb (OH) 6, en formant des sels contenant l'anion antimoniate Sb (OH) -
6. Sels métalliques déshydratants contenant cet anion rendements oxydes mixtes.
De nombreux minerais d'antimoine sont les sulfures, y compris stibine (Sb 2 S 3), pyrargyrite (Ag 3 SbS 3), Zinkénite, jamesonite, et boulangerite. Pentasulfure d'antimoine est non stoechiométrique et dispose d'antimoine dans les trois États oxydation obligations et SS. Plusieurs thioantimonides sont connus, par exemple [Sb 6 S 10] 2- et [Sb 8 S 13] 2-.
Halogénures
Antimoine forme deux séries de halogénures, SBX SBX 3 et 5. Les trihalogénures SbF 3, SbCl3, SbBr 3, et SBI 3 sont tous les composés moléculaires ayant trigonale pyramidale de la géométrie moléculaire. Le trifluorure de SbF 3 est préparé par la réaction de Sb 2 O 3 avec HF:
- Sb 2 O 3 + 6 HF → 2 SbF 3 + 3 H 2 O
C'est Lewis acide et accepte volontiers ions fluorure pour former les anions complexes SBF -
4 et SBF 2-
5. Molten SbF 3 est un faible conducteur électrique. Le trichlorure de SbCl 3 est préparée en dissolvant Sb 2 S 3 dans l'acide chlorhydrique :
- Sb 2 S 3 + 6 HCl → 2 SbCl3 + 3 H 2 S
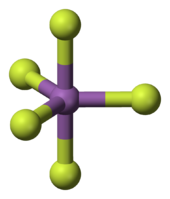
Les pentahalogénures SBF 5 et 5 ont sbcl géométrie pentagonale moléculaire dans la phase gazeuse, mais dans la phase liquide, SbF 5 est polymère, tandis que SbCl 5 est monomère. SbF 5 est un acide de Lewis puissant utilisé pour fabriquer le superacide Acide fluoroantimonique ("HSbF 6").
Oxyhalogénures sont plus fréquents pour l'antimoine que l'arsenic et le phosphore. Le trioxyde d'antimoine se dissout dans l'acide concentré pour former des composés tels que oxoantimonyl et SbOCl (SBO) 2 SO 4.
Antimoniures, les hydrures et les composés organoantimoine
Composés de cette classe sont généralement décrits comme des dérivés de Sb 3-. formes d'antimoine antimoniures de métaux, tels que antimoniure d'indium (InSb) et l'antimoniure d'argent (Ag 3 Sb). Les métaux zinc et antimoniures alcalins tels que Na 3 Sb et Zn 3 Sb 2, sont plus réactifs. Le traitement de ces antimoniures avec de l'acide produit le gaz instable stibine, SbH 3:
- 3- Sb + 3 H + → SbH 3
Stibine peuvent également être produits en traitant les sels de Sb avec des réactifs tels que l'hydrure le borohydrure de sodium. Stibine se décompose spontanément à la température ambiante. Parce stibine a un effet positif chaleur de formation, il est thermodynamiquement instable et donc antimoine ne réagit pas avec l'hydrogène directement.
Organoantimoine composés sont généralement préparés par alkylation d'halogénures d'antimoine avec Les réactifs de Grignard. Une grande variété de composés sont connus à la fois Sb (III) et Sb (V) centres, y compris les dérivés mixtes organochlorés, des anions et cations,. Des exemples comprennent du Sb (C 6 H 5) 3 ( triphénylstibine), Sb 2 (C 6 H 5) 4 (avec une liaison de Sb-Sb), et cyclique [Sb (C 6 H 5)] n. Organoantimoine pentacoordiné composés sont courants, des exemples étant le Sb (C 6 H 5) 5 et plusieurs halogénures apparentés.
Histoire
Antimoine (III) de sulfure, Sb 2 S 3, a été reconnu dans Egypte prédynastique comme un cosmétique oeil ( kohl) dès propos 3100 BC, quand le palette à fard a été inventé.
Un artefact, dit faire partie d'un vase, fait d'antimoine datant à environ 3000 ans avant JC a été trouvée à Tello, Chaldée (partie de l'actuelle jours Irak ), et un objet de cuivre plaqué avec de l'antimoine datant entre 2500 avant JC et 2200 avant JC ont été trouvés dans l'Egypte . Austen, lors d'une conférence par Herbert Gladstone en 1892 a déclaré que «nous ne savons d'antimoine, de nos jours comme un métal très fragile et cristalline, qui pourrait difficilement être façonné dans un vase utile, et donc cette« trouvaille »remarquable (artefact mentionné ci-dessus) doit représenter l'art perdu de rendre l'antimoine malléable ».
Moorey était pas convaincu l'artefact était en effet un vase, de mentionner que Selimkhanov, après son analyse de l'objet Tello (publié en 1975), "essayé de rapporter le métal à l'antimoine naturelle transcaucasienne" (ce est à dire natif de métal) et que «les objets d'antimoine de Transcaucasie sont tous les petits ornements personnels. " Cela affaiblit la preuve d'un art perdu "de rendre l'antimoine malléable."
La première description d'une procédure européenne pour isoler l'antimoine est dans le livre De la Pirotechnia de 1540 par Vannoccio Biringuccio; ce est antérieure à la plus célèbre livre de 1556 Agricola, De re metallica. Dans ce contexte Agricola a été souvent incorrectement crédité de la découverte de l'antimoine métallique. Le livre Currus Triumphalis Antimonii (Le char triomphal d'antimoine), décrivant la préparation de l'antimoine métallique, a été publié en Allemagne en 1604. Il a été censé avoir été écrit par un Moine bénédictin, écrivant sous le nom Basile Valentin, au 15ème siècle; si elles étaient authentiques, qui ne est pas, il serait antérieurs à Biringuccio.
L'antimoine pur était bien connu Jabir Ibn Hayyan dans le 8ème siècle. Il ya une controverse en cours, avec le traducteur Marcellin Berthelot indiquant l'antimoine n'a jamais été retrouvé dans les livres de Jabir, mais d'autres affirmant que Berthelot traduit seulement une partie des livres les moins importantes, tandis que les plus intéressants (dont certains pourraient décrire l'antimoine) ne sont pas encore traduits et leur contenu est totalement inconnu.
La première occurrence naturelle de l'antimoine pur dans la croûte terrestre a été décrit par le Scientifique suédois et ingénieur de district de la mine locale Anton von Swab en 1783; la Type-échantillon a été prélevé à partir de la Sala mine d'argent dans le district minier de Bergslagen Sala, Västmanland, Suède .
Étymologie
Les mots anciens pour l'antimoine ont la plupart du temps, leur signification en chef, Kohl, le sulfure d'antimoine. Pline l'Ancien, cependant, la distinction entre les hommes et les formes féminines d'antimoine; la forme masculine est probablement le sulfure, tandis que la forme féminine, qui est supérieur, plus lourd et moins friable, a été soupçonné d'être l'antimoine métallique natif.
Les Égyptiens appelaient antimoine mśdmt; en hiéroglyphes, les voyelles sont incertaines, mais il ya une tradition arabe que le mot est ميسديميت mesdemet. Le mot grec, stimmi στίμμι, est probablement une mot d'emprunt de l'arabe ou SDM égyptienne
|
et est utilisé par Grenier tragique poètes du 5ème siècle avant JC; plus tard, les Grecs également utilisé Stibi στἰβι, comme l'a fait Celse et Pline, écrit en latin, dans le premier siècle de notre ère. Pline donne également les noms Stimi [ sic], larbaris, albâtre, et les platyophthalmos "très communs", "large-eye" (de l'effet de la cosmétique). Les auteurs postérieurs latine adapté le mot latin comme stibium. Le mot arabe pour la substance, par opposition à la cosmétique, peut apparaître comme إثمد ithmid, athmoud, othmod ou uthmod. Littré suggère la première forme, qui est la plus ancienne, dérive de stimmida, un accusatif pour stimmi.
L'utilisation de Sb comme le symbole chimique standard pour l'antimoine est due à Jöns Jakob Berzelius, qui a utilisé cette abréviation du nom stibium. La forme latin médiéval, à partir de laquelle les langues modernes et à la fin Grecque byzantine prendre leurs noms pour l'antimoine, est antimoine. L'origine de cette augmentation est incertaine; toutes les suggestions ont de la difficulté soit de la forme ou de l'interprétation. Le étymologie populaire, de ἀντίμοναχός anti-monachos ou antimoine français, a encore des adhérents; cela signifierait "moine-tueur", et se explique par de nombreux premiers alchimistes étant moines, et l'antimoine étant toxique.
Une autre étymologie populaire est le mot grec hypothétique ἀντίμόνος antimonos, "contre la solitude", a expliqué que "non trouvé que le métal" ou "non trouvé non allié". Lippmann conjecturé un mot grec hypothétique ανθήμόνιον anthemonion, ce qui signifierait "fleuron", et cite plusieurs exemples de mots grecs connexes (mais pas que) qui décrivent une chimique ou biologique efflorescence.
Les premières utilisations de l'antimoine comprennent les traductions, en 1050-1100, par Constantin l'Africain de traités de médecine arabe. Plusieurs autorités estiment antimoine est une corruption de certains scribes forme arabe; Meyerhof dérive à partir ithmid; autres possibilités incluent athimar, le nom arabe du métalloïde, et un hypothétique-stimmi, provenant ou parallèle à la grecque.
Production
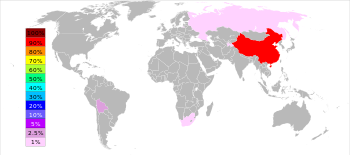
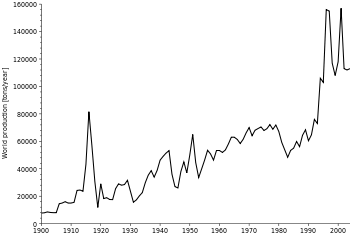
Principaux producteurs et les volumes de production
Le British Geological Survey a indiqué que, en 2005, la République populaire de Chine était le premier producteur d'antimoine avec une part mondiale d'environ 84%, suivi à distance par l'Afrique du Sud, la Bolivie et le Tadjikistan. Mine Xikuangshan dans La province du Hunan a les plus grands gisements en Chine avec un dépôt d'environ 2,1 millions de tonnes métriques.
En 2010, en fonction de la US Geological Survey, la Chine représentait 88,9% de la production totale d'antimoine avec l'Afrique du Sud, la Bolivie et la Russie partage la deuxième place.
| Pays | Tonnes | % Du total |
|---|---|---|
| | 120000 | 88,9 |
| | 3000 | 2.2 |
| | 3000 | 2.2 |
| | 3000 | 2.2 |
| | 2000 | 1,5 |
| Top 5 | 131000 | 97,0 |
| Monde Total | 135000 | 100,0 |
Cependant, Roskill Conseil estime pour le spectacle de la production primaire qu'en 2010, la Chine a tenu une part 76,75 de% de l'approvisionnement du monde avec 120 462 tonnes (90 000 tonnes de signalés et 30 464 tonnes de la production de non-déclarée), suivie par la Russie (4,14% part, 6,500 tonnes de production), Myanmar (3,76% part, 5897 tonnes), le Canada (3,61% part, 5660 tonnes), le Tadjikistan (3,42% part, 5370 tonnes) et la Bolivie (3,17% part, 4980 tonnes).
Roskill estime que la production secondaire à l'échelle mondiale en 2010 était de 39 540 tonnes.
Antimoine a été classé premier dans une liste des risques publié par le British Geological Survey dans la seconde moitié de 2011. La liste donne une indication du risque relatif à la fourniture d'éléments chimiques ou groupes d'éléments nécessaires pour maintenir l'économie britannique actuel et mode de vie.
En outre, l'antimoine a été identifié comme l'un des 12 matières premières critiques pour l'UE dans un rapport publié en 2011, principalement en raison du manque d'approvisionnement en dehors de Chine.
La production déclarée de l'antimoine en Chine est tombé en 2010 et ne devrait pas augmenter dans les prochaines années, selon le rapport Roskill. Aucun dépôt antimoine importantes en Chine ont été développés pour une dizaine d'années, et les réserves restantes économiques se épuisent rapidement.
Plus grands producteurs d'antimoine au monde, selon Roskill, sont énumérés ci-dessous:
| Pays | Société | Capacité (tonnes par an) |
|---|---|---|
| | Mandalay Resources | 2750 |
| | divers | 5460 |
| | Beaver Brook | 6000 |
| | Hsikwangshan étoile de scintillement | 55000 |
| | Hunan Chenzhou Mines | 20000 |
| | Chine Tin Groupe | 20000 |
| Shenyang Huacheng Antimoine | 15000 | |
| | Kazzinc | 1000 |
| | Kadamdzhai | 500 |
| | SRS | 500 |
| | US Antimoine | 70 |
| | divers | 6000 |
| | GeoProMining | 6500 |
| | Consolidated Murchison | 6000 |
| | Unzob | 5500 |
| | inconnu | 600 |
| | Cengiz & Özdemir Antimuan Madenleri | 2400 |
Réserves
Selon les statistiques de l'US Geological Survey (USGS), les réserves mondiales actuelles de l'antimoine seront épuisées dans 13 ans. Cependant, la United States Geological Survey attend davantage de ressources seront trouvées.
| Pays | Réserves (tonnes de contenu d'antimoine) | % Du total |
|---|---|---|
| | 950000 | 51,88 |
| | 350000 | 19,12 |
| | 310000 | 16,93 |
| | 50000 | 2,73 |
| | 21000 | 1,15 |
| Autres pays | 150000 | 8,19 |
| Monde Total | 1831000 | 100,0 |
Le processus de production
L'extraction à partir de minerais d'antimoine dépend de la qualité du minerai et la composition du minerai. La plupart antimoine est extrait comme sulfure; minerais de qualité inférieure sont concentrées par flottation par moussage, tandis que les minerais à teneurs plus élevées sont chauffés à 500-600 ° C, la température à laquelle fond la stibine et est séparée de la minéraux gangue. L'antimoine peut être isolé à partir du sulfure d'antimoine brut par une réduction avec de la ferraille:
- Sb 2 S 3 + 3 Fe → 2 SB + 3 FeS
Le sulfure est converti en un oxyde et l'avantage est souvent pris de la volatilité de l'antimoine (III) de l'oxyde, qui est récupéré à partir de la torréfaction. Ce matériau est souvent utilisé directement pour les principales applications, les impuretés étant l'arsenic et le sulfure. Isolement de l'antimoine à partir de son oxyde est réalisée par une réduction carbothermique:
- 2 Sb 2 O 3 + 3 C → 4 Sb + 3 CO 2
Les minerais de qualité inférieure sont réduites hauts fourneaux tandis que les minerais de qualité plus élevés sont réduits fours à réverbère.
Applications
Environ 60% de l'antimoine est consommé dans retardateurs de flamme, et 20% est utilisé dans les alliages pour des batteries, des paliers lisses et des soudures.
Les retardateurs de flamme
L'antimoine est principalement utilisé comme sa trioxyde de décision ignifuge composés. Il est presque toujours utilisé en association avec des retardateurs de flamme halogénés, avec la seule exception étant dans des polymères contenant des halogènes. La formation de composés d'antimoine halogénés est la cause de l'effet retardateur de flamme de trioxyde d'antimoine, en raison de la réaction de ces composés avec des atomes d'hydrogène et probablement aussi par des atomes d'oxygène et des radicaux OH, inhibant ainsi le feu. Les marchés pour ces applications ignifuges comprennent vêtements, jouets, avions et sièges d'automobile les capots des enfants. Il est également utilisé dans le fibre de verre industrie des composites, comme additif à résines de polyester pour des articles tels que couvertures de moteurs d'avions de la lumière. La résine va brûler tandis qu'une flamme est tenue à elle, mais va se éteindre dès que la flamme est retirée.
Alliages
L'antimoine forme une grande utilité avec l'alliage de plomb , ce qui augmente sa dureté et sa résistance mécanique. Pour la plupart des applications impliquant le plomb, des quantités variables d'antimoine sont utilisés comme métal d'alliage. En batteries plomb-acide, cette addition améliore les caractéristiques de charge et réduit la génération d'hydrogène indésirables pendant la charge. Il est utilisé dans les alliages antifriction (tels que Babbitt métalliques), en balles et grenaille de plomb, gaines de câbles, Type de métal (par exemple, par machines d'impression linotype), soudure (certains " sans plomb "soudures contiennent 5% Sb), dans étain et des alliages à durcissement à faible étain contenu dans la fabrication de tuyaux d'orgue.
D'autres applications
Trois autres applications représentent près tout le reste de la consommation. Une de ces utilisations est comme stabilisant et d'un catalyseur pour la production de polyéthylène téréphtalate. Une autre application est de servir comme agent de collage pour éliminer les bulles microscopiques dans le verre , la plupart pour des écrans de télévision; ceci est obtenu par l'interaction d'ions d'antimoine avec de l'oxygène, en interférant de ce dernier formant des bulles. La troisième application importante est l'utilisation comme pigment.
L'antimoine est de plus en plus utilisé dans le semiconducteur industrie comme un pour dopant fortement dopée de type n de silicium wafers dans la production de des diodes, détecteurs infrarouges, et Dispositifs à effet Hall. Dans les années 1950, de minuscules perles d'un plomb alliage -antimony ont été utilisés pour doper les émetteurs et les collectionneurs de NPN alliage transistors de jonction avec l'antimoine. Antimoniure d'indium est utilisé comme matériau pour la mi des détecteurs à infrarouge.
Peu d'applications biologiques ou médicales existent pour l'antimoine. Traitements contenant principalement de l'antimoine sont connus comme et antimoniés sont utilisés comme émétiques. composés d'antimoine sont utilisés comme médicaments antiprotozoaires. Potassium tartrate d'antimoine, ou de tartre émétique, était autrefois utilisé comme un anti- schistosomal drogues de 1919 sur. Il a ensuite été remplacé par praziquantel. Antimoine et ses composés sont utilisés dans plusieurs préparations vétérinaires comme anthiomaline lithium ou l'antimoine thiomalate, qui est utilisé comme agent de conditionnement de la peau chez ruminants. Antimoine a un effet nourrissant ou conditionné sur tissus kératinisés, au moins chez les animaux.
Les médicaments à base d'antimoine, tels que antimoniate de méglumine, sont également considérés comme les médicaments de choix pour le traitement de la leishmaniose chez animaux domestiques. Malheureusement, ainsi que présentant une faible indices thérapeutiques, les médicaments sont pauvres à pénétrer le la moelle osseuse, où une partie de la Leishmania amastigotes résident, et ainsi de guérison de la maladie - en particulier la forme viscérale - est très difficile. Antimoine élémentaire en tant que antimoine pilule était autrefois utilisé comme un médicament. Il pourrait être réutilisé par d'autres après l'ingestion.
Dans les têtes de certains allumettes de sûreté, d'antimoine (III) est utilisé sulfure. Antimoine-124 est utilisé en association avec le béryllium en sources de neutrons; la les rayons gamma émis par antimoine-124 initier la photodésintégration de béryllium. Les neutrons émis ont une énergie moyenne de 24 keV. Sulfures d'antimoine ont été montré pour aider à stabiliser le coefficient de frottement des matériaux de plaquettes de frein automobile.
L'antimoine est également utilisé dans la fabrication de balles et de traceurs de balles. Cet élément est également utilisé dans les cosmétiques traditionnels, la peinture de l'événement et de l'artisanat d'art en verre. Une application en tant opacifiant dans l'émail a diminué dans l'emploi après les années 1930, après plusieurs intoxications ont été signalées.
Précautions
L'antimoine et beaucoup de ses composés sont toxiques, et les effets de l'empoisonnement de l'antimoine sont similaires à empoisonnement à l'arsenic. La toxicité de l'antimoine est de loin inférieur à celui de l'arsenic; cela pourrait être causé par les différences significatives de l'absorption, le métabolisme et l'excrétion entre l'arsenic et l'antimoine. L'absorption de l'antimoine (III) ou d'antimoine (V) dans le tractus gastro-intestinal est d'au plus 20%. L'antimoine (V) ne est pas réduit quantitativement à l'antimoine (III) dans la cellule (en fait, l'antimoine (III) est oxydé en antimoine (V) à la place).
Depuis méthylation de l'antimoine ne se produit pas, l'excrétion d'antimoine (V) dans l'urine est la principale voie d'élimination. Comme l'arsenic, l'effet le plus grave de l'intoxication aiguë est d'antimoine cardiotoxicité et le débouché myocardite, mais il peut aussi se manifester Adams-Stokes syndrome lesquels l'arsenic ne est pas. Les cas signalés d'intoxication par l'antimoine équivalente à 90 mg tartrate d'antimoine de potassium dissous de l'émail a été rapporté pour montrer que des effets à court terme. Une intoxication à 6 g de tartrate d'antimoine de potassium a été signalé à entraîner la mort après trois jours.
L'inhalation de poussières d'antimoine est nocif et dans certains cas peuvent être fatales; à petites doses, l'antimoine provoque des maux de tête , étourdissements, et la dépression. Des doses plus importantes comme le contact prolongé avec la peau peut causer une dermatite ou endommager les reins et le foie, provoquant violents et fréquents vomissements, entraînant la mort en quelques jours.
Antimoine est incompatible avec une forte agents oxydants, des acides forts, des acides d'halogène, le chlore ou le fluor . Il devrait être tenu à l'écart de la chaleur.
Antimoine lixivie de polyéthylène téréphtalate (PET) dans des bouteilles de liquides. Bien que les niveaux observés pour l'eau en bouteille sont en dessous de l'eau potable des lignes directrices, jus de fruits concentrés (pour lesquels aucune orientations sont établies) produites au Royaume-Uni se sont révélés contenir jusqu'à 44,7 g / L d'antimoine, bien au-dessus des limites de l'UE pour l'eau du robinet de 5 ug / L. Les lignes directrices sont les suivantes:
- Organisation mondiale de la santé : 20 ug / L
- Japon: 15 ug / L
- Agence américaine protection de l'environnement, Santé Canada et le ministère de l'Environnement de l'Ontario: 6 g / L
- Ministère fédéral allemand de l'environnement: 5 ug / L