
Lutetium
À propos de ce écoles sélection Wikipedia
SOS Enfants a essayé de rendre le contenu plus accessible Wikipedia par cette sélection des écoles. Un lien rapide pour le parrainage d'enfants est http://www.sponsor-a-child.org.uk/
| Lutetium | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
71 Lu | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||
blanc argenté  | |||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||
| Nom, symbole, nombre | lutétium, Lu, 71 | ||||||||||||||||||||||||||||||
| Prononciation | / LJ U t Je ʃ Je ə m / TEE lew- -shee-əm | ||||||||||||||||||||||||||||||
| Élément Catégorie | lanthanides parfois considéré comme un métal de transition | ||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 6, ré | ||||||||||||||||||||||||||||||
| Poids atomique standard | 174.9668 (4) | ||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 6s 2 4f 14 5d 1 2, 8, 18, 32, 9, 2 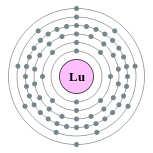 | ||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||
| Découverte | Georges Urbain et Carl Auer von Welsbach (1906) | ||||||||||||||||||||||||||||||
| Premier isolement | Carl Auer von Welsbach (1906) | ||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 9,841 g · cm -3 | ||||||||||||||||||||||||||||||
| Liquid densité au mp | 9,3 g · cm -3 | ||||||||||||||||||||||||||||||
| Point de fusion | 1925 K , 1652 ° C, 3006 ° F | ||||||||||||||||||||||||||||||
| Point d'ébullition | 3675 K, 3402 ° C, 6156 ° F | ||||||||||||||||||||||||||||||
| La chaleur de fusion | ca. 22 kJ · mol -1 | ||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 414 kJ · mol -1 | ||||||||||||||||||||||||||||||
| Capacité thermique molaire | 26,86 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||
| États d'oxydation | 3, 2, 1 (Faiblement oxyde de base) | ||||||||||||||||||||||||||||||
| Électronégativité | 1,27 (échelle de Pauling) | ||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 523,5 kJ · mol -1 | ||||||||||||||||||||||||||||||
| 2ème: 1340 kJ · mol -1 | |||||||||||||||||||||||||||||||
| 3ème: 2022,3 kJ · mol -1 | |||||||||||||||||||||||||||||||
| Rayon atomique | 174 h | ||||||||||||||||||||||||||||||
| Rayon covalente | 187 ± 20 heures | ||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | ||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||
| Résistivité électrique | ( rt) (poly) 582 nΩ · m | ||||||||||||||||||||||||||||||
| Conductivité thermique | 16,4 W · m -1 · K -1 | ||||||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (poly) 9,9 um / (m · K) | ||||||||||||||||||||||||||||||
| Le module d'Young | 68,6 GPa | ||||||||||||||||||||||||||||||
| Module de cisaillement | 27,2 GPa | ||||||||||||||||||||||||||||||
| Module Bulk | 47,6 GPa | ||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,261 | ||||||||||||||||||||||||||||||
| Dureté Vickers | 1160 MPa | ||||||||||||||||||||||||||||||
| Dureté Brinell | 893 MPa | ||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7439-94-3 | ||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de lutétium | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Lutétium est un élément chimique avec le symbole Lu et de numéro atomique 71. Ce est un blanc argenté métallique résistant à la corrosion dans un endroit sec, mais pas l'air humide. Ce est le dernier élément de la lanthanides série, et traditionnellement compté parmi les terres rares.
Lutétium a été découvert indépendamment en 1907 par le scientifique français Georges Urbain, minéralogiste autrichien Baron Carl Auer von Welsbach et chimiste américain Charles James. Tous ces hommes ont trouvé le lutétium sous forme d'impuretés dans le minerai ytterbium, qui a été précédemment pensé à constitués entièrement de l'ytterbium. Le différend sur la priorité de la découverte se est produite peu de temps après, avec Urbain et von Welsbach accusant mutuellement de la publication des résultats influencés par les recherches publiées de l'autre; l'honneur est allé à nommer Urbain comme il a publié ses résultats plus tôt. Il a choisi le nom lutécium pour le nouvel élément, mais en 1949 l'orthographe de l'élément 71 a été modifié au lutécium. En 1909, la priorité a été finalement accordé à Urbain et ses noms ont été adoptées comme les officiels; Toutefois, le nom cassiopeium (ou cassiopium tard) pour l'élément 71 proposé par von Welsbach a été utilisé par de nombreux scientifiques allemands jusqu'à ce que les années 1950.
Lutetium ne est pas un élément particulièrement abondante, bien significativement plus fréquente que l'argent dans la croûte de la terre; elle a peu d'utilisations spécifiques. Lutécium-176 est un (2,5%) isotope radioactif relativement abondante avec une demi-vie d'environ 38 milliards d'années, et ainsi utilisée pour déterminer l'âge de météorites. Lutetium se produit habituellement en association avec l'élément yttrium et est parfois utilisé dans le métal et alliages comme catalyseur dans différentes réactions chimiques. Lu- 177 DOTA-TATE est utilisé pour la thérapie par radionucléides (voir La médecine nucléaire) sur les tumeurs neuroendocrines.
Caractéristiques
Propriétés physiques
Un atome de lutétium a 71 électrons, disposés dans la configuration [ Xe ] 4f 14 5d 1 6s 2. Lors de la saisie d'une réaction chimique, l'atome perd ses deux électrons ultrapériphériques et 5d-électron unique; ce est inhabituel puisque les réactions des autres lanthanides impliquent invariablement électrons f-shell. L'atome de lutétium est la plus petite parmi les atomes de lanthanides, en raison de la contraction lanthanide, et en tant que résultat de lutétium a la plus forte densité, point de fusion, et la dureté des lanthanides.
Les composés chimiques et les propriétés
Les composés de lutécium contiennent toujours l'élément à l'état d'oxydation +3. Les solutions aqueuses de la plupart des sels de lutétium sont incolores et forment des solides cristallins blancs lors du séchage, à l'exception de l'iodure commun. Les sels solubles, tels que le nitrate, le sulfate et l'acétate hydrates forment lors de la cristallisation. Le l'oxyde, l'hydroxyde, le fluorure, le carbonate, le phosphate et oxalate sont insolubles dans l'eau.
Lutetium métal est légèrement instable dans l'air dans des conditions normales, mais il brûle facilement à 150 ° C pour former de l'oxyde de lutécium. Le composé résultant est connu pour adsorber l'eau et le dioxyde de carbone , et peut être utilisée pour éliminer les vapeurs de ces composés d'atmosphères closes. Des observations similaires sont en cours de réaction entre le lutétium et de l'eau (lent et rapide à froid à chaud); hydroxyde de lutétium est formée dans la réaction. Lutécium métal est connu pour réagir avec les quatre halogènes légers pour former tri halogénures; chacun d'entre eux (à l'exception du fluorure) sont solubles dans l'eau.
Lutécium se dissout facilement dans les acides faibles et diluer l'acide sulfurique pour former des solutions contenant des ions de lutétium incolores, qui existent en tant que [Lu (H 2 O) 9] 3+ complexe:
- Lu 2 + 3 H 2 SO 4 + 18 H 2 O 2 → [Lu (H 2 O) 9] 3+ + 3 SO 2-
4 + 3 H 2 ↑
Isotopes
Lutetium se produit sur la Terre sous forme de deux isotopes: lutécium-175 et le lutécium-176. Sur ces deux, seul le premier est stable, ce qui rend l'élément monoisotopique. Ce dernier l'un, lutécium-176, se désintègre via désintégration bêta avec une demi-vie de 3,78 × 10 10 ans; il représente environ 2,5% du lutécium naturel. À ce jour, 32 des radio-isotopes de l'élément de synthèse ont été caractérisés, en masse allant de 149,973 (lutétium-150) à 183,961 (lutétium-184); les isotopes les plus stables telles sont lutétium-174, avec une demi-vie de 3,31 ans et le lutétium-173, avec une demi-vie de 1,37 ans. Tout le reste isotopes radioactifs ont des demi-vies qui sont moins de 9 jours, et la majorité d'entre eux ont des demi-vies qui sont à moins d'une demi-heure. Isotopes plus léger que l'écurie décroissance lutécium-175 via capture d'électrons (pour produire des isotopes de l' ytterbium ), avec une certaine alpha et la tomographie par émission); les isotopes plus lourds se désintègrent principalement par désintégration bêta, la production d'isotopes d'hafnium.
L'élément 42 comporte également isomères nucléaires, avec des masses de 150, 151, 153-162, 166-180 (pas tous un numéro de masse correspond à un seul isomère). Le plus stable d'entre eux sont lutétium-177m, avec demi-vie de 160,4 jours et le lutétium-174m, avec demi-vie de 142 jours; ce est plus longue que la demi-vie des états fondamentaux de tous les isotopes radioactifs de lutétium, sauf que pour le lutécium-173, 174 et 176.
Histoire
Lutétium, dérivé du latin Lutetia ( Paris ), était indépendamment découvert en 1907 par le scientifique français Georges Urbain, minéralogiste autrichien Baron Carl Auer von Welsbach et chimiste américain Charles James. Ils ont trouvé comme impureté dans ytterbium, qui a été pensé par le chimiste suisse Jean Charles Galissard de Marignac à constitués entièrement de l'ytterbium . Les scientifiques ont proposé des noms différents pour les éléments: Urbain a choisi neoytterbium et le lutécium, tandis que Welsbach choisi aldebaranium et cassiopeium. Ces deux articles se accusent mutuellement de la publication des résultats sur la base de l'autre partie.
La Commission sur la masse atomique, qui était alors responsable de l'attribution de nouveaux noms d'éléments, a réglé le différend en 1909 en accordant la priorité à Urbain et l'adoption de ses noms comme ceux officielles, basées sur le fait que la séparation des lutécium de la ytterbium de Marignac a été le premier décrit par Urbain; après les noms de Urbain ont été reconnus, neoytterbium a été revenue à l'ytterbium. Jusque dans les années 1950, certains chimistes allemands appelés par leur nom de lutétium cassiopeium de von Welsbach; en 1949, l'orthographe de l'élément 71 a été modifié au lutécium. Cependant, 1907 échantillons de Welsbach de lutétium avaient été pure, tandis que les échantillons de 1907 Urbain contenaient seulement des traces de lutétium. Ce trompé tard Urbain en pensant qu'il avait découvert l'élément 72, qu'il nomma celtium , qui était en fait le lutétium très pur. Charles James, qui est resté hors de l'argument prioritaire, a travaillé sur une échelle beaucoup plus grande et possédait la plus grande offre de lutétium à l'époque. Pur lutétium métal a été la première fois en 1953.
Présence et la production

Trouvé avec presque tous les autres métaux des terres rares mais jamais par elle-même, le lutétium est très difficile de séparer d'autres éléments. Le principal minerai commercialement viable de lutétium est la terre rare phosphate minéral monazite: ( Ce , La , etc.) P O 4, qui contient 0,0001% de l'élément. L'abondance de lutétium dans la croûte terrestre est seulement d'environ 0,5 mg / kg. Les principales zones minières sont la Chine , États-Unis , le Brésil , l'Inde , le Sri Lanka et l'Australie . La production mondiale de lutétium (sous la forme d'oxyde) est d'environ 10 tonnes par an. Pur lutétium métal est très difficile à préparer. Il est l'un des plus rare et le plus cher des métaux des terres rares avec le prix environ US $ 10 000 par kilogramme, soit environ un quart de celle de l'or .
Minéraux broyés sont traitées avec des concentrée chaude d'acide sulfurique pour produire des sulfates de terres rares soluble dans l'eau. thorium précipite dans la solution sous forme d'hydroxyde et est enlevée. Après que la solution est traitée avec oxalate d'ammonium pour convertir les terres rares dans leurs oxalates insolubles. Les oxalates sont convertis en oxydes par recuit. Les oxydes sont dissous dans de l'acide nitrique qui exclut l'un des principaux composants, le cérium , dont l'oxyde est insoluble dans HNO 3. Plusieurs métaux de terres rares, y compris le lutétium, sont séparés comme un double sel avec du nitrate d'ammonium par cristallisation. Lutétium est séparé par l'échange d'ions. Dans ce procédé, les ions de terres rares sont adsorbés sur la résine échangeuse d'ions appropriée, par échange avec de l'hydrogène, l'ammonium ou des ions cuivriques présents dans la résine. sels de lutétium sont ensuite lavées sélectivement par agent complexant approprié. Lutetium métal est alors obtenue par réduction des anhydre Lu Cl 3 ou Lu F 3 soit par un métal alcalin ou métal alcalino-terreux .
- 2 LUCL 3 + 3 → Ca 2 + 3 Lu CaCl2
Applications
En raison de la rareté et le prix élevé, le lutétium a très peu d'utilisations commerciales. Cependant, le lutétium stable peut être utilisé en tant que catalyseurs en pétrole craquage dans les raffineries et peut également être utilisé dans l'alkylation, l'hydrogénation , et des applications de polymérisation.
Lutécium grenat d'aluminium (Al 5 O 12 Lu 3) a été proposé pour une utilisation comme matériau de lentille en haut indice de réfraction la lithographie par immersion. En outre, une petite quantité de lutétium est ajouté en tant que dopant à gadolinium gallium grenat (GGG), qui est utilisé dans dispositifs de mémoire à bulles magnétiques. Cérium dopé lutétium oxyorthosilicate (LSO) est actuellement le composé préféré pour les détecteurs dans tomographie par émission de positrons (PET). Lutétium est utilisé comme un phosphore dans les ampoules LED.
Mis à part le lutétium stable, ses isotopes radioactifs ont plusieurs utilisations spécifiques. Le mode demi-vie et de la décomposition appropriée fait lutétium-176 utilisé comme un émetteur bêta pur, en utilisant le lutétium qui a été exposé à activation neutronique, et le lutétium-hafnium datant de la date météorites. L'isotope synthétique lutétium-177 lié à octréotate (a analogue de la somatostatine), est utilisé expérimentalement ciblée la thérapie par radionucléides pour tumeurs neuroendocrines.
Tantalate de lutétium (LuTaO 4) est la matière la plus dense connue stable blanc (densité 9,81 g / cm 3) et par conséquent est un hôte idéal pour les luminophores X-ray. Le matériau blanc seulement plus dense est le dioxyde de thorium, avec une densité de 10 g / cm 3, mais il contient le thorium est radioactif.
Précautions
Comme d'autres métaux des terres rares, le lutétium est considéré comme ayant un degré de toxicité faible, mais ses composés doit être manipulé avec soin néanmoins: par exemple, l'inhalation de fluorure lutétium est dangereux et le composé irrite la peau. nitrate de Lutetium peut être dangereux car il peut d'exploser et de brûler une fois chauffé. poudre d'oxyde de lutécium est toxique aussi bien si inhalé ou ingéré.
De la même façon avec une autre groupe 3 éléments et les lanthanides, le lutétium a pas de rôle biologique connu, mais il se trouve même dans les êtres humains , en se concentrant dans les os, et dans une moindre mesure dans le foie et les reins. sels de lutétium sont connus pour se produire avec d'autres sels lanthanides dans la nature; l'élément est le moins abondant dans le corps humain de tous les lanthanides. L'alimentation humaine ne ont pas été suivis pour le contenu de lutétium, donc on ne sait pas combien l'humain moyen prend en, mais estimations montrer le montant ne est que de plusieurs microgrammes par année, provenant tous de petites quantités prises par les plantes. Sels solubles lutétium sont légèrement toxiques, mais ceux ne sont pas insolubles.

