
Néon
Renseignements généraux
SOS Enfants a fait cette sélection Wikipedia aux côtés d'autres écoles des ressources . Parrainage d'enfants aide les enfants du monde en développement à apprendre aussi.
| Néon | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
10 Ne | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||
gaz incolore présentant une lueur orange-rouge lorsqu'il est placé dans un champ électrique à haute tension  Gaz néon dans un tube à décharge, dits néon. Des lignes spectrales de néon dans la région visible | |||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||
| Nom, symbole, nombre | néon, Ne, 10 | ||||||||||||||||||||||||
| Prononciation | / n Je ɒ n / | ||||||||||||||||||||||||
| Élément Catégorie | gaz nobles | ||||||||||||||||||||||||
| Groupe, période, bloc | 18 (gaz rares) , 2, p | ||||||||||||||||||||||||
| Poids atomique standard | 20,1797 (6) | ||||||||||||||||||||||||
| Configuration électronique | [ Il ] 2s 2 2p 6 2, 8 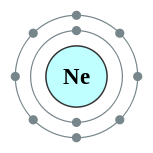 | ||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||
| Prédiction | William Ramsay (1897) | ||||||||||||||||||||||||
| Découverte | William Ramsay & Morris Travers (1898) | ||||||||||||||||||||||||
| Premier isolement | William Ramsay et Morris Travers (1898) | ||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||
| Phase | gaz | ||||||||||||||||||||||||
| Densité | (0 ° C, 101,325 kPa) 0,9002 g / L | ||||||||||||||||||||||||
| Liquid densité à BP | 1,207 g · cm -3 | ||||||||||||||||||||||||
| Point de fusion | 24,56 K , -248,59 ° C, -415,46 ° F | ||||||||||||||||||||||||
| Point d'ébullition | 27,07 K, -246,08 ° C, -410,94 ° F | ||||||||||||||||||||||||
| Point triple | 24,5561 K (-249 ° C), 43 kPa | ||||||||||||||||||||||||
| Point critique | 44,4 K, 2,76 MPa | ||||||||||||||||||||||||
| La chaleur de fusion | 0,335 kJ · mol -1 | ||||||||||||||||||||||||
| Chaleur de vaporisation | 1,71 kJ · mol -1 | ||||||||||||||||||||||||
| Capacité thermique molaire | 5 R / 2 = 20,786 J · mol -1 · K -1 | ||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||
| États d'oxydation | 1, 0 | ||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 2080,7 kJ · mol -1 | ||||||||||||||||||||||||
| 2ème: 3952,3 kJ · mol -1 | |||||||||||||||||||||||||
| 3ème: 6122 kJ · mol -1 | |||||||||||||||||||||||||
| Rayon covalente | 58 h | ||||||||||||||||||||||||
| Rayon de Van der Waals | 154 h | ||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | ||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | ||||||||||||||||||||||||
| Conductivité thermique | 49.1x10 -3 W · m -1 · K -1 | ||||||||||||||||||||||||
| Vitesse du son | (Gaz, 0 ° C) 435 m · s -1 | ||||||||||||||||||||||||
| Module Bulk | 654 GPa | ||||||||||||||||||||||||
| Numéro de registre CAS | 7440-01-9 | ||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||
| Article détaillé: Isotopes du néon | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Enseigne lumineuse est un élément chimique avec le symbole Ne et de numéro atomique 10. Ce est dans le groupe 18 (gaz nobles) de la classification périodique des éléments . Neon est un gaz incolore et inodore sous monoatomique des conditions standard, avec environ deux tiers de la densité de l'air. Il a été découvert (ainsi que du krypton et du xénon), en 1898, comme l'un des trois éléments rares inertes restant dans l'air sec, après l'azote, l'oxygène, l'argon et le dioxyde de carbone sont enlevés. Neon était la deuxième de ces trois gaz rares à découvrir, et a été immédiatement reconnu comme un nouvel élément de son rouge vif spectre d'émission. Le nom de Neon est dérivé des mots grecs signifiant «nouveau». Neon est chimiquement inerte et ne forme pas de composés chimiques non chargés.
Pendant cosmique Nucleogenesis des éléments, de grandes quantités de néon sont construits à partir du processus de fusion alpha-capture dans les étoiles. Bien que le néon est un élément très commun dans l'univers et le système solaire (ce est le cinquième en abondance cosmique après l'hydrogène, de l'hélium, de l'oxygène et du carbone), il est très rare sur la Terre. Il compose environ 18,2 ppm en volume de l'air (ce qui est environ le même que la fraction moléculaire ou mole), et une fraction plus petite dans la croûte. La raison de la rareté relative de néon sur la Terre et les planètes (terrestres) intérieures, est que les formes de néon pas de composés pour le fixer solides, et est très volatile, donc se échapper de la planétésimaux sous la chaleur du Soleil nouvellement enflammé dans le système solaire primitif. Même l'atmosphère de Jupiter est quelque peu appauvri en néon, sans doute pour cette raison.
Neon donne une distincte rougeâtre lueur orange lorsque utilisé soit faible tension lampes de lueur au néon ou en haute tension tubes à décharge ou enseignes publicitaires au néon. La ligne d'émission rouge de néon est également responsable de la lumière rouge bien connu de lasers hélium-néon. Neon est utilisé dans quelques applications de tubes de plasma et de fluide frigorigène, mais a quelques autres utilisations commerciales. Il est extrait dans le commerce par la distillation fractionnée du air liquide. Il est considérablement plus cher que l'hélium, puisque l'air est sa seule source.
Histoire

Neon (νέον grec (néon) signifiant "nouveau") a été découvert en 1898 par les chimistes britanniques Sir William Ramsay (1852-1916) et Morris W. Travers (1872-1961) à Londres. Neon a été découvert lorsque Ramsay refroidi un échantillon d'air jusqu'à ce qu'il devienne un liquide, puis réchauffé le liquide et capturé les gaz comme ils ebullition. Le gaz azote , l'oxygène et de l'argon ont été identifiés, mais les gaz restants ont été isolés à peu près leur ordre d'abondance, dans une période de six semaines à compter de la fin de mai 1898. Première d'être identifié était le krypton . La prochaine, après le krypton avait été retiré, était un gaz qui a donné une lumière rouge brillante sous décharge spectroscopique. Ce gaz, identifié en Juin, a été nommé le néon, l'analogue grecque de «novum» (nouveau), le fils du nom Ramsay suggéré. La couleur brillante caractéristique rouge-orange qui est émis par le néon gazeux lorsqu'il est excité électriquement a été noté immédiatement; Travers a écrit plus tard, «la flamme de la lumière pourpre du tube dit sa propre histoire et était une vue d'insister sur et ne jamais oublier." Enfin, la même équipe a découvert xénon par le même procédé, en Juillet.
La rareté de Neon empêché son application rapide pour l'éclairage le long des lignes de Tubes Moore, qui a utilisé l'azote et qui ont été commercialisés dans les années 1900. Après 1902, La compagnie de Georges Claude, Air Liquide, a été de produire des quantités industrielles de néon comme un sous-produit de son entreprise de liquéfaction d'air. En Décembre 1910 Claude démontré moderne l'éclairage au néon basé sur un tube scellé de néon. Claude essayé brièvement pour obtenir des tubes de néon à être utilisés pour l'éclairage intérieur, en raison de leur intensité, mais a échoué, que les propriétaires ont rejeté les sources de lumière au néon en raison de leur couleur. Enfin, en 1912, l'associé de Claude a commencé à vendre des tubes à décharge au néon panneaux publicitaires, où ils étaient instantanément plus de succès que les capteurs oculaires. Ils ont été introduits aux États-Unis en 1923, lorsque deux grandes enseignes au néon ont été achetés par un concessionnaire automobile de Los Angeles Packard. La lueur et arrêtant couleur rouge fait la publicité au néon complètement différent de la concurrence.
Neon a joué un rôle dans la compréhension fondamentale de la nature des atomes en 1913, quand JJ Thomson , dans le cadre de son exploration dans la composition de rayons canaux, canalisées flux de ions de néon à travers un champ magnétique et un champ électrique et mesuré leur déformation en plaçant une plaque photographique sur leur chemin. Thomson a observé deux pièces séparées de la lumière sur la plaque photographique (voir image), qui a suggéré deux paraboles différentes de déviation. Thomson a finalement conclu que certains des atomes de néon gaz étaient de masse plus élevée que le reste. Bien que pas compris à l'époque par Thomson, ce était la première découverte d' isotopes de stables atomes. Elle a été faite en utilisant une version brut d'un instrument nous maintenant terme comme un spectromètre de masse .
Isotopes

Neon est le gaz inerte le plus léger secondes. Neon a trois isotopes stables :. Ne 20 (90,48%), 21 Ne (0,27%) et 22 NE (9,25%) de 21 et 22 Ne Ne sont en partie primordiale et en partie nucléogéniques (c.-à-fait par des réactions nucléaires d'autres nucléides avec des neutrons ou d'autres particules dans l'environnement) et de leurs variations dans abondance naturelle sont bien compris. En revanche, 20 Ne (le chef isotopes primordiale faite en stellaire nucleosynthesis) ne est pas connu pour être ou nucléogéniques radiogénique (sauf pour la production de décroissance cluster, qui est pensé pour produire seulement une petite quantité). Les causes de la variation de 20 Ne dans la terre ont ainsi été vivement débattue.
Le principal réactions nucléaires qui génèrent néon nucléogéniques isotopes commencent à partir de 24 mg et 25 mg, qui produisent 21 22 Ne et Ne, respectivement, après capture de neutrons et l'émission immédiate d'un particule alpha. Les neutrons qui produisent les réactions sont essentiellement produites par des réactions de spallation secondaires à partir de particules alpha, à son tour, proviennent de l'uranium -série chaînes de désintégration. Le résultat net donne une tendance inférieure 20 Ne / 22 Ne plus élevés et 21 Ne / 22 Ne ratios observés dans les roches riches en uranium comme granites . Néon-21 peut aussi être produite dans une réaction nucléogéniques, lorsque 20 Ne absorbe un neutron provenant de diverses sources naturelles de neutrons terrestres.
En outre, l'analyse isotopique des terrestres exposés roches a démontré la cosmogénique (cosmique ray) production de 21 Ne. Cet isotope est générée par Les réactions de spallation sur magnésium , sodium , silicium et aluminium . En analysant tous les trois isotopes, la composante cosmogénique peut être résolu à partir magmatique néon et néon nucléogéniques. Ceci suggère que le néon sera un outil utile pour déterminer cosmiques exposition âges des roches de surface et météorites.
Similaires à xénon , la teneur en néon observé dans des échantillons de volcaniques gaz est enrichi en 20 Ne, ainsi que nucléogéniques 21 Ne, par rapport à 22 la teneur Ne. Le néon contenu isotopique de ces échantillons de mantellique représente une source non-atmosphérique de néon. Les 20 composants Ne-enrichis sont attribués à exotiques primordiaux rares composants de gaz dans la terre, pouvant représenter néon solaire. 20 Ne abondances élevées sont trouvées dans les diamants , ce qui suggère en outre un réservoir de néon solaire dans la terre.
Caractéristiques

Neon est le deuxième plus léger gaz noble, après l'hélium . Il brille rouge-orange dans un Tube à décharge à vide. En outre, le néon a la gamme la plus étroite de liquide d'un élément: de 24,55 à 27,05 K K (-248,45 ° C à -245,95 ° C, ou -415,21 à -410,71 ° F ° F). Il a plus de 40 fois la capacité de réfrigération de liquide d'hélium et trois fois celle du liquide d'hydrogène (sur une base de volume par unité). Dans la plupart des applications, il est moins cher réfrigérant de l'hélium.
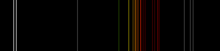
plasma Neon a décharge de la lumière la plus intense à des tensions et des courants de tous les gaz nobles normales. La couleur moyenne de cette lumière à l'œil humain est rouge-orange en raison de nombreuses lignes de cette gamme; il contient également une forte ligne verte qui est caché, à moins que les éléments visuels sont dispersées par un spectroscope.
Deux types très différents de éclairage au néon sont d'usage courant. lampes à incandescence au néon sont généralement petit, la plupart fonctionnant à environ 100 à 250 volts . Ils ont été largement utilisés comme indicateurs de mise sous tension et de l'équipement de circuit d'essai, mais des diodes électroluminescentes (LED) dominent actuellement dans de telles applications. Ces dispositifs de néon simples étaient les précurseurs des les écrans plasma et les écrans de télévision plasma. Des enseignes au néon fonctionnent généralement à des tensions beaucoup plus élevées (2-15 de kilovolts ) et les tubes lumineux sont couramment mètres de long. Le tube de verre est souvent formé dans des formes et des lettres pour la signalisation ainsi que des applications architecturales et artistiques.
Occurrence
Les isotopes stables de néon sont produites en étoiles. 20 Ne est créée en fusionnant l'hélium et l'oxygène dans le processus d'alpha, qui nécessite des températures supérieures à 100 méga kelvins et des masses de plus de 3 masses solaires.
Neon est abondante à l'échelle universelle; c'est le cinquième élément le plus abondant de produits chimiques dans l'univers de la masse, après l'hydrogène, l'hélium, l'oxygène et le carbone (voir élément chimique ). Sa rareté relative sur Terre, comme celle de l'hélium, est due à sa relative légèreté, haute pression de vapeur à très basses températures, et l'inertie chimique, toutes les propriétés qui tendent à l'empêcher d'être pris au piège dans les gaz et de poussières de condensation des nuages qui ont abouti à la formation de plus petites et plus chaudes planètes solides comme la Terre.
Neon est monoatomique, le rendant plus léger que les molécules d'azote et d'oxygène diatomique qui forment la majeure partie de l'atmosphère terrestre; un ballon rempli avec le néon se élèvera dans l'air, bien que plus lentement qu'un ballon d'hélium.
L'abondance de masse dans l'univers est d'environ 1 part à 750 et dans le Sun et probablement dans le système nébuleuse proto-solaire, environ 1 partie en 600. Le Sonde Galileo sonde de rentrée atmosphérique a constaté que même dans la haute atmosphère de Jupiter, l'abondance du néon est réduite (épuisé) par un facteur d'environ 10, à un niveau de 1 partie en 6000 en masse. Cela peut indiquer que la même glace planétésimaux qui ont amené le néon sur Jupiter du système solaire externe, formés dans une région qui était trop chaud pour eux ont gardé leur néon (abondance des gaz inertes lourds sur Jupiter sont à plusieurs reprises que l'on trouve dans le Soleil).
Neon est rare sur Terre, a trouvé dans le atmosphère de la Terre à une part à 55 000, ou 18,2 ppm en volume (ce est environ le même que la molécule ou fraction molaire), ou une partie de l'air dans 79 000 en masse. Elle comprend une fraction plus petite dans la croûte. Elle est produite industriellement par cryogénique distillation fractionnée de l'air liquéfié.
Applications

Enseigne lumineuse est souvent utilisé dans signes et produit une lumière brillante rouge-orange unique. Bien qu'il soit encore dénommé "néon", toutes les autres couleurs sont générées avec les autres gaz nobles ou en plusieurs couleurs de éclairage fluorescent.
Neon est utilisé dans les tubes à vide, des indicateurs à haute tension, parafoudres, tubes de compteurs d'onde, télévision tubes, et lasers hélium-néon. Néon liquéfié est utilisé dans le commerce comme un cryogénique frigorigène dans les applications ne nécessitant pas la plage de température est inférieur à celui des plus extrêmes réfrigération hélium liquide.
Les deux gaz néon et de néon liquide sont relativement coûteux - pour de petites quantités, le prix du néon liquide peut être plus de 55 fois supérieur à celui de l'hélium liquide. Le pilote de la charge de néon est la rareté du néon, qui, contrairement à l'hélium, ne peut être obtenu à partir de l'air.
Le triple température de point de néon (24,5561 K) est un point fixe dans la définition Échelle internationale de température de 1990.
Composés
Neon est le premier gaz noble bloc p. Enseigne lumineuse est généralement considéré comme inerte. Pas de véritables composés neutres du néon sont connus. Cependant, les ions Ne +, (Ne Ar ) +, (Ne H +) et ( Il NE +) ont été observés à partir optique et spectrométrie de masse des études, et il ya des informations non vérifiées d'un instable hydrate.

