
Tableau périodique
Contexte des écoles Wikipédia
SOS Enfants, qui se déroule près de 200 sos écoles dans le monde en développement, a organisé cette sélection. SOS Children travaille dans 45 pays africains; pouvez-vous aider un enfant en Afrique ?
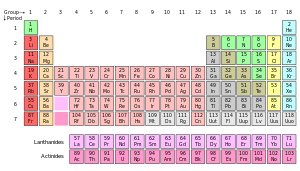
Le tableau périodique est un affichage tabulaire des éléments chimiques , organisé sur la base de leurs numéros atomiques , configurations électrons, et récurrent propriétés chimiques. Les éléments sont présentés en ordre croissant de numéro atomique (nombre de protons). La forme standard de table comprend une grille 18 × 7 ou corps principal des éléments, positionné au-dessus d'une double rangée de petits éléments. La table peut également être déconstruit en quatre blocs rectangulaires: la s-bloc vers la gauche, la p-bloc vers la droite, la d-bloc dans le milieu, et la f-bloc dessous. Les lignes de la table sont appelés périodes; les colonnes des S-, D-, et les p-blocs sont appelés groupes, avec certains de ces noms ayant tels que les halogènes ou les gaz rares . Puisque, par définition, un tableau périodique incorpore tendances récurrentes, un tel tableau peuvent être utilisées pour obtenir des relations entre les propriétés des éléments et de prédire les propriétés de la nouvelle, encore à découvrir ou synthétisé, éléments. En conséquence, une table, que ce soit périodique sous la forme standard ou une autre variante-fournit un cadre utile pour l'analyse du comportement chimique, et ces tables sont largement utilisés dans la chimie et autres sciences.
Bien que précurseurs existent, Dmitri Mendeleïev est généralement crédité de la publication, en 1869, du premier tableau périodique largement reconnue. Il a développé sa table pour illustrer les tendances périodiques dans les propriétés des éléments alors connus. Mendeleïev prédit également certaines propriétés de éléments alors inconnus qui seraient attendus pour combler les lacunes dans ce tableau. La plupart de ses prédictions se avèrent exactes lorsque les éléments en question ont ensuite été découverts. Tableau périodique de Mendeleïev a depuis été élargi et affiné avec la découverte ou la synthèse d'autres nouveaux éléments et le développement de nouveaux modèles théoriques pour expliquer le comportement chimique.
Tous les éléments de numéros atomiques 1 ( d'hydrogène ) à 118 ( ununoctium ) ont été découverts ou synthétisé. Parmi ceux-ci, tout jusqu'à et y compris californium existe naturellement; le reste ne ont été synthétisés dans les laboratoires. Production d'éléments au-delà ununoctium se poursuit, avec la question de la façon dont le tableau périodique peut être nécessaire de modifié pour accueillir de tels ajouts étant une question de débat. Nombreux synthétique radionucléides d'éléments naturels ont également été produits dans les laboratoires.
Disposition
| Tableau périodique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Groupe → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||||||||||||||||||||||||
| ↓ Période | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 1 H | 2 Il | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 3 Li | 4 Être | 5 B | 6 C | 7 N | 8 O | 9 Fa | 10 Ne | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 11 N / A | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 19 K | 20 Californie | 21 Caroline du Sud | 22 Ti |
23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Géorgie | 32 Ge | 33 Comme | 34 Se |
35 Br | 36 Kr | ||||||||||||||||||||||||||||||||||||||
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd |
47 Ag | 48 CD | 49 En | 50 Sn | 51 Sb | 52 Te | 53 Je | 54 Xe | ||||||||||||||||||||||||||||||||||||||
| 6 | 55 Cs | 56 Ba | * | 72 Hf | 73 Ta |
74 W | 75 Ré | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 À | 86 Rn |
||||||||||||||||||||||||||||||||||||||
| 7 | 87 Fr | 88 Ra | ** | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Uut | 114 Fl | 115 Uup | 116 Lv | 117 Uus | 118 Uuo | ||||||||||||||||||||||||||||||||||||||
| * lanthanides | 57 La | 58 Ce | 59 Pr | 60 Dakota du Nord | 61 Pm | 62 Sm | 63 Ue | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 YB | 71 Lu | |||||||||||||||||||||||||||||||||||||||||
| ** actinides | 89 Un C | 90 Th | 91 Pennsylvanie | 92 U | 93 Np | 94 Pu | 95 Suis | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 Aucun |
103 Lr | |||||||||||||||||||||||||||||||||||||||||
Ce est un 18-colonne tableau périodique présentation, ce qui est venu à être appelé la forme commune ou de la norme, en raison de sa popularité. Il est aussi parfois appelée la forme longue, en comparaison à la forme courte ou Mendeleïev de style, qui omet les groupes 3-12 en plaçant leurs éléments dans les groupes principaux. Le grande table périodique intègre les lanthanides et les actinides , plutôt que de les séparer du corps principal de la table afin d'économiser de l'espace. Le tableau périodique étendu ajoute les périodes 8e et 9e, y compris le superactinides. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Toutes les versions de la table périodique des éléments chimiques ne comprennent que, non les mélanges, les composés , ou particules subatomiques. Chaque élément chimique a un numéro atomique unique représentant le nombre de protons dans son noyau. La plupart des éléments ont des nombres différents de neutrons parmi des atomes différents, avec ces variantes étant désignées comme étant des isotopes . Par exemple, le carbone a trois isotopes naturels: l'ensemble de ses atomes possèdent six protons et la plupart ont six neutrons aussi bien, mais environ un pour cent de sept neutrons, et une très petite fraction avoir huit neutrons. Les isotopes ne sont jamais séparés dans le tableau périodique; ils sont toujours regroupés dans un seul élément. Éléments sans isotopes stables ont les masses atomiques de leurs isotopes les plus stables, où ces masses sont représentés, figurant entre parenthèses.
Dans le tableau périodique standard, les éléments sont énumérés en ordre croissant de numéro atomique (nombre de protons dans le noyau d'un atome). Une nouvelle ligne ( période) est commencé quand une nouvelle couche électronique a son premier électron. (Colonnes groupes) sont déterminées par la configuration d'électrons de l'atome; éléments avec le même nombre d'électrons dans un sous-shell notamment tombent dans les mêmes colonnes (par exemple l'oxygène et le sélénium sont dans la même colonne, car ils ont tous deux quatre électrons dans le p-sous-shell à l'extérieur). Les éléments ayant des propriétés chimiques semblables se retrouvent généralement dans le même groupe dans le tableau périodique, bien que dans le bloc f, et à certains égards à la d-bloc, les éléments de la même période ont tendance à avoir des propriétés similaires, aussi bien. Ainsi, il est relativement facile de prédire les propriétés chimiques d'un élément, si l'on connaît les propriétés des éléments qui l'entourent.
À partir de 2012, le tableau périodique contient 118 éléments chimiques confirmés. Parmi ces éléments, 114 ont été officiellement reconnu et nommé par le Union internationale de chimie pure et appliquée (UICPA). Un total de 98 de ces se produisent naturellement, dont 84 sont primordiale. Les 14 autres éléments naturels se produisent seulement dans chaînes d'éléments primordiaux de désintégration. Tous les éléments de einsteinium à copernicium , ainsi que Flérovium et Livermorium, tout en ne se trouve naturellement dans l'univers, ont été dûment synthétisé et reconnue officiellement par l'IUPAC. Éléments 113 , 115 , 117 et 118 auraient été synthétisé en laboratoire, mais ces rapports ne ont pas encore été confirmés. En tant que telle de ces éléments sont actuellement connues que par leurs noms d'éléments systématiques, en fonction de leurs nombres atomiques. Aucun élément plus lourd que einsteinium (élément 99) n'a jamais été observé dans des quantités macroscopiques dans sa forme pure. Aucun élément dernières 118 ont été synthétisés à partir de 2012.
Regroupement méthodes
Groupes
Un groupe ou de la famille est une colonne verticale dans le tableau périodique. Groupes ont généralement tendances périodiques plus importantes que les périodes et les blocs, expliquées ci-dessous. Modernes théories de mécanique quantique de la structure atomique expliquent les tendances de groupe en proposant que des éléments au sein du même groupe ont généralement configurations d'électrons mêmes dans leur shell valence. Par conséquent, les éléments du même groupe ont tendance à avoir une chimie partagée et présentent une tendance claire dans les propriétés avec l'augmentation de nombre atomique. Cependant, dans certaines parties du tableau périodique, tels que le d-bloc et le bloc f, similitudes horizontales peuvent être aussi importantes, sinon plus prononcé que, similitudes verticales.
En vertu d'une convention de nommage internationale, les groupes sont numérotées numériquement 1-18 de la colonne de gauche (les métaux alcalins) à la colonne de droite (les gaz nobles). Auparavant, ils étaient connus par les chiffres romains . En Amérique, les chiffres romains ont été suivis soit par un «A» si le groupe était dans le s- ou p-bloc, ou un "B" si le groupe a participé à la D-Block. Les chiffres romains utilisés correspondent au dernier chiffre de la convention de nommage d'aujourd'hui (par exemple, le groupe 4 éléments étaient le groupe IVB, et de la groupe 14 éléments était groupe IVA). En Europe, le lettrage est similaire, sauf que «A» a été utilisé si le groupe était avant groupe 10, et «B» a été utilisé pour les groupes, y compris et après groupe 10. En outre, des groupes 8, 9 et 10 utilisés pour être traités comme un groupe triple de taille, connu collectivement dans les deux notations que groupe VIII. En 1988, le nouveau système de nommage de l'UICPA a été mis en service, et les anciens noms de groupe ont été désapprouvée.
| Groupe | Nom |
|---|---|
| 1 | les métaux alcalins |
| 2 | métaux alcalino-terreux |
| 11 | métaux monnayage |
| 12 | métaux volatils (rarement utilisé) |
| 13 | icosagens (rarement utilisé) |
| 14 | crystallogens (rarement utilisé) |
| 15 | pnictogens |
| 16 | chalcogènes |
| 17 | halogènes |
| 18 | gaz nobles (rarement aerogens ) |
Certains de ces groupes ont été donnés triviales noms (non systématiques), comme on le voit dans le tableau à droite, même si certains sont rarement utilisés. Groupes 3-10 ne ont pas de noms triviaux et sont appelés simplement par leurs numéros de groupe ou par le nom du premier membre de leur groupe (tels que 'le groupe de scandium »pour Groupe 3), car ils affichent moins de similitudes et / ou les tendances verticales.
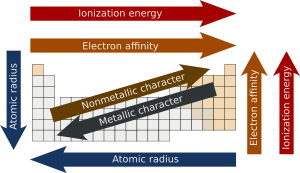
Éléments du même groupe ont tendance à montrer des modèles dans rayon atomique, énergie d'ionisation, et électronégativité. De haut en bas dans un groupe, le rayon atomique des éléments augmente. Comme il existe des niveaux d'énergie plus remplis, les électrons de valence se trouvent plus loin du noyau. Du sommet, chaque élément successif a une énergie d'ionisation inférieure, car il est plus facile de retirer un électron depuis les atomes sont moins étroitement liés. De même, un groupe a un haut en bas d'électronégativité diminution due à une augmentation de la distance entre les électrons de valence et le noyau. Il ya des exceptions à ces tendances, cependant, un exemple de ce qui se produit dans groupe 11 où électronégativité augmente plus bas du groupe.
Périodes
Une période est une ligne horizontale dans le tableau périodique. Bien que les groupes ont généralement tendances périodiques les plus importants, il ya des régions où les tendances horizontales sont plus importants que les tendances de groupe verticaux, tels que le f-bloc, où les lanthanides et actinides forment deux séries horizontale important d'éléments.
Éléments pour la même période montrent les tendances dans le rayon atomique, énergie d'ionisation, affinité électronique, et électronégativité. Se déplaçant de gauche à droite sur une période, rayon atomique diminue habituellement. Cela se produit parce que chaque élément successif a un proton et d'ajouter électrons qui provoque l'électron à être tirée plus près du noyau. Cette diminution de rayon atomique provoque également l'énergie d'ionisation à augmenter lorsque se déplaçant de gauche à droite sur une période. L'un élément plus étroitement lié est, plus l'énergie est nécessaire pour enlever un électron. Électronégativité augmente de la même manière que l'énergie d'ionisation en raison de la traction exercée sur les électrons par le noyau. Affinité électronique montre également une légère tendance sur une période. Metals (côté gauche d'une période) ont généralement une plus faible affinité d'électrons de non-métaux (côté droit d'une période), à l'exception des gaz nobles.
Blocs
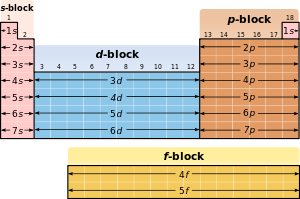
En raison de l'importance de la coque la plus externe d'électrons, les différentes régions de la classification périodique sont parfois appelées blocs, nommées en fonction de la sous-couche dans laquelle l'électron "dernier" réside. Le s-bloc comprend les deux premiers groupes (métaux alcalins et de métaux alcalino-terreux), ainsi que l'hydrogène et l'hélium. Le p-bloc comprend les six derniers groupes qui sont des groupes 13 à 18 de l'IUPAC (3A à 8A en Amérique) et contient, entre autres éléments, tous les métalloïdes. Le d-bloc comprend des groupes 3 à 12 dans UICPA (2B ou 3B de numérotation de groupe en américain) et contient tous les métaux de transition. Le bloc f, généralement compensée en dessous du reste de la table périodique, comprend les lanthanides et les actinides.
D'autres conventions et variations
Dans les présentations du tableau périodique, les lanthanides et les actinides sont habituellement présentés comme deux rangées supplémentaires ci-dessous le corps principal de la table, avec des emplacements ou bien un seul élément sélectionné de chaque série (soit le lanthane ou le lutétium, et soit l'actinium ou lawrencium , respectivement) présentée dans une seule cellule de la table principale, entre le baryum et le hafnium , et le radium et rutherfordium , respectivement. Cette convention est entièrement une question d'esthétique et praticité formatage; un rarement utilisé tableau périodique grand format insère le lanthanides et des actinides à leur place, comme des parties de sixième et septième lignes du tableau (périodes).
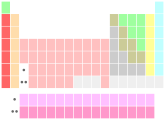 | 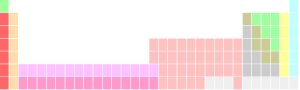 |
| Tableau périodique avec bloc f séparés (gauche) et en ligne (à droite) | |
Certains tableaux périodiques comprennent un divisant la ligne, ou équivalent, entre les métaux et non-métaux. Diverses autres catégories d'éléments peuvent également être mis en évidence sur un tableau périodique, y compris, par exemple, des métaux de transition , post-transition métaux, ou métalloïdes. Groupes spécialisés comme le métaux réfractaires et la des métaux nobles, qui sont des sous-ensembles (dans cet exemple) des métaux de transition, sont également connus et parfois désignés.
Tendances périodiques
Configuration électronique

La configuration électronique ou l'organisation d'électrons en orbite autour atomes neutres montre un schéma récurrent ou de la périodicité. Les électrons occupent une série de coquilles d'électrons (coque numérotée 1, shell 2, et ainsi de suite). Chaque coquille est constituée d'un ou plusieurs sous-couches (s nommés, p, d, f et g). Comme numéro atomique augmente, les électrons remplissent progressivement ces coquilles et sous-couches plus ou moins en fonction de la Madelung règle ou d'énergie règle de commande, comme indiqué dans le schéma de droite. La configuration d'électrons pour néon , par exemple, est de 1 s 2 s 2 2 2p 6. Avec un numéro atomique de dix, le néon a deux électrons dans la première enveloppe, et huit électrons dans la seconde coque-deux dans la sous-couche s et six dans le sous-shell p. Pour ce qui est de la table périodique, la première fois qu'un électron occupe une nouvelle coquille correspond au début de chaque nouvelle période, ces positions étant occupées par un atome d'hydrogène et les métaux alcalins .
Depuis les propriétés d'un élément sont principalement déterminées par sa configuration électronique, les propriétés des éléments montrent également des motifs ou comportement périodique, quelques exemples qui sont présentés dans le diagramme sur la gauche récurrents. Ce est cette périodicité des propriétés, manifestations dont ont été bien remarqué avant la théorie sous-jacente a été développée , qui a conduit à la mise en place de la loi périodique (les propriétés des éléments reviennent à intervalles variables) et la formulation des premières tables périodiques.
Rayons atomiques
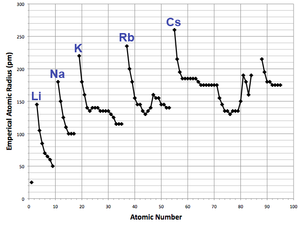
Rayons atomiques varient d'une manière prévisible et explicable à travers la table périodique. Par exemple, les rayons diminuent en général le long de chaque période de la table, à partir de métaux alcalins à des gaz nobles; et d'augmenter en bas de chaque groupe. Le rayon augmente fortement entre le gaz noble à la fin de chaque période et le métal alcalin au début de la période suivante. Ces tendances des rayons atomique (et de diverses autres propriétés physiques des éléments chimiques et autres) peut être expliqué par la théorie de la coquille d'électrons de l'atome; ils ont fourni des preuves importantes pour le développement et la confirmation de la théorie quantique .
Les électrons dans le 4f-sous-shell, qui est progressivement rempli de cérium (Z = 58) au lutétium (Z = 71), ne sont pas particulièrement efficaces pour protéger le charge nucléaire croissante des sous-coquilles plus loin. Les éléments qui suivent immédiatement les lanthanides ont des rayons atomiques qui sont plus petites que celui qui serait prévu et qui sont pratiquement identiques aux rayons atomique des éléments immédiatement au-dessus. Ainsi hafnium a pratiquement le même rayon atomique (et de la chimie) et le zirconium , et du tantale a un rayon atomique proche de niobium , et ainsi de suite. Ceci est connu comme la contraction lanthanide. L'effet de la contraction des lanthanides est perceptible jusqu'à platine (Z = 78), après quoi il est masqué par un effet relativiste connu sous le nom inerte effet de paire. Le d-bloc contraction, ce qui est un effet similaire entre le d-bloc et p-bloc, est moins prononcée que la contraction des lanthanides, mais découle d'une cause semblable.
l'énergie d'ionisation
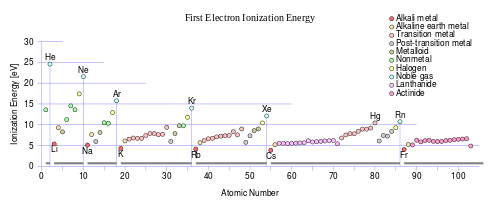
La première énergie d'ionisation est l'énergie qu'il faut pour retirer un électron de l'atome, la seconde énergie d'ionisation est l'énergie qu'il faut pour retirer un deuxième électron de l'atome, et ainsi de suite. Pour un atome donné, les énergies d'ionisation successives augmentent avec le degré d'ionisation. Pour magnésium à titre d'exemple, la première énergie d'ionisation est 738 kJ / mol, et la seconde est 1450 kJ / mol. Les électrons dans les orbitales plus étroits éprouvent de plus grandes forces d'attraction électrostatique; ainsi, leur retrait nécessite de plus en plus d'énergie. énergie d'ionisation devient plus grande en haut et à droite du tableau périodique.
Les grands sauts successifs dans les énergies d'ionisation molaires se produisent lors du retrait d'un électron à partir d'une configuration de gaz noble (couche électronique complète). Pour magnésium de plus, les deux premières énergies molaires d'ionisation de magnésium ci-dessus correspondent à l'élimination des deux 3 électrons, et la troisième énergie d'ionisation est un nombre beaucoup plus 7,730 kJ / mol, pour l'élimination d'un électron 2p de la très stable néon -like configuration de Mg 2+. Sauts similaires se produisent dans les énergies d'ionisation d'autres atomes de la troisième rangée.
Électronégativité
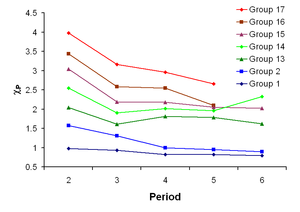
Électronégativité est la tendance d'un atome à attirer des électrons . L'électronégativité de l'atome est affectée à la fois par son numéro atomique et la distance entre le électrons de valence et le noyau. Le plus son électronégativité, plus un élément attire les électrons. Il a d'abord été proposé par Linus Pauling en 1932. En général, électronégativité augmente en passant de gauche à droite le long d'une période, et diminue en descendant un groupe. De ce fait, le fluor est le plus électronégatif des éléments, tandis que le césium est le moins, au moins de ces éléments pour lesquels des données sont disponibles substantielle.
Il ya quelques exceptions à cette règle générale. Gallium et le germanium ont électronégativités plus élevés que l'aluminium et le silicium respectivement en raison de la contraction d-bloc. Éléments de la quatrième période immédiatement après la première ligne des métaux de transition ont inhabituellement faible rayons atomiques parce que les électrons 3d ne sont pas efficaces au blindage de la charge nucléaire accrue et une plus petite taille atomique corrélation avec électronégativité plus élevée. L'électronégativité anormalement élevée de plomb, surtout en comparaison avec le thallium et le bismuth , semble être un artefact de la sélection de données (et la disponibilité des données) -méthodes de calcul autre que la méthode Pauling montrer les tendances périodiques normales pour ces éléments.
Affinité électronique
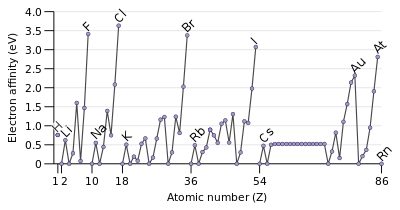
L'affinité d'électrons d'un atome est la quantité d'énergie libérée quand un électron est ajouté à un atome neutre pour former un ion négatif. Bien affinité électronique varie grandement, certaines tendances se dégagent. Généralement, non-métaux ont des valeurs d'affinité électronique plus positifs que les métaux . Chlore plus fortement attire un électron supplémentaire. Les affinités électroniques des gaz nobles ne ont pas été mesurées de façon concluante, de sorte qu'ils peuvent ou non avoir des valeurs légèrement négatives.
Affinité électronique augmente généralement sur une période. Ceci est causé par le remplissage de la couche de valence de l'atome; un groupe 17 atome libère plus d'énergie qu'un atome groupe 1 sur l'acquisition d'un électron, car il obtient une couche de valence rempli et est donc plus stable.
Une tendance à la baisse affinité électronique descendre groupes serait prévu. L'électron supplémentaire va entrer dans une orbitale plus loin du noyau. En tant que tel cet électron serait moins attiré vers le noyau et se libérer moins d'énergie lorsqu'il est ajouté. Cependant, à descendre un groupe, environ un tiers d'éléments sont anormales, avec des éléments plus lourds ayant des affinités d'électrons plus élevés que leurs congénères plus légers prochaines. Largement, cela est dû à la mauvaise protection par des électrons d et f. Une diminution uniforme dans affinité électronique se applique uniquement aux groupes une atomes.
Caractère métallique
Plus les valeurs d'énergie d'ionisation, l'électronégativité et l'affinité électronique plus métallique de l'élément présente un caractère. Caractère non métallique inverse, augmente avec des valeurs plus élevées de ces propriétés. Compte tenu des tendances périodiques de ces trois propriétés, caractère métallique tend à diminuer traversant une période et, avec quelques irrégularités (principalement) en raison de la mauvaise sélection du noyau par des électrons d et f, et effets relativistes, tend à augmenter descendre un groupe. Ainsi, les éléments les plus métalliques (tels que le césium et le francium ) se trouvent en bas à gauche de tables périodiques traditionnelles et les éléments les plus non métalliques ( oxygène , le fluor , chlore ) en haut à droite. La combinaison des tendances horizontales et verticales à caractère métallique explique la forme escalier- ligne de division entre les métaux et non-métaux trouvés sur certains tableaux périodiques, et la pratique de catégoriser parfois plusieurs éléments adjacents à cette ligne, ou des éléments adjacents à ces éléments, que métalloïdes.
Histoire
Premières tentatives de systématisation

En 1789, Antoine Lavoisier a publié une liste de 33 éléments chimiques , en les regroupant en gaz , métaux , les non-métaux, et terres; Chimistes ont passé le siècle suivant recherchant un système de classification plus précis. En 1829, Johann Wolfgang Döbereiner a observé que plusieurs des éléments pourraient être groupés dans les triades en fonction de leurs propriétés chimiques. lithium , sodium et potassium , par exemple, ont été regroupés dans une triade aussi doux, des métaux réactifs. Döbereiner a également observé que, lorsqu'elle est disposée en poids atomique, le deuxième membre de chaque triade était à peu près la moyenne de la première et la troisième; ce est devenu connu comme le Loi des triades. Chimiste allemand Leopold Gmelin a travaillé avec ce système, et d'ici 1843 il avait identifié dix triades, trois groupes de quatre, et un groupes de cinq. Jean-Baptiste Dumas travaux publiés en 1857 décrivant les relations entre les divers groupes de métaux. Bien que les divers chimistes aient pu identifier des rapports entre de petits groupes d'éléments, ils ont eu établir encore un plan qui les a entourés tous.
En 1858, le chimiste allemand Août Kekulé observé que le carbone a souvent quatre autres atomes liés à elle. Le méthane , par exemple, a un atome de carbone et quatre atomes d'hydrogène. Ce concept est devenu connu comme valence ; différents éléments liaison avec des nombres différents d'atomes.
En 1862, Alexandre-Émile Béguyer de Chancourtois, un géologue français, a publié une première forme de tableau périodique, qu'il a appelé l'hélice tellurique ou une vis. Il était la première personne à remarquer la périodicité des éléments. Avec les éléments disposés en spirale sur un cylindre par ordre croissant de poids atomique, de Chancourtois a montré que des éléments ayant des propriétés similaires ont semblé se produire à intervalles réguliers. Son tableau comprenait certains ions et composés en plus des éléments. Son journal a également utilisé géologiques plutôt que des termes chimiques et ne comprenait pas un schéma; en conséquence, il a reçu peu d'attention jusqu'à ce que le travail de Dmitri Mendeleïev .
En 1864, Julius Lothar Meyer, un chimiste allemand, a publié une table avec 44 éléments disposés par la valence. Le tableau montre que les éléments avec les propriétés semblables ont souvent partagé la même valence. Parallèlement, William Odling (un chimiste anglais) a publié un arrangement de 57 éléments, ordonné sur la base de leurs poids atomiques. Avec quelques irrégularités et des lacunes, il a remarqué ce qui semblait être une périodicité de poids atomiques entre les éléments et que ceci se accordait avec 'leurs groupements généralement reçues. " Odling fait allusion à l'idée d'une loi périodique, mais n'a pas le poursuivre. Il a ensuite proposé (en 1870) une classification fondée valence des éléments.
Le chimiste anglais John Newlands a produit une série de documents de 1863 à 1866 notant que lorsque les éléments ont été classés par ordre de poids atomique croissant, les propriétés physiques et chimiques semblables se sont reproduites à intervalles de huit; comme il a comparé à la périodicité octaves de la musique. Cette sorte appelé Loi des octaves, cependant, a été ridiculisé par les contemporains de Newlands, et de la Chemical Society a refusé de publier son travail. Newlands était néanmoins capable de rédiger un tableau des éléments et l'a utilisé pour prédire l'existence d'éléments manquants, tels que le germanium . The Chemical Society seulement reconnu l'importance de ses découvertes cinq ans après leur crédités Mendeleïev.
En 1867, Gustave Hinrichs, un chimiste universitaire danois né réparties en Amérique, publié un système périodique spirale sur la base de spectres et le poids atomique, et les similitudes chimiques. Son travail a été considéré comme idiosyncrasique, ostentatoire et labyrinthique et cela peut avoir milité contre la reconnaissance et l'acceptation.
La table de Mendeleïev


Professeur de chimie russe Dmitri Mendeleev et chimiste allemand Julius Lothar Meyer indépendamment édité leurs tables périodiques en 1869 et 1870, respectivement. La table de Mendeleïev était sa première version publiée; celle de Meyer était une version élargie de sa table (Meyer) de 1864. Ils ont tous deux ont construit leurs tables en énumérant les éléments en lignes ou en colonnes par ordre de poids atomique et en commençant une nouvelle rangée ou colonne quand les caractéristiques des éléments ont commencé à répéter .
La reconnaissance et l'acceptation bénéficient de la table de Mendeleev est venu de deux décisions qu'il a prises. Le premier était de laisser des lacunes dans la table quand il a semblé que l'élément correspondant ne avait pas encore été découvert. Mendeleev ne était pas le premier chimiste à faire, mais il était le premier à être reconnu comme employant les tendances dans sa table périodique de prévoir les propriétés de ceux éléments manquants, tels que le gallium et le germanium. La deuxième décision était de temps en temps d'ignorer l'ordre suggéré par les poids atomiques et de commuter les éléments adjacents, tels que le tellure et l'iode , pour les classifier mieux dans les familles chimiques. Avec le développement des théories de structure atomique, il est devenu évident que Mendeleev avait involontairement énuméré les éléments par ordre croissant de numéro atomique ou une charge nucléaire.
La signification des nombres atomiques à l'organisation de la table périodique n'a pas été apprécié jusqu'à ce que l'existence et les propriétés des protons et les neutrons se est compris. Tables périodiques de Mendeleïev utilisés poids atomique au lieu de numéro atomique d'organiser les éléments, informations déterminable à la précision équitable dans son temps. Poids atomique fonctionnait assez bien dans la plupart des cas à (indication contraire) donne une présentation qui était capable de prédire les propriétés des éléments manquants de façon plus précise que toute autre méthode alors connu. Remplacement des numéros atomiques, une fois compris, a donné une séquence définitive, entier non pour les éléments, encore utilisé aujourd'hui même si de nouveaux éléments synthétiques sont produites et étudiées.
La poursuite du développement
En 1871, Mendeleïev a publié une mise à jour sous forme de tableau périodique (voir à gauche), ainsi que de donner des prévisions détaillées pour les éléments qu'il a précédemment noté manquaient, mais devrait exister. Ces lacunes ont ensuite été remplis que les chimistes découvraient des éléments naturels supplémentaires. Il est souvent affirmé que le dernier élément naturel à découvrir était francium (désigné par Mendeleev comme eka-césium) en 1939. Toutefois, le plutonium , produit synthétiquement en 1940, a été identifié en quantités infimes comme un élément primordial naturel en 1971 et en 2011 il a été constaté que tous les éléments jusqu'à californium peuvent se produire naturellement que des traces dans les minerais d'uranium par capture de neutrons et de la désintégration bêta.
La disposition du tableau périodique populaire, aussi connu comme la forme commune ou de la norme (comme illustré à divers autres points dans cet article), est attribuable à Horace Groves Deming. En 1923, Deming, un chimiste américain, publié courte ( Le style de Mendeleïev) et moyen ( 18-colonne) forment tableaux périodiques. Merck and Company préparé un formulaire de document de 18 colonnes de la table de support de Deming, en 1928, qui a été largement diffusé dans les écoles américaines. Dans les années 1930 la table de Deming apparaissait dans les manuels et les encyclopédies de la chimie. Il a également été distribué pendant de nombreuses années par le Sargent-Welch Scientific Company.
Avec le développement des modernes mécanique quantique théories de électrons dans les atomes configurations, il est devenu évident que chaque période (ligne) dans le tableau correspond au remplissage d'une coquille de quantum des électrons. Plus grands atomes ont plus de sous-coquilles d'électron, plus tard tables ont exigé progressivement de plus longues périodes.

En 1945, Glenn Seaborg, un scientifique américain, a suggéré que les éléments actinides , comme les lanthanides remplissaient un sous-niveau f. Avant cette époque, les actinides ont été pensés pour être la formation d'un quatrième bloc d rangée. Les collègues de Seaborg lui conseillent de ne pas publier une telle suggestion radicale qu'elle serait très probablement ruiner sa carrière. Comme Seaborg considéré qu'il n'a pas alors une carrière à déconsidérer, il a publié de toute façon. La suggestion de Seaborg a été jugée correcte et il est allé ensuite à remporter le prix Nobel 1951 de chimie pour ses travaux dans la synthèse des éléments d'actinides.
Bien que des quantités infimes de certains transuraniens se produisent naturellement, ils ont tous été d'abord découvert dans les laboratoires. Leur production a élargi le tableau périodique de manière significative, le premier d'entre eux étant le neptunium , synthétisé en 1939. Comme bon nombre des éléments transuraniens sont très instables et la pourriture rapidement, ils sont difficiles à détecter et caractériser lorsqu'elle est produite. Il y a eu controverses concernant l'acceptation de la découverte en compétition les réclamations pour certains éléments, exigeant un examen indépendant pour déterminer la partie qui a la priorité, et donc les droits de nommage. Les éléments les plus récemment reconnus et nommés sont flérovium (élément 114) et livermorium (élément 116), tous deux nommés le 31 mai 2012. En 2010, une collaboration russo-américain à Dubna, l'oblast de Moscou, en Russie, a affirmé avoir synthétisé six atomes de Ununseptium (élément 117), ce qui en fait la découverte la plus récemment affirmé.
Agencements alternatifs
Il ya beaucoup de tables périodiques avec les dispositions autres que celle de la forme commune ou de la norme. Dans les 100 ans de l'apparition de la table de Mendeleev en 1869 il a été estimé que près de 700 différentes versions périodiques de table ont été publiés. Ainsi que de nombreuses variations rectangulaires, d'autres formats de table périodiques ont inclus, par exemple, circulaire, cubique, cylindrique, edificial (bâtiment-like), hélicoïdale, lemniscate, prismatique octogonale, pyramidale, séparés, sphérique, en spirale, et des formes triangulaires. Ces alternatives sont souvent développés pour mettre en évidence ou accentuer des propriétés chimiques ou physiques des éléments qui ne sont pas aussi apparent dans les tableaux périodiques traditionnels.
Une mise en page alternative populaire est celle de Theodor Benfey (1960). Les éléments sont disposés en une spirale continue, avec de l'hydrogène au centre et les métaux de transition, les lanthanides, les actinides et les péninsules d'occupation.
La plupart des tables périodiques sont deux dimensions tables mais en trois dimensions sont connus pour aussi loin que au moins 1862 (pré-datant tableau à deux dimensions de Mendeleïev de 1869). Des exemples plus récents incluent périodique Classification des Courtines (1925), Système de Lamina Wringley (1949), périodique hélice de Giguère (1965) et Arbre périodique de Dufour (1996). Franchissant un mieux, tableau périodique de Physicien de Stowe (1989) a été décrit comme étant à quatre dimensions (trois ayant une dimension spatiale et de la couleur).
Les diverses formes de tableaux périodiques peuvent être considérés comme se trouvant dans un continuum de chimie-physique. Vers la fin de la chimie du continuum peut être trouvé, par exemple, «indisciplinés» Inorganic Droguerie Tableau périodique de Rayner-Canham (2002), qui met l'accent sur les tendances et les schémas et les relations chimiques inhabituelles et propriétés. Vers la fin de la physique du continuum est Gauche-Step tableau périodique de Janet (1928). Cela a une structure qui montre un lien plus étroit avec l'ordre de remplissage électrons coquille et, par association, la mécanique quantique . Quelque part au milieu du continuum est la forme courante ou norme omniprésente du tableau périodique. Ceci est considéré comme exprimant mieux les tendances empiriques dans l'état physique, la conductivité électrique et thermique, et nombres d'oxydation, et d'autres propriétés facilement inférées à partir de techniques traditionnelles de laboratoire chimique.
| Janet gauche étape tableau périodique | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1s | H | Il | ||||||||||||||||||||||||||||||
| 2s | Li | Être | ||||||||||||||||||||||||||||||
| 2p 3s | B | C | N | O | Fa | Ne | N / A | Mg | ||||||||||||||||||||||||
| 3p 4s | Al | Si | P | S | Cl | Ar | K | Californie | ||||||||||||||||||||||||
| 3d 4p 5s | Caroline du Sud | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Géorgie | Ge | Comme | Se | Br | Kr | Rb | Sr | ||||||||||||||
| 4d 5p 6s | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | CD | En | Sn | Sb | Te | Je | Xe | Cs | Ba | ||||||||||||||
| 4f 5d 6p 7s | La | Ce | Pr | Dakota du Nord | Pm | Sm | Ue | Gd | Tb | Dy | Ho | Er | Tm | YB | Lu | Hf | Ta | W | Ré | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | À | Rn | Fr | Ra |
| 5f 6d 7p 8s | Un C | Th | Pennsylvanie | U | Np | Pu | Suis | Cm | Bk | Cf | Es | Fm | Md | Aucun | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | Uue | UBN |
| f-bloc | D-Block | p-bloc | s-bloc | |||||||||||||||||||||||||||||
| Cette forme de tableau périodique est plus en harmonie avec l'ordre dans lequel les coquilles d'électrons sont remplis, comme indiqué dans la séquence d'accompagnement dans la marge gauche (lire de haut en bas, de gauche à droite). Le placement de l'hélium (un gaz noble) au-dessus du béryllium (un métal alcalino-terreux) attire habituellement de fortes critiques de chimistes. | ||||||||||||||||||||||||||||||||
Questions et controverses ouvertes
Éléments ayant des propriétés chimiques inconnus
Bien que tous les éléments jusqu'à à ununoctium ont été découverts, seuls les éléments jusqu'à hassium (élément 108), avec copernicium (élément 112), ont connu des propriétés chimiques. Les autres éléments peuvent se comporter différemment de ce que devrait être prédite par extrapolation, en raison des effets relativistes; par exemple, flérovium a été prédit pour éventuellement présenter certaines propriétés comme noble gaz, même si elle est actuellement placé dans les groupe de carbone. expériences plus récentes ont suggéré, cependant, que flérovium comporte chimiquement comme le plomb, comme prévu à partir de sa position de la table périodique.
D'autres extensions de table périodiques
Il est difficile de savoir si de nouveaux éléments vont continuer le modèle de la table périodique actuelle comme période de 8, ou exiger d'autres adaptations ou aménagements. Seaborg attend la huitième période, qui comprend-bloc d'un à deux éléments pour les éléments 119 et 120, une nouvelle g -BLOC pour les 18 prochaines éléments, et 30 éléments supplémentaires poursuivies l'f- actuelle, d- et p-blocs. Plus récemment, des physiciens comme Pekka Pyykkö ont théorisé que ces éléments supplémentaires ne suivent pas la règle Madelung, qui prédit comment coquilles électrons sont remplis et affecte l'apparence de la présente table périodique ainsi.
Elément avec le numéro atomique le plus élevé possible
Le nombre d'éléments possibles est pas connue. Une suggestion très tôt réalisé par Elliot Adams en 1911, et sur la base de la disposition des éléments dans chaque tableau périodique rangée horizontale, était que des éléments de poids atomique supérieur à 256 ± (ce qui équivaudrait à entre 99 et 100 éléments en termes modernes ) n'a pas existé. A-plus élevé récente estimation est que le tableau périodique peut se terminer peu après l' îlot de stabilité, qui devrait tourner autour élément 126, comme l'extension des tableaux périodiques et nucléides est limité par protons et de neutrons lignes d'égouttement. Autres prédictions de la fin de la table périodique comprennent au élément 128 par John Emsley, à l'élément 137 par Richard Feynman et à l'élément 155 par Albert Khazan.
- Modèle de Bohr
Le Modèle de Bohr présente des difficultés pour les atomes de numéro atomique supérieur à 137, comme tout élément ayant un nombre atomique supérieur à 137 exigerait électrons 1s de voyager plus vite que c , la vitesse de la lumière . Ainsi le modèle Bohr non relativiste est inexact lorsqu'il est appliqué à un tel élément.
- Équation de Dirac relativiste
Le relativiste équation de Dirac a des problèmes pour les éléments avec plus de 137 protons. Pour ces éléments, la fonction d'onde de l'état fondamental de Dirac est oscillant plutôt que lié, et il n'y a pas d'écart entre les spectres d'énergie positive et négative, comme dans le paradoxe Klein. Des calculs plus précis en prenant en compte les effets de la taille finie du noyau indiquent que l'énergie de liaison supérieure à la première limite pour les éléments de plus de 173 protons. Pour les éléments les plus lourds, les plus à l'intérieur si orbitaux (1s) ne sont pas remplies, le champ électrique du noyau va tirer un électron à partir du vide, ce qui entraîne l' émission spontanée d'un positron; Toutefois, cela ne se produit pas si le plus à l'intérieur est rempli orbital, de sorte que l'élément 173 ne sont pas nécessairement à la fin de la table périodique.
Placement d'hydrogène et d'hélium
L'hydrogène et l'hélium sont souvent placés dans des endroits différents que leurs configurations électroniques indiqueraient; un atome d'hydrogène est généralement placé au-dessus de lithium, conformément à sa configuration d'électrons, mais il est parfois placé au-dessus de fluor , ou encore du carbone, il se comporte comme également quelque peu similaire à eux. L'hydrogène est également parfois placé dans son propre groupe, car il ne se comporte pas suffisamment similaire à un élément à être placé dans un groupe à un autre. L'hélium est presque toujours placé au-dessus du néon , car ils sont très semblables chimiquement, même si elle est parfois placé au-dessus de béryllium en raison d'avoir une configuration de couche électronique comparable (hélium: 1s 2 ; béryllium: [Il] 2s 2 ).
Groupes inclus dans les métaux de transition
La définition d'un métal de transition , comme indiqué par l'IUPAC, est un élément dont l'atome a une sous-couche d incomplète, ou qui peuvent donner lieu à des cations avec un sous-shell d incomplètes. Par cette définition, tous les éléments des groupes 3 à 11 sont des métaux de transition. La définition exclut par conséquent groupe IUPAC 12, comprenant du zinc, du cadmium et du mercure, à partir de la catégorie des métaux de transition.
Récupéré à partir de " http://en.wikipedia.org/w/index.php?title=Periodic_table&oldid=545187902 "

