Ununoctium
Renseignements généraux
SOS Enfants, qui se déroule près de 200 sos écoles dans le monde en développement, a organisé cette sélection. Cliquez ici pour en savoir plus sur le parrainage d'enfants.
| Ununoctium | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
118 Uuo | ||||||||||||||||
| ||||||||||||||||
| Apparence | ||||||||||||||||
| inconnu | ||||||||||||||||
| Propriétés générales | ||||||||||||||||
| Nom, symbole, nombre | ununoctium, Uuo, 118 | |||||||||||||||
| Prononciation | / U n . U n ɒ k t Je ə m / oon-oon- OK -tee-əm | |||||||||||||||
| Catégorie Metallic | inconnu | |||||||||||||||
| Groupe, période, bloc | 18 (gaz rares) , 7, p | |||||||||||||||
| Poids atomique standard | [294] | |||||||||||||||
| Configuration électronique | [ Rn ] 5f 14 6d 10 7s 2 7p 6 (Prévue) 2, 8, 18, 32, 32, 18, 8 (prévue)  | |||||||||||||||
| Histoire | ||||||||||||||||
| Découverte | Institut unifié de recherches et nucléaire Lawrence Livermore National Laboratory (2002) | |||||||||||||||
| Propriétés physiques | ||||||||||||||||
| Phase | solide (prévue) | |||||||||||||||
| Densité (à proximité rt) | (Prévue), 13,65 g · cm -3 | |||||||||||||||
| Point d'ébullition | (Extrapolée) 350 ± 30 K, 80 ± 30 ° C, de 170 ± 50 ° F | |||||||||||||||
| Point critique | (Extrapolé) 439 K, 6,8 MPa | |||||||||||||||
| La chaleur de fusion | (Extrapolé) 23,5 kJ · mol -1 | |||||||||||||||
| Chaleur de vaporisation | (Extrapolé) 19,4 kJ · mol -1 | |||||||||||||||
| Propriétés atomiques | ||||||||||||||||
| États d'oxydation | (Prévue), -1, 0, 1, 2, 4, 6 | |||||||||||||||
| énergies d'ionisation | 1er: (extrapolée) 839,4 kJ · mol -1 | |||||||||||||||
| 2ème: (extrapolée) 1450 kJ · mol -1 | ||||||||||||||||
| Rayon atomique | (Prévue) 152 h | |||||||||||||||
| Rayon covalente | (Prévue) 157 h | |||||||||||||||
| Miscellanées | ||||||||||||||||
| Numéro de registre CAS | 54144-19-3 | |||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||
| Article détaillé: Isotopes de ununoctium | ||||||||||||||||
| ||||||||||||||||
Ununoctium temporaire est le UICPA nommer pour la Transactinide ayant le numéro atomique 118 et temporaire élément symbole Uuo. Il est également connu que eka radon-118 ou de l'élément, et sur la tableau périodique des éléments il se agit d'un Elément p-bloc et le dernier de la 7e période. Ununoctium est actuellement le seul membre synthétique du Groupe 18 . Il a le numéro atomique plus élevé et le plus haut masse atomique de tous les éléments découvert jusqu'à présent.
Le radioactifs atome d'ununoctium est très instable, et, depuis 2002, seulement trois ou peut-être quatre atomes de l'isotope 294 Uuo ont été détectés. Bien que ce permis pour très peu caractérisation expérimentale de ses propriétés et possibles des composés , des calculs théoriques ont abouti à de nombreuses prédictions, dont certains inattendus. Par exemple, bien que ununoctium est un membre du groupe de 18, il peut éventuellement ne pas être un gaz noble , contrairement à tous les autres éléments du Groupe 18. Il était autrefois considéré comme un gaz, mais est maintenant prévu pour être un solide sous des conditions normales en raison de effets relativistes.
Histoire
Les tentatives de synthèse non retenus
À la fin de 1998, le physicien polonais Robert Smolańczuk publié calculs sur la fusion des noyaux d'atomes vers la synthèse de atomes super-lourds, y compris ununoctium. Ses calculs ont suggéré qu'il pourrait être possible de faire ununoctium par fusion de plomb avec le krypton dans des conditions soigneusement contrôlées.
En 1999, des chercheurs de Lawrence Berkeley National Laboratory a fait usage de ces prévisions et a annoncé la découverte de Livermorium et ununoctium, dans un article publié dans Physical Review Letters, et très peu de temps après les résultats ont été rapportés dans Science. Les chercheurs ont rapporté avoir effectué la réaction
- 86
36 Kr + 208
82 Pb → 293
118 Uuo + n .
L'année suivante, ils ont publié une rétractation après des chercheurs d'autres laboratoires ont été incapables de reproduire les résultats et le laboratoire de Berkeley se était incapable de les reproduire ainsi. En Juin 2002, le directeur du laboratoire a annoncé que la demande initiale de la découverte de ces deux éléments a été basée sur des données fabriquées par auteur principal Victor Ninov.
rapports de découverte
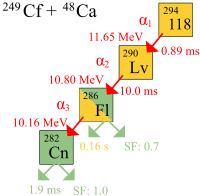
La première désintégration d'atomes de ununoctium a été observée à la Institut unifié de recherches nucléaires (JINR) par Yuri Oganessian et son groupe Dubna, en Russie, en 2002. Le 9 Octobre 2006, des chercheurs du JINR et Lawrence Livermore National Laboratory de Californie, États-Unis, travaillant à l'IURN dans Dubna, ont annoncé qu'ils avaient détecté indirectement un total de trois (voire quatre) noyaux de ununoctium-294 (un ou deux en 2002 et deux autres en 2005) produit par collisions de californium -249 atomes et 48 ions calcium:
- 249
98 Cf + 48
20 Ca → 294
118 Uuo + 3 n .
En 2011, UICPA a évalué les résultats de la collaboration Dubna-Livermore 2006 et a conclu: "Les trois événements rapportés pour les Z = 118 isotopes ont une très bonne redondance interne mais sans ancrage à noyaux connus ne satisfont pas aux critères de la découverte".
En raison de la très faible probabilité de réaction de fusion (la fusion section est de 0,3 à 0,6 ~ pb = (3-6) × 10 -41 m 2) l'expérience a pris quatre mois et a impliqué une dose de faisceau de 4 × 10 19 calcium ions qui devait être tiré au californium cible pour produire le premier événement enregistré croit être le synthèse de ununoctium. Néanmoins, les chercheurs sont très confiants que les résultats ne sont pas une faux positif, puisque la chance que les détections étaient des événements aléatoires a été estimée à moins d'une partie de 100 000.
Dans les expériences, la désintégration alpha de trois atomes d'ununoctium a été observée. Un quatrième se désintègrent en directe fission spontanée a également été proposé. Une demi-vie de 0,89 ms a été calculé: 294 se désintègre en Uuo 290 Lv par désintégration alpha. Comme il n'y avait que trois noyaux, la demi-vie provenant de vies observées dispose d'une grande incertitude: 0,89 1,07
-0,31 Ms.
- 294
118 290 Uuo →
116 Lv + 4
2 Il
L'identification des 294 noyaux UUO a été vérifiée par la création séparément putatif Lv fille noyau 290 directement au moyen d'un bombardement de 245 cm avec 48 ions Ca,
- 245
96 cm + 48
20 Ca → 290
116 Lv + 3 n ,
et de vérifier que le 290 Lv correspondait à la décroissance chaîne des 294 noyaux UUO de décroissance. Le noyau de fille 290 Lv est très instable, avec une durée de vie en décomposition de 14 millisecondes en 286 Fl, qui peuvent rencontrer l'un fission spontanée ou de la désintégration alpha en 282 Cn, qui subira la fission spontanée.
Dans un modèle quantique tunnel, la demi-vie de la désintégration alpha 294 Uuo a été prévu pour être 0,66 0,23
-0,18 Ms avec le Q-valeur expérimentale publiée en 2004. Calcul avec Q-valeurs théoriques du modèle macroscopique-microscopique de Muntian-Hofman-Patyk-Sobiczewski donne des résultats quelque peu faibles mais comparables.
Après le succès à obtenir ununoctium, les découvreurs ont commencé des expériences similaires dans l'espoir de créer Unbinilium (élément 120) à partir de 58 Fe et 244 Pu. Isotopes de Unbinilium sont supposé avoir désintégration alpha demi-vies de l'ordre de microsecondes.
Appellation
Jusqu'aux années 1960 ununoctium était connu comme eka-émanation (émanation est l'ancien nom de radon ). En 1979, le UICPA a publié des recommandations selon lesquelles l'élément devait être appelé ununoctium, un nom de l'élément systématique, comme un espace réservé jusqu'à la découverte de l'élément est confirmée et la IUPAC décide d'un nom.
Avant le retrait en 2002, les chercheurs de Berkeley avaient l'intention de nommer le ghiorsium élément (Gh), après Albert Ghiorso (un membre éminent de l'équipe de recherche).
Les découvreurs russes ont rapporté leur synthèse en 2006. En 2007, le chef de l'institut de Russie a déclaré l'équipe envisageait deux noms pour le nouvel élément: flyorium (AF), en l'honneur de Gueorgui Fliorov, le fondateur du laboratoire de recherche de Dubna; et moskovium (Mk), en reconnaissance de la Oblast de Moscou où se trouve Dubna. Il a également déclaré que, bien que l'élément a été découvert comme une collaboration américaine, qui a fourni la cible de californium, l'élément doit à juste titre être nommé en l'honneur de la Russie depuis le Laboratoire Flerov des réactions nucléaires dans IURN était le seul établissement dans le monde qui pourrait atteindre cet résultat. Ces noms ont ensuite été proposés pour l'élément 114 (Flérovium) et l'élément 116 (moscovium). Cependant, le nom final proposé pour l'élément 116 a été la place Livermorium.
Aucun nom n'a encore été officiellement proposé pour l'élément. Selon les lignes directrices actuelles de l'UICPA, le nom ultime pour tous les nouveaux éléments devrait se terminer par "-ium", ce qui signifie le nom de ununoctium peut se terminer par "-ium", pas "-on", même si ununoctium se avère être un gaz noble , qui ont traditionnellement noms se terminant par "-on" (à l'exception de l'hélium , qui ne était pas connu pour être un gaz noble quand il a été découvert).
Caractéristiques
La stabilité et le noyau isotopes
La stabilité des noyaux diminue fortement avec l'augmentation du nombre atomique après plutonium , le plus lourd élément primordial, de sorte que tous les isotopes de numéro atomique ci-dessus 101 désintégrer radioactivement avec une demi-vie sous un jour, à l'exception des dubnium -268. Aucune éléments ayant les numéros atomiques 82 ci-dessus (après le plomb ) ont des isotopes stables. Néanmoins, en raison de raisons de ne pas encore très bien compris, il ya une légère augmentation de la stabilité nucléaire autour numéros atomiques 110 - 114 , ce qui conduit à l'apparition de ce qui est connu en physique nucléaire comme " îlot de stabilité ". Ce concept, proposé par Université de Californie professeur Glenn Seaborg, explique pourquoi éléments super-lourds durent plus longtemps que prévu. Ununoctium est radioactifs et a une demi-vie qui semble être inférieure à un milliseconde. Néanmoins, ce est toujours plus longue que quelques valeurs prédites, donnant ainsi un soutien supplémentaire à l'idée de cette "îlot de stabilité".
Calculs utilisant un modèle quantique tunnel prédisent l'existence de plusieurs isotopes riches en neutrons de ununoctium avec des alpha-désintégration des demi-vies de près de 1 ms.
Des calculs théoriques effectués sur les voies de synthèse pour, et la demi-vie de l'autre, isotopes ont montré que certains pourraient être un peu plus stable que l'isotope 294 synthétisé Uuo, probablement 293 Uuo, 295 Uuo, 296 Uuo, 297 Uuo, 298 Uuo, 300 et 302 Uuo Uuo. Parmi ceux-ci, 297 Uuo pourrait fournir les meilleures chances d'obtenir des noyaux de plus longue durée, et donc pourrait devenir l'objet de travaux futurs avec cet élément. Certains isotopes avec beaucoup plus de neutrons, comme certains sont situés autour de 313 Uuo pourraient également fournir des noyaux de plus longue durée.
Propriétés atomiques et physiques calculées
Ununoctium est un membre du groupe 18, les zéro- valence éléments. Les membres de ce groupe sont généralement inerte à des réactions chimiques les plus courants (par exemple, parce que la combustion) extérieure valence coquille est complètement rempli huit électrons. Ceci produit une configuration stable, minimum d'énergie dans laquelle les électrons externes sont étroitement liés. On pense que, de même, a une ununoctium couche de valence extérieure fermée dans laquelle son les électrons de valence sont disposées dans un 7s 7p 2 6 configuration.
Par conséquent, certains se attendre ununoctium pour avoir des propriétés physiques et chimiques semblables à d'autres membres de son groupe, la plus proche de gaz noble dessus dans le tableau périodique, le radon . Suivant le tendance périodique, ununoctium serait devrait être légèrement plus réactif que le radon. Cependant, des calculs théoriques ont montré qu'il pouvait être très réactif, de sorte qu'il ne peut probablement pas être considéré comme un gaz noble. En plus d'être beaucoup plus réactif que le radon, ununoctium peut être encore plus réactif que les éléments Flérovium et copernicium . La raison de l'amélioration apparente de l'activité chimique de ununoctium par rapport au radon est une déstabilisation énergique et une expansion radiale de la dernière occupées 7p- sous-shell. Plus précisément, considérable interactions spin-orbite entre les 7p électrons avec les 7s inertes deux électrons, conduisent effectivement à une deuxième clôture de couche de valence au Flérovium , et une diminution significative dans la stabilisation de la coque fermée de l'élément 118. Il a également été calculé que ununoctium, contrairement à d'autres gaz nobles, se lie avec un électron libération d'énergie ou en d'autres termes, il présente positif affinité électronique.
Ununoctium devrait avoir, de loin, la plus large polarisabilité de tous les éléments dont il est saisi dans le tableau périodique, et presque double du radon. En extrapolant à partir des autres gaz nobles, il est prévu que ununoctium a un point d'ébullition compris entre 320 et 380 K. Ce est très différentes des valeurs estimées précédemment de 263 K ou 247 K. Même étant donné les grandes incertitudes des calculs, il semble hautement improbable que ununoctium serait un gaz sous des conditions standard, et que la gamme liquide des autres gaz est très étroit, entre 2 et 9 kelvins, cet élément doit être solide dans des conditions standard. Si ununoctium forme un gaz sous des conditions standards néanmoins, il serait l'une des substances les plus denses gazeux dans les conditions normales (même si elle est monoatomique comme les autres gaz nobles).
En raison de sa grande polarisabilité, ununoctium devrait avoir un anormalement bas énergie d'ionisation (similaire à celle de plomb qui est de 70% de celle du radon et significativement plus petite que celle de Flérovium) et un état standard phase condensée .
Composés prédits
Pas composés de ununoctium n'a encore été synthétisé, mais des calculs sur composés théoriques ont été effectués depuis 1964. Il est prévu que si le énergie d'ionisation de l'élément est suffisamment élevé, il sera difficile de oxyder et par conséquent, la plus courante état d'oxydation va de 0 (comme pour les autres gaz rares).
Calculs sur la dimère molécule Uuo 2 a montré une liaison interaction peu près équivalente à celle calculée pour Hg 2, et un énergie de dissociation de 6 kJ / mol, environ quatre fois supérieure à celle de R 2. Mais le plus frappant, il a été calculé d'avoir un longueur plus courte que dans R 2 de 0,16 Å, ce qui serait indicatif d'une interaction de liaison significative liaison. D'autre part, le composé UuoH + présente une énergie de dissociation (en d'autres termes proton affinité de Uuo) qui est plus petite que celle de RNH +.
La liaison entre ununoctium et hydrogène dans UuoH est prévu pour être très mou et peut être considérée comme un pur interaction de van der Waals plutôt qu'un véritable liaison chimique . D'autre part, avec des éléments fortement électronégatifs, ununoctium semble pour former des composés plus stables que par exemple copernicium ou Flérovium . Les états d'oxydation stables 2 et 4 ont été prédits à exister dans le fluorures UuoF 2 et 4 UuoF. Ceci est le résultat des mêmes interactions spin-orbite qui ununoctium exceptionnellement réactif. Par exemple, on a montré que la réaction de ununoctium avec F 2 pour former le composé 2 ne UuoF libérer une énergie de 106 kcal / mol, dont environ 46 kcal / mole proviennent de ces interactions. A titre de comparaison, l'interaction spin-orbite de la molécule semblable RNA 2 est d'environ 10 kcal / mol par une énergie de formation de 49 kcal / mol. La même interaction stabilise le tétraédrique configuration T d pour UuoF 4, à la différence de la carré plane D 4h un des XeF 4 qui rnf 4 est également prévu d'avoir. Le lien Uuo-F sera probablement ionique plutôt que covalente, ce qui rend la UuoF n composés non volatils. UuoF 2 est prévu pour être partiellement ionique en raison de ununoctium plus haut électropositivité. Contrairement aux autres gaz nobles, ununoctium a été prévu pour être suffisamment électropositif pour former une liaison Uuo-Cl avec du chlore .