
Cobalto
Antecedentes
Esta selección Wikipedia está disponible sin conexión de SOS Children para su distribución en el mundo en desarrollo. El apadrinamiento de niños ayuda a los niños uno por uno http://www.sponsor-a-child.org.uk/ .
| Cobalto | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
27 Co | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||
duro metal gris brillante  | |||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | cobalto, Co, 27 | ||||||||||||||||||||||||||||||||||||
| Pronunciación | / k oʊ b ɒ l t / KOH -bolt | ||||||||||||||||||||||||||||||||||||
| Categoría Elemento | metal de transición | ||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 9, 4, d | ||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 58.933195 (5) | ||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Ar ] 4s 2 3d 7 2, 8, 15, 2 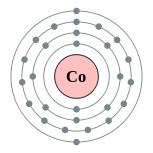 | ||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||
| Descubrimiento | Georg Brandt (1732) | ||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||
| Color | gris metálico | ||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 8,90 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 7,75 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1768 K , 1495 ° C, 2723 ° F | ||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 3200 K, 2927 ° C, 5301 ° F | ||||||||||||||||||||||||||||||||||||
| Calor de fusión | 16.06 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 377 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 24.81 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 5, 4, 3, 2, 1, -1 ( óxido anfótero) | ||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,88 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 760.4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Segundo: 1648 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Tercero: 3232 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Radio atómico | 125 pm | ||||||||||||||||||||||||||||||||||||
| Radio covalente | 126 ± 3 (de bajo espín), 150 ± 7 (alta rotación) pm | ||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal compacta | ||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | ferromagnético | ||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 62,4 nΩ · m | ||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 100 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 13,0 m · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 4720 m · s -1 | ||||||||||||||||||||||||||||||||||||
| El módulo de Young | 209 GPa | ||||||||||||||||||||||||||||||||||||
| Módulo de corte | 75 GPa | ||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 180 GPa | ||||||||||||||||||||||||||||||||||||
| Relación de Poisson | 0.31 | ||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 5.0 | ||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 1043 MPa | ||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 700 MPa | ||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-48-4 | ||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de cobalto | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
El cobalto es un elemento químico con el símbolo Co y número atómico 27. Se encuentra naturalmente sólo en forma combinada químicamente. El elemento libre, producido por la fundición reductora, es una de color gris plateado duro, lustroso metálico .
Pigmentos azules a base de cobalto ( azul cobalto) se han utilizado desde la antigüedad para la joyería y pinturas, y para impartir un tinte azul distintivo al vidrio, pero el color se pensó más tarde por los alquimistas que se debe a que el metal conocido bismuto . Los mineros habían utilizado durante mucho tiempo el nombre kobold mineral (alemán para el mineral de duende) por parte de la producción de minerales azul de pigmento; fueron nombrados porque eran pobres en metales conocidos y dieron venenoso arsénico -Con humos sobre la fundición. En 1735, se encontró que dichos minerales ser reducibles a un nuevo metal (el primero descubierto desde la antigüedad), y esto fue nombrado en última instancia para el kobold.
Hoy en día, algunos de cobalto se produce específicamente de diversos minerales metálicos lustered, por ejemplo cobaltite (CoAsS), pero la principal fuente del elemento es como un subproducto de cobre y níquel minería. El cinturón de cobre en la República Democrática del Congo y Zambia rinde mayor parte del metal cobalto extraído todo el mundo.
Cobalto se utiliza en la preparación de magnética , resistente al desgaste y alta resistencia aleaciones. Silicato de cobalto y cobalto (II) aluminato (carbón 2 O 4, azul cobalto) dan un color azul profundo distintivo al vidrio , esmalte, cerámica, tintas, pinturas y barnices. Cobalt ocurre naturalmente, ya que sólo un isótopo estable, cobalto-59. Cobalto-60 es un radioisótopo comercialmente importante, que se utiliza como una trazador radiactivo y en la producción de rayos gamma.
El cobalto es el centro activo de coenzimas llamados cobalaminas, el ejemplo más común de las cuales es la vitamina B 12 . Como tal, es una traza esencial mineral dietético para todos los animales. Cobalt en forma inorgánica también es un nutriente activo para las bacterias, algas y hongos .
Características

El cobalto es un metal ferromagnético con una gravedad específica de 8,9. Cobalto puro no se encuentra en la naturaleza, pero los compuestos de cobalto son comunes. Pequeñas cantidades de que se encuentran en la mayoría de las rocas, el suelo, las plantas y los animales. La Temperatura de Curie es de 1115 ° C y el momento magnético es 1.6 a 1.7 Bohr magnetones por átomo . En la naturaleza, que se asocia frecuentemente con níquel, y ambos son componentes menores característicos de hierro meteórico. El cobalto tiene una permeabilidad relativa de dos tercios que de hierro . metálico de cobalto se produce como dos estructuras cristalográficas: hcp y fcc. La temperatura de transición ideal entre la hcp y las estructuras de la FCC es de 450 ° C, pero en la práctica, la diferencia de energía es tan pequeña que intercrecimiento aleatoria de los dos es común.
El cobalto es un metal ligeramente reductor que está protegida de la oxidación por un película de óxido de pasivación. Es atacado por los halógenos y azufre. Calefacción en oxígeno produce Co 3 O 4 que pierde oxígeno a 900 ° C para dar el monóxido de CoO. El metal reacciona con F 2 a 520 K para dar Cancha de tiro 3, con Cl 2, Br 2 y 2, se formaron los correspondientes haluros binarios. No tiene ninguna reacción con H 2 y N 2 , incluso cuando se calienta, pero no reacciona con boro , carbono , fósforo , arsénico y azufre . A temperaturas ordinarias, reacciona lentamente con ácidos minerales, y muy lentamente con húmedo, pero no seco, aire.
Compuestos
Comunes estados de oxidación de cobalto incluyen 2 y 3, aunque también se conocen compuestos con estados de oxidación que van -3-4. Un estado de oxidación común para los compuestos simples es 2. Cobalt (II) las sales forman el rojo-rosa [Co (H 2 O) 6] 2+ complejo en solución acuosa. La adición de cloruro da intensamente azul [CoCl
4] 2-
.
Compuestos oxigenados y calcógenos
Varios Se conocen óxidos de cobalto. Verde cobalto (II) óxido (CoO) tiene estructura rocksalt. Se oxida fácilmente con el agua y el oxígeno a marrón de cobalto (III) de hidróxido de (Co (OH) 3). A temperaturas de 600-700 ° C, CoO oxida al azul cobalto (II, III) óxido (Co 3 O 4), que tiene una estructura de espinela. Negro cobalto (III) óxido (Co 2 O 3) también se conoce. Óxidos de cobalto son antiferromagnético a baja temperatura : CoO ( Neel temperatura 291 K) y Co 3 O 4 (temperatura de Neel: 40 K), que es análoga a magnetita (Fe 3 O 4), con una mezcla de 2 y 3 estados de oxidación.
El director calcogenuros de cobalto incluyen el negro cobalto (II) sulfuros, CoS 2, que adopta una pirita estructura -como, y Co 2 S 3. Pentlandita (Co 9 S 8) es rica en metales.
Haluros

Cuatro dihalogenuros de cobalto (II) son conocidos: cobalto (II) de fluoruro (COF 2, rosa), (II) de cloruro de cobalto (CoCl 2, azul), cobalto (II) bromuro de (COBr 2, verde), cobalto (II) yoduro (COI 2, azul-negro). Estos haluros existen en formas anhidras e hidratadas. Considerando que el dicloruro anhidro es azul, el hidrato es de color rojo.
El potencial de reducción para la reacción de
- Co 3+
+ E - → Co 2+
es 1,92 V, más allá de que para el cloro a cloruro, 1,36 V. Como consecuencia de cobalto (III) y cloruro daría lugar a la de cobalto (III) se reduce a cobalto (II). Debido a que el potencial de reducción para el flúor al fluoruro es tan alto, 2.87 V, cobalto (III) El flúor es uno de los pocos compuestos simples de cobalto estable (III). Cobalto (III) de fluoruro, que se utiliza en algunas reacciones de fluoración, reacciona vigorosamente con agua.
Compuestos de coordinación
Como para todos los metales, compuestos moleculares de cobalto se clasifican como complejos de coordinación, es decir moléculas o iones que contienen cobalto vinculado a varios ligandos. Los principios de electronegatividad y dureza suavidad de una serie de ligandos se puede utilizar para explicar el estado de oxidación habitual del cobalto. Por ejemplo Co 3 complejos tienden a tener ligandos de amina. Como el fósforo es más suave que el nitrógeno, ligandos fosfina tienden a aparecer con el más suave Co 2 + y + Co, siendo un ejemplo tris (trifenilfosfina) cobalto (I) cloruro ((P (C 6 H 5) 3) 3 CoCl). El óxido y fluoruro más electronegativo (y más difícil) pueden estabilizar Co 4+ 5+ y Co derivados, por ejemplo de cesio hexafluorocobaltate (Cs 2 canchas de tiro 6) y percobaltate potasio (K 3 CoO 4).
Alfred Werner, un ganador del premio Nobel pionero en química de coordinación, trabajó con los compuestos de fórmula empírica CoCl 3 (NH 3) 6. Uno de los isómeros determinados era cobalto (III) cloruro de hexamina. Este complejo de coordinación, un "típico" complejo de tipo Werner, consiste en un átomo de cobalto centro coordinado por seis ligandos de amina ortogonales entre sí y tres contraiones de cloruro. Utilizando quelante ligandos etilendiamina en lugar de amoniaco da tris (etilendiamina) de cobalto (III) cloruro de ([Co (en) 3] Cl 3), que fue uno de los primeros complejos de coordinación que se resolvió en isómeros ópticos. El complejo existe como dos formas, ya sea de derecha o zurdos de una "hélice de tres palas". Este complejo fue aislado por primera vez por Werner como cristales en forma de agujas de color amarillo-oro.
Los compuestos organometálicos
Cobaltoceno es un análogo estructural ferroceno, donde cobalto sustituye a hierro. Cobaltoceno es sensible a la oxidación, mucho más que ferroceno. Carbonilo de cobalto (Co 2 (CO 8)) es un catalizador en reacciones de carbonilación. La vitamina B 12 (ver a continuación ) es un compuesto organometálico encuentra en la naturaleza y es la única vitamina que contiene un átomo de metal.
Isótopos
59 Co es la única cobalto estable isótopo y el único isótopo de existir en la naturaleza. 22 radioisótopos se han caracterizado con los más estables el 60 Co con una vida media de 5,2714 años, 57 Co, con una vida media de 271,79 días, 56 Co, con una vida media de 77,27 días, y 58 Co con una vida media de 70,86 días. Todos los restantes isótopos radiactivos tienen vidas medias que son más cortos de 18 horas, y la mayoría de estos son menos de 1 segundo. Este elemento también tiene 4 estados de la meta, todos los cuales tienen una vida media de menos de 15 minutos.
Los isótopos de cobalto en rango peso atómico de 50 u (50 Co) a 73 u (73 Co). El primario modo de desintegración de isótopos con unidad de masa atómica valores inferiores a la del isótopo estable más abundante, de 59 Co, es captura de electrones y el modo primario de la descomposición para aquellos de más de 59 unidades de masa atómica es desintegración beta. El primario productos de desintegración antes de 59 Co son elemento 26 ( de hierro ) isótopos y los productos primarios después de son elemento 28 (níquel) isótopos.
Historia

Los compuestos de cobalto se han utilizado durante siglos para impartir un color azul rico para vidrio , esmaltes y cerámica. El cobalto se ha detectado en la escultura egipcia y joyas Pérsico desde el tercer milenio antes de Cristo, en las ruinas de Pompeya (destruido en el año 79), y en China data de la dinastía Tang (618-907) y la dinastía Ming (1368-1644 UNA D).
El cobalto se ha utilizado para colorear el vidrio desde la Edad del Bronce . La excavación de la Uluburun naufragio produjo un lingote de cristal azul, que fue lanzado durante el siglo 14 aC. Artículos de vidrio azul de Egipto se colorean con el cobre, el hierro o cobalto. El vidrio de color más antigua de cobalto-fue desde el momento de la Dinastía XVIII de Egipto (1550-1292 aC). El lugar donde se obtuvieron los compuestos de cobalto es desconocida.
La palabra de cobalto se deriva de la kobalt alemán, desde kobold significado "duende", un término utilizado para el supersticioso mineral de cobalto por los mineros. Los primeros intentos de fundición de estos minerales para producir metales como el cobre o níquel fracasaron, dando simplemente polvo (cobalto (II) óxido) en su lugar. Además, debido a los minerales primarios de cobalto siempre contienen arsénico, fundición del mineral oxida el contenido de arsénico en el altamente tóxico y volátil óxido de arsénico, que también disminuyó la reputación del mineral para los mineros.
Químico sueco Georg Brandt (1694-1768) se le atribuye el descubrimiento de cobalto circa 1735, mostrando que es un nuevo elemento previamente desconocido diferente de bismuto y otros metales tradicionales, y decir que es un nuevo "semi-metal." Él fue capaz de demostrar que los compuestos de metal cobalto eran la fuente del color azul en el vidrio, que previamente había sido atribuido al bismuto encontrado con cobalto. El cobalto se convirtió en el primer metal para ser descubierto desde el período pre-histórico, durante el cual todos los metales conocidos (hierro, cobre, plata, oro, zinc, mercurio, estaño, plomo y bismuto) no tenían descubridores grabados.
Durante el siglo 19, una parte significativa de la producción mundial de azul cobalto (un tinte hecho con compuestos de cobalto y alúmina) y smalt ( vidrio de cobalto en polvo para su uso con fines de pigmento en cerámica y pintura) se llevó a cabo en el Norwegian Blaafarveværket. Las primeras minas para la producción de esmalte en el 16 al siglo 18 se encuentran en Noruega, Suecia , Sajonia y Hungría. Con el descubrimiento del mineral de cobalto en Nueva Caledonia en 1864 la extracción de cobalto en Europa disminuyó. Con el descubrimiento de yacimientos de mineral en Ontario, Canadá en 1904 y el descubrimiento de yacimientos aún mayores en el La provincia de Katanga en el Congo en 1914 las operaciones mineras cambió de nuevo. Con el Conflicto Shaba a partir de 1978, la principal fuente de cobalto, las minas de cobre de la provincia de Katanga, casi se detuvo su producción. El impacto en la economía de cobalto mundo de este conflicto fue sin embargo menor de lo esperado. Cobalt siendo una rara y el pigmento de ser altamente tóxico, la industria había ya establecido formas eficaces para el reciclaje de materiales de cobalto y en algunos casos fue capaz de cambiar a alternativas libres de cobalto.
En 1938, John y Livingood Glenn T. Seaborg descubrió cobalto-60. Este isótopo se utilizó en famoso Universidad de Columbia, en la década de 1950 para establecer violación de la paridad en radiactivo desintegración beta.
Después de la Segunda Guerra Mundial, los EE.UU. queríamos estar seguros de que nunca fue menos que el mineral necesario para el cobalto como los alemanes y se fue a explorar para una entrega en la frontera de Estados Unidos. Un buen suministro del mineral necesario se encuentra en Idaho cerca Cañón Mirlo en la ladera de una montaña. La firma Calera Mining Company obtuvo la producción comenzó en el sitio.
Aparición
La forma estable de cobalto se crea en supernovas a través de la r-proceso. Comprende 0,0029% de la corteza terrestre y es uno de los primeros metales de transición serie.
Cobalt se produce en los minerales de cobre y níquel y en combinación con azufre y el arsénico en el sulfidic cobaltite (CoAsS), Safflorita (CoAs 2) y Skutterudite (CoAs 3) minerales. El mineral cattierite es similar a la pirita y se produce junto con Vaesita en los depósitos de cobre de la provincia de Katanga. Al entrar en contacto con la atmósfera, meteorización se produce y los minerales de sulfuro se oxida para formar rosa erythrite ("vista de cobalto": Co 3 (ASO 4) 2 · 8H 2 O) y Esferocobaltita (CoCo 3).
El cobalto no se encuentra como metal nativo, pero se obtiene principalmente como una subproducto del níquel y cobre las actividades mineras. Los principales minerales de cobalto son cobaltite, erythrite, glaucodot y Skutterudite.
Producción

En 2005, los depósitos de cobre en la provincia de Katanga (antigua provincia de Shaba) de la República Democrática del Congo fueron el principal productor de cobalto con casi el 40% de la cuota mundial, informa el British Geological Survey. La situación política en el Congo influye en el precio del cobalto significativamente.
La Proyecto Mukondo Montaña, operado por la Centroafricana Minería y Exploration Company en Katanga, pueden ser la reserva más rica de cobalto en el mundo. Se estima que será capaz de producir alrededor de un tercio de la producción mundial total de cobalto en 2008. En julio de 2009 CAMEC anunció un acuerdo a largo plazo bajo el cual CAMEC entregaría la totalidad de su producción anual de cobalto en el concentrado de Mukondo Montaña de Zhejiang Galico Cobalt y Materiales de níquel de China.
Existen varios métodos para la separación de cobalto a partir de cobre y níquel. Ellos dependen de la concentración de cobalto y la composición exacta del mineral utilizado. Una etapa de separación implica flotación de la espuma, en la que los tensioactivos se unen a diferentes componentes de mineral, que conduce a un enriquecimiento de minerales de cobalto. Posterior tostado convierte los minerales a la sulfato de cobalto, mientras que el cobre y el hierro se oxida a óxido. La lixiviación con agua extrae el sulfato junto con el arseniatos. Los residuos se lixivian adicionalmente con ácido sulfúrico dando una solución de sulfato de cobre. El cobalto también puede ser lixiviado de la escoria de la fundición de cobre.
Los productos de los procesos antes mencionados se transforman en el óxido de cobalto (Co 3 O 4). Este óxido se reduce al metal por el reacción aluminotérmica o reducción con carbono en una alto horno.
Aplicaciones
La principal aplicación de cobalto es como el metal en aleaciones.
Aleaciones
Con cobalto superaleaciones consumen la mayor parte del cobalto producido. La estabilidad de la temperatura de estas aleaciones hace adecuados para su uso en álabes de la turbina de gas turbinas y chorro de aeronaves motores, aunque basada en níquel- aleaciones monocristalinas les superan en este aspecto. Aleaciones a base de cobalto son también la corrosión y resistente al desgaste. Esto los hace útiles en el campo de la medicina, donde se utiliza a menudo de cobalto (junto con titanio ) para ortopédica implantes que no se desgastan con el tiempo. El desarrollo de las aleaciones de cobalto resistentes al desgaste se inició en la primera década del siglo 19 con la aleaciones de estelita, que son aleaciones de cobalto-cromo con diferentes tungsteno y el contenido de carbono. La formación de cromo y carburos de tungsteno les hace muy duro y resistente al desgaste. Cobalto cromo especiales molibdeno aleaciones como Vitallium se utilizan para piezas de prótesis, como las prótesis de cadera y rodilla. Aleaciones de cobalto se utilizan también para prótesis dentales, en las que son útiles para evitar las alergias al níquel. Algunos alta velocidad brocas de acero también utilizan el cobalto para aumentar el calor y la resistencia al desgaste. Las aleaciones especiales de aluminio, níquel, cobalto y hierro, conocido como Alnico y de samario y cobalto ( imán de samario-cobalto) se utilizan en imanes permanentes . También se alea con un 95% de platino para los propósitos de la joyería, obteniéndose una aleación que es adecuado para la fundición fina detallada y también es ligeramente magnético.
Baterías
Óxido de cobalto y litio (LiCoO 2) se utiliza ampliamente en litio cátodos de baterías de iones. El material está compuesto de capas de óxido de cobalto en la que el litio es intercalado. Durante la descarga del litio intercalado entre las capas es liberado en forma de ión de litio. Níquel-cadmio (NiCd) y hidruro metálico de níquel (NiMH) baterías también contienen cantidades significativas de cobalto; el cobalto mejora las capacidades de oxidación de níquel en la batería.
Catálisis
Varios compuestos de cobalto se utilizan en las reacciones químicas como catalizadores de oxidación. Acetato de cobalto se utiliza para la conversión de xileno para ácido tereftálico, el precursor del polímero a granel tereftalato de polietileno. Los catalizadores típicos son el cobalto carboxilatos (conocidos como jabones de cobalto). También se utilizan en pinturas, barnices, tintas y como "agentes de secado" a través de la oxidación de aceites secantes. Los mismos carboxilatos se utilizan para mejorar la adherencia del acero al caucho en neumáticos radiales con cinturón de acero.
Catalizadores a base de cobalto también son importantes en las reacciones que implican monóxido de carbono . El reformado con vapor, útil en la producción de hidrógeno, utiliza catalizadores de óxido de cobalto-base. El cobalto es también un catalizador en el Proceso de Fischer-Tropsch, utilizado en la hidrogenación de monóxido de carbono en combustibles líquidos. La hidroformilación de alquenos menudo se basan en octacarbonilo de cobalto como catalizador, aunque estos procesos se han desplazado en parte por catalizadores de iridio y a base de rodio más eficientes, por ejemplo, la Proceso Cativa.
La hidrodesulfuración de petróleo utiliza un catalizador derivado de cobalto y molibdeno. Este proceso ayuda a deshacerse de petróleo de impurezas de azufre que interfieren con la refinación de combustibles líquidos.
Pigmentos y colorantes


Antes del siglo 19, el uso predominante de cobalto era como pigmento. Desde la Edad Media, se ha involucrado en la producción de esmalte, un vidrio de color azul. Esmalte se produce por fusión de una mezcla del mineral tostado smaltite, cuarzo y carbonato de potasio, produciendo un vidrio de silicato de color azul oscuro que se muele después de la producción. Esmalte fue ampliamente utilizado para la coloración de vidrio y como pigmento para pinturas. En 1780, Sven Rinman descubierto verde cobalto y en 1802 Louis Jacques Thénard descubrió azul cobalto. Las dos variedades de azul cobalto, aluminato de cobalto y verde de cobalto (una mezcla de cobalto (II) y óxido óxido de zinc), fueron utilizados como pigmentos para pinturas debido a su estabilidad superior.
Radioisótopos
Cobalto-60 (Co-60 o 60 Co) es útil como fuente de rayos gamma, ya que se puede producir en cantidad predecible y de alta actividad mediante el bombardeo de cobalto con neutrones . Produce dos rayos gamma con energías de 1,17 y 1,33 MeV.
Sus usos incluyen la radioterapia de haz externo, la esterilización de suministros médicos y los desechos médicos, el tratamiento de radiación de alimentos para la esterilización (frío pasteurización), industrial radiografía (por ejemplo soldadura radiografías integridad), medidas de densidad (por ejemplo, mediciones de la densidad de hormigón), y los interruptores de la altura de llenado del tanque. El metal tiene la mala costumbre de producir un polvo fino, causando problemas con protección contra las radiaciones. Cobalt de máquinas de radioterapia ha sido un grave peligro si no se eliminan correctamente, y uno de los peores accidentes de contaminación de radiación en América del Norte se produjo en 1984, después de una unidad de radioterapia desechados que contienen cobalto-60 fue desmontado por error en un depósito de chatarra en Juárez, México.
Cobalto-60 tiene una vida media radiactiva de 5,27 años. Esta disminución de la actividad requiere una sustitución periódica de las fuentes utilizadas en radioterapia y es una de las razones por qué las máquinas de cobalto se han sustituido en gran medida por aceleradores lineales en radioterapia moderna.
Cobalto-57 (Co-57 o 57 Co) es un radioisótopo de cobalto más a menudo utilizado en pruebas médicas, como un marcador radiactivo para la vitamina B 12 absorción, y para el Prueba de Schilling. Se utiliza cobalto-57 como una fuente de Espectroscopia Mössbauer y es una de varias fuentes posibles en Dispositivos de fluorescencia de rayos X.
Diseños de armas nucleares podrían intencionalmente incorporar 59 Co, algunos de los cuales se activaría en un explosión nuclear para producir 60 Co. El 60 Co, dispersa como lluvia radiactiva, crea lo que a veces se llama un bomba de cobalto.
Otros usos
Otros usos de cobalto están en galvanoplastia, debido a su atractiva apariencia, dureza y resistencia a la oxidación, y como capas de base para porcelana esmaltes.
Papel biológico
El cobalto es esencial para todos los animales . Es un componente clave de la cobalamina, también conocida como vitamina B 12, que es el depósito biológica primaria de cobalto como un elemento "ultratrazas". Las bacterias en los intestinos de animales rumiantes convertir sales de cobalto en vitamina B 12, un compuesto que sólo puede ser producida por bacterias o arqueas. La presencia mínima de cobalto en suelos, por tanto, mejora notablemente la salud de los animales de pastoreo, y una absorción de 0,20 mg / kg al día se recomienda para ellos, ya que pueden obtener la vitamina B 12 de ninguna otra manera. En el siglo 20, durante el desarrollo de la agricultura de la Meseta Volcánica de la Isla Norte de Nueva Zelanda, el ganado sufría de lo que se denominó la "enfermedad arbusto". Se descubrió que los suelos volcánicos carecían de sales de cobalto, que era necesario para el ganado. La dolencia se curó mediante la adición de pequeñas cantidades de cobalto a los fertilizantes.
En la década de 1930 "enfermedad costa" de ovejas en el Ninety Mile desierto del Sudeste de Australia del Sur se encontró que era debido a las deficiencias de nutrientes de los elementos traza de cobalto y cobre. La deficiencia de cobalto fue superada por el desarrollo de "balas de cobalto", pellets densas de óxido de cobalto mezclado con barro, que se insertan por vía oral a presentar en el rumen del animal.
Herbívoros no rumiantes producen vitamina B 12 de la bacteria en sus dos puntos que a su vez hace la vitamina de sales de cobalto simples. Sin embargo, la vitamina no puede ser absorbido desde el colon, y por lo tanto no rumiantes deben ingerir heces para obtener el nutriente. Los animales que no cumplan con estos métodos de obtener la vitamina B 12 de sus propias bacterias gastrointestinales o la de otros animales, deben obtener la vitamina pre-hecho en otros productos de origen animal en su dieta, y no pueden beneficiarse de la ingestión de sales de cobalto simples.
Las proteínas de origen cobalamina utilizan corrin para sostener el cobalto. La coenzima B 12 cuenta con un enlace C-Co reactiva, que participa en sus reacciones. En los seres humanos, existe B 12 con dos tipos de alquilo ligando: metilo y adenosil. MeB 12 promueve metilo (-CH 3) el traslado de grupos. La versión adenosil de B 12 cataliza reordenamientos en el que un átomo de hidrógeno se transfiere directamente entre dos átomos adyacentes con el intercambio concomitante del segundo sustituyente, X, que puede ser un átomo de carbono con sustituyentes, un átomo de oxígeno de un alcohol, o una amina. Metilmalonil coenzima A mutasa (MUT) conversos IMM-CoA a Su-CoA, un paso importante en la extracción de energía de las proteínas y las grasas.
Aunque mucho menos común que otras metaloproteínas (por ejemplo, las de zinc y hierro), cobaltoproteins son conocidos aparte de B 12. Estas proteínas incluyen metionina aminopeptidasa 2 una enzima que se produce en los seres humanos y otros mamíferos que no utilizan el anillo de corrina de B 12, pero se une directamente cobalto. Otra enzima de cobalto no es corrina nitrilo hidratasa, una enzima en bacterias que son capaces de metabolizar nitrilos.
Precauciones
El cobalto es un elemento esencial para la vida en pequeñas cantidades. La LD valor 50 para sales de cobalto solubles ha sido estimada entre 150 y 500 kg mg /. Por lo tanto, para una persona 100 kg el LD 50 sería de unos 20 gramos.
Después de níquel y cromo, cobalto es una causa importante de dermatitis de contacto. En 1966, la adición de cobalto compuestos para estabilizar espuma de la cerveza en Canadá llevó a miocardiopatía, que llegó a ser conocida como cardiomiopatía de bebedor de cerveza.

