
Argón
Acerca de este escuelas selección Wikipedia
Esta selección Escuelas fue originalmente elegido por SOS para las escuelas en el mundo en desarrollo que no tienen acceso a Internet. Está disponible como una descarga intranet. Haga clic aquí para obtener información sobre el apadrinamiento de niños.
| Argón | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
18 Ar | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||||||||||||||
gas incoloro que presenta un brillo lila / violeta cuando se coloca en un campo eléctrico de alto voltaje  Las líneas espectrales de argón | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | argón, Ar, 18 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / ɑr ɡ ɒ n / | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría metálico | gases nobles | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 18 (gases nobles) , 3, p | ||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 39.948 (1) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Ne ] 3s 2 3p 6 2, 8, 8 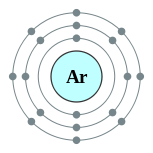 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Lord Rayleigh y William Ramsay (1894) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Lord Rayleigh y William Ramsay (1894) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | gas | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | (0 ° C, 101,325 kPa) 1,784 g / L | ||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidad en pb | 1,40 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 83.80 K , -189.35 ° C, -308.83 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 87.30 K, -185.85 ° C, -302.53 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto Triple | 83,8058 K (-189 ° C), 69 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico | 150,87 K, 4.898 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 1.18 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 6.43 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 5 R / 2 = 20.786 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | sin datos (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 1520,6 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 2665,8 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 3931 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 106 ± 22:00 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radio | 188 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | cara cúbica centrada  | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 17.72x10 -3 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | (Gas, 27 ° C) 323 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-37-1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de argón | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
El argón es un elemento químico con el símbolo Ar y número atómico 18. Es en grupo 18 (gases nobles) de la tabla periódica . El argón es el tercer gas más común en la atmósfera de la Tierra , en un 0,93% (9300 ppm), por lo que es aproximadamente 23,8 veces más abundante como próximos gas atmosférico más común, el dióxido de carbono (390 ppm), y más de 500 veces más abundante que el junto gas más común noble, neón (18 ppm). Casi todo este argón es radiogénico argón-40 derivado de la descomposición de potasio-40 en la corteza terrestre. En el universo, argón-36 es, con mucho, el isótopo más común de argón, siendo el isótopo preferido de argón producido por estelar nucleosíntesis en supernovas .
El nombre "de argón" se deriva del griego palabra αργον significa "perezoso" o "el inactivo", una referencia al hecho de que el elemento se somete casi no las reacciones químicas. La completa octeto (ocho electrones) en la capa atómica externa hace argón estable y resistente a la unión con otros elementos. Su la temperatura del punto triple de 83,8058 K es un punto fijo que define en el Escala Internacional de Temperatura de 1990.
El argón se produce industrialmente por el destilación fraccionada de aire líquido. El argón se utiliza sobre todo como un gas protector inerte en soldadura y otros procesos industriales de alta temperatura donde sustancias que normalmente no reactivos se convierten reactiva; por ejemplo, una atmósfera de argón se utiliza en los hornos eléctricos de grafito para evitar que el grafito de la quema. Gas Argón también tiene usos en iluminación incandescente y fluorescente, y otros tipos de tubos de descarga de gas. Argon hace un distintivo láser de gas de color azul-verde.
Características

El argón tiene aproximadamente la misma solubilidad en agua como el oxígeno, y es 2,5 veces más soluble en agua que el nitrógeno . El argón es incoloro, inodoro, no tóxico y como un sólido, líquido y gas. El argón es químicamente inerte en la mayoría de las condiciones y las formas no hay compuestos estables confirmados a temperatura ambiente.
Aunque el argón es un gas noble , se ha encontrado que tienen la capacidad de formación de algunos compuestos. Por ejemplo, la creación de fluorohydride argón (Harf), un compuesto marginalmente estable de argón con flúor y el hidrógeno , se informó por investigadores de la Universidad de Helsinki en 2000. Aunque los compuestos químicos en estado fundamental neutrales de argón se limita actualmente a Harf, puede formar argón clatratos con agua cuando los átomos de la misma están atrapadas en una red de las moléculas de agua. Que contiene argón- iones y complejos de estado excitado, tales como ArH + y ArF, respectivamente, se sabe que existen. Los cálculos teóricos han predicho varios compuestos de argón que deberían ser estable, pero para los que se conoce en la actualidad no hay rutas de síntesis.
Historia
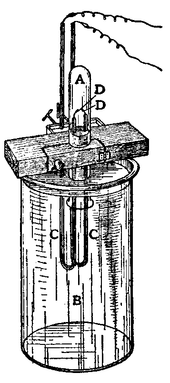
Argon (αργος, griega que significa "inactivo", en referencia a su inactividad química) era sospechoso de estar presente en el aire por Henry Cavendish en 1785, pero no fue aislado hasta 1894 por Lord Rayleigh y Sir William Ramsay en Escocia en un experimento en el que se llevaron todo el oxígeno , el dióxido de carbono , agua y nitrógeno de una muestra de aire limpio. Ellos habían determinado que el nitrógeno producido a partir de compuestos químicos era un medio por ciento más ligero que el nitrógeno de la atmósfera. La diferencia parecía insignificante, pero era lo suficientemente importante como para atraer su atención durante muchos meses. Llegaron a la conclusión de que había otro gas en el aire mezclado con el nitrógeno. Argon también se encontró en 1882 a través de la investigación independiente de HF Newall y WN Hartley. Cada observaron nuevas líneas en el espectro de colores de aire, pero no fueron capaces de identificar el elemento responsable de las líneas. El argón se convirtió en el primer miembro de los gases nobles para ser descubierto. El símbolo para el argón es ahora Ar, pero hasta 1957 era una.
Aparición
Argon constituye 0,934% en volumen y 1,28% en masa de la atmósfera de la Tierra , y el aire es la principal materia prima utilizada por la industria para producir productos de argón purificados. El argón se aisló a partir de aire por fraccionamiento, más comúnmente por criogénico destilación fraccionada, un proceso que también produce purificada de nitrógeno , oxígeno , neón , kriptón y xenón .
Isótopos
Los principales isótopos de argón encontrados en la Tierra son 40 Ar (99,6%), 36 Ar (0,34%), y 38 Ar (0,06%). De origen natural 40 K con una vida media de 1,25 x 10 9 años, decae a 40 Ar estable (11,2%) por captura de electrones o por emisión de positrones, y también para estable 40 Ca (88,8%) a través de desintegración beta. Estas propiedades y relaciones se utilizan para determinar la edad de rocas por el método de K-Ar de citas.
En la atmósfera de la Tierra, 39 Ar es hecha por la actividad de rayos cósmicos, principalmente con el 40 Ar. En el entorno del subsuelo, también se produce a través captura de neutrones por 39 K o emisión alfa de calcio . 37 Ar se crea a partir del neutrón espalación de 40 Ca como resultado de subsuelo explosiones nucleares. Tiene una vida media de 35 días.
El argón es notable, ya que su composición isotópica varía mucho entre los diferentes lugares en el sistema solar . Cuando la fuente principal de argón es la decadencia de 40 K en las rocas, 40 Ar será el isótopo dominante, ya que es en la Tierra. Argon producido directamente por nucleosíntesis estelar, en cambio, está dominada por la nucleido proceso alpha, 36 Ar. Correspondientemente, argón solar contiene 84,6% 36 Ar basa en mediciones de viento solar.
El predominio de radiogenic 40 Ar es responsable del hecho de que la peso atómico estándar de argón terrestre es mayor que el del elemento siguiente, de potasio . Esto fue desconcertante en el momento en que se descubrió el argón, ya Mendeleev había colocado los elementos en su tabla periódica en función de su peso atómico, aunque la inercia de argón implica que debe ser presentado al potasio metal alcalino reactivo. Henry Moseley más tarde resolvió este problema al mostrar que la tabla periódica está realmente dispuesta en orden de número atómico . (Ver Historia de la tabla periódica).
La mucho mayor abundancia en la atmósfera de argón en relación con los otros gases nobles también se debe a la presencia de radiogenic 40 Ar. Primordial 36 Ar tiene una abundancia de sólo 31,5 ppmv (= 9340 ppmv x 0,337%), comparable a la de neón (18,18 ppmv).
La Atmósfera marciana contiene 1,6% de 40 Ar y 5 ppm de 36 Ar. La Sonda espacial Mariner fly-by del planeta Mercurio en 1973 encontró que Mercurio tiene una atmósfera muy delgada con un 70% de argón, que se cree que el resultado de las emisiones de gas como un producto de la desintegración de materiales radiactivos en el planeta. En 2005, la Huygens también descubrió la presencia de 40 Ar en Titán, la luna más grande de Saturno .
Compuestos
Octeto completo de Argón de electrones indica completo s y p subniveles. Este nivel total de energía exterior hace de argón muy estable y extremadamente resistente a la unión con otros elementos. Antes de 1962, el argón y los otros gases nobles se consideraron ser químicamente inerte e incapaz de formar compuestos; Sin embargo, los compuestos de los gases nobles más pesados ya se han sintetizado. En agosto de 2000, el primer compuesto de argón fue formado por investigadores de la Universidad de Helsinki. Haciendo brillar la luz ultravioleta en argón congelado que contiene una pequeña cantidad de fluoruro de hidrógeno con yoduro de cesio, se formó fluorohydride argón (Harf). Es estable hasta 40 grados Kelvin (-233 ° C). La metaestable ArCF 2+
2 indicación, que es la valencia isoelectrónico con fluoruro de carbonilo, se observó en 2010.
Producción
Industrial
El argón se produce industrialmente por el destilación fraccionada de aire líquido en un criogénico unidad de separación de aire; un proceso que separa nitrógeno líquido, que hierve a 77,3 K, a partir de argón, que hierve a 87,3 K, y oxígeno líquido, que hierve a 90,2 K. Acerca 700000 toneladas de argón se producen en todo el mundo cada año.
En desintegraciones radiactivas
40 Ar, el más abundante de isótopos de argón, se produce por la descomposición de 40 K con una vida media de 1,25 x 10 9 años por captura de electrones o emisión de positrones. Debido a esto, se utiliza en potasio-argón citas para determinar la edad de las rocas.
Aplicaciones

Hay varias razones diferentes de argón se utiliza en aplicaciones particulares:
- Una se necesita gas inerte. En particular, el argón es la alternativa más barata cuando el nitrógeno no es suficientemente inerte.
- Bajo se requiere conductividad térmica.
- Las propiedades electrónicas (ionización y / o el espectro de emisión) son necesarios.
Otros gases nobles probablemente funcionan tan bien en la mayoría de estas aplicaciones, pero argón es, con mucho, el más barato. El argón es barato, ya que es un subproducto de la producción de oxígeno líquido y nitrógeno líquido a partir de una criogénico unidad de separación de aire, ambos de los cuales se utilizan en una gran escala industrial. Los otros gases nobles (excepto el helio ) se producen de esta manera también, pero argón es el más abundante, con mucho, ya que tiene una concentración mucho más alta en la atmósfera. La mayor parte de las aplicaciones de argón surgen simplemente porque es inerte y relativamente barato.
Procesos industriales
El argón se utiliza en algunos procesos industriales de alta temperatura, donde sustancias que normalmente no reactivos se convierten reactiva. Por ejemplo, una atmósfera de argón se utiliza en los hornos eléctricos de grafito para evitar que el grafito de la quema.
Para algunos de estos procesos, la presencia de gases de nitrógeno o de oxígeno podría causar defectos en el material. El argón se utiliza en diversos tipos de soldadura por arco tal como la soldadura por arco metálico con gas y Soldadura TIG , así como en el procesamiento de titanio y otros elementos reactivos. Una atmósfera de argón se utiliza también para el crecimiento de cristales de silicio y germanio .
El argón es una asfixiante en la industria avícola, ya sea para el sacrificio masivo tras los brotes de enfermedades, o como un medio de masacre más humano que el baño eléctrico. Relativamente alta densidad de Argón hace que permanezca cerca del suelo durante gaseamiento. Su naturaleza no reactiva hace que sea adecuado en un producto alimenticio, y puesto que reemplaza al oxígeno dentro del ave muerta, argón también mejora la vida útil.
El argón se utiliza a veces para la extinción de incendios en los que es daños en el equipo que debe evitarse.
Investigación científica
El argón se utiliza, principalmente en forma líquida, como el objetivo para directos de materia oscura búsquedas. La interacción de un hipotético Partícula WIMP con el núcleo de argón produce luz de centelleo que es detectada luego por tubos fotomultiplicadores. Detectores de dos fases también utilizan gas argón para detectar los electrones ionizados producidos durante la dispersión WIMP-núcleo. Como con la mayoría de los otros gases nobles licuados, argón tiene un lightyield alta de centelleo (~ 51 fotones / keV), es transparente a su propia luz de centelleo, y es relativamente fácil de purificar. En comparación con xenón , argón es más barato y tiene un perfil de tiempo de centelleo distinto que permite la separación de retrocesos electrónicos de retrocesos nucleares. Por otro lado, su fondo intrínseca de rayos gamma es más grande debido a la contaminación 39 Ar, a menos que uno utiliza fuentes de argón subterráneas con un bajo nivel de radiactividad. Detectores de materia oscura que actualmente operan con argón líquido incluyen urdimbre, ARDM, MicroClean y PAAD-I.
Preservativo

El argón se utiliza para desplazar el aire en oxígeno y que contiene humedad en el material de embalaje para extender las vidas de almacenamiento de los contenidos (argón tiene la Código europeo de aditivos alimentarios de E938). La oxidación aérea, hidrólisis y otras reacciones químicas que degradan los productos son retrasados o impedido por completo. Botellas de sustancias químicas de alta pureza y de determinados productos farmacéuticos están disponibles en botellas selladas o ampollas envasados en atmósfera de argón. En la elaboración del vino, argón se utiliza para barriles top-off para evitar la oxidación aérea de etanol a ácido acético durante el proceso de envejecimiento.
Argon también está disponible en latas de tipo aerosol, que pueden utilizarse para preservar compuestos tales como barniz, poliuretano, pintura, etc. para el almacenamiento después de la apertura.
Desde 2002, la American Almacena los Archivos Nacionales documentos nacionales importantes, como la Declaración de Independencia y la Constitución en casos de argón-llenado para retardar su degradación. Uso de argón reduce la fuga de gas, en comparación con el helio usado en las cinco décadas anteriores.
Equipo de laboratorio
El argón puede utilizarse como la gas inerte dentro de Líneas Schlenk y guanteras. Se prefiere el uso de argón durante nitrógeno comparativamente menos costoso donde el nitrógeno puede reaccionar con los reactivos o aparatos experimentales.
El argón puede ser utilizado como gas portador en cromatografía de gases y en ionización por electrospray espectrometría de masas; que es el gas de elección para el plasma utilizado en ICP espectroscopia . El argón se prefiere para el recubrimiento por pulverización catódica de especímenes para microscopía electrónica de barrido. El gas argón se usa también comúnmente para farfullar la deposición de películas delgadas como en microelectrónica y para oblea de limpieza en la microfabricación.
El uso médico
Procedimientos tales como criocirugía uso crioablación licuado argón para destruir cancerosas las células. En la cirugía se utiliza en un procedimiento llamado "de argón coagulación mejorada", que es una forma de haz de plasma de argón electrocirugía. El procedimiento conlleva un riesgo de producir embolia de gas en el paciente y ha resultado en la muerte de una persona a través de este tipo de accidente. Láseres de argón azules se utilizan en la cirugía para soldar arterias, destruir los tumores, y para corregir defectos en los ojos. También se ha utilizado experimentalmente para reemplazar nitrógeno en la respiración o la descompresión de la mezcla, para acelerar la eliminación de nitrógeno disuelto de la sangre. Ver Argox.
Iluminación

Las luces incandescentes están llenas de argón, para preservar la filamentos a alta temperatura de la oxidación. Se utiliza para el modo específico se ioniza y emite luz, como en globos de plasma y calorimetría en experimental de física de partículas . Lámparas de descarga de gas llenas de argón proporcionan una luz azul. El argón se utiliza también para la creación de azul y verde luz láser.
Seguridad
Aunque argón no es tóxico, es 38% más denso que el aire y por lo tanto se considera un peligroso asfixiante en áreas cerradas. También es difícil de detectar, ya que es incoloro, inodoro e insípido. Un incidente de 1994 en el que un hombre era asfixiado después de entrar en una sección de argón llenado de la tubería de aceite en construcción en Alaska destaca los peligros de fugas del tanque de argón en espacios confinados, y hace hincapié en la necesidad para el buen uso, el almacenamiento y la manipulación.


