
Dysprosium
Saviez-vous ...
Enfants SOS ont produit une sélection d'articles de wikipedia pour les écoles depuis 2005. Les enfants de parrainage aide les enfants du monde en développement à apprendre aussi.
| Dysprosium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
66 Dy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
blanc argenté  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | dysprosium, Dy, 66 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / ré ɪ s p r oʊ z Je ə m / affichage PROH -zee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | lanthanides | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 6, fa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 162,500 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 10 6s 2 2, 8, 18, 28, 8, 2 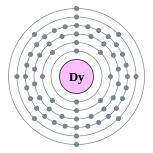 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Lecoq de Boisbaudran (1886) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 8,540 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 8,37 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1680 K , 1407 ° C, 2565 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 2840 K, 2562 ° C, 4653 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 11,06 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 280 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 27,7 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 3, 2, 1 (Faiblement oxyde de base) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,22 (échelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 573,0 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1130 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 2200 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 178 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 192 ± 19 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique à 300 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | ( rt) (α, poly) 926 nΩ · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 10,7 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (α, poly) 9,9 um / (m · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 2,710 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | (Formulaire de α) 61,4 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | (Formulaire de α) 24,7 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | (Formulaire de α) 40,5 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | (Formulaire de α) 0,247 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 540 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 500 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7429-91-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de dysprosium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dysprosium est un élément chimique avec le symbole Dy et de numéro atomique 66. C'est un élément de terre rare avec un éclat d'argent métallique. Dysprosium est jamais trouvé dans la nature comme élément libre, si elle se trouve dans divers minéraux, tels que xénotime. Naturellement dysprosium se produisant est composé de sept isotopes , la plupart abondant qui est de 164 Dy.
Dysprosium a été identifié en 1886 par Paul Émile Lecoq de Boisbaudran, mais n'a pas été isolé sous forme pure jusqu'à ce que le développement de techniques d'échange d'ions dans les années 1950. Dysprosium est utilisé pour l'absorption des neutrons thermiques section transversale élevée dans la fabrication des barres de commande dans réacteurs nucléaires, pour sa haute la susceptibilité magnétique dans les applications de stockage de données, et en tant que composant de Terfenol-D. Les sels solubles de dysprosium sont légèrement toxique, alors que les sels insolubles sont considérés comme non toxiques.
Caractéristiques
Propriétés physiques

Dysprosium est un élément des terres rares qui a un métallique, éclat argent brillant. Il est suffisamment souple pour être coupé avec un couteau, et peut être usiné sans provoquer en cas de surchauffe est évitée. Caractéristiques physiques de dysprosium peuvent être fortement affectées même par de faibles quantités d'impuretés.
Dysprosium et l'holmium ont les forces magnétiques les plus élevés des éléments, en particulier à basses températures. Dysprosium a simple ordre ferromagnétique à des températures inférieures à 85 K (-188,2 ° C). Au-dessus de 85 K (-188,2 ° C), il se transforme en une hélice état antiferromagnétique dans lequel tous les moments atomiques dans un particulier couche de plan de base sont parallèles et orientés selon un angle fixe les moments de couches adjacentes. Ce antiferromagnétisme inhabituelle transforme en désordre ( paramagnétique) état à 179 K (-94 ° C).
Propriétés chimiques
Dysprosium métallique ternit lentement à l'air et brûle facilement pour former dysprosium (III) de l'oxyde:
- Dy 4 + 3 O 2 → 2 Dy 2 O 3
Dysprosium est assez électropositive et réagit lentement avec l'eau froide et assez rapidement avec de l'eau chaude pour former l'hydroxyde de dysprosium:
- Dy 2 (s) + 6 H 2 O (l) → 2 Dy (OH) 3 (aq) + 3 H 2 (g)
Dysprosium métal réagit vigoureusement avec tous les halogènes au-dessus de 200 ° C:
- 2 Dy (s) + 3 F 2 (g) → 2 DyF 3 (s) [vert]
- 2 Dy (s) + 3 Cl 2 (g) → 2 DyCl 3 (s) [blanc]
- 2 Dy (s) + 3 Br 2 (g) → 2 DyBr 3 (s) [blanc]
- 2 Dy (s) + 3 I 2 (g) → 2 Dyl3 (s) [vert]
Dysprosium dilué dissout facilement dans l'acide sulfurique pour former des solutions contenant le jaune Dy (III), des ions qui existent en tant que [Dy 2 (OH) 9] 3+ complexes:
- 2 Dy (s) + 3 H 2 SO 4 (aq) → 2 Dy 3+ (aq) + 3 SO 2-
4 (aq) + 3 H 2 (g)
Composés

halogénures de dysprosium, tels que DyF 3 et DyBr 3, ont tendance à prendre une couleur jaune. l'oxyde de dysprosium, également connu sous le nom d'oxyde de dysprosium, est une poudre blanche qui est hautement magnétique , d'autant plus que l'oxyde de fer.
Dysprosium combine avec divers non-métaux à des températures élevées pour former des composés binaires avec différentes composition et d'oxydation trois Etats et parfois deux, comme DyN, DPJ, DYH 2 et 3 DYH; Dys, Dys 2, Dy 2 S 3 et S Dy 5 7; DYB 2, DYB 4, 6 et DYB DYB 12, ainsi que Dy 3 C et Dy 2 C 3.
le carbonate de dysprosium, Dy 2 (CO 3) 3, et du sulfate de dysprosium, Dy 2 (SO 4) 3, le résultat de réactions similaires. La plupart des composés de dysprosium sont solubles dans l'eau, bien que le carbonate de dysprosium tétrahydraté (Dy 2 (CO 3) 3 · 4H 2 O) et le dysprosium oxalate décahydraté (Dy 2 (C 2 O 4) 3 · 10H 2 O) sont tous deux insolubles dans l'eau.
Isotopes
Naturellement dysprosium se produisant est composé de sept isotopes : 156 Dy, 158 Dy, 160 Dy, 161 Dy, 162 Dy, 163 Dy, 164 et Dy. Ceux-ci sont tous considérés comme stables, bien que 156 Dy désintègre par désintégration alpha avec une demi-vie de plus de 1 × 10 18 ans. Parmi les isotopes naturels, 164 Dy est le plus abondante à 28%, suivie par 162 Dy à 26%. Le moins abondant est 156 Dy à 0,06%.
Vingt-neuf des radio-isotopes ont également été synthétisés, en masse atomique allant de 138 à 173. Le plus stable de ceux-ci est de 154 Dy avec une demi-vie d'environ 3 × 10 6 ans, suivi de 159 Dy, avec une demi-vie de 144,4 jours. L'moins stable est 138 Dy, avec une demi-vie de 200 ms. Les isotopes qui sont plus légers que les isotopes stables ont tendance à se désintégrer essentiellement par β + décroissance, tandis que ceux qui sont plus lourds ont tendance à pourrir par β -. désintégration, à quelques exceptions près 154 Dy se désintègre principalement par désintégration alpha, et 152 et 159 Dy Dy carie principalement par capture d'électrons. Dysprosium comporte également au moins 11 isomères métastables, en masse atomique allant de 140 à 165. Le plus stable de ceux-ci est 165m Dy, qui a une demi-vie de 1,257 minutes. 149 Dy a deux isomères métastables, dont la seconde, 149m2 Dy, a une demi vie de 28 ns.
Histoire
En 1878, l'erbium minerais ont été trouvés pour contenir les oxydes d' holmium et le thulium . Chimiste français Paul Émile Lecoq de Boisbaudran, tout en travaillant avec oxyde d'holmium, séparé de l'oxyde de dysprosium dans Paris en 1886. Sa procédure pour isoler le dysprosium impliqués dissoudre l'oxyde de dysprosium dans de l'acide, puis en ajoutant de l'ammoniac pour précipiter l'hydroxyde. Il n'a pu isoler de son oxyde de dysprosium, après plus de 30 tentatives de sa procédure. Sur réussir, il a nommé l'élément le dysprosium des dysprositos grecs (de δυσπρόσιτος), ce qui signifie «difficiles à obtenir". Cependant, l'élément n'a pas été isolé sous forme relativement pure jusqu'à ce que le développement de techniques d'échange d'ions par Frank Spedding au Iowa State University dans les années 1950.
En 1950, Glenn T. Seaborg, Albert Ghiorso, et Stanley G. Thompson bombardés 241 Am avec des ions d'hélium, qui ont produit des atomes avec un numéro atomique de 97 et qui ressemblaient de près la lanthanides voisin terbium . Parce que le terbium a été nommé d'après Ytterby, la ville dans laquelle elle et plusieurs autres éléments ont été découverts, ce nouvel élément a été nommé berkelium pour la ville dans laquelle il a été synthétisé. Toutefois, lorsque l'équipe de recherche élément 98 synthétisé, ils ne pouvaient pas penser à une bonne analogie pour le dysprosium, et à la place du nom de l'élément californium en l'honneur de l'état dans lequel il a été synthétisé. L'équipe de recherche a continué à "souligner que, en reconnaissance du fait que le dysprosium est nommé sur la base d'un mot grec signifiant« difficile d'obtenir au, que les chercheurs pour un autre élément il ya un siècle ont trouvé difficile de aller en Californie ".
Occurrence

Dysprosium ne se rencontre jamais comme un élément libre, mais on le trouve dans de nombreux minéraux , y compris xénotime, fergusonite, gadolinite, euxénite, polycrase, blomstrandine, monazite et bastnäsite; souvent avec de l'erbium et holmium ou d'autres éléments des terres rares. Actuellement, la plupart de dysprosium est obtenu à partir des ions adsorption minerais argileuses du sud de la Chine, et les sources futures comprendra la région Halls Creek en Australie occidentale. Dans le haut yttrium version de ceux-ci, le dysprosium se trouve être le plus abondant des lourds lanthanides , comprenant jusqu'à 8.7% du concentré (par comparaison à environ 65% pour l'yttrium). La concentration de Dy dans la croûte terrestre est d'environ 5,2 mg / kg et à l'eau de mer de 0,9 ng / l.
Production
Dysprosium est obtenu principalement à partir sable monazite, un mélange de différents phosphates. Le métal est obtenu comme sous-produit de l'extraction commerciale de l'yttrium. En isolant le dysprosium, la plupart des métaux indésirables peuvent être éliminés par un ou magnétiquement procédé de flottation. Dysprosium peut alors être séparé des autres métaux de terres rares par un échange d'ions processus de déplacement. Les ions dysprosium résultants peuvent ensuite réagir avec soit un atome de fluor ou de chlore pour former du fluorure de dysprosium, DyF 3, ou le chlorure de dysprosium, DyCl 3. Ces composés peuvent être réduits en utilisant soit le calcium ou des métaux lithium dans les réactions suivantes:
- 3 Ca + 2 DyF 3 → 2 Dy + 3 CaF 2
- 3 Li + DyCl Dy + 3 → 3 LiCl
Les composants sont placés dans une tantale creuset et cuites dans un hélium atmosphère. Lorsque la réaction progresse, les composés d'halogénure de dysprosium et fondu résultant se séparent en raison de différences de densité. Lorsque le mélange refroidit, le dysprosium peut être coupé à l'écart des impuretés.
Environ 100 tonnes de dysprosium sont produites dans le monde chaque année, avec 99% de ce total produit en Chine. prix de dysprosium ont augmenté de près de vingt fois, de 7 $ la livre en 2003, à 130 $ US la livre à la fin de 2010. Selon le Département de l'Énergie des États-Unis, le large éventail de ses utilisations actuelles et projetées, ainsi que l'absence de tout remplacement immédiatement approprié, rend le dysprosium l'élément le plus critique unique pour les technologies énergétiques propres émergents - même leurs plupart des projections conservatrices prédisent un déficit de dysprosium avant 2015.
Applications
Dysprosium est utilisé, en conjonction avec le vanadium et d'autres éléments, en faisant laser matériaux et l'éclairage commercial. En raison de dysprosium plus haut absorption des neutrons thermiques la section transversale, l'oxyde de dysprosium-nickel cermets sont utilisées dans les barres de commande neutrophages en les réacteurs nucléaires. Dysprosium- cadmium chalcogénures sont des sources de rayonnement infrarouge qui est utile pour étudier des réactions chimiques. Parce que le dysprosium et ses composés sont très sensibles à la magnétisation, ils sont utilisés dans diverses applications de stockage de données, comme dans disques durs.
Néodyme -fer-bore aimants peuvent avoir jusqu'à 6% du néodyme substitué par le dysprosium pour élever le coercivité pour les applications exigeantes telles que les moteurs de propulsion pour véhicules électriques hybrides. Cette substitution exigerait jusqu'à 100 grammes de dysprosium pour voiture hybride produite. Basé sur Projetées 2.000.000 unités de Toyota par an, l'utilisation de dysprosium dans des applications telles que ce seraient rapidement épuiser l'offre disponible du métal. La substitution de dysprosium peut également être utile dans d'autres applications, car il améliore la résistance à la corrosion des aimants.
Dysprosium est l'une des composantes de Terfenol-D, ainsi que du fer et de terbium. Terfenol-D a la température ambiante plus élevée magnétostriction de tout matériau connu; cette propriété est employée dans transducteurs, à large bande résonateurs mécaniques et de haute précision des injecteurs de carburant liquide.
Dysprosium est utilisé dans dosimètres pour mesurer rayonnement ionisant. Cristaux de du sulfate de calcium ou le fluorure de calcium sont dopées avec le dysprosium. Lorsque ces cristaux sont exposés à un rayonnement, les atomes de dysprosium deviennent excité et luminescent. La luminescence peut être mesurée pour déterminer le degré d'exposition à laquelle le dosimètre a été soumis.
Nanofibres de composés de dysprosium ont une grande résistance et une grande surface; par conséquent, ils peuvent être utilisés pour le renforcement d'autres matériaux et en tant que catalyseur. Fibres de fluorure d'oxyde de dysprosium peuvent être produits par chauffage d'une solution aqueuse de NaF et DyBr 3 à 450 ° C à 450 bars de pression pendant 17 heures. Ce matériau est remarquablement robuste, survivant plus de 100 heures dans diverses solutions aqueuses à des températures supérieures à 400 ° C sans re-dissoudre ou l'agrégation.
l'iodure de dysprosium et du bromure de dysprosium sont utilisés dans l'éclairage de haute intensité. Ces composés se dissocient à proximité du centre chaud de la lampe libérant isolés atomes de dysprosium. Ce dernier ré-émettre de la lumière dans la partie verte et rouge du spectre produisant ainsi efficacement la lumière brillante.
Précautions
Comme beaucoup de poudres, la poudre de dysprosium peut présenter un risque d'explosion lorsqu'il est mélangé avec de l'air et quand une source d'inflammation est présente. Feuilles minces de la substance peuvent également se enflammer par des étincelles ou par des électricité statique. feux de dysprosium ne peuvent pas être mis par l'eau. Il peut réagir avec l'eau pour produire inflammables hydrogène gaz. feux de chlorure de dysprosium, cependant, peut être éteint avec de l'eau, tandis que le fluorure de dysprosium et l'oxyde de dysprosium sont ininflammables. le nitrate de dysprosium, Dy (NO 3) 3, est un solide agent oxydant et se enflamme facilement au contact de substances organiques.
Les sels de dysprosium soluble, tel que le chlorure de dysprosium et du nitrate de dysprosium, sont légèrement toxique lorsqu'il est ingéré. Les sels insolubles, cependant, ne sont pas toxiques. Basé sur la toxicité de chlorure de dysprosium de souris , il est estimé que l'ingestion de 500 grammes ou plus pourrait être fatal à un être humain.

