Hassium
Renseignements généraux
Arrangeant une sélection Wikipedia pour les écoles dans le monde en développement sans internet était une initiative de SOS Enfants. Voir http://www.soschildren.org/sponsor-a-child pour connaître le parrainage d'enfants.
| Hassium | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
108 HS | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||
| argenté (prévue) | |||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | hassium, HS, 108 | ||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / h æ s Je ə m / -Əm de HASS | ||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | métal de transition | ||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 8, 7, ré | ||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | [269] | ||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Rn ] 5f 14 6d 6 7s 2 (Prévue) 2, 8, 18, 32, 32, 14, 2 (prévue) 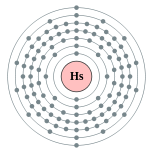 | ||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||
| Découverte | Gesellschaft für Schwerionenforschung (1984) | ||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||
| Phase | solide (prévue) | ||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 41 (prévue) g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 8, 6, 5, 4, 3, 2 (prévue) (États d'oxydation ne en gras sont connus expérimentalement) | ||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 733,3 (estimation) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1756,0 (estimation) kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||
| 3ème: 2827,0 (estimation) kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 126 (estimation) h | ||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 134 (estimation) h | ||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 54037-57-9 | ||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de hassium | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
Hassium est un élément chimique avec le symbole Hs et de numéro atomique 108, nommé en l'honneur de l'Etat allemand de Hesse. C'est un élément synthétique (un élément qui peut être créé dans un laboratoire, mais ne se trouve pas dans la nature) et radioactifs; le connu plus stable isotope , 269 HS, a une demi-vie d'environ 9,7 secondes, même si une non confirmée état métastable, 277m Hs, peut avoir une demi-vie plus longue d'environ 11 minutes. Plus de 100 atomes de hassium ont été synthétisés à ce jour.
Dans le tableau périodique des éléments, ce est un D-Block Transactinide. Ce est un membre de la 7e période et appartient à la groupe 8 éléments. expériences de chimie ont confirmé que hassium se comporte comme le plus lourd homologue à l'osmium dans le groupe 8. Les propriétés chimiques de hassium se caractérisent en partie seulement, mais ils se comparent bien avec la chimie de l'autre groupe 8 éléments. En vrac, hassium devrait être un métal argenté qui réagit facilement avec l'oxygène dans l'air, formant un tétroxyde volatile.
Histoire
Découverte officielle
Hassium était synthétisé pour la première en 1984 par une équipe de recherche allemande dirigée par Peter Armbruster et Gottfried Münzenberg au Institut de Recherche des Ions Lourds (Gesellschaft für Schwerionenforschung) dans Darmstadt. L'équipe bombardé une cible de plomb -208 avec des noyaux accélérés de fer-58 pour produire trois atomes de l' isotope hassium-265 dans la réaction:
- 208
82 Pb + 58
26 Fe → 265
108 Hs + n
Le Groupe de travail Transfermium UICPA / UIPPA (GTT) a reconnu la collaboration GSI comme découvreurs officiels dans leur rapport de 1992.
Appellation
Utilisation La nomenclature de Mendeleïev pour les éléments anonymes et inconnus, hassium devrait être connu comme eka- osmium ou DVI ruthénium . En 1979, lors de la Transfermium Wars (mais avant la synthèse de hassium), UICPA a publié des recommandations selon lesquelles l'élément devait être appelé unniloctium (avec le symbole correspondant de Uno), un Dénomination systématique comme un espace réservé, jusqu'à ce que l'élément a été découvert (et la découverte ensuite confirmé) et un nom permanente a été décidée. Les recommandations ont été la plupart du temps ignorés parmi les scientifiques, qui soit appelé "élément 108", avec le symbole de (108) ou même simplement 108, ou utilisé le nom proposé "hassium".
Le nom hassium été proposé par les découvreurs allemands officiellement reconnus en 1992, dérivé du latin nom (Hassia) pour le Land allemand de Hesse où est situé l'institut.
En 1994, un comité de l'UICPA recommandé cet élément 108 être nommé hahnium (Hn) après le physicien allemand Otto Hahn, en dépit de la convention de longue date pour donner le découvreur le droit de proposer un nom, afin que les éléments nommés d'après Hahn et Lise Meitner ( meitnerium ) serait à côté de l'autre, honorer leur découverte conjointe de la fission nucléaire . Ce était parce qu'ils estimaient que Hesse ne méritait pas un élément étant nommé d'après lui. Après les protestations des découvreurs allemandes et la American Chemical Society, UICPA a cédé et le nom hassium (HS) a été adoptée à l'échelle internationale en 1997.
Occurrence naturelle

Au début des années 1960, il était prévu que longue durée de vie déformée isomères de hassium pourraient se produire naturellement sur Terre des traces. Cela a été théorisé pour expliquer les dommages de rayonnement extrême dans certains minéraux qui ne auraient pas été causés par un connue naturelle radio-isotopes, mais pourrait avoir été causé par des éléments super-lourds. En 1963, Victor Tcherdyntsev affirmé avoir découvert élément 108 en naturelle molybdénite et a suggéré le nom sergenium pour elle, après une région Kazakhstan où ses échantillons provenaient de molybdénite.
En 2006, il a été émis l'hypothèse que d'un isomère de Hs 271 peut avoir une demi-vie d'environ (2,5 ± 0,5) x 10 8 y, ce qui expliquerait l'observation de particules alpha avec des énergies de l'ordre de 4,4 MeV dans certains échantillons de molybdénite et osmiride. Cet isomère de 271 HS pourrait être produite à partir de la désintégration bêta de 271 Bh et 271 Sg , qui, étant homologue à rhénium et de molybdène, respectivement, devrait se produire dans la molybdénite avec rhénium et molybdène se ils ont eu lieu dans la nature. Depuis hassium est homologue à l'osmium, il devrait également se produire avec d'osmium dans osmiride si elle se est produite dans la nature. Cependant, les chaînes de désintégration de ces isotopes sont très hypothétique et la demi-vie prévue de ce hassium isomère hypothétique ne est pas assez long pour ne importe quelle quantité suffisante pour rester sur la Terre. Il est possible que plus de 271 HS peuvent être déposés sur la Terre que le système solaire se déplace dans les bras spiraux de la Voie Lactée , ce qui expliquerait aussi les excès de plutonium-239 disponible sur les étages de l' océan Pacifique et de la Golfe de Finlande, mais enrichis en minéraux 271 HS sont prédit devez aussi avoir excès de l'uranium-235 et entraîner -207, et aurait des proportions différentes d'éléments qui sont formés au cours fission spontanée, tel que le krypton , le zirconium , et le xénon . Ainsi, l'apparition de hassium dans la nature dans des minéraux tels que la molybdénite et osmiride est théoriquement possible, mais hautement improbable.
En 2004, l'Institut unifié de recherches nucléaires a effectué une recherche pour hassium naturel. Cela a été fait sous terre pour éviter les interférences et de faux positifs les rayons cosmiques, mais aucun résultat n'a été publié, ce qui implique fortement qu'aucun hassium naturel a été trouvé. La mesure du possible de hassium primordiale sur Terre est incertain; il pourrait maintenant ne existent que dans les traces, ou aurait même pu complètement pourri maintenant après avoir causé le dommage de rayonnement depuis longtemps.
Isotopes
| Isotope | Demi-vie | Pourriture mode | Découverte année | Réaction |
|---|---|---|---|---|
| 263 HS | 0,74 | α, SF | 2008 | 208 Pb (56 Fe, n) |
| 264 HS | ~ 0,8 ms | α, SF | 1986 | 207 Pb (58 Fe, n) |
| 265 HS | 1,9 ms | α, SF | 1984 | 208 Pb (58 Fe, n) |
| 265m Hs | 0,3 ms | α | 1984 | 208 Pb (58 Fe, n) |
| 266 HS | 2.3 ms | α, SF | 2000 | 270 Ds (-, α) |
| 267 HS | 52 | α, SF | 1995 | 238 U (34 S, 5n) |
| 267m Hs | 0,8 | α | 1995 | 238 U (34 S, 5n) |
| 268 HS | 0,4 | α | 2009 | 238 U (34 S, 4n) |
| 269 HS | 3,6 | α | 1996 | 277 Cn (-, 2α) |
| 269m Hs | 9,7 | α | 2004 | 248 cm (26 mg, 5n) |
| 270 HS | 3,6 | α | 2004 | 248 cm (26 mg, 4n) |
| 271 HS | ~ 4 s | α | 2004 | 248 cm (26 mg, 3n) |
| 272 HS | 40? s | α, SF? | inconnu | - |
| 273 HS | 0,24 | α | 2004 | 285 Fl (-, 3α) |
| 274 HS | 1? min | α, SF? | inconnu | - |
| 275 HS | 0,15 | α | 2003 | 287 Fl (-, 3α) |
| 276 HS | 1? h | α, SF? | inconnu | - |
| 277 HS | 2 | α | 2009 | 289 Fl (-, 3α) |
| 277m HS? | ~ 11 min? | α | 1999 | 289 Fl (-, 3α) |
Hassium n'a pas d'isotopes stables ou naturels. Plusieurs isotopes radioactifs ont été synthétisés dans le laboratoire, soit par fusion de deux atomes ou en observant la décroissance des éléments plus lourds. Douze isotopes différents ont été rapportés avec les masses atomiques 263-277 (à l'exception de 272, 274 et 276), dont quatre, hassium-265, hassium-267, hassium-269, et hassium-277, ont connu états métastables (bien que celle de hassium-277 est non confirmée). La plupart de ces Decay principalement par désintégration alpha, mais certains subissent également fission spontanée.
Les isotopes les plus légers ont généralement plus courtes demi-vies; la demi-vie de moins de 1 ms pour 263 HS, 264 HS et 265m Hs ont été observés. 265 HS et 266 HS sont plus stables autour de 2 ms, 267 HS a une demi-vie d'environ 50 ms, 267m HS, 268 HS , 273 HS et 275 HS vivent entre 0,1 et 1 seconde et 269 HS, 269m HS, 270 HS, 271 HS et 277 HS sont plus stables, à entre 1 et 30 secondes. Les isotopes les plus lourds sont les plus stables, avec 277 M HS ayant une demi-vie mesurée d'environ 11 minutes. L'inconnu isotopes 272 HS, 274 HS et 276 HS sont prédit d'avoir même plus longue demi-vie d'environ 40 secondes, 1 minute et 1 heure respectivement. Avant sa découverte, 271 HS a également prévu d'avoir une longue demi-vie de 40 secondes, mais il se est avéré avoir une demi-vie plus courte de seulement environ 4 secondes.
Les isotopes les plus légers ont été synthétisés par fusion directe entre deux noyaux plus légers et en tant que produits de désintégration. L'isotope le plus lourd produit par fusion directe est de 271 HS; des isotopes plus lourds ne ont été observé que des produits de désintégration des éléments ayant les numéros atomiques plus grands. En 1999, des scientifiques américains de l'Université de Californie, Berkeley, ont annoncé qu'ils avaient réussi à synthétiser trois atomes de 293 118. Ces noyaux mères auraient successivement émis trois particules alpha pour former hassium-273 noyaux, ce qui a été affirmé avoir subi une désintégration alpha, émettant des particules alpha avec des énergies de désintégration de 9,78 et 9,47 MeV et la demi-vie de 1,2 s, mais leur demande a été rétractée en 2001. L'isotope, cependant, a été produit en 2010 par la même équipe. Les nouvelles données correspondaient aux données antérieures (préfabriquées).
270 HS: perspectives pour un noyau doublement magique déformé
Selon les calculs, 108 est un proton nombre magique pour les noyaux déformés (noyaux qui sont loin d'être sphérique ), et 162 est une neutrons nombre magique pour les noyaux déformés. Cela signifie que ces noyaux sont déformés de façon permanente dans leur état fondamental mais ont élevés, les barrières de fission étroites à une déformation supplémentaire et donc relativement longues durées de vie à la fission spontanée. Les fission spontanée des demi-vies dans cette région sont généralement réduits par un facteur de 10 9 par rapport à celles au voisinage de la double noyau sphérique magique 298 Fl , causée par la barrière de fission plus étroit de ces noyaux déformés. Ainsi, le noyau 270 HS est prometteuse comme un noyau doublement magique déformé. Les données expérimentales de la désintégration de la darmstadtium (Z = 110) isotopes 271 et 273 Ds Ds fournit des preuves solides pour la magie de la nature N = 162 sous-shell. La synthèse récente de 269 HS, 270 HS et 271 HS également soutenir pleinement la mission de N = 162 comme un chiffre magique. En particulier, l'énergie de désintégration faible pour 270 HS est en complet accord avec les calculs.
La preuve de l'magicité de la coquille Z = 108 à protons peut être obtenu à partir de deux sources:
- la variation de la partie fission spontanée demi-vie isotones
- l'écart important dans le alpha La valeur Q pour les noyaux isotoniques de hassium et darmstadtium .
Pour la fission spontanée, il est nécessaire de mesurer les demi-vies pour l'isotonique noyaux 268 Sg, 270 HS et 272 Ds. Depuis le isotopes 268 et 272 Sg Ds ne sont pas actuellement connus, et la fission de 270 HS n'a pas été mesurée, cette méthode ne peut être utilisée à ce jour pour confirmer la nature de stabilisation de la Z = 108 coquille. Cependant, une bonne preuve de la magicité du Z = 108 coque peut être considéré comme des grandes différences dans les énergies de désintégration alpha mesurées pour 270 HS, 271 et 273 Ds Ds. Preuves plus concluantes viendrait de la détermination de l'énergie de décroissance pour le noyau inconnue 272 Ds.
Propriétés prédites
Chimique
Hassium est le sixième élément de la série 6d de métaux de transition et devrait être dans la des métaux du groupe du platine. Calculs sur son potentiels d'ionisation, rayon atomique, ainsi que des rayons, les énergies orbitales, et les niveaux de ses états ionisés au sol sont similaires à celle de l'osmium . Par conséquent, il a été conclu que les propriétés de base de hassium se apparentent à ceux de l'autre groupe 8, les éléments ci-dessous fer , le ruthénium et l'osmium. Certains de ses propriétés ont été déterminées par des expériences de chimie en phase gazeuse. Le groupe 8 éléments dépeignent une grande variété d'états d'oxydation, mais les deux derniers membres du groupe décrivent facilement leur état de huit d'oxydation du groupe et cet état devient plus stable que le groupe est descendu. Le ruthénium et l'osmium indiquent les états d'oxydation les plus élevés de tous les éléments dans leur respectif périodes et sont les seuls éléments non-super-lourds pour montrer l'état 8, sauf pour le xénon , l'iridium et le plutonium (instable). Ainsi devrait hassium pour former un 8 état stable. Osmium montre également stables 5, 4, 3 et états à l'état le plus stable 4. Pour le ruthénium, les six, cinq et trois états sont stables à l'état 3 étant le plus stable. On se attend donc à montrer Hassium également d'autres états d'oxydation inférieure stables, tels que 6, 5, 4, 3, 2 et.
Le groupe 8 éléments montrent une très distinctif la chimie de l'oxyde qui permet des extrapolations à faire facilement pour hassium. Tous les membres ont plus légers tétroxydes hypothétiques, MO 4 connu ou. Le pouvoir oxydant diminue à mesure que l'on descend le groupe tels que FeO 4 ne est pas connu en raison d'une extraordinaire affinité électronique qui se traduit par la formation de la bien connue oxoanion ferrate (VI), 2- FeO
4. Le tétroxyde de ruthénium, RuO 4, formé par oxydation du ruthénium (VI) dans l'acide , subit facilement réduction de ruthénate (VI), RuO 2-
4. L'oxydation du ruthénium métallique dans de l'air constitue le gaz, RuO 2. En revanche, l'osmium brûle pour former l'écurie tétroxyde, OsO 4, qui forme un complexe avec l'ion hydroxyde pour former un osmium (VIII) - mange complexe, [OsO 4 (OH) 2] 2-. Par conséquent, les propriétés de EKA-osmium pour hassium devraient être mises en évidence par la formation d'une stable tétroxyde, très volatil HSO 4 (en raison de la nature tétraédrique de la molécule), qui subit une complexation avec de l'hydroxyde pour former un hassate (VIII), [HSO 4 (OH) 2] 2-. La tendance de la volatilité des groupes 8 tétroxydes devrait être RuO 4 <4 OsO ≤ HSO 4, calculées sur la base des enthalpies de adsorption pour les trois composés; cette tendance reste la même ou non les effets relativistes sont pris en compte.
Physique atomique et
Hassium est supposé avoir une masse volumique apparente de 41 g / cm 3, le plus haut de l'un des 118 éléments connus et près de deux fois la densité de l'osmium , l'élément de mesure le plus dense, à 22,61 g / cm 3. Ceci résulte du poids atomique élevé de hassium, le lanthanides et des actinides contractions, et effets relativistes, bien que la production d'une quantité suffisante hassium pour mesurer cette quantité ne serait pas pratique, et l'échantillon serait rapidement se dégrader. Le rayon atomique de hassium devrait se situer autour de 126 h. En raison de la stabilisation relativiste de la déstabilisation orbital et 7s de l'orbitale 6d, l'ion HS + est supposé avoir une configuration électronique de [Rn] 5f 14 6d 5 7s 2, donnant un électron 6d au lieu d'un électron 7s, qui est le contraire du comportement de ses homologues plus légers. D'autre part, l'ion HS est prévu d'avoir une configuration électronique de [Rn] 5f 14 7s 6d 5 1, analogue à celle calculée pour la Os 2+ ions.
Experimental atomique chimie en phase gazeuse
| Formule | Noms |
|---|---|
| HSO 4 | tétroxyde d'hassium; hassium (VIII) oxyde |
| Na 2 [ASS 4 (OH) 2] | hassate de sodium (VIII); dihydroxytetraoxohassate disodique (VIII) |
Malgré le fait que la sélection d'un composé de hassium volatile (hassium de tétroxyde) pour les études chimiques en phase gazeuse était clair dès le début, la caractérisation chimique de hassium a été considérée comme une tâche difficile pour un long moment. Bien que les isotopes de hassium ont d'abord été synthétisés en 1984, ce ne est qu'en 1996 que long vécu assez un isotope de hassium pour permettre des études chimiques à effectuer a été synthétisé. Malheureusement, cet isotope de hassium, 269 HS, a ensuite été synthétisé indirectement de la désintégration du 277 Cn ; non seulement sont des méthodes de synthèse indirects pas favorables pour les études chimiques, mais aussi la réaction qui produit l'isotope 277 CN avait un faible rendement (sa section était seulement 1 pb), et n'a donc pas fournir suffisamment d'atomes de hassium pour une enquête chimique. La synthèse directe de 269 HS 270 HS et la réaction dans 248 cm (26 mg, xn) 274-x Hs (x = 4 ou 5) est apparu plus prometteurs, comme la section transversale de cette réaction était un peu plus grande, à 19 heures . Toutefois, ce rendement était encore autour d'un ordre de grandeur inférieur à celui de la réaction utilisée pour la caractérisation chimique de bohrium . Les nouvelles techniques de l'irradiation, la séparation et la détection ont dû être introduit avant hassium pourrait être caractérisé chimiquement avec succès en tant que membre typique de groupe 8 au début de 2001.
Ruthénium et l'osmium ont la chimie très similaire en raison de la lanthanides contraction, mais le fer montre quelques différences d'eux: par exemple, bien que le ruthénium et l'osmium forment tétroxydes stables dans lequel le métal est à l'état d'oxydation 8, le fer ne est pas. Par conséquent, en vue de la caractérisation chimique de hassium, des recherches axées sur le ruthénium et l'osmium plutôt que le fer, comme on se attendait à hassium être aussi proche de ruthénium et l'osmium en raison de la actinide contraction. Cependant, dans l'expérience prévue pour étudier hassocene (Hs ( C 5 H 5 2)), ferrocene peut également être utilisée pour la comparaison avec ruthénocène et osmocene.
Les premières expériences de chimie ont été effectuées à l'aide de gaz thermochromatography en 2001, en utilisant 172 et 173 Os Os comme une référence. Pendant l'expérience, cinq atomes de hassium ont été synthétisés en utilisant la réaction de 248 cm (26 mg, 5n) 269 Hs. Ils ont ensuite été thermalisés et oxydés dans un mélange d' hélium et d'oxygène gazeux pour former du tétroxyde.
- 269 Hs + 2 O 2 → 269 HSO 4
Le mesurée température de dépôt indiqué que hassium (VIII) oxyde est moins volatil que le tétroxyde d'osmium, OsO quatre, et les endroits hassium fermement dans le groupe 8. Cependant, l'enthalpie d'adsorption pour l'ASS 4 mesurée, (-46 ± 2) kJ / mol, était significativement inférieure à ce qui était prévu, (-36,7 ± 1,5) kJ / mol, ce qui indique que OsO 4 était plus volatil que l'ASS 4, contredisant calculs antérieurs, ce qui implique qu'ils devraient avoir volatilités très similaires. A titre de comparaison, la valeur de OsO 4 est (-39 ± 1) kJ / mol. Il est possible que hassium tétroxyde interagit différemment avec les différents produits chimiques ( nitrure de silicium et le dioxyde de silicium ) utilisé pour le détecteur; recherches supplémentaires sont nécessaires, y compris des mesures plus précises des propriétés nucléaires de 269 HS et des comparaisons avec RuO 4 en plus de OsO 4.
Pour explorer davantage la chimie de hassium, les scientifiques ont décidé d'évaluer la réaction entre hassium tétroxyde et de l'hydroxyde de sodium pour former hassate de sodium (VIII), une réaction bien connue avec l'osmium. En 2004, les scientifiques ont annoncé qu'ils avaient réussi à réaliser la première réaction acide-base avec un composé de hassium:
- HSO 4 + 2 NaOH → Na 2 [ASS 4 (OH) 2]
L'équipe de la Université de Mayence envisagent d'étudier l'électrodéposition d'atomes de hassium utilisant la nouvelle installation de TASCA au GSI. L'objectif actuel est d'utiliser la réaction 226 Ra (48 Ca, 4n) 270 HS. En outre, les scientifiques du GSI espèrent utiliser TASCA pour étudier la synthèse et les propriétés de la hassium (II) hassocene composé, Hs ( C 5 H 5) 2, en utilisant la réaction 226 Ra (Ca 48, xn). Ce composé est analogue au briquet ferrocène, ruthénocène, et osmocene, et l'on attend d'avoir les deux noyaux cyclopentadiényle dans un conformation éclipsée comme ruthénocène et osmocene et non dans un conformation décalée comme ferrocène. Hassocene a été choisi parce qu'il a hassium à l'état bas d'oxydation formel de +2 (bien que la liaison entre le métal et les anneaux est principalement covalentes métallocènes) plutôt que le 8 état haut qui a été étudié, et les effets relativistes ont été devrait être plus forte dans l'état d'oxydation inférieur. Beaucoup de métaux dans les périodiques métallocènes forme de tableau, afin que les tendances pourraient être plus faciles à déterminer, et la structure très symétrique de hassocene et son faible nombre d'atomes font également des calculs relativistes plus facile. Hassocene devrait être un composé stable et hautement volatile.