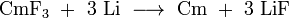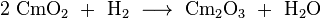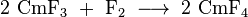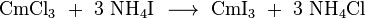Curium
Renseignements généraux
Cette sélection se fait pour les écoles par la charité pour enfants lire la suite . Avec enfants SOS vous pouvez choisir de parrainer des enfants dans plus de cent pays
| Curium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
96 cm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
argenté  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | curium, cm, 96 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / k jʊər Je ə m / KEWR -ee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | actinides | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 7, fa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | (247) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Rn ] 5f 7 6d 1 7s 2 2, 8, 18, 32, 25, 9, 2 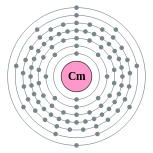 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Glenn T. Seaborg, Ralph A. James, Albert Ghiorso (1944) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 13,51 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1613 K , 1340 ° C, 2444 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 3383 K, 3110 ° C, 5630 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | ? 15 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 4, 3 ( l'oxyde amphotère) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,3 (échelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1e: 581 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 174 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 169 ± 15 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | antiferromagnétique transition → paramagnétique à 52 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | 1,25 μΩ · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-51-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de curium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Curium est un transuraniens radioactive élément chimique avec le symbole Cm et de numéro atomique 96. Cet élément de la actinides série a été nommée d'après Marie Sklodowska-Curie et son mari Pierre Curie - deux étaient connus pour leurs recherches sur la radioactivité. Curium a été produit intentionnellement et identifié en Juillet 1944 par le groupe de Glenn T. Seaborg au Université de Californie, Berkeley. La découverte a été gardé secret et ne rendu public en Novembre 1945. La plupart curium est obtenu en bombardant de l'uranium ou du plutonium avec des neutrons dans - une réacteurs nucléaires tonne de passé combustible nucléaire contient environ 20 grammes de curium.
Curium est un, dense, métal argenté dur avec un point de fusion relativement élevé et le point d'ébullition pour une actinides. Considérant qu'il est paramagnétique les conditions ambiantes, il devient antiferromagnétiques lors du refroidissement, et d'autres transitions magnétiques sont également observées pour de nombreux composés de curium. Dans les composés, curium présente habituellement valence trois et parfois quatre, et la valence 3 est prédominante dans les solutions. Curium oxyde facilement, et ses oxydes sont une forme dominante de cet élément. Il forme fortement complexes fluorescents avec divers composés organiques, mais il n'y a aucune preuve de son incorporation dans les bactéries et archées. Lorsqu'il est introduit dans le corps humain, le curium se accumule dans les os, les poumons et le foie, où il favorise le cancer .
Tous connus isotopes de curium sont radioactifs et ont un petit masse critique pour un soutenue réaction nucléaire en chaîne. Ils émettent principalement α-particules, et la chaleur dégagée dans ce processus peut potentiellement produire de l'électricité générateurs thermoélectriques radio-isotopes. Cette application est entravée par la rareté, le coût élevé et la radioactivité des isotopes du curium. Curium est utilisé dans la production des actinides plus lourds et du 238 Pu radionucléide pour les sources d'alimentation en stimulateurs cardiaques artificielles. Elle a servi de α-source dans le particules alpha spectromètres à rayons X installés sur le Sojourner, Mars, Mars 96, Athena , Esprit et rovers Opportunity ainsi que le Mars Science Laboratory d'analyser la composition et la structure des roches sur la surface de Mars et de la Lune . Un tel spectromètre sera également utilisé par le Atterrisseur Philae de la Rosetta pour sonder la surface de la 67P / Churyumov-Gerasimenko comète .
Histoire


Bien que le curium avait probablement été produit dans des expériences nucléaires précédents, il était premier intentionnellement synthétisé, isolé et identifié en 1944, à la Université de Californie, Berkeley par Glenn T. Seaborg, Ralph A. James, et Albert Ghiorso. Dans leurs expériences, ils ont utilisé un 60 pouces (150 cm) cyclotron.
Curium a été chimiquement identifié au laboratoire métallurgique (maintenant Argonne National Laboratory) au Université de Chicago. Ce était la troisième Transuranien à découvrir même si ce est le quatrième de la série - l'élément léger américium était inconnue à l'époque.
L'échantillon a été préparé comme suit: tout d'abord plutonium solution de nitrate a été appliquée sur une platine feuille d'environ 0,5 cm 2, la solution a été évaporée et le résidu a été converti en dioxyde de plutonium (PuO 2) par recuit. À la suite de l'irradiation de cyclotron l'oxyde, le revêtement a été dissous avec de l'acide nitrique , puis précipité sous forme d'hydroxyde en utilisant aqueuse concentrée une solution d'ammoniaque. Le résidu a été dissous dans l'acide perchlorique, et en outre la séparation a été effectuée par échange d'ions pour donner un certain isotope du curium. La séparation de l'américium et le curium était si laborieux que le groupe Berkeley initialement appelé ces éléments pandémonium (du grec pour tous les démons ou l'enfer) et délire (du latin pour la folie).
L'isotope le curium-242 a été produite en Juillet-Août 1944 par bombardant avec 239 Pu α-particules pour produire le curium avec la sortie d'un neutron :
Curium-242 a été identifié sans ambiguïté par l'énergie caractéristique des α-particules émises lors de la désintégration:
La demi-vie de cette désintégration alpha a été mesurée en 150 jours, puis corrigée à 162,8 jours.
Un autre isotope 240 cm a été produite dans une réaction similaire en Mars 1945:
La demi-vie de la 240 cm α-decay a été correctement déterminée comme étant 26,7 jours.
La découverte de curium, ainsi que l'américium, en 1944 a été étroitement liée à la Manhattan Project, les résultats étaient confidentielles et ne déclassifié en 1945. Seaborg divulgué la synthèse des éléments 95 et 96 sur l'émission de radio des États-Unis pour les enfants, les Quiz enfants, cinq jours avant la présentation officielle à un Réunion de l'American Chemical Society, le 11 Novembre 1945, lorsque l'un des auditeurs a demandé si aucun élément nouveau de transuraniens côté de plutonium et le neptunium avait été découvert pendant la guerre. La découverte de curium (242 cm et 240 cm), leur production et les composés ont ensuite été breveté liste ne Seaborg comme l'inventeur.
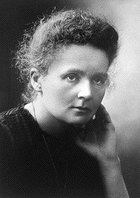 |  | |
Marie et Pierre Curie | ||
Le nouvel élément a été nommé d'après Marie Sklodowska-Curie et son mari Pierre Curie qui a noté pour découvrir le radium et pour leur travail dans la radioactivité. Il a suivi l'exemple du gadolinium , un lanthanides élément ci-dessus curium dans le tableau périodique, qui a été nommé d'après l'explorateur de la éléments des terres rares Johan Gadolin:
- "Comme son nom pour l'élément de numéro atomique 96, nous voudrions proposer" curium ", avec le symbole cm. La preuve indique que l'élément 96 contient sept 5f électrons et est donc analogue au gadolinium élément avec ses sept 4f électrons dans la régulière série des terres rares. Sur cet élément de base 96 est nommé d'après les Curie d'une manière analogue à la désignation de gadolinium, dans lequel le chimiste Gadolin a été honoré. "
Les premiers échantillons de curium étaient à peine visibles, et ont été identifiés par leur radioactivité. Louis Werner et Isadore Perlman a créé le premier échantillon substantielle de 30 ug curium-242 de l'hydroxyde à l'Université de Californie en 1947 en bombardant l'américium -241 avec des neutrons. Quantités macroscopiques de fluorure de curium ont été obtenus en 1950 par WWT Crane, JC Wallmann et BB Cunningham. Sa susceptibilité magnétique était très proche de celle de GdF 3 fournir la première preuve expérimentale pour la valence de 3 curium dans ses composés. Métal curium a été produit seulement en 1951 par la réduction de fluorure de curium avec le baryum .
Caractéristiques
Physique

Un synthétique, élément radioactif, le curium est un métal dur et dense avec l'aspect blanc argenté et les propriétés physiques et chimiques ressemblant à ceux de gadolinium . Son point de 1340 ° C de fusion est nettement supérieur à celui de la précédente éléments transuraniens neptunium (637 ° C), de plutonium (639 ° C) et de l'américium (1173 ° C). En comparaison, le gadolinium fond à 1312 ° C. Le point de curium d'ébullition est 3110 ° C. Avec une densité de 13,52 g / cm 3, le curium est nettement plus léger que le neptunium (20,45 g / cm 3) et de plutonium (19,8 g / cm 3), mais est plus lourd que la plupart des autres métaux. Entre deux formes cristallines du curium, l'α-Cm est plus stable dans les conditions ambiantes. Il a une symétrie hexagonale, groupe spatial P6 3 / mmc, paramètres de maille a = 365 h et c = 1 182 heures, et quatre des unités de formule par cellule unitaire. Le cristal est constitué d'un double hexagonal emballage avec la succession de couches et donc ABAC est isotypique avec α-lanthane. A des pressions supérieures à 23 GPa, à la température ambiante, α-β transforme en Cm-Cm, qui a un cubique à faces centrées symétrie, groupe d'espace Fm 3 m et la constante de réseau a = 493 h. Après une nouvelle compression à 43 GPa, se transforme en un curium orthorhombique γ-Cm structure similaire à celle des α-uranium, sans autres transitions observées jusqu'à 52 GPa. Ces trois phases de curium sont également appelés Cm I, II et III.
Curium a des propriétés magnétiques particulières. Alors que son élément voisin actinium ne montre aucun écart par rapport à Curie-Weiss paramagnétisme dans toute la plage de température, α-Cm transforme à un état antiferromagnétique lors du refroidissement à 65-52 K et β-cm présente une ferrimagnétique transition à environ 205 K. Pendant ce temps, pnictures de curium montrer transitions ferromagnétiques lors du refroidissement: 244 244 CMN et les RMR à 109 K, 248 K CMP à 73 et 248 à 162 CMSB K. De même, l'analogue des lanthanides de curium, le gadolinium, ainsi que ses pnictures montrent également transitions magnétiques lors du refroidissement, mais le caractère de transition est quelque peu différente: D.ieu et GdN deviennent ferromagnétique, et le PIB, GDA et GdSb montrent ordre antiferromagnétique.
Conformément à données magnétiques, la résistivité électrique de curium augmente avec la température - environ deux fois entre 4 et 60 K - puis reste à peu près constante jusqu'à la température ambiante. Il existe une augmentation significative de la resistvity au fil du temps (environ 10 μOhm · cm / h) du fait de l'auto-endommagement du réseau cristallin par un rayonnement alpha. Cela rend incertaine la valeur de résistivité pour curium absolu (environ 125 μΩ · cm). La résistivité du curium est similaire à celle du gadolinium et du plutonium et du neptunium actinides, mais est nettement supérieure à celle de l'américium, l'uranium, le polonium et le thorium .
Sous un éclairage ultraviolet, le curium (III) des ions présenter solide et stable jaune-orange fluorescence avec un maximum dans l'intervalle d'environ 590 à 640 nm en fonction de leur environnement. La fluorescence provient des transitions du premier état excité 6 7/2 D et de l'état du sol 8 S 7/2. L'analyse de cette fluorescence permet des interactions entre de surveillance Cm (III) en ions complexes organiques et inorganiques.
Chimique
ions en solution Curium supposent l' état d'oxydation de +3, qui est l'état d'oxydation le plus stable pour le curium. L'état d'oxydation +4 est observée que dans quelques phases solides, telles que CMO 2 et 4 CmF. comportement chimique de curium est différent du actinides thorium et l'uranium, et est similaire à celui de l'américium et de nombreux lanthanides . En solution aqueuse, le CM 3+ ions est incolore à vert pâle, et Cm de l'ion est jaune pâle. L'absorption optique d'ions cm 3+ contient trois pics bien définis à 375,4, 381,2 et 396,5 nanomètres et leur force peut être directement convertie en la concentration des ions. les ions sont Curium disques acides de Lewis et forment ainsi des complexes plus stables avec des bases dures. La liaison est essentiellement ionique, avec une petite composante covalente. Curium dans ses complexes présente habituellement un environnement de coordination neuf fois, dans un tricapped géométrie prismatique trigonal.
Isotopes
| Neutrons thermiques des sections transversales ( granges) | ||||||
|---|---|---|---|---|---|---|
| 242 cm | 243 cm | 244 cm | 245 cm | 246 cm | 247 cm | |
| Fission | 5 | 617 | 1,04 | 2145 | 0,14 | 81,90 |
| Capture | 16 | 130 | 15,20 | 369 | 1,22 | 57 |
| C / F | 3,20 | 0,21 | 14,62 | 0,17 | 8,71 | 0,70 |
| LEU combustible usé 20 ans après 53 MWj / kg brûler | ||||||
| 3 isotopes communs | 51 | 3700 | 390 | |||
| Réacteur rapide Combustible MOX (moy 5 échantillons, combustion 66-120GWd / t) | ||||||
| Curium total 3,09 × 10 -3% | 27,64% | 70,16% | 2,166% | 0,0376% | 0.000928% | |
| Isotope | 242 cm | 243 cm | 244 cm | 245 cm | 246 cm | 247 cm | 248 cm | 250 cm |
| Masse critique, en kg | 25 | 7,5 | 33 | 6,8 | 39 | 7 | 40,4 | 23,5 |
Environ 20 les radio-isotopes et 7 isomères nucléaires entre 233 cm et 252 cm sont connus pour le curium, et aucun stables isotopes . Les plus longues demi-vies ont été rapportés pour 247 cm (15,6 millions d'années) et 248 cm (348000 années). D'autres isotopes à vie longue sont 245 cm (demi-vie 8500 années), 250 cm (8300 années) et 246 cm (4760 années). Curium-250 est inhabituel par qu'il majoritairement (environ 86%) se désintègre via fission spontanée. Les isotopes de curium plus couramment utilisés sont 242 cm et 244 cm avec les demi-vies de 162,8 jours et 18,1 ans, respectivement.
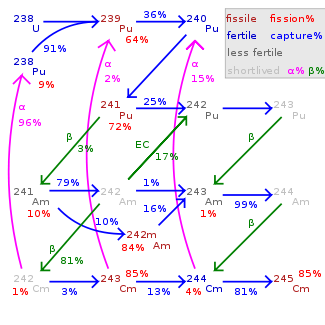
pourcentage de fission est montré moins 100 pourcentages.
Total du transmutation varie considérablement selon nucléide.
245 cm 248 cm sont à long vécu avec décroissance négligeable.
Tous les isotopes entre 242 cm et 248 cm, ainsi que 250 cm, subissent une auto-entretenue réaction nucléaire en chaîne, et donc, en principe, peut agir comme un le combustible nucléaire dans un réacteur. Comme dans la plupart des éléments transuraniens, la fission nucléaire section est particulièrement élevé pour le curium impair de masse des isotopes 243 cm, 245 cm et 247 cm. Ceux-ci peuvent être utilisés dans les réacteurs à neutrons thermiques, tandis qu'un mélange d'isotopes de curium ne convient que pour réacteurs surgénérateurs rapides depuis les isotopes pairs de masse ne sont pas fissiles dans un réacteur thermique et se accumulent avec l'augmentation du taux de combustion. Le combustible à oxydes mixtes (MOX), qui doit être utilisé dans les réacteurs de puissance, devrait contenir peu ou pas parce que le curium activation neutronique de 248 cm créera californium . Ce est fort neutrons émetteur et polluerait la fin du cycle de carburant et augmenter la dose au personnel du réacteur. Par conséquent, si le actinides mineurs doivent être utilisées comme combustible dans un réacteur à neutrons thermiques, le curium doit être exclu de la mise en carburant ou de combustible tiges spéciales où il est le seul actinides présents.
Le tableau de droite indique le des masses critiques pour les isotopes de curium pour une sphère, sans un modérateur et le réflecteur. Avec un réflecteur métallique (30 cm de l'acier), les masses critiques des isotopes impairs sont environ 4.3 kg. Lors de l'utilisation de l'eau (~ 20 à 30 cm d'épaisseur) en tant que réflecteur, la masse critique peut être aussi faible que 59 g pour 245 cm, 155 g pour 243 cm et 1,550 gramme pour 247 Cm. Il ya une incertitude significative de ces valeurs de masse critique. Considérant qu'il est habituellement de l'ordre de 20%, les valeurs de 242 cm et 246 cm ont été répertoriés comme grand que 371 kg et 70,1 kg, respectivement, par certains groupes de recherche.
Actuellement, le curium ne est pas utilisé comme combustible nucléaire en raison de sa faible disponibilité et le prix élevé. 245 cm et 247 cm ont une très petite masse critique et pourraient donc être utilisés dans les portables armes nucléaires , mais aucun n'a été rapporté à ce jour. Curium-243 ne est pas adapté à cette fin en raison de sa courte demi-vie et l'émission de α forte qui se traduirait par une chaleur excessive. Curium-247 serait très approprié, ayant une demi-vie 647 fois supérieure à celle de plutonium-239.
Occurrence

L'isotope plus longue durée de curium, 247 cm, a une demi-vie de 15,6 millions d'années. Par conséquent, toute curium primordiale, ce est le curium présents sur la Terre lors de sa formation, aurait pourri maintenant. Curium est produite artificiellement, en petites quantités à des fins de recherche. En outre, il se produit dans dépensé combustible nucléaire. Curium est présent dans la nature dans certaines zones utilisées pour l'atmosphère essais d'armes nucléaires, qui ont été menées entre 1945 et 1980. Donc, l'analyse des débris sur le site d'essai de la première US bombe à hydrogène, Ivy Mike, (1 Novembre 1952, Enewetak Atoll), à côté einsteinium , fermium , le plutonium et l'américium a également révélé isotopes de berkelium, californium et le curium, en particulier 245 cm, 246 cm et de petites quantités de 247 cm, 248 cm et 249 cm. Pour des raisons de secret militaire, ce résultat a été publié seulement en 1956.
Curium composés atmosphériques sont peu solubles dans les solvants courants et surtout adhèrent aux particules du sol. L'analyse du sol a révélé une concentration d'environ 4000 fois plus élevée de curium les particules du sol de sable que dans l'eau présente dans les pores du sol. Un rapport encore plus élevé d'environ 18 000 a été mesurée dans les sols limoneux.
Quelques atomes de curium peuvent être produits par réactions de capture de neutrons et désintégration bêta en très fortement concentrées uranium dépôts -bearing.
Synthèse
préparation d'isotopes
Curium est produit en petites quantités dans réacteurs nucléaires, et par plus que kg de celui-ci ont été accumulés pour le 242 cm et 244 cm et grammes ou même milligrammes pour des isotopes plus lourds. Ce qui explique le prix élevé du curium, qui a été cité à être de 160 à 185 USD par milligramme, avec une estimation plus récente à 2000 USD / g pour 242 cm et 170 USD / g pour 244 cm. Dans les réacteurs nucléaires, le curium est formée à partir de 238 U d'une série de réactions nucléaires. Dans la première chaîne, 238 U capture un neutron et se transforme en U 239, qui par l'intermédiaire de β - décroissance se transforme en 239 Np et 239 Pu.
![\ Mathrm {^ {238} _ {\ 92} U \ \ xrightarrow {(n, \ gamma)} \ ^ {239} _ {\ 92} U \ \ xrightarrow [23,5 \ min] {\ beta ^ -} \ ^ {239} _ {\ 93} Np \ \ xrightarrow [2,3565 \ d] {\ beta ^ -} \ ^ {239} _ {\ 94}} Pu](../../images/1281/128135.png) (Les temps sont des demi-vies ).
(Les temps sont des demi-vies ).
En outre capture de neutrons suivie par β - -decay produit l'isotope 241 Am de l'américium qui convertit plus loin dans 242 cm:
![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {2 (n, \ gamma)} \ ^ {241} _ {\ 94} Pu \ \ xrightarrow [14,35 \ an] {\ beta ^ -} \ ^ {241} _ {\ 95} Am \ \ xrightarrow {(n, \ gamma)} \ ^ {242} _ {\ 95} Am \ \ xrightarrow [16,02 \ h] {\ beta ^ -} \ ^ { 242} _ {\} 96 cm}](../../images/2302/230202.png) .
.
À des fins de recherche, le curium est obtenu en irradiant pas uranium plutonium, mais, ce qui est disponible en grandes quantités à partir de combustible nucléaire usé. Beaucoup plus élevé de flux de neutrons est utilisé pour l'irradiation qui résulte en une chaîne de réaction différents et formation de 244 cm:
Curium-244 se désintègre en 240 Pu par émission de particule alpha, mais elle absorbe également neutrons résultant dans une petite quantité d'isotopes lourds de curium. Parmi ceux-ci, 247 cm et 248 cm sont populaires dans la recherche scientifique en raison de leurs longues demi-vies. Cependant, le taux de production de 247 cm dans les réacteurs à neutrons thermiques est relativement faible en raison de elle est sujette à subir une fission induite par des neutrons thermiques. Synthèse de l'intermédiaire 250 cm absorption de neutrons est également peu probable en raison de la courte demi-vie du produit intermédiaire 249 cm (64 min), qui convertit par β - désintégration à l' berkelium isotope 249 Bk.
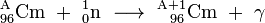 (A = 244 à 248)
(A = 244 à 248)
La cascade de dessus (n, γ) des réactions produit un mélange de différents isotopes de curium. Leur séparation post-synthèse est encombrant, et donc une synthèse sélective est désirée. Curium-248 est favorisée à des fins de recherche en raison de sa longue demi-vie. La méthode de préparation la plus efficace de cet isotope est par l'intermédiaire d'α-désintégration de la californium isotope 252 Cf, qui est disponible en quantités relativement importantes en raison de sa longue demi-vie (2,65 années). A propos de 35 à 50 mg de 248 cm est produit par ce procédé chaque année. La réaction associé produit 248 cm avec la pureté isotopique de 97%.
Un autre élément intéressant pour les isotopes de recherche 245 cm peut être obtenu à partir de l'α-désintégration de 249 Cf, et ce dernier isotope est produit en quantités infimes de la β - -decay du berkelium isotope 249 Bk.
Préparation de métal
La plupart des routines de synthèse produisent un mélange de différents isotopes d'actinides comme oxydes, à partir de laquelle un certain isotope de curium doit être séparé. Un exemple de procédure pourrait être de dissoudre combustible usé du réacteur (par exemple, Combustible MOX) dans l'acide nitrique , et de supprimer la majeure partie de l'uranium et du plutonium en utilisant un PUREX (P lutonium - UR anium EX traction) taper extraction avec le phosphate de tributyle dans un hydrocarbure. Les lanthanides et les actinides restants sont ensuite séparées du résidu aqueux ( raffinât) par une extraction à base de diamide-pour donner, après le décapage, un mélange des actinides et lanthanides trivalents. Composé de curium est ensuite extrait en utilisant de façon sélective à plusieurs étapes chromatographiques et des techniques de centrifugation avec un réactif approprié. Bis -triazinyl complexe bipyridine a récemment été proposé en tant que tel réactif qui est hautement sélectif pour le curium. La séparation de l'américium à partir d'une curium très similaire peut également être obtenue par traitement d'une suspension de leurs hydroxydes dans une solution aqueuse du bicarbonate de sodium avec de l'ozone à température élevée. Les deux américium et le curium sont présents dans la plupart des solutions à l'état de valence 3; alors américium oxyde à la forme soluble Am (IV) complexes, curium reste inchangé et peuvent donc être isolées par centrifugation répétée.
Curium métallique est obtenu par réduction de ses composés. Initialement, le curium (III) le fluorure a été utilisé à cette fin. La réaction a été effectuée dans le milieu exempt d'eau et d'oxygène, dans l'appareil en le tantale et le tungstène , en utilisant élémentaire baryum ou de lithium comme agents réducteurs.
Une autre possibilité est la réduction du curium (IV) oxyde de magnésium en utilisant un alliage de zinc dans une masse fondue de chlorure de magnésium et le fluorure de magnésium.
Les composés et réactions
Oxydes
Curium réagit facilement avec l'oxygène formant essentiellement cm 2 O 3 et OCM deux oxydes, mais l'OCM d'oxyde bivalent est également connu. Noir OCM 2 peut être obtenue par la combustion du curium oxalate (cm 2 (C 2 O 4) 3), nitrate (Cm (NO 3) 3) ou d'hydroxyde dans l'oxygène pur. Lors d'un chauffage à 600-650 ° C sous vide (environ 0,01 Pa), il se transforme en Cm blanchâtre 2 O 3:
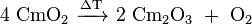 .
.
Alternativement, Cm 2 O 3 peut être obtenue en réduisant OCM 2 avec moléculaire hydrogène :
En outre, un certain nombre d'oxydes ternaires de type M (II) sont connus OCM 3, où M reste pendant un métal divalent, tel que le baryum.
Halogénures
Le curium incolore (III) fluorure (CMF 3) peut être produit en introduisant des ions fluorures dans le curium (III) contenant des solutions. Le brun tétravalent curium (IV) fluorure (CMF 4) d'autre part ne est obtenu par réaction curium (III) avec le fluorure moléculaire fluor :
Une série de fluorures ternaires sont connus de la forme A 7 cm 6 F 31, où A représente un métal alcalin .
La incolore curium (III) chlorure (CMCl 3) est produit dans la réaction de curium (III) hydroxyde (Cm (OH) 3) anhydre avec gaz de chlorure d'hydrogène. Il peut en outre être converti en d'autres halogénures, tels que le curium (III) bromure (incolore au vert clair) et curium (III) d'iodure (incolore), en le faisant réagir avec l' ammoniac le sel d'halogénure correspondant à une température élevée d'environ 400 450 ° C:
Un autre mode opératoire est le chauffage de l'oxyde de curium à environ 600 ° C avec de l'acide correspondant (tel que bromhydrique pour le bromure de curium). Phase vapeur hydrolyse de curium (III) Résultats de chlorure dans le curium oxychlorure:
Chalcogenides et pnictures
Sulfures, des séléniures et des tellurures de curium ont été obtenus par traitement de curium gazeux avec du soufre , du sélénium ou du tellure sous vide à température élevée. Le pnictures de curium du type CMX sont connus pour les éléments azote , phosphore , arsenic et antimoine . Ils peuvent être préparés en faisant réagir soit le curium (III) d'hydrure (CMH 3) ou curium métallique avec ces éléments à des températures élevées.
Composés Organocurium et aspects biologiques
Complexes organométalliques analogue à Uranocène sont connus aussi pour d'autres actinides, tels que le thorium, le protactinium, le neptunium, le plutonium et l'américium. Théorie des orbitales moléculaires prédit une "curocene" stable complexe (η 8 à C 8 H 8) 2 cm, mais il n'a pas encore été signalé expérimentalement.
La formation des complexes du type Cm (nC 3 H 7 -BTP) 3, où BTP représente 2,6-di (1,2,4-triazine-3-yl) pyridine, dans des solutions contenant nC 3 H 7 - ions BTP et Cm 3+ a été confirmée par EXAFS. Certains de ces complexes de type BTP interagissent sélectivement avec curium et sont donc utiles dans la séparation sélective de lanthanides et les actinides autre. Ions cm 3+ dissous se lient avec de nombreux composés organiques, tels que l'acide hydroxamique, l'urée , fluorescéine et l'adénosine triphosphate . Beaucoup de ces composés sont liés à l'activité biologique de divers micro-organismes. Les complexes résultants présentent une forte émission jaune-orange sous excitation par la lumière UV, ce qui est pratique, non seulement pour leur détection, mais aussi pour l'étude des interactions entre l'ion cm 3+ et des ligands par l'intermédiaire de variations de la demi-vie (de l'ordre ~ 0,1 ms) et le spectre de la fluorescence.
Curium n'a pas de signification biologique. Il ya peu de rapports sur biosorption de Cm 3+ par les bactéries et archées, cependant aucune preuve pour l'incorporation de curium en eux.
Applications
Radionucléides
Curium est l'un des éléments les plus radioactifs isolables. Ses deux isotopes les plus communs 242 cm et 244 cm sont émetteurs alpha fortes (énergie 6 MeV); ils sont relativement courtes demi-vies de 162,8 jours et 18,1 années, et produisent autant que 120 W / g et 3 W / g de l'énergie thermique, respectivement. Par conséquent, le curium peut être utilisé dans sa forme oxyde commune générateurs thermoélectriques radio-isotopiques comme ceux dans les vaisseaux spatiaux. Cette application a été étudié pour l'isotope 244 cm, tandis que 242 cm a été abandonné en raison de son prix prohibitif d'environ 2000 USD / g. Curium-243 avec un ~ 30 années demi-vie et un bon rendement énergétique de ~ 1,6 W / g pourrait faire pour un carburant approprié, mais il produit des quantités importantes de nuisibles gamma et rayonnement bêta à partir de produits de désintégration radioactive. Bien que l'α-émetteur, 244 cm nécessite une protection beaucoup plus mince blindage de rayonnement, il a un taux de fission spontanée élevée, et donc le taux de rayonnement neutronique et gamma sont relativement forte. Par rapport à un concurrent isotope du générateur thermoélectrique tel que 238 Pu, 244 cm émet une heure 500 plus grande fluence de neutrons, et son émission gamma plus élevée nécessite un bouclier qui est 20 fois plus épaisse - environ 2 pouces de plomb pour une source de 1 kW, comme par rapport à 0,1 pour 238 en Pu. Par conséquent, cette application de curium est actuellement considéré comme impraticable.
Une application plus prometteur de 242 cm est de produire 238 Pu, un radio-isotope plus approprié pour les générateurs thermoélectriques tels que dans les stimulateurs cardiaques. Les itinéraires alternatifs pour Pu 238 utilisent le (n, γ) réaction de 237 Np, ou deuteron bombardement de l'uranium, qui à la fois produisent toujours 236 Pu comme un sous-produit indésirable - puisque ce dernier se désintègre en 208 Tl avec une forte émission gamma.
Curium est également une matière de départ commun pour la production ultérieure de transuraniens et transactinides. Ainsi, le bombardement de 248 cm avec l'oxygène (18 O) ou de magnésium (26 mg) a donné certains isotopes de seaborgium (265 Sg) et hassium (269 HS et 270 HS). Californium a été découvert quand une cible microgrammes taille du curium-242 a été irradié avec 35 MeV particules alpha en utilisant le cyclotron de 60 pouces (150 cm) à Berkeley:
- 242
96 cm + 4
2 Il → 245
98 Cf + 1
0 n
Seulement environ 5000 atomes de californium ont été produits dans cette expérience.

Spectromètre à rayons X
L'application la plus pratique de 244 cm - mais un peu limité en volume totale - est en tant que source α-particules dans le particules alpha spectromètres à rayons X (APXS). Ces instruments ont été installés sur la Sojourner, Mars, Mars 96, Esprit, Athena et rovers Opportunity, ainsi que le Mars Science Laboratory d'analyser la composition et la structure des roches sur la surface de la planète Mars . APXS a également été utilisé dans le SURVEYOR 5-7 sondes de lune mais avec une source de 242 cm.
Une configuration APXS élaboré est équipé d'une tête de capteur contenant six sources de curium ayant le taux de désintégration radioactive total de plusieurs dizaines de millicuries (environ un gigabecquerel). Les sources sont collimatés sur l'échantillon, et les spectres d'énergie des particules alpha et des protons dispersés à partir de l'échantillon sont analysés (l'analyse de protons est mis en oeuvre que dans certains spectromètres). Ces spectres contiennent des informations quantitatives sur tous les principaux éléments dans les échantillons à l'exception de l'hydrogène, l'hélium et le lithium. Un APXS sera également utilisé par le Atterrisseur Philae de la Rosetta pour sonder la surface de la 67P / Churyumov-Gerasimenko comète .
Sécurité
En raison de sa forte radioactivité, le curium et ses composés doit être manipulé dans des laboratoires, selon des modalités particulières. Considérant que le curium se HPS α-particules qui sont absorbés par des couches minces de matériaux communs, certains de ses produits de désintégration émettent fractions importantes de rayonnements bêta et gamma, qui nécessitent une protection plus élaborée. Si consommé, le curium est excrété dans quelques jours et seulement 0,05% est absorbé dans le sang. De là, environ 45% va à la foie, 45% pour les os, et les 10% restants sont excrétés. Dans l'os, curium se accumule à l'intérieur des interfaces avec le la moelle osseuse et ne redistribue pas de manière significative avec le temps; ses détruit de rayonnement arrêts de la moelle osseuse et donc rouge création de cellules sanguines. Le demi-vie biologique de curium est d'environ 20 ans dans le foie et 50 années dans les os. Curium est absorbé dans le corps beaucoup plus fortement par inhalation, et la dose totale autorisée de 244 cm sous forme soluble est 0,3 μ C. injection intraveineuse de 242 cm et 244 cm contenant des solutions à des rats a augmenté l'incidence des tumeur osseuse, et l'inhalation promus pulmonaire et cancer du foie.
isotopes de Curium sont inévitablement présents dans le combustible nucléaire usé avec une concentration d'environ 20 g / tonne. Parmi eux, les 245 cm 248 cm isotopes ont des temps de désintégration des milliers d'années et doivent être enlevés pour neutraliser le carburant pour l'élimination. La procédure associée comporte plusieurs étapes, où le curium est d'abord séparé et ensuite converti par bombardement neutronique dans des réacteurs spéciaux de nucléides de courte durée. Cette procédure, transmutation nucléaire, tout bien documenté pour d'autres éléments, est toujours en cours d'élaboration pour le curium.

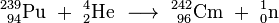
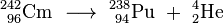
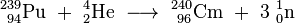
![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {4 (n, \ gamma)} \ ^ {243} _ {\ 94} Pu \ \ xrightarrow [4956 \ h] {\ beta ^ -} \ ^ {243} _ {\ 95} Am \ \ xrightarrow {(n, \ gamma)} \ ^ {244} _ {\ 95} Am \ \ xrightarrow [10.1 \ h] {\ beta ^ -} \ ^ { 244} _ {\} 96 cm}](../../images/2302/230203.png)
![\ Mathrm {^ {244} _ {\ 96 cm} \ \ xrightarrow [18,11 \ an] {\ alpha} \ ^ {240} _ {\ 94}} Pu](../../images/2302/230204.png)
![\ Mathrm {^ {252} _ {\} 98 Cf \ \ xrightarrow [2,645 \ an] {\ alpha} \ ^ {248} _ {\} 96 cm}](../../images/2302/230206.png)
![\ Mathrm {^ {249} _ {\ 97} Bk \ \ xrightarrow [330 \ d] {\ beta ^ -} \ ^ {249} _ {\} 98 Cf \ \ xrightarrow [351 \ an] {\ alpha} \ ^ {245} _ {\} 96 cm}](../../images/2302/230207.png)