
Xénon
Saviez-vous ...
SOS croit que l'éducation donne une meilleure chance dans la vie des enfants dans le monde en développement aussi. SOS Children travaille dans 45 pays africains; pouvez-vous aider un enfant en Afrique ?
| Xénon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
54 Xe | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
gaz incolore, présentant une lueur bleue lorsqu'il est placé dans un champ électrique à haute tension  Raies spectrales du xénon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | xénon, Xe, 54 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / z ɛ n ɒ n / ZEN -on ou / z Je n ɒ n / ZEE -non | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | gaz nobles | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 18 (gaz rares) , 5, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 131,293 (6) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Kr ] 5s 2 5p 4d 10 6 2, 8, 18, 18, 8 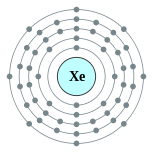 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | William Ramsay et Morris Travers (1898) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | William Ramsay et Morris Travers (1898) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | gaz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité | (0 ° C, 101,325 kPa) 5,894 g / L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité à BP | 3,057 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | (101,325 kPa) 161,4 K , -111,7 ° C, -169,1 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | (101,325 kPa) 165,03 K, -108,12 ° C, -162,62 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point triple | 161,405 K (-112 ° C), 81,6 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point critique | 289,77 K, 5,841 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | (101,325 kPa) 2,27 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | (101,325 kPa) 12,64 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 5 R / 2 = 20,786 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 0, 1, 2, 4, 6, 8 (Rarement plus de 0) (Faiblement acide oxyde) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 2,6 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 1170,4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 2046,4 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 3099,4 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 140 ± 21 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 216 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 5,65 × 10 -3 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | (Liquide) 1090 mlle; (Gaz) 169 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-63-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes du xénon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le xénon est un élément chimique avec le symbole Xe et de numéro atomique 54. Ce est un lourd, incolore et inodore gaz noble , qui se produit dans l' atmosphère de la Terre en quantités infimes. Bien que généralement non réactif, le xénon peut subir quelques réactions chimiques telles que la formation de hexafluoroplatinate xénon, le premier Composé de gaz noble à synthétiser.
D'origine naturelle est constitué de xénon huit isotopes stables. Il ya aussi plus de 40 isotopes instables qui subissent désintégration radioactive. Les ratios d'isotopes de xénon sont un outil important pour l'étude de l'histoire des débuts du système solaire . Radioactif xénon-135 est produit à partir de l'iode-135 à la suite de la fission nucléaire , et il agit comme le plus important absorbeur de neutrons dans les réacteurs nucléaires.
Le xénon est utilisé dans lampes flash et Les lampes à arc, et en tant que anesthésie générale. La première conception de laser excimère a utilisé un xénon molécule dimère (Xe 2) que son milieu laser, et les premiers laser dessins utilisés lampes flash au xénon comme pompes. Xenon est également utilisé pour rechercher hypothétique interagissant faiblement particules massives et que la propulseur pour propulseurs ioniques dans engin spatial.
Histoire
Xenon a été découvert en Angleterre par le chimiste écossais William Ramsay et chimiste anglais Morris Travers le 12 Juillet 1898, peu de temps après leur découverte des éléments du krypton et le néon . Ils ont trouvé xénon dans le résidu laissé plus de se évaporer de composants air liquide. Ramsay a suggéré le nom de xénon pour ce gaz à partir du grec mot ξένον [xénon], la forme neutre singulier de ξένος [Xenos], ce qui signifie «étranger (er)», «étrange (r)», ou «invité». En 1902, Ramsay estime la proportion de xénon dans l'atmosphère de la Terre comme une part à 20 millions. Le symbole actuel de xénon Xe est cependant historiquement il a aussi été écrit comme X.
Durant les années 1930, l'ingénieur américain Harold Edgerton a commencé à explorer stroboscope technologie de la lumière pour la photographie à haute vitesse. Cela l'a conduit à l'invention de la lampe flash au xénon, dans lequel la lumière est générée en envoyant un bref courant électrique à travers un tube rempli de gaz xénon. En 1934, Edgerton a pu générer clignote aussi bref que une microseconde avec cette méthode.
En 1939, médecin américain Albert R. Behnke Jr. a commencé à explorer les causes de «l'ivresse» dans plongeurs sous-marins. Il a testé les effets de la variation des mélanges respiratoires à ses sujets, et a découvert que cela a causé les plongeurs de percevoir un changement en profondeur. De ses résultats, il en déduit que le gaz xénon pourrait servir anesthésique. Bien que toxicologue Russe Nikolay V. Lazarev apparemment étudié l'anesthésie au xénon en 1941, le premier rapport publié confirmant l'anesthésie au xénon a été en 1946 par le chercheur médical américain John H. Lawrence, qui a expérimenté sur des souris. A été d'abord utilisé comme une anesthésie chirurgicale en 1951 par anesthésiste américain Stuart C. Cullen, qui a opéré avec succès sur deux patients Xenon.
Xénon et les autres gaz rares ont été longtemps considérées comme totalement inerte chimiquement et non capables de former des composés . Cependant, tout en enseignant à la Université de la Colombie-Britannique, Neil Bartlett a découvert que le gaz platine hexafluorure (FTC 6) était un puissant agent oxydant pouvant oxyder le gaz oxygène (O 2) pour former dioxygényle hexafluoroplatinate (O 2 + [PtF 6] -). Depuis 2 O et du xénon ont presque le même premier potentiel d'ionisation, Bartlett est rendu compte que l'hexafluorure de platine peut aussi être capable d'oxyder le xénon. Le 23 Mars 1962, il a mélangé les deux gaz et produit le premier composé connue d'un gaz rare, hexafluoroplatinate xénon. Bartlett a pensé sa composition être Xe + [PtF 6] -, bien que le travail plus tard a révélé que ce était probablement un mélange de différents sels contenant du xénon. Depuis lors, de nombreux autres composés de xénon ont été découverts, ainsi que certains composés du gaz noble argon , le krypton et le radon , y compris Fluorohydrure d'argon (Harf), difluorure de krypton (KrF 2), et fluorure radon. En 1971, plus de 80 composés xénon ont été connus.
Caractéristiques

( la version animée)
Xenon a le numéro atomique 54; ce est son noyau contient 54 protons . À température et pression normales, le gaz de xénon pur a une masse volumique de 5,761 kg / m 3, à environ 4,5 fois la densité de surface de l'atmosphère de la terre, 1,217 kg / m 3. En tant que liquide, le xénon a une densité de 3,100 jusqu'à g / ml, avec le maximum de densité se produisant au niveau du point triple. Dans les mêmes conditions, la densité du xénon solide, 3,640 g / cm 3, est supérieure à la densité moyenne de granit , 2,75 g / cm 3. Utilisation gigapascals de la pression, le xénon a été contraint à une phase métallique.
Solides xénon changements de cubique à faces centrées (cfc) à hexagonal emballé (hcp) phase cristalline sous pression et commence à tourner métallique à environ 140 GPa, sans changement notable du volume dans la phase hcp. Il est complètement métallique à 155 GPa. Lorsque métallisé, le xénon regarde le bleu du ciel, car il absorbe la lumière rouge et transmet d'autres fréquences visibles. Un tel comportement est inhabituel pour un métal et se explique par les relativement petites largeurs de bandes d'électrons dans xénon métallique.
Le xénon est un membre des zéro- valence éléments qui sont appelés noble ou inertes gaz . Il est inerte à la plupart des réactions chimiques courantes (telles que la combustion, par exemple) car l'extérieur valence enveloppe contient huit électrons. Ceci produit une configuration stable, minimum d'énergie dans laquelle les électrons externes sont étroitement liés. Cependant, le xénon peut être oxydé par des agents oxydants puissants, et de nombreux composés de xénon ont été synthétisés.
Dans un tube rempli de gaz, le xénon émet un bleu ou lueur lavenderish lorsque le gaz est excité par décharge électrique. Xénon émet une bande de raies d'émission qui se étendent sur le spectre visible, mais les lignes les plus intenses se produisent dans la région de la lumière bleue, qui produit la coloration.
Présence et la production
Le xénon est un tracer gaz dans l'atmosphère terrestre , produisant à 87 ± 1 parties par milliard (NL / L), soit environ 1 partie par 11,5 millions, et se retrouve également dans les gaz émis par certains sources minérales.
Le xénon est obtenu dans le commerce en tant que sous-produit de la séparation de l'air en oxygène et azote . Après cette séparation, généralement effectuée par distillation fractionnée dans une usine à double colonne, le l'oxygène liquide produit contiendra de petites quantités de krypton et de xénon. Par des étapes supplémentaires de distillation fractionnée, l'oxygène liquide peut être enrichi pour contenir de 0,1 à 0,2% d'un mélange krypton / xénon, qui est extrait, soit par adsorption sur gel de silice ou par distillation. Enfin, le mélange krypton / xénon peut être séparé en krypton et du xénon par distillation. Extraction d'un litre de xénon à partir de l'atmosphère nécessite 220 watt-heures d'énergie. La production mondiale de xénon en 1998 a été estimé à 5.000-7.000 m 3. En raison de sa faible abondance, le xénon est beaucoup plus cher que les prix nobles légers gaz-approximatives pour l'achat de petites quantités en Europe en 1999 était de 10 € / L pour le xénon, 1 € / L pour le krypton, et 0,20 € / L pour néon; l'argon beaucoup plus abondante coûte moins d'un cent le litre.
Dans le système solaire, la fraction de nucléon du xénon est 1,56 × 10 -8, pour un l'abondance d'environ une part à 630 000 de la masse totale. Xenon est relativement rare dans le Sun l 'atmosphère, sur la Terre , et les astéroïdes et les comètes . La planète Jupiter a une abondance anormalement élevée de xénon dans l'atmosphère; environ 2,6 fois plus que le Soleil Cette forte abondance reste inexpliquée et peut avoir été causée par une accumulation précoce et rapide de planétésimaux-petits-subplanetary organismes avant la disque présolaire commencé à se réchauffer. (Sinon, le xénon ne aurait pas été pris au piège dans les glaces planétésimaux.) Le problème de la faible xénon terrestre peut potentiellement se expliquer par la liaison covalente du xénon à l'oxygène à l'intérieur de quartz , ce qui réduit par conséquent le dégazage du xénon dans l'atmosphère.
Contrairement aux gaz nobles plus faible masse, la normale processus nucléosynthèse stellaire intérieur d'une étoile ne fait pas xénon. Éléments plus massives que fer-56 ont un coût net d'énergie pour produire par fusion, il n'y a donc pas de gain d'énergie pour une étoile lors de la création xénon. Au lieu de cela, le xénon est formé au cours de supernovae explosions, par le processus de capture de neutrons lents ( processus s) des géantes rouges étoiles qui ont épuisé l'hydrogène à leurs noyaux et entrés dans le Branche géante asymptotique, dans le classique nova explosions et de la désintégration radioactive des éléments tels que l'iode , l'uranium et le plutonium .
Isotopes et des études isotopiques
Naturellement xénon se produisant est faite de huit stables isotopes , plus que tout autre élément à l'exception de l'étain , qui a dix. Xenon et l'étain sont les seuls éléments à avoir plus de sept isotopes stables. Les isotopes 124 et 134 Xe Xe sont prévus à subir la double désintégration bêta, mais cela n'a jamais été observé de sorte qu'ils sont considérés comme stables. Outre ces formes stables, il ya plus de 40 isotopes instables qui ont été étudiés. Le plus long vécu de ces isotopes est 136 Xe, qui a été observée à subir la double désintégration bêta avec une demi-vie de 2,11 x 10 21 ans. 129 Xe est produit par désintégration bêta de 129 I , qui a une demi-vie de 16 millions d'années, tandis 131m Xe, 133 Xe, 133m Xe, et 135 Xe sont quelques-uns des fission produits des deux 235 U et 239 Pu , et donc utilisés comme indicateurs de explosions nucléaires.
Les noyaux de deux de l'écurie isotopes de xénon, 129 et 131 Xe Xe, ont non nulle intrinsèque moments angulaires ( spins nucléaires, appropriés pour résonance magnétique nucléaire). Les spins nucléaires peuvent être alignés au-delà des niveaux de polarisation ordinaires au moyen de lumière polarisée circulairement et rubidium vapeur. La résultante polarisation de spin de xénon noyaux peut dépasser 50% de sa valeur maximale possible, dépassant largement la valeur d'équilibre dicté par la Distribution de Boltzmann (typiquement de 0,001% de la valeur maximale à la température ambiante, même dans les plus forts aimants ). Cet alignement des spins de non-équilibre est un état temporaire, et est appelé hyperpolarisation. Le processus d'hyperpolarisation le xénon est appelé pompage optique (même si le processus est différent de le pompage d'un laser).
Parce qu'un Xe 129 a un noyau spin de 1/2, et donc un zéro électrique moment quadrupolaire, le 129 Xe noyau ne connaît pas toutes les interactions quadripolaires lors de collisions avec d'autres atomes, et donc sa hyperpolarisation peut être maintenue pendant de longues périodes de temps, même après que le faisceau laser a été éteinte et la vapeur alcalin éliminée par condensation d'une chambre -Température surface. Spin polarisation de 129 Xe peut persister de plusieurs seconde pour atomes de xénon dissous dans le sang à plusieurs heures dans la phase gazeuse et plusieurs jours dans xénon solide gelé en profondeur. En revanche, 131 Xe présente une valeur de spin nucléaire de 3/2 et une valeur non nulle quadripolaire moment, et a une T temps de relaxation dans le milliseconde et seconde gammes.
Certains isotopes radioactifs du xénon, par exemple, 133 et 135 Xe Xe, sont produites par neutrons irradiation de matières fissiles dans les les réacteurs nucléaires. 135 Xe est d'une importance considérable dans l'opération de réacteurs de fission nucléaire. 135 Xe a un énorme section pour neutrons thermiques, 2,6 × 10 6 granges, il agit comme un absorbeur de neutrons ou " poison "qui peuvent ralentir ou arrêter la réaction en chaîne après une période de fonctionnement. Ceci a été découvert dans les premiers réacteurs nucléaires construits par l'American Projet Manhattan pour plutonium production. Dispositions Heureusement, les concepteurs avaient faites dans la conception pour augmenter la réactivité du réacteur (le nombre de neutrons par fission qui se passent à la fission d'autres atomes de combustible nucléaire). 135 Xe empoisonnement du réacteur a joué un rôle majeur dans la catastrophe de Tchernobyl . A l'arrêt ou la diminution de puissance d'un réacteur peuvent entraîner une accumulation de 135 Xe et d'obtenir le réacteur dans le pit iode.
Dans des conditions défavorables, des concentrations relativement élevées d'isotopes radioactifs au xénon peuvent être trouvés émanant de réacteurs nucléaires en raison de la libération de produits de fission de craquage des barres de combustible, ou fission de l'uranium dans eau de refroidissement.
Parce que le xénon est un traceur pour les deux isotopes de parents, le xénon rapports isotopiques dans météorites sont un outil puissant pour étudier la formation du système solaire. Le Procédé iode-xénon de datation donne le temps écoulé entre nucléosynthèse et la condensation d'un objet solide de la nébuleuse solaire. En 1960, le physicien John H. Reynolds a découvert que certains météorites contenaient une anomalie isotopique sous la forme d'une surabondance de xénon-129. Il en a déduit que ce était un produit décroissance radioactive l'iode-129. Cet isotope se produit lentement par cosmique spallation de rayons et de la fission nucléaire , mais est produit en quantité que dans les explosions de supernovae. Comme la demi-vie de 129 I est relativement court sur une échelle de temps cosmologique, seulement 16 millions d'années, ont démontré que ce que peu de temps avait passé entre la supernova et le temps les météorites avaient solidifié et pris au piège de la 129 I. Ces deux événements (supernovae et de solidification du nuage de gaz) ont été déduites s'être produit au cours de l'histoire des débuts du système solaire , comme l'isotope 129 I a probablement été généré avant le système solaire se est formé, mais pas longtemps avant, et ensemencées le gaz solaire Cloud avec isotopes d'une seconde source. Cette source de supernova peut également avoir causé l'effondrement du nuage de gaz solaire.
De la même manière, les abondances isotopiques xénon tels que 129 Xe / 130 et 136 Xe Xe / 130 Xe sont également un outil puissant pour comprendre la différenciation planétaire et dégazage tôt. Par exemple, le atmosphère de Mars montre une abondance de xénon similaire à celle de la Terre: 0,08 parties par million, cependant Mars montre une proportion plus élevée de 129 Xe que la Terre ou du Soleil Comme cet isotope est produit par la désintégration radioactive, le résultat peut indiquer que Mars a perdu la plupart de son atmosphère primordiale, peut-être dans les 100 premiers millions d'années après que la planète a été formée. Dans un autre exemple, l'excès de 129 Xe trouve dans dioxyde de carbone des gaz de puits de Nouveau-Mexique a été considéré comme de la désintégration du gaz de mantellique peu de temps après la formation de la Terre.
Composés
Après la découverte de Neil Bartlett en 1962 que le xénon peut former des composés chimiques, un grand nombre de composés xénon ont été découverts et décrits. Xénon composés presque tous connus contiennent le atomes de fluor ou de l'oxygène électronégatif.
Halogénures

Trois fluorures sont connus: XeF 2, XeF 4, et XeF 6. XeF est théorisé à être instable. Les fluorures sont le point de départ pour la synthèse de composés presque tous xénon.
Le solide, difluorure cristalline XeF 2 est formé quand un mélange de fluor et de gaz xénon est exposée à la lumière ultraviolette. La lumière du jour est suffisante. Chauffage à long terme de XeF 2 à haute température sous un catalyseur NiF 2 donne XeF 6. La pyrolyse du XeF 6 en présence de NaF donne de haute pureté XeF 4.
Les fluorures xénon se comportent comme deux accepteurs fluorure et les donateurs fluorure, former des sels qui contiennent ces cations que XeF + et Xe
2 F +
3, et des anions tels que XeF -
5, XeF -
7, et XeF 2-
8. Le vert, Xe paramagnétique +
2 est formé par la réduction du XeF 2 par le gaz xénon.
XeF 2 est également en mesure de former des complexes de coordination avec des ions de métaux de transition. Plus de 30 ces complexes ont été synthétisés et caractérisés.
Alors que les fluorures xénon sont bien caractérisés, les autres halogénures ne sont pas connus, la seule exception étant le dichlorure, XeCl 2. Xenon dichlorure est signalé comme étant un, incolore, le composé cristallin endothermique qui se décompose dans les éléments à 80 ° C, formé par l'irradiation à haute fréquence d'un mélange de xénon, de fluor, et silicium ou le tétrachlorure de carbone . Cependant, le doute a été posée de savoir si XeCl 2 est un composé réel et pas seulement un van der Waals molécule composée d'atomes Xe faiblement liés et Cl 2 molécules. Des calculs théoriques montrent que la molécule linéaire XeCl 2 est moins stable que le complexe de van der Waals.
Oxydes et Oxohalogénures
Trois oxydes de xénon sont connus: trioxyde xénon (Xeo 3) et tétroxyde xénon (Xeo 4), qui sont tous deux dangereusement agents explosifs et puissants oxydants, et dioxyde xénon (Xeo 2), qui a été signalé en 2011 avec un indice de coordination égal à quatre. Xeo deux formes quand xénon tétrafluorure est versé sur de la glace. Sa structure cristalline peut lui permettre de remplacer le silicium dans les silicates. Le cation XeOO + a été identifié par La spectroscopie infrarouge à l'état solide argon .
Xenon ne réagit pas directement avec l'oxygène; l'anhydride est formé par l'hydrolyse du XeF 6:
- XeF 6 + 3 H 2 O → Xeo 3 + 6 HF
Xeo 3 est faiblement acide, la dissolution dans un alcali pour former des sels de xenate instables contenant le HXeO -
4 anion. Ces sels instables facilement disproportionnée en gaz xénon et Perxénate sels, contenant le Xeo 4-
6 anion.
Perxénate baryum, lorsque traité avec de concentré acide sulfurique , on obtient le xénon gazeux tétroxyde:
- Ba 2 Xeo 6 + 2 H 2 SO 4 → 2 BaSO 4 + 2 H 2 O + 4 Xeo
Pour éviter la décomposition, le tétroxyde xénon ainsi formé est refroidi rapidement pour former un solide jaune pâle. Il explose au-dessus de -35,9 ° C en xénon et de l'oxygène gazeux.
Un certain nombre de oxyfluorures xénon sont connus, y compris XeOF 2, XeOF 4, xeo 2 F 2, F 3 et xeo 2. XeOF 2 est formé par la réaction de D 2 avec du gaz xénon à basse température. Il peut également être obtenu par hydrolyse partielle du XeF 4. Il dismutation à -20 ° C dans XeF 2 et xeo 2 F 2. XeOF 4 est formé par l'hydrolyse partielle de XeF 6, ou la réaction de avec XeF 6 Perxénate de sodium, Na 4 xeo 6. La dernière réaction produit également une petite quantité de Xeo 3 F 2 XeOF 4 réagit avec. CsF pour former le XeOF -
5 anions, tandis que XeOF 3 réagit avec les fluorures de métaux alcalins KF, RbF et le LCR pour former le XeOF -
4 anion.
D'autres composés
Récemment, on a eu un intérêt dans les composés où xénon xénon est directement lié au moins un élément électronégatif que le fluor ou de l'oxygène, en particulier du carbone . Groupes électro-attracteurs, tels que les groupes ayant une substitution de fluor, sont nécessaires pour stabiliser ces composés. De nombreux de ces composés ont été caractérisés, incluant:
- C 6 F 5 + -N≡C -xe-CH 3, C 6 F 5 est le groupe pentafluorophényle.
- [C 6 F 5] 2 Xe
- C 6 F 5 -xe-X, où X est CN, F ou Cl.
- R-C≡C-Xe +, où R est C 2 F -
5 ou tert-butyle. - C 6 F 5 + -XeF
2 - (C 6 F 5 Xe) 2 Cl +
D'autres composés contenant du xénon lié à un élément moins électro comprennent F-Xe-N (SO 2 F) 2 et F-Xe-BF 2. Celui-ci est synthétisé à partir de dioxygényle tétrafluoroborate, O 2 BF 4, à -100 ° C.
Un ions xénon est inhabituel contenant le tetraxenonogold (II) cation, AuXe 2+
4, qui contient des Au Xe-liaisons. Cet ion se produit dans le composé AuXe 4 (Sb 2 F 11) 2, et est remarquable en ayant des liaisons chimiques directes entre deux atomes notoirement non réactifs, le xénon et l'or , avec du xénon agissant comme un ligand de métal de transition.
En 1995, M. Räsänen et ses collègues, les scientifiques à la Université d'Helsinki en Finlande , a annoncé la préparation de xénon dihydrure (HXeH), et plus tard au xénon hydrure-hydroxyde (HXeOH), hydroxenoacetylene (HXeCCH), et d'autres molécules contenant Xe. En 2008, Khriachtchev et al. A rapporté la préparation de HXeOXeH par le photolyse de l'eau dans un cryogénique matrice de xénon. Molécules deutérés, HXeOD et DXeOH, ont également été produits.
Clathrates et excimères
En plus des composés où xénon forme une liaison chimique , le xénon peut former clathrates-substances où les atomes de xénon sont piégés par le réseau cristallin d'un autre composé. Un exemple est hydrate de xénon (Xe • 5,75 H 2 O), où des atomes de xénon occupent postes dans un réseau de molécules d'eau. Ce clathrate a un point de 24 ° C de fusion. Le Version deutéré de cet hydrate a également été produit. Tel hydrates de clathrates peuvent se produire naturellement dans des conditions de haute pression, comme dans le lac Vostok sous le Antarctique feuille de glace. formation de clathrate peut être utilisée pour éliminer par distillation fractionnée du xénon, de l'argon et le krypton.
Xénon peut également former composés de fullerène endohédriques, où un atome de xénon est coincé à l'intérieur d'un molécule de fullerène. L'atome de xénon piégé dans le fullerène peut être contrôlé via 129 Xe résonance magnétique (RMN) nucléaire. En utilisant cette technique, les réactions chimiques de la molécule de fullerène peuvent être analysés, en raison de la sensibilité de la déplacement chimique de l'atome de xénon à son environnement. Toutefois, l'atome de xénon a également une influence sur la réactivité électronique du fullerène.
Alors que des atomes de xénon sont à leur état d'énergie du sol, ils se repoussent et ne sera pas former une liaison. Quand les atomes de xénon devient sous tension, cependant, ils peuvent former un excimer (dimère excité) jusqu'à ce que les électrons retournent à la état fondamental. Cette entité est créée parce que l'atome de xénon a tendance à remplir sa plus à l'extérieur couche électronique, et peut brièvement le faire en ajoutant un électron d'un atome de xénon voisin. La durée de vie typique d'un excimer xénon est 1-5 ns, et la désintégration de presse photons avec les longueurs d'onde d'environ 150 et 173 nm. Xénon peut également former des excimères avec d'autres éléments, tels que la halogènes brome , chlore et fluor .
Applications
Bien que le xénon est rare et relativement coûteux à extraire de la l'atmosphère terrestre , il présente un certain nombre d'applications.
Illumination et de l'optique
Lampes à décharge
Le xénon est utilisé dans des dispositifs d'émission de lumière appelées lampes flash au xénon, qui sont utilisés dans et les lampes éclairs stroboscopiques photographiques; à exciter le milieu actif dans lasers qui génèrent ensuite lumière cohérente; et, parfois, dans lampes bactéricides. Le premier à l'état solide laser , inventé en 1960, a été pompé par une lampe flash au xénon, et les lasers utilisés pour la puissance fusion par confinement inertiel sont également pompé par lampes flash au xénon.



Continue, arc court, haute pression lampes à arc xénon ont une température de couleur se rapprochant étroitement midi la lumière du soleil et sont utilisés dans simulateurs solaires. Autrement dit, le chromaticité de ces lampes rapproche étroitement d'une chauffée noir radiateur du corps qui a une température proche de celle observée du Soleil Après qu'ils ont été introduits dans les années 1940, ces lampes ont commencé à remplacer la courte durée lampes à arc de carbone dans les projecteurs de cinéma. Ils travaillent dans typique 35mm, IMAX et le nouveau projecteurs numériques systèmes de projection de film, de l'automobile Phares HID, haut de gamme lampes de poche «tactiques» et autres utilisations spécialisées. Ces lampes à arc sont une excellente source de courte longueur d'onde ultraviolet rayonnement et ils ont émissions intenses dans la proximité infrarouge, qui est utilisé dans certaines Les systèmes de vision nocturne.
Les cellules individuelles dans un affichage à plasma utilise un mélange de xénon et néon qui est converti en un plasma à l'aide électrodes. L'interaction de ce plasma avec les électrodes génère des ultraviolets photons , qui excitent alors la revêtement luminophore sur la face avant de l'écran.
Le xénon est utilisé comme un "gaz starter" à lampes au sodium haute pression. Il a le plus faible conductivité thermique plus faible et potentiel d'ionisation de tous les gaz nobles non radioactifs. En tant que gaz rare, il ne interfère pas avec les réactions chimiques se produisant dans la lampe d'opération. La faible conductivité thermique minimise les pertes thermiques dans la lampe alors que dans l'état de fonctionnement et le faible potentiel d'ionisation provoque la tension de claquage du gaz soit relativement faible à l'état froid, qui permet à la lampe d'être plus facilement commencé.
Lasers
En 1962, un groupe de chercheurs de Laboratoires Bell a découvert l'effet laser dans le xénon, et plus tard trouvé que le gain de laser a été améliorée par l'ajout d' hélium pour le milieu à effet laser. La première laser excimère utilisé un xénon dimère (Xe 2) excité par un faisceau d'électrons pour produire émission stimulée à un rayonnement ultraviolet de longueur d'onde de 176 nm. Le chlorure et le fluorure de xénon xénon ont également été utilisés dans excimère (ou, plus exactement, exciplexe) lasers. Le laser à excimère de chlorure de xénon a été utilisée, par exemple, dans certaines utilisations dermatologiques.
Médical
Anesthésie
Xénon a été utilisé en tant que anesthésie générale. Bien qu'il soit coûteux, appareils d'anesthésie qui peuvent fournir au xénon sont sur le point d'apparaître sur le marché européen, parce que les progrès dans la récupération et le recyclage de xénon ont rendu économiquement viable.
Xenon interagit avec de nombreux récepteurs différents et des canaux ioniques et comme beaucoup d'anesthésiques par inhalation théoriquement multi-modales ces interactions sont susceptibles complémentaire. Le xénon est un glycine site de haute affinité Antagoniste du récepteur NMDA. Toutefois, le xénon se distingue des autres antagonistes des récepteurs NMDA cliniquement utilisés dans son manque de neurotoxicité et la capacité de son pour inhiber la neurotoxicité de la kétamine et l'oxyde nitreux. Contrairement à la kétamine et de l'oxyde nitreux, le xénon ne stimule pas un efflux de la dopamine de la le noyau accumbens. Comme l'oxyde nitreux et le xénon cyclopropane activent le canal domaine potassium deux pores TREK-1. Un canal liées TASK-3 également impliqué dans des actions anesthésiques est insensible au xénon. Xénon inhibe les récepteurs nicotiniques de l'acétylcholine alpha4beta2 qui contribuent à l'analgésie spinale médiation. Le xénon est un inhibiteur efficace de la membrane plasmique de Ca2 + ATPase. Xénon inhibe Ca + ATPase en se liant à un pore hydrophobe à l'intérieur de l'enzyme et la prévention de l'enzyme à partir de l'hypothèse conformations actives.
Le xénon est un inhibiteur compétitif de la sérotonine 5HT3. Bien que ni anesthésie, ni antinociceptives cette activité réduit les nausées et les vomissements anesthésie-émergente.
Xénon a un concentration minimale alvéolaire (MAC) de 72% à 40 ans, ce qui en fait 44% plus puissant que le N 2 O comme anesthésique. Ainsi, il peut être utilisé avec de l'oxygène à des concentrations qui ont un risque plus faible de hypoxie. Contrairement à l'oxyde nitreux (N 2 O), le xénon ne est pas un gaz à effet de serre et ainsi il est également considéré comme écologique. Xenon évacué dans l'atmosphère est d'être renvoyée à sa source d'origine, donc pas d'impact environnemental est probable.
Neuroprotecteur
Xenon induit cardioprotection robuste et neuroprotection par plusieurs une variété de mécanismes d'action. Grâce à son influence sur Ca2 +, K +, KATP \ HIF et NMDA antagonisme xénon est neuroprotecteur lorsqu'il est administré avant, pendant et après les insultes ischémiques. Le xénon est un antagoniste à forte affinité au niveau du récepteur glycine NMDA site.Xenon est cardioprotecteur dans des conditions d'ischémie-reperfusion par induction de préconditionnement pharmacologique non ischémique. Le xénon est cardioprotecteur par l'activation de la PKC epsilon-et-MAPK p38 en aval. Imite xénon neuronale de préconditionnement ischémique en activant ATP canaux potassiques sensibles. Xénon réduit allostérique chaîne médiée par l'inhibition de l'activation de l'ATP indépendamment de la sous-unité receptor1 sulfonylurée, augmentant KATP temps et en fréquence de canal ouvert. Xenon régule hypoxie inducible factor 1 alpha (HIF1A).
A été ajouté gaz xénon comme ingrédient de la mélange de ventilation pour un nouveau-né au Hôpital St. Michael, Bristol, en Angleterre, dont la vie chances ont été par ailleurs très compromise, et a réussi, conduisant à l'autorisation de essais cliniques pour des cas similaires. Le traitement se fait en même temps que refroidir le la température du corps de 33,5 ° C.
Imagerie
Émission gamma de la radio-isotope 133 Xe du xénon peut être utilisé pour imager le cœur, les poumons et le cerveau, par exemple, au moyen de photon unique tomographie d'émission. 133 Xe a également été utilisé pour mesurer le flux sanguin.
Xenon, en particulier de 129 Xe hyperpolarisé, est un agent de contraste utile pour imagerie par résonance magnétique (IRM). Dans la phase gazeuse, il peut être utilisé pour imager l'espace vide comme des cavités dans un échantillon poreux ou alvéoles dans les poumons. Hyperpolarisation rend 129 Xe beaucoup plus détectable via imagerie par résonance magnétique et a été utilisé pour les études des poumons et d'autres tissus. Il peut être utilisé, par exemple, pour suivre le flux de gaz dans les poumons. Parce que le xénon est soluble dans l'eau et dans les solvants hydrophobes aussi, il peut être utilisé pour divers tissus biologiques mous d'image.
Spectroscopie RMN
Parce que de grandes, flexible externe électrons coquille de l'atome, le Changements de spectre RMN en réponse aux conditions environnantes, et peut donc être utilisé comme une sonde pour mesurer les circonstances chimiques autour de l'atome de xénon. Par exemple xénon dissous dans l'eau, le xénon dissous dans un solvant hydrophobe, et le xénon associé à certaines protéines peuvent être distingués par RMN.
Xénon hyperpolarisé peut être utilisé par surface-chimistes. Normalement, il est difficile de caractériser les surfaces utilisant la RMN, parce que les signaux de la surface d'un échantillon seront comblés par des signaux de l'Extrême-plus-de nombreux noyaux atomiques dans la masse. Cependant, spins nucléaires sur des surfaces solides peuvent être polarisés de manière sélective, par transferrering polarisation de spin à eux de gaz xénon hyperpolarisé. Cela rend les signaux de surface assez fortes pour mesurer, et les distingue des signaux en vrac.
Autre
Dans l'énergie nucléaire applications, le xénon est utilisé dans les chambres à bulles, des sondes, et dans d'autres domaines où une haute masse moléculaire et de la nature inerte est souhaitable. Un sous-produit de l'arme nucléaire tests est la libération de radioactive xénon 133 et le xénon-135. La détection de ces isotopes est utilisé pour contrôler le respect nucléaire traités d'interdiction des essais, ainsi que pour confirmer les explosions expérimentales nucléaires par des États tels que la Corée du Nord .

Xénon liquide est utilisé dans pour les mesures de calorimètres les rayons gamma, ainsi qu'un moyen destiné à détecter hypothétique interagissant faiblement particules massives, ou WIMP. Quand un WIMP entre en collision avec un noyau au xénon, il devrait, en théorie, dépouiller un électron et créer un primaire scintillation. En utilisant le xénon, ce sursaut d'énergie pourrait alors être facilement distinguée de manifestations similaires causés par des particules telles que les rayons cosmiques. Cependant, l'expérience au XENON Gran Sasso Laboratoire national en Italie et le Zeplin-II et III-Zeplin expériences au Laboratoire souterrain Boulby au Royaume-Uni ont jusqu'à présent pas réussi à trouver des WIMP confirmés. Même si aucun WIMP sont détectés, les expériences serviront à contraindre les propriétés de la matière noire et certains modèles de physique. Le détecteur de courant à l'installation Gran Sasso a démontré une sensibilité comparable à celle des meilleurs détecteurs cryogéniques, et devrait être la sensibilité accrue par un ordre de grandeur en 2009.
Xenon est le préféré propulseur pour ion de propulsion engin spatial en raison de sa faible par le potentiel d'ionisation poids atomique, et sa capacité à être stockés sous forme liquide à proximité la température ambiante (sous haute pression) encore être facilement reconverti en un gaz pour alimenter le moteur. La nature inerte du xénon, il est respectueux de l'environnement et moins corrosive à un moteur d'ions que d'autres combustibles tels que le mercure ou le césium . A été utilisé pour la première Xenon pour les moteurs ioniques par satellite dans les années 1970. Il a ensuite été utilisé comme propulseur pour de JPL Deep Space 1 de la sonde, de l'Europe SMART-1 la sonde et pour les trois ions moteurs de propulsion de la NASA sur Aube Spacecraft.
Chimiquement, les composés perxenate sont utilisés comme agents d'oxydation en chimie analytique . difluorure de xénon est utilisé comme un agent de gravure de silicium , en particulier dans la production de systèmes micro-électromécaniques (MEMS). Le médicament anticancéreux 5-fluorouracile peut être produit en faisant réagir du difluorure de xénon avec l'uracile. Xénon est également utilisé dans la cristallographie des protéines. Appliqué à des pressions de 0,5 à 5 MPa (5 à 50 atm) à un cristal de protéine, des atomes de xénon se lient de manière prédominante dans les cavités hydrophobes, créant souvent un, isomorphe, dérivé atome lourd de haute qualité, qui peut être utilisé pour résoudre le problème de phase.
Précautions
Beaucoup contenant de l'oxygène xénon composés sont toxiques en raison de leur forte propriétés oxydantes et explosive en raison de leur tendance à se décomposent en xénon, plus élémentaire diatomique oxygène (O2), qui contient des liaisons chimiques beaucoup plus fortes que les composés de xénon.
Gaz xénon peut être conservé en toute sécurité dans des contenants de verre ou de métal scellé normales au température et pression normales. Cependant, il se dissout facilement dans la plupart des plastiques et du caoutchouc, et va progressivement échapper à un récipient scellé avec de tels matériaux. Xenon est non toxique, même si elle ne se dissout dans le sang et appartient à un groupe restreint de substances qui pénètrent dans la barrière hémato-encéphalique, provoquant légère à chirurgicale complète l'anesthésie par inhalation à des concentrations élevées avec de l'oxygène.
À 169 m / s, la vitesse du son dans le gaz xénon est inférieure à celle dans l'air à cause de la plus lente vitesse moyenne des atomes de xénon lourds par rapport aux molécules d'azote et d'oxygène. Par conséquent, le xénon réduit les fréquences de résonance du conduit vocal lorsqu'il est inhalé. Cela produit un timbre de la voix caractéristique réduit, un effet opposé à la voix haut-timbrée causée par l'inhalation d' hélium . Comme l'hélium, le xénon ne satisfait pas les besoins de l'organisme en oxygène. Xenon est à la fois simple asphyxiant et une anesthésie plus puissant que l'oxyde nitreux; par conséquent, de nombreuses universités ne permettent plus le coup de la voix comme une chimie démonstration générale. Que le xénon est cher, le gaz hexafluorure de soufre, qui est similaire au xénon en poids moléculaire (146 contre 131), est généralement utilisé dans cette cascade, et est un asphyxiant sans anesthésie.
Il est possible de respirer en toute sécurité des gaz lourds tels que le xénon ou l'hexafluorure de soufre quand ils sont dans un mélange avec de l'oxygène; l'oxygène comprenant au moins 20% du mélange. Xénon à une concentration de 80% avec 20% d'oxygène produit rapidement la perte de conscience de l'anesthésie générale (et a été utilisé à cet effet, tel que discuté ci-dessus). La respiration de gaz se mélange de différentes densités très efficacement et rapidement de sorte que les gaz plus lourds sont purgés avec de l'oxygène, et ne pas accumuler au fond des poumons. Il ya, cependant, un danger associé à tout gaz lourd en grandes quantités: elle pourra siéger invisible dans un récipient, et si une personne entre dans un récipient rempli d'un gaz incolore et inodore, ils peuvent se trouver à respirer sans le savoir. Xenon est rarement utilisé en quantités suffisamment grandes pour que ce soit un sujet de préoccupation, même si le potentiel de danger existe tout moment un réservoir ou un conteneur de xénon sont conservées dans un espace non ventilé.

