
Germanium
À propos de ce écoles sélection Wikipedia
Enfants SOS bénévoles ont aidé à choisir des articles et faites autre matériel de programme Cliquez ici pour en savoir plus sur le parrainage d'enfants.
| Germanium | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
32 Ge | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||
blanc grisâtre  A 12 g (2x3 cm) bloc polycristallin de Ge avec des surfaces inégales clivées | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | germanium, Ge, 32 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / dʒ ər m eɪ n Je ə m / jər- PEUT -neE-əm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | métalloïde | ||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 14, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 72,63 (1) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ar ] 3d 10 4s 2 4p 2 2, 8, 18, 4 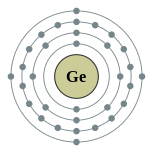 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||
| Prédiction | Dmitri Mendeleev (1871) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Clemens Winkler (1886) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 5,323 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 5,60 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1211,40 K , 938,25 ° C, 1720,85 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 3106 K, 2833 ° C, 5131 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 36,94 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 334 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 23,222 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 4, 3, 2, 1, 0, -1, -2, -3, -4 ( l'oxyde amphotère) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 2,01 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1e: 762 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1537,5 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 3302,1 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 122 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 122 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 211 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | Diamant | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | Diamagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 1 Ω · m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 60,2 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | 6,0 um / (m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 5,400 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 103 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 41 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 75 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,26 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 6.0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-56-4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de bande interdite à 300 K | 0,67 eV | ||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes du germanium | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Le germanium est un élément chimique avec le symbole Ge et de numéro atomique 32. Ce est un brillant, dur, blanc grisâtre dans le métalloïde groupe de carbone, chimiquement similaire à son voisin du groupe de l'étain et de silicium . Germanium purifiée est un semi-conducteurs , avec un aspect plus semblable à du silicium élémentaire. Comme le silicium, le germanium réagit naturellement et forme des complexes avec de l'oxygène dans la nature. Contrairement silicium, il est trop réactif se trouve naturellement sur Terre à l'état (natif) gratuit.
Parce que très peu de minéraux contiennent en haute concentration, le germanium a été découvert relativement tard dans l'histoire de la chimie. Germanium classe presque cinquantenaire l'abondance relative des éléments dans la croûte de la Terre. En 1869, Dmitri Mendeleïev prédit son existence et certaines de ses propriétés en fonction de sa position sur son tableau périodique et a appelé l'élément ekasilicon. Près de deux décennies plus tard, en 1886, Clemens Winkler a estimé le nouvel élément long avec de l'argent et de soufre, dans un minéral rare appelée argyrodite. Bien que le nouvel élément ressemblait un peu à l'arsenic et l'antimoine en apparence, ses ratios combinant dans les composés de l'élément nouveau d'accord avec les prédictions de Mendeleïev pour un parent prévue de silicium. Winkler nommé l'élément après son pays, Allemagne. Aujourd'hui, le germanium est extrait essentiellement de sphalérite (le minerai de zinc primaire), bien que le germanium est également récupéré dans le commerce auprès d'argent , le plomb et le cuivre de minerais.
Germanium "métal" (germanium isolé) est utilisé comme semi-conducteur dans transistors et d'autres dispositifs électroniques. Historiquement la première décennie de l'électronique de semi-conducteurs ont été entièrement basé sur le germanium, bien que sa production pour une telle utilisation est aujourd'hui une petite fraction (2%) de celle du silicium ultra-pur, qui a largement remplacé. Fin majeure de Germanium utilise dans la présente sont fibre optique et des systèmes optique infrarouge. Il est utilisé dans des applications de piles solaires. composés de germanium sont utilisés pour des catalyseurs de polymérisation. Germanium est de trouver une nouvelle utilisation dans nanofils. Germanium forme un grand nombre de des composés organométalliques, tels que tetraethylgermane, qui sont utiles en chimie.
Germanium ne est pas considéré comme un élément essentiel pour tout organisme vivant. Certains composés organiques complexés de germanium sont objet d'une enquête que les produits pharmaceutiques possibles mais aucune n'a eu du succès. Semblable à du silicium et de l'aluminium, les composés du germanium naturelles, qui ont tendance à être insolubles dans l'eau, ont une faible toxicité par voie orale. Cependant, les sels solubles de germanium synthétiques sont composés de germanium chimiquement réactifs néphrotoxiques, et synthétiques avec des halogènes et de l'hydrogène sont irritants et les toxines.
Histoire
Dans son rapport sur le droit périodique des éléments chimiques, en 1869, le chimiste russe Dmitri Ivanovitch Mendeleïev prédit l'existence de plusieurs inconnus éléments chimiques , y compris celui qui comblerait une lacune dans le famille de carbone dans son tableau périodique des éléments, situé entre le silicium et l'étain . En raison de sa position dans son tableau périodique, Mendeleïev a appelé ekasilicon (Es), et il a estimé que ses poids atomique que sur 72,0.
À la mi-1885, dans une mine près de Freiberg, en Saxe, un nouveau minéral a été découvert et nommé argyrodite, en raison de sa haute argent contenu. Le chimiste Clemens Winkler analysé cette nouvelle minérale, qui se est avéré être une combinaison d'argent, de soufre, et un nouvel élément. Winkler a pu isoler ce nouvel élément et l'a trouvé un peu similaire à l'antimoine , en 1886. Avant de Winkler a publié ses résultats sur le nouvel élément, il a décidé qu'il serait nommer son élément le neptunium, depuis la découverte récente de la planète Neptune en 1846 avait été précédé par les prédictions mathématiques de son existence. Cependant, le nom "neptunium" avait déjà été donné à un autre élément chimique proposée (mais pas l'élément qui porte aujourd'hui le nom neptunium , qui a été découvert en 1940), de sorte qu'au lieu, Winkler nommé le nouvel élément germanium (du latin mot, Germania, pour l'Allemagne ) en l'honneur de sa patrie. Argyrodite prouvé empiriquement pour être Ag 8 GeS 6.
Parce que ce nouvel élément a montré quelques similitudes avec le éléments de l'arsenic et l'antimoine, sa place dans le tableau périodique était à l'étude, mais ses similitudes avec prédit élément "la ekasilicon" de Dmitri Mendeleïev a confirmé qu'il appartenait à cet endroit sur le tableau périodique. Avec en outre un matériau de 500 kg de minerai des mines de Saxe, Winkler a confirmé les propriétés chimiques de l'élément nouveau en 1887. Il a également déterminé une masse atomique de 72,32 en analysant tétrachlorure de germanium pur (GeCl4), tandis que Lecoq de 72,3 Boisbaudran déduit par comparaison des lignes dans l'étincelle spectre de l'élément.
Winkler a pu préparer plusieurs nouveaux composés de germanium, y compris ses fluorures, des chlorures, des sulfures, le dioxyde de germanium, et tetraethylgermane (Ge (C 2 H 5) 4), le premier organogermane. Les données physiques de ces composés - qui correspondait bien avec les prédictions de Mendeleïev - ont fait la découverte d'une confirmation importante de l'idée de Mendeleïev élément périodicité . Voici une comparaison entre la prédiction et les données de Winkler:
| Propriété | Ekasilicon | Germanium |
|---|---|---|
| masse atomique | 72,64 | 72,59 |
| Densité (g / cm 3) | 5.5 | 5,35 |
| point de fusion (° C) | élevé | 947 |
| couleur | gris | gris |
| Type d'oxyde | dioxyde réfractaire | dioxyde réfractaire |
| densité d'oxyde (g / cm 3) | 4.7 | 4.7 |
| l'activité de l'oxyde | faiblement base | faiblement base |
| point de chlorure d'ébullition (° C) | moins de 100 | 86 (GeCl 4) |
| densité de chlorure (g / cm 3) | 1,9 | 1,9 |
Jusqu'à la fin des années 1930, le germanium a été pensé pour être un métal mauvais conducteur. Germanium ne est pas devenu économiquement significatif qu'après 1945, lorsque ses propriétés comme un semi-conducteur ont été reconnus comme étant très utile dans l'électronique . Cependant, au cours de la Seconde Guerre mondiale , de petites quantités de germanium ont commencé à être utilisé dans certains spéciaux appareils électroniques , principalement diodes. Sa première grande utilisation a été le point contact diodes Schottky pour radar de détection d'impulsion pendant la guerre. La première alliages silicium-germanium ont été obtenus en 1955. Avant 1945, seulement quelques centaines de kilogrammes de germanium ont été produits dans les usines chaque année, mais à la fin des années 1950, la production mondiale annuelle avait atteint 40 tonnes métriques.
Le développement du germanium transistor en 1948 a ouvert la porte à d'innombrables applications de électronique de l'état solide. De 1950 jusqu'au début des années 1970, cette région a fourni un marché croissant pour le germanium, mais alors silicium de haute pureté a commencé à remplacer germanium dans les transistors, les diodes, et redresseurs. Par exemple, la société qui est devenu Fairchild Semiconductor a été fondée en 1957 dans le but exprès de produire des transistors de silicium. Silicon possède des propriétés électriques supérieures, mais elle exige la pureté beaucoup plus élevé, et cette pureté ne pourrait être atteint dans le commerce dans les premières années de électronique de semi-conducteurs.
Pendant ce temps, la demande de germanium pour une utilisation dans les fibres optiques des réseaux de communication, infrarouge systèmes de vision nocturne, et polymérisation catalyseurs augmenté de façon spectaculaire. Ces utilisations finales représentaient 85% de la consommation de germanium dans le monde entier en 2000. Le gouvernement américain germanium même désigné comme un matériau stratégique et critique, appelant à un 146 tonne (132 t) l'approvisionnement de la réserve nationale de la défense en 1987.
Germanium diffère de silicium en ce que la fourniture de germanium est limitée par la disponibilité de sources exploitables, tandis que la fourniture de silicium ne est limitée que par la capacité de production depuis silicium provient de sable ordinaire ou quartz . En conséquence, tandis que le silicium peut être acheté en 1998 pour moins de 10 $ par kg, le prix de 1 kg de germanium était alors presque 800 $.
Caractéristiques
Sous conditions standard germanium est un blanc argenté, élément semi-métallique fragile. Ce formulaire constitue une allotrope techniquement connu comme α-germanium, qui a un éclat métallique et un diamant structure cristalline cubique, la même que celle du diamant . À des pressions supérieures à 120 kbar, une forme allotropique différente connue en tant que formes de β-germanium, qui a la même structure que β- étain . Avec le silicium, le gallium , le bismuth , l'antimoine , et de l'eau , il est l'un des quelques substances qui se dilate lors de sa solidification (ce est à dire gèle) de son état fondu.
Le germanium est un semi-conducteur . Zone techniques de raffinage ont conduit à la production de germanium cristallin pour semi-conducteurs qui a une impureté d'une seule pièce en 10 10, ce qui en fait l'un des matériaux les plus purs jamais obtenus. Le premier matériau métallique découvert (en 2005) de devenir supraconducteur en présence d'une très forte un champ électromagnétique était alliage de germanium avec de l'uranium et le rhodium.
Germanium pur est connu d'extruder spontanément très longtemps dislocations vis. Ils sont l'une des principales raisons de l'échec des diodes et des transistors plus âgés à base de germanium; en fonction de ce qu'ils finissent par toucher, ils peuvent conduire à une court-circuit électrique.
Chimie
Germanium élémentaire se oxyde lentement à GeO 2 à 250 ° C. Germanium est insoluble dans les acides dilués et alcalis, mais se dissout lentement dans concentré acide sulfurique et réagit violemment avec les alcalis en fusion pour produire germanates ([GeO 3] 2-). Germanium se produit principalement dans le degré d'oxydation 4 bien que de nombreux composés sont connus à l'état d'oxydation de +2. D'autres états d'oxydation sont rares, tel que trouvé dans trois des composés tels que Ge 2 Cl 6, et 3 et 1 observé à la surface des oxydes ou des états d'oxydation négatifs dans germanes, comme dans GeH 4 -4. anions de cluster de Germanium ( Ions Zintl) tels que Ge 4 2-, 4- 9 Ge, Ge 9 2- [(Ge 9) 2] 6 ont été préparés par extraction à partir d'alliages contenant des métaux alcalins et de germanium dans de l'ammoniac liquide en présence de éthylènediamine ou un cryptand. Les états d'oxydation de l'élément dans ces ions ne sont pas des nombres entiers-mêmes à la ozonides O 3 -.
Deux oxydes de germanium sont connues: dioxyde de germanium (GEO 2, germanium) et germanium monoxyde, (GEO). Le dioxyde, GeO 2 peut être obtenue par grillage disulfure de germanium (GeS 2), et est une poudre blanche qui ne est que légèrement soluble dans l'eau mais réagit avec les alcalis pour former des germanates. Le monoxyde de carbone, l'oxyde germaneux, peut être obtenu par la réaction à haute température de GeO 2, de Ge métallique. Le dioxyde de carbone (et les oxydes et germanates connexes) présente la propriété inhabituelle d'avoir un indice de réfraction élevé pour la lumière visible, mais la transparence la lumière infrarouge. Le germanate de bismuth, Bi 4 Ge 3 O 12, (BGO) est utilisé en tant que scintillateur.
Composés binaires avec d'autres chalcogènes sont également connus, tels que le di sulfure de (GeS 2), le di séléniure (GeSe 2), et le monosulfure (SGE), séléniure (GeSe), et tellurure (GeTe). GeS 2 forme un précipité blanc que lorsque le sulfure d'hydrogène est passé à travers des solutions fortement acides contenant du Ge (IV). Le disulfure est sensiblement soluble dans l'eau et dans des solutions d'alcalis ou alcalins caustiques sulfures. Néanmoins, il ne est pas soluble dans l'eau acide, ce qui a permis de découvrir Winkler l'élément. En chauffant le disulfure dans un courant d' hydrogène , le monosulfure (GES) est formée, qui se sublime dans des plaques minces d'un éclat métallique et de couleur sombre, et qui est soluble dans des solutions d'alcalis caustiques. Lors de la fusion avec les carbonates alcalins et de soufre , les composés de germanium forment des sels appelés thiogermanates.
Quatre tétra les halogénures sont connus. Dans des conditions normales GEI est un 4, le FEM 4 un gaz solide et les autres liquides volatils. Par exemple, tétrachlorure de germanium, GeCl 4, est obtenu sous forme d'un liquide incolore bouillant fumant à 83,1 ° C en chauffant le métal avec du chlore. Tous les tétrahalogénures sont facilement hydrolyses au dioxyde de germanium hydraté. GeCl4 est utilisé dans la production de composés d'organogermanium. Les quatre dihalogénures sont connus et à la différence des tétrahalogénures sont des solides polymères. En outre Ge 2 Cl 6 et certains composés plus élevés de formule Ge n Cl 2 n 2 sont connus. Le composé inhabituelle Ge 6 Cl 16 a été préparé qui contient l'unité Ge 5 Cl 12 avec un la structure néopentane.
Germane (GeH 4) est un composé de structure similaire à méthane . Polygermanes composés qui sont similaires à des alcanes de formule Ge n H 2 n 2 contenant jusqu'à cinq atomes de germanium sont connus. Les germanes sont moins volatiles et moins réactifs que leurs analogues de silicium correspondants. Geh 4 réagit avec les métaux alcalins dans l'ammoniaque liquide pour former MGeH cristalline blanche 3 qui contiennent le GeH 3 - anions . Les halohydrates de germanium avec une, deux et trois atomes d'halogène sont des liquides réactifs incolores.
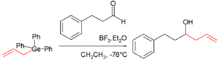
La première organogermanium composé a été synthétisé par Winkler en 1887; la réaction du tétrachlorure de germanium avec diéthylzinc donné tetraethylgermane (Ge (C 2 H 5) 4). Organogermanes du type R 4 Ge (où R est un alkyle ) tels que tetramethylgermane (Ge (CH 3 4)) et sont accessibles par tetraethylgermane moins cher le précurseur de germanium disponibles tétrachlorure de germanium et des nucléophiles d'alkyle. Des hydrures de germanium organique tels que isobutylgermane ((CH 3) 2 CHCH 2 GeH 3) ont été jugés moins dangereux et peut être utilisé comme un substitut liquide pour toxiques gaz germane en semi-conducteurs applications. Beaucoup de germanium intermédiaires réactifs sont connues: germyle radicaux libres, germylènes (similaires à carbènes), et germynes (similaires à carbynes). Le composé organogermanium 2-carboxyethylgermasesquioxane a été signalée pour la première dans les années 1970, et pendant un certain temps a été utilisé comme un supplément diététique et de la pensée d'avoir éventuellement des qualités anti-tumorales.
Isotopes
Le germanium a cinq naturels isotopes , 70 Ge, 72 Ge, 73 Ge, 74 Ge, 76 Ge. Parmi ceux-ci, 76 Ge est très légèrement radioactifs, par décomposition la double désintégration bêta avec une demi-vie de 1,78 × 10 21 ans. 74 Ge est l'isotope le plus commun, ayant une abondance naturelle d'environ 36%. 76 Ge est le moins commun avec une abondance naturelle d'environ 7%. Lorsque bombardés avec des particules alpha, l'isotope 72 Ge va générer stable 77 Se, libérant des électrons de haute énergie dans le processus. Pour cette raison, il est utilisé en combinaison avec de radon batteries nucléaires.
Au moins 27 radio-isotopes ont également été synthétisés allant en masse atomique de 58 à 89. Le plus stable de ces 68 est Ge, par décomposition capture d'électrons avec une demi-vie de 270,95 d. Le moins stable est de 60 Ge avec une demi-vie de 30 mme. Alors que la plupart des radio-isotopes la désintégration de germanium désintégration bêta, 61 et 64 Ge Ge décroissance par β + retardé protons émissions. 84 Ge Ge isotopes à travers 87 présentent aussi mineure β - retardé neutrons chemins émissions de désintégration.
Occurrence
Germanium est créé par nucléosynthèse stellaire, principalement par le s-processus asymptotiques étoiles géantes de la branche. Le s-processus est lent neutrons capture d'éléments plus légers à l'intérieur pulsations géantes rouges étoiles. Germanium a été détecté dans l'atmosphère de Jupiter et dans certaines des étoiles les plus distantes. Son abondance dans la croûte de la Terre est d'environ 1,6 ppm. Il ya seulement quelques minéraux comme argyrodite, briartite, germanite, et renierite qui contiennent des quantités appréciables de germanium, mais pas de gisements exploitables existent pour l'un d'eux. Certains gisements de zinc-cuivre-plomb contiennent suffisamment de germanium ce qu 'il peut être extrait à partir du concentré de minerai final. Un processus d'enrichissement inhabituelle entraîne une forte teneur en germanium dans certaines veines de charbon, qui a été découvert par Victor Moritz Goldschmidt au cours d'une vaste enquête sur les dépôts de germanium. La concentration la plus élevée jamais trouvé était dans le Hartley cendres de charbon avec un maximum de 1,6% de germanium. Les gisements de charbon près de Xilinhaote, Mongolie intérieure, contiennent environ 1600 tonnes de germanium.
Production

A propos de 118 tonnes de germanium ont été produites en 2011 dans le monde, principalement en Chine (80 t), la Russie (5 t) et États-Unis (3 t). Germanium est récupéré comme sous-produit à partir de sphalérite zinc minerais où elle est concentrée dans des quantités allant jusqu'à 0,3%, surtout à partir, d'énormes roches sédimentaires Zn - Pb - Cu (- Ba ) les dépôts et les dépôts de Zn-Pb à carbonate. Les chiffres pour les réserves GE dans le monde ne sont pas disponibles, mais aux États-Unis, il est estimé à 450 tonnes. En 2007 35% de la demande a été satisfaite par le germanium recyclé.
Bien qu'il soit principalement produite à partir de sphalérite, il se trouve également dans l'argent , plomb et cuivre minerais. Une autre source de germanium est cendres volantes de centrales électriques au charbon, qui utilisent le charbon de certains gisements de charbon avec une grande concentration de germanium. Russie et la Chine utilisés comme une source de germanium. Les dépôts de la Russie se trouvent dans l'est loin du pays sur L'île de Sakhaline. Les mines de charbon nord-est de Vladivostok ont également été utilisés comme source de germanium. Les dépôts en Chine sont principalement situés dans le les mines de lignite près Lincang, Yunnan; mines de charbon près de Xilinhaote, Mongolie intérieure sont également utilisés.
| Année | Coût ( $ / kg) |
|---|---|
| 1999 | 1400 |
| 2000 | 1250 |
| 2001 | 890 |
| 2002 | 620 |
| 2003 | 380 |
| 2004 | 600 |
| 2005 | 660 |
| 2006 | 880 |
| 2007 | 1240 |
| 2008 | 1490 |
| 2009 | 950 |
Les concentrés de minerai sont le plus souvent sulfuré; ils sont convertis en le oxydes par chauffage à l'air, dans un processus connu sous le nom torréfaction:
- GeS 2 + 3 O 2 → Geo 2 + 2 SO 2
Une partie du germanium se retrouve dans la poussière produite durant ce processus, tandis que le reste est converti en germanates qui sont lessivés avec le zinc de la cendre par l'acide sulfurique. Après neutralisation seul le zinc reste en solution et le précipité contenant le germanium et d'autres métaux. Après avoir réduit la quantité de zinc dans le précipité par le procédé Waelz , l'oxyde Waelz résidant est lixivié une seconde fois. Le le dioxyde est obtenu comme précipité et converti avec le chlore gazeux ou acide chlorhydrique pour tétrachlorure de germanium, qui a un point d'ébullition bas et peut être séparé par distillation:
- GeO 2 + 4 HCl → GeCl 4 + 2 H 2 O
- GeO 2 + 2 Cl 2 → GeCl 4 + O 2
Tétrachlorure de germanium est soit hydrolysé en l'oxyde (GeO 2) ou purifié par distillation fractionnée et ensuite hydrolysé. Le GeO 2 de grande pureté est maintenant approprié pour la production de verre de germanium. L'oxyde de germanium pur est réduit par la réaction avec l'hydrogène pour obtenir le germanium convient pour les optiques infrarouges ou de l'industrie des semi-conducteurs:
- GeO 2 + H 2 → 2 Ge + 2 H 2 O
Le germanium pour la production d'acier et d'autres procédés industriels est normalement réduite en utilisant du carbone:
- GeO 2 + C → Ge + CO 2
Applications
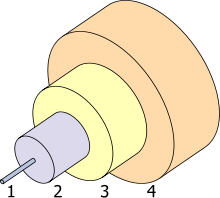
1. Noyau 8 um
2. Bardage 125 um
3. Tampon de 250 um
4. Veste 400 um
La fin principales utilisations du germanium en 2007, dans le monde entier, ont été estimées à: 35% pour les fibres optiques des systèmes, 30% optique infrarouge, de 15% pour catalyseurs de polymérisation, et 15% pour les applications électroniques et électriques solaires. Les 5% restants sont allés dans d'autres utilisations telles que phosphores, la métallurgie, et la chimiothérapie.
Optique
Les caractéristiques physiques les plus remarquables de germanium (GeO 2) sont sa haute indice de réfraction et de son faible dispersion optique. Ceux-ci font qu'il est particulièrement utile pour lentilles de caméra grand-angle, la microscopie et de la partie de noyau de fibres optiques . Il a également remplacé oxyde de titane, la silice dopant de la fibre de silice, ce qui élimine la nécessité d'un traitement thermique ultérieur, ce qui fait que les fibres cassantes. À la fin de 2002, l'industrie de la fibre optique a représenté 60% de l'utilisation de germanium annuelle aux États-Unis, mais cette utilisation représente moins de 10% de la consommation mondiale de large. Est un GeSbTe Matériau à changement de phase utilisé pour ses propriétés optiques, comme dans DVD réinscriptibles.
Parce que le germanium est transparent dans l'infrarouge est un très important Matériau optique infrarouge, qui peut être facilement découpé et poli dans les lentilles et les fenêtres. Il est surtout utilisé comme dans l'optique frontal caméras thermiques travaillant dans le 8-14 micron gamme de longueur d'onde pour l'imagerie thermique passive et pour la détection des points chauds dans le domaine militaire, nuit système de vision dans les voitures, et d'incendie applications. Il est donc utilisé dans l'infrarouge spectroscopes et autres équipements optiques extrêmement sensibles qui nécessitent des détecteurs à infrarouge. Le matériau a une très haute indice de réfraction (4.0) et doit donc être enduit anti-reflet. En particulier, un revêtement antireflet très dur spécial de carbone de type diamant (DLC), indice de réfraction 2,0, est un bon match et produit une surface dure comme du diamant qui peut résister à beaucoup mauvais traitements de l'environnement.
Électronique
Les alliages de silicium-germanium deviennent rapidement un matériau semi-conducteur importante, pour une utilisation dans des circuits intégrés à grande vitesse. Circuits utilisant les propriétés des jonctions Si-SiGe peuvent être beaucoup plus rapides que ceux utilisant du silicium seul. Silicium-germanium commence à remplacer arséniure de gallium (GaAs) dans les appareils de communication sans fil. Les puces SiGe, avec des propriétés à grande vitesse, peuvent être faites avec des techniques de production à faible coût, bien établies de la puce de silicium industrie.
La récente hausse des coûts de l'énergie a amélioré l'économie de panneaux solaires, un nouvel usage important potentiel du germanium. Le germanium est le substrat de plaquettes à haut rendement cellules photovoltaïques à jonctions multiples pour les applications spatiales.
Parce que le germanium et arséniure de gallium ont des constantes de réseau très similaires, substrats de germanium peut être utilisé pour fabriquer l'arséniure de gallium cellules solaires. Les Mars Exploration Rovers et plusieurs satellites utilisent jonction triple arséniure de gallium sur les cellules germanium.
Substrats de germanium sur isolant sont considérées comme un remplacement potentiel de silicium sur les puces miniaturisées. D'autres utilisations de l'électronique comprennent phosphores dans les lampes fluorescentes, à base de germanium et de diodes d'émission de lumière à semi-conducteurs (LED). transistors au germanium sont encore utilisés dans certains pédales d'effets par des musiciens qui souhaitent reproduire le caractère tonal distinctif de la "Fuzz" -tone du début rock and roll époque, notamment le Dallas Arbiter Visage Fuzz.
D'autres utilisations

le dioxyde de germanium est également utilisé dans les catalyseurs pour polymérisation dans la production de polyéthylène téréphtalate (PET). La brillance élevée du polyester produit est surtout utilisé pour les bouteilles en PET commercialisés dans le Japon . Cependant, aux États-Unis, le germanium ne est utilisé pour les catalyseurs de polymérisation. En raison de la similitude entre la silice (SiO 2) et de dioxyde de germanium (GeO 2), la phase stationnaire de la silice dans certaines colonnes de chromatographie en phase gazeuse peuvent être remplacés par GeO 2.
Au cours des dernières années a connu germanium utilisation croissante dans les alliages de métaux précieux. En alliages d'argent sterling, par exemple, il a été trouvé pour réduire firescale, augmenter ternir la résistance, et d'augmenter la réponse de l'alliage à durcissement par précipitation. Un alliage en argent sterling ternir, marque déposée Argentium, nécessite 1,2% de germanium.
Germanium de haute pureté détecteurs monocristallines peuvent identifier précisément les sources de rayonnement-exemple dans la sécurité de l'aéroport. Le germanium est utile pour monochromateurs pour lignes de lumière utilisé dans monocristal la diffusion des neutrons et synchrotron diffraction des rayons X. La réflectivité a des avantages sur le silicium et des neutrons haute énergie applications X-ray. Cristaux de germanium de haute pureté sont utilisés dans des détecteurs pour spectroscopie gamma et la recherche de la matière noire .
Les compléments alimentaires, développement pharmaceutique, et dangereux pour la santé
Germanium ne est pas considéré comme essentiel à la santé des plantes ou des animaux. Germanium dans l'environnement a un impact peu ou pas de la santé. Ce est principalement parce qu'il se produit habituellement seulement comme un oligo-élément dans les minerais et des matières carbonées, et est utilisé en très petites quantités qui ne sont pas susceptibles d'être ingéré, dans ses diverses applications industrielles et électroniques. Pour des raisons similaires, germanium dans les utilisations finales a peu d'impact sur l'environnement comme un danger biologique. Certains composés intermédiaires réactifs de germanium sont toxiques (voir les précautions ci-dessous).
Dès 1922, les médecins aux États-Unis ont utilisé la forme inorganique du germanium (généralement le sesquioxyde) pour traiter les patients atteints d'anémie . Il a été utilisé dans d'autres formes de traitements comme un stimulant du système immunitaire supposée du système, mais son efficacité est douteuse. Son rôle dans traitements contre le cancer a été débattu, avec l'American Cancer Society affirmant qu'aucun effet anticancéreux ont été démontrés. La recherche Food and Drug Administration des États-Unis a conclu que le germanium, lorsqu'il est utilisé comme supplément nutritionnel, "présente le potentiel humain danger pour la santé ".
Certains composés de germanium sont disponibles en faible dose aux États-Unis que sans ordonnance alimentaire «suppléments» dans des capsules orales ou des comprimés. D'autres composés de germanium ont été administrées par des médecins alternatives comme des solutions injectables non-FDA-autorisées. Formes inorganiques solubles de germanium utilisés dans un premier temps notamment le sel, citrate-lactate, ont conduit à un certain nombre de cas de rénale dysfonctionnement, une stéatose hépatique et périphérique neuropathie chez les personnes qui les utilisent sur une base chronique. Les concentrations plasmatiques et de l'urine germanium dans ces personnes, plusieurs d'entre eux sont morts, étaient de plusieurs ordres de grandeur supérieurs niveaux endogènes. Une forme organique plus récente, bêta-CarboxyethylGermanium sesquioxyde ( propagermanium), n'a pas montré le même spectre d'effets toxiques.
Certains composés de germanium ont une faible toxicité pour les mammifères , mais avoir des effets toxiques contre certaines bactéries . Toutefois, aucun composé de germanium a encore démontré une utilisation pharmaceutique, soit comme un antibactérien ou un cancer agent chimiothérapeutique.
Précautions pour les composés de germanium chimiquement réactifs
Certains des composés de germanium sont très réactifs et présentent un danger immédiat pour la santé humaine de l'exposition. Par exemple, le chlorure de germanium et germane (GeH 4) sont un liquide et de gaz, respectivement, qui peut être très irritant pour les yeux, la peau, les poumons et de la gorge.

