
Tantale
À propos de ce écoles sélection Wikipedia
SOS Enfants, un organisme de bienfaisance de l'éducation , a organisé cette sélection. Voir http://www.soschildren.org/sponsor-a-child pour connaître le parrainage d'enfants.
| Tantale | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
73 Ta | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
gris bleu  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | le tantale, Ta, 73 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / t æ n t əl ə m / -Əm de TAN; précédemment / t æ n t æ l Je ə m / tan- TAL -ee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | métal de transition | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 5, 6, ré | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 180,94788 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 14 5d 3 6s 2 2, 8, 18, 32, 11, 2 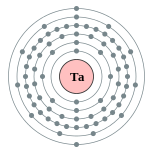 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Anders Gustaf Ekeberg (1802) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reconnu comme un distincte élément par | Heinrich Rose (1844) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 16,69 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 15 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 3290 K , 3017 ° C, 5463 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 5731 K, 5458 ° C, 9856 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 36,57 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 732,8 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 25,36 J · mol -1 .K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 5, 4, 3, 2, -1 (légèrement acide oxyde) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,5 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 761 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1500 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 146 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 170 ± 20 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique centré  α-Ta | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
quadrilatère  β-Ta | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 131 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 57,5 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 6,3 pm · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 3,400 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 186 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 69 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 200 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 6.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 873 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 800 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-25-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de tantale | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le tantale est un élément chimique avec le symbole Ta et de numéro atomique 73. Auparavant connu sous le tantale, le nom vient de Tantale, un personnage de la mythologie grecque. Le tantale est une maladie rare, dur, gris-bleu, lustré métal de transition qui est très résistant à la corrosion. Il fait partie de la groupe des métaux réfractaires, qui sont largement utilisés en tant que composants mineurs dans les alliages. L'inertie chimique du tantale en fait une substance utile à l'équipement de laboratoire et un substitut de platine , mais son utilisation principale en est aujourd'hui condensateurs au tantale en électronique équipements tels que les téléphones mobiles , lecteurs de DVD, systèmes de jeux vidéo et les ordinateurs . Tantale, toujours avec l'chimiquement similaire niobium , se produit dans les minéraux tantalite, colombite et coltan (un mélange de colombite et tantalite).
Histoire
Tantale a été découvert en Suède en 1802 par Anders Ekeberg. Un an plus tôt, Charles Hatchett avait découvert l'élément niobium . En 1809, le chimiste anglais William Hyde Wollaston comparé les oxydes dérivés à la fois columbium- columbite, avec une densité de 5,918 g / cm 3, et tantale tantalite, avec une densité de 7,935 g / cm 3, et a conclu que les deux oxydes, en dépit de leur différence de densité mesurée, étaient identiques. Il a décidé de garder le nom de tantale. Après Friedrich Wöhler a confirmé ces résultats, on a pensé que le niobium et le tantale sont le même élément. Cette conclusion a été contestée en 1846 par le chimiste allemand Heinrich Rose, qui ont fait valoir qu'il y avait deux éléments supplémentaires dans l'échantillon de tantalite, et il les nommés d'après les enfants de Tantalus: niobium (à partir Niobe, la déesse de larmes), et pelopium (de Pélops). L'élément "pelopium" supposé a ensuite été identifié comme étant un mélange de tantale et le niobium, et on a constaté que le niobium est identique à la columbium déjà découvert en 1801 par Hatchett.
Les différences entre le tantale et le niobium ont été démontrées sans équivoque en 1864 par Christian Wilhelm Blomstrand, et Henri Sainte-Claire Deville, ainsi que par Louis J. Troost, qui a déterminé les formules empiriques de certains de leurs composés en 1865. Une autre confirmation est venue du chimiste suisse Jean Charles Galissard de Marignac, en 1866, qui a prouvé qu'il n'y avait que deux éléments. Ces découvertes scientifiques ne ont pas cessé de publier des articles à propos de la soi-disant ilmenium jusqu'en 1871. De Marignac fut le premier à produire la forme métallique de tantale en 1864, quand il le chlorure de tantale réduite par chauffage dans une atmosphère d' hydrogène . Les premiers enquêteurs avaient été seulement en mesure de produire le tantale impur, et le premier métal ductile relativement pur a été produit par Werner von Bolton en 1903. Fils faites de tantale métallique ont été utilisés pour filaments d'ampoules jusqu'à tungstène remplacés dans l'utilisation généralisée.
Le nom de tantale a été dérivé du nom de la mythologie Tantale, le père de Niobe dans la mythologie grecque . Dans l'histoire, il avait été puni après la mort en étant condamné à se tenir jusqu'aux genoux dans l'eau avec fruit parfait croissante dessus de sa tête, qui tous deux éternellement lui Tantale. (Se il se pencha pour boire de l'eau, il drainé dessous du niveau qu'il pouvait atteindre, et se il atteint pour les fruits, les branches déplacé hors de sa portée.) Ekeberg a écrit "Ce métal que je appelle le tantale ... en partie en faisant allusion à son incapacité , lorsqu'il est immergé dans de l'acide, pour absorber tout et d'être saturé ".
Pendant des décennies, la technologie commerciale pour séparer le tantale niobium impliqué la cristallisation fractionnée de potassium heptafluorotantalate loin de potassium oxypentafluoroniobate monohydrate, un processus qui a été découvert par Jean Charles Galissard de Marignac en 1866. Cette méthode a été supplanté par extraction par solvant à partir de solutions contenant du fluorure de tantale.
Caractéristiques
Propriétés physiques
Tantale est sombre (bleu-gris), dense, ductile, très dur, facile à fabriquer et très conducteur de la chaleur et de l'électricité. Le métal est réputé pour sa résistance à la corrosion par les acides ; en fait, à des températures inférieures à 150 ° C le tantale est presque complètement à l'abri à l'attaque par l'normalement agressive l'eau régale. Il peut être dissous avec de l'acide fluorhydrique ou des solutions acides contenant du ion fluorure et le trioxyde de soufre, ainsi que par une solution de l'hydroxyde de potassium. Haute température de fusion de tantale de 3017 ° C (point d'ébullition 5458 ° C) ne est dépassée que par le tungstène , le rhénium et l'osmium pour les métaux et le carbone .
Tantale existe sous deux phases cristallines, alpha et bêta. La phase alpha est relativement ductile et douce; il a une structure cubique centrée ( groupe d'espace Im3m, constante de réseau a = 0,33058 nm), Dureté Knoop 200-400 HN et résistivité électrique de 15 à 60 μΩ ּ cm. La phase bêta est dur et cassant; la symétrie du cristal est quadratique (groupe d'espace P42 / MNM, a = 1,0194 nm, c = 0,5313 nm), la dureté Knoop est 1000-1300 HN et la résistivité électrique est relativement élevée au cm de 170-210 μΩ. La phase bêta est métastable et se transforme en la phase alpha lors du chauffage à 750 à 775 ° C. Tantale vrac est la phase alpha presque entièrement, et la phase bêta existe habituellement des films minces obtenus par magnétron pulvérisation cathodique, dépôt chimique en phase vapeur ou dépôt électrochimique à partir d'un solution de sel en fusion eutectique.
Propriétés chimiques
formes de tantale oxydes avec les états d'oxydation 5 (Ta 2 O 5) et quatre (Tao 2). L'état d'oxydation le plus stable est 5, le pentoxyde de tantale. Le pentoxyde de tantale est le matériau de départ pour plusieurs composés du tantale. Les composés sont créés par dissolution du pentoxyde base hydroxyde solutions ou par fusion dans un autre oxyde métallique. De tels exemples sont tantalate de lithium (LiTaO 3) et le lanthane tantalate (latão 4). Dans le tantalate de lithium, le tantalate ion TAO -
3 ne se produit pas; à la place, cette partie de la formule représente liaison de Tao 7-
6 octaèdres pour former une tridimensionnel cadre perovskite; tandis que le tantalate de lanthane contient seul TaO 3-
4 groupes tétraédriques.
Les fluorures de tantale peuvent être utilisés pour sa séparation de niobium. Tantale forme des composés halogènes dans les états d'oxydation de 5, 4, 3 et du type taxe de 5, taxe de 4, 3 et fiscales, bien que complexes multi-cœur et composés substoechiométriques sont également connus. Pentafluorure de tantale (TAF 5) est un solide blanc avec un point de 97,0 ° C de fusion et le pentachlorure de tantale (TaCl 5) est un solide blanc avec un point de 247,4 ° C de fusion. Est le pentachlorure de tantale hydrolysé par l'eau et réagit avec le tantale supplémentaire à des températures élevées en formant le noir et très le tétrachlorure de tantale hygroscopique (TaCl 4). Bien que les composés trihalogène peuvent être obtenus par réduction des pentahalogenes avec de l'hydrogène, les composés dihalogénés ne existent pas. Il se forme un alliage de tantale-tellure quasicristaux. composés de tantale avec les États aussi faibles que -1 d'oxydation ont été signalés en 2008.
Semblable à la plupart des autres métaux réfractaires, les composés les plus durement connus de tantale sont ses nitrures et carbures stables. Carbure de tantale, tac, comme le plus communément utilisé le carbure de tungstène, est une céramique très dur qui est utilisé dans les outils de coupe. Tantale (III) de nitrure est utilisée comme isolant à film mince, dans certains procédés de fabrication microélectroniques. Les chimistes de la Los Alamos National Laboratory aux États-Unis ont développé une tantale carbure graphite matériau composite qui est l'un des matériaux les plus durs toujours synthétisées. Chercheurs coréens ont développé un alliage de tantale-tungstène-cuivre amorphe plus souple et deux à trois fois plus forte que les alliages d'acier couramment utilisés. Il ya deux aluminiures de tantale, Taal 3 et Ta 3 al. Ceux-ci sont stables, réfractaire, et réfléchissant, et ils ont été proposés en tant que revêtements pour utilisation dans miroirs d'ondes infrarouges.
Isotopes
Tantale naturel se compose de deux isotopes : 180m Ta (0,012%) et 181 Ta (99,988%) 181 Ta est un. isotope stable 180m Ta (m désigne un état métastable) est prévu à la pourriture de trois façons.: à la transition isomérique état fondamental de 180 Ta, désintégration bêta à 180 W , ou la capture d'électrons à 180 Hf . Cependant, la radioactivité de cette isomère nucléaire n'a jamais été observé. Seule une limite inférieure de sa demi-vie de plus de 10 15 ans est. L'état de 180 Ta du sol a une demi-vie de seulement 8 heures. 180m Ta est le lieu uniquement naturellement isomère nucléaire (hors nucléides court vie radiogéniques et cosmogéniques). Ce est aussi la plus rare isotope dans l'Univers, en tenant compte de l'abondance élémentaire du tantale et l'abondance isotopique de 180m Ta dans le mélange naturel d'isotopes (et encore l'exclusion de nucléides de courte vie radiogéniques et cosmogéniques).
Le tantale a été étudiée en théorie comme une " salage "matériel pour des armes nucléaires ( cobalt est le matériau de salage hypothétique mieux connu). Une coquille externe de 181 Ta serait irradiée par l'intensif à haute énergie flux de neutrons d'une arme nucléaire explosant hypothétique. Cela transmuter le tantale dans le radioactifs Ta isotope 182, qui a une demi-vie de 114,4 jours et produit rayons gamma avec environ 1,12 millions d'électron-volts (MeV) d'énergie chacun, ce qui augmenterait considérablement la radioactivité de la les retombées nucléaires de l'explosion pendant plusieurs mois. Ces armes "salé" ne ont jamais été construits ou testé, dans la mesure où est publiquement connu, et certainement jamais utilisé comme armes.
Occurrence

Le tantale est estimé pour compenser environ 1 2 ppm ou ppm de la Terre de la croûte en poids. Il existe de nombreuses espèces de minéraux tantale, dont certains seulement sont à ce jour utilisés par l'industrie comme matières premières: tantalite, ULM, wodginite, euxénite, polycrase. Tantalite ( Fe , Mn ) Ta 2 O 6 est le minéral le plus important pour l'extraction du tantale. Tantalite a la même structure minérale colombite ( Fe , Mn ) (Ta, Nb ) 2 O 6; quand il ya plus de Ta Nb il est appelé tantalite et quand il ya plus Nb de Ta est-il appelé colombite (ou niobite). La haute densité de tantale et d'autres minéraux contenant du tantale rend l'utilisation de la séparation gravitationnelle de la meilleure méthode. Autres minéraux comprennent samarskite et fergusonite.
L'extraction minière primaire de tantale est en Australie , où le plus grand producteur, Global Metals avancée, anciennement connu sous le nom Talison minéraux, exploite deux mines en Australie occidentale, Greenbushes dans le Sud-Ouest et Wodgina dans le Région de Pilbara. La mine Wodgina a été rouvert en Janvier 2011, après l'exploitation minière sur le site a été suspendu à la fin de l'année 2008 en raison de la crise financière mondiale. Moins d'un an après sa réouverture, Global Metals avancée a annoncé qu'en raison de nouveau "... fléchissement de la demande de tantale ...", et d'autres facteurs, les opérations minières de tantale devaient cesser à la fin de Février 2012. Wodgina produit une tantale primaire concentré qui est encore amélioré à l'opération Greenbushes avant d'être vendus à des clients. Alors que les grands producteurs de niobium sont le Brésil et le Canada , le minerai, il donne également un petit pourcentage de tantale. D'autres pays tels que la Chine , l'Ethiopie et le Mozambique minerais de la mine avec un pourcentage plus élevé de tantale, et ils produisent un pourcentage important de la production mondiale de celui-ci. Le tantale est également produite en Thaïlande et la Malaisie en tant que sous-produit de l' étain minière il. Pendant la séparation gravitationnelle des minerais de dépôts alluvionnaires, non seulement est Cassitérite (SnO 2) a trouvé, mais un petit pourcentage de tantalite également inclus. Les scories des fonderies d'étain contient alors quantités économiquement utiles de tantale, qui est lessivé de la scorie. Sources futures d'approvisionnement en tantale, par ordre de taille estimée, sont explorées en Arabie Saoudite , l'Egypte , le Groenland , la Chine , le Mozambique , le Canada , l'Australie , le Royaume-Unis , la Finlande et le Brésil .
Le coltan, le nom industriel pour une columbite- tantalite minérale à partir de laquelle le niobium (c.-à-niobium) et le tantale sont extraites, peut également être trouvée dans l'Afrique centrale , ce est pourquoi le tantale est liée à la guerre en République démocratique du Congo (anciennement Zaïre). Selon un Octobre 23, 2003 des Nations Unies rapport, la contrebande et l'exportation du coltan a contribué à alimenter la guerre au Congo, une crise qui a abouti à environ 5,4 millions de décès depuis 1998 - ce qui en fait le plus meurtrier conflit documentée du monde depuis la Seconde Guerre mondiale . Questions éthiques ont été soulevées concernant le comportement responsable des entreprises, les droits humains et la faune en danger, en raison de l'exploitation des ressources comme le coltan dans les régions du bassin du Congo de conflit armé. Cependant, bien qu'il soit important pour l'économie locale au Congo, la contribution de l'exploitation du coltan au Congo à l'offre mondiale de tantale est généralement faible. Le Rapports United States Geological Survey dans son annuaire que cette région a produit un peu moins de 1% de la production de tantale dans le monde en 2002-2006, avec un pic à 10% en 2000 et 2008.
On estime qu'il ya moins de 50 ans reste des ressources tantale, basée sur l'extraction au rythme actuel, ce qui démontre la nécessité d'accroître le recyclage .
La production et la fabrication
Plusieurs étapes sont impliquées dans l'extraction de tantale de tantalite. Tout d'abord, le minéral est écrasé et on concentre par la séparation par gravité. Ce est généralement réalisée à proximité de la mine de place. Traitement ultérieur par séparation chimique est généralement effectuée en traitant le minerai avec un mélange de de l'acide fluorhydrique et l'acide sulfurique à plus de 90 ° C. Ces réactifs se dissolvent les oxydes de tantale et de niobium pour donner fluorures complexes, qui peuvent être séparés à partir de impuretés et de l'autre:
- Ta 2 O 5 + 14 HF → 2 H 2 [TaF 7] 5 + H 2 O
- Nb 2 O 5 + 10 HF → 2 H 2 [NbOF 5] 3 + H 2 O
La première séparation à l'échelle industrielle, développé par de Marignac, utilisé la différence de solubilité entre les niobium et de tantale fluorures complexes K 2 [NbOF 5] • H 2 O (oxypentafluoroniobate potassium monohydraté) et K 2 [TaF 7] ( heptafluorotantalate de potassium) dans l'eau. De nouveaux procédés utilisent l'extraction liquide des fluorures solution aqueuse par des solvants organiques tels que cyclohexanone. Les niobium et de tantale fluorures complexes sont extraits séparément du solvant organique à l'eau, et soit précipité par l'addition de le fluorure de potassium pour produire un complexe de fluorure de potassium, ou précipité avec de l' ammoniac en tant que pentoxyde:
- H 2 [TaF 7] + KF 2 → K 2 [TaF 7] ↓ + 2 HF
- 2 H 2 [TaF 7] + 14 NH 4 OH → Ta 2 O 5 + ↓ 14 NH 4 F + 9 H 2 O
Le purifiée K 2 [TaF 7] est généralement traitée par réduction avec fusion sodium pour produire une poudre de tantale grossière.
En termes de fabrication, tous les soudage de tantale doit être fait dans une atmosphère inerte de l'argon ou de l'hélium afin de protéger de toute contamination avec les gaz atmosphériques. Le tantale est pas soudable. Grincement de tantale est difficile, particulièrement pour le tantale recuit. Dans l'état recuit, le tantale est extrêmement ductile et peut être facilement réalisé sous forme de tôles.
Applications
Électronique

La principale utilisation de tantale, comme la poudre métallique, est dans la production de composants électroniques, notamment condensateurs et certains de haute puissance résistances. Tantale condensateurs électrolytiques exploitent la tendance de tantale pour former une protection couche d'oxyde de surface, utilisant de la poudre de tantale, pressé dans une forme de pastille, comme une "plaque" de condensateur, l'oxyde comme le diélectrique, et une solution électrolytique solide conducteur ou l'autre comme "plaque". Parce que le couche diélectrique peut être très mince (plus mince que la couche analogue à, par exemple, un condensateur électrolytique en aluminium), une haute capacité peut être obtenue dans un petit volume. En raison de la taille et de poids avantages, les condensateurs au tantale sont attrayants pour les téléphones portables, les ordinateurs personnels , et l'électronique automobile.
Alliages
Le tantale est également utilisé pour produire une variété de alliages qui ont des points de fusion élevés, sont forts et ont une bonne ductilité. Allié avec d'autres métaux, il est également utilisé dans la fabrication des outils en carbure pour l'équipement de travail des métaux et dans la production de superalliages pour les composants de moteurs d'avions, de l'équipement de procédé chimique, réacteurs nucléaires, et des pièces de missiles. En raison de sa ductilité, de tantale peut être aspiré dans les fils ou filaments fins, qui sont utilisés pour l'évaporation de métaux tels que l' aluminium . Comme il résiste à l'attaque par les fluides corporels et est non irritant, le tantale est largement utilisé dans la fabrication d'instruments chirurgicaux et d'implants. Par exemple, des revêtements de tantale poreux sont utilisés dans la construction des implants orthopédiques en raison de la capacité de tantale pour former une liaison directe au tissu dur.
Le tantale est inerte contre la plupart des acides, à l'exception l'acide fluorhydrique et chaude de l'acide sulfurique , aussi chaude solutions alcalines provoquent le tantale se corroder. Cette propriété permet un métal idéal pour les navires et les tuyaux de réaction chimique pour liquides corrosifs. Échange de chaleur bobines pour le chauffage de vapeur d'acide chlorhydrique sont fabriqués à partir de tantale. Le tantale a été largement utilisé dans la production de ultra haute fréquence tubes électroniques pour émetteurs radio. Le tantale est capable de capturer l'oxygène et de l'azote en formant des nitrures et des oxydes et contribue à maintenir le vide élevé nécessaire pour les tubes par conséquent.
D'autres utilisations
Le point de fusion élevé et de résistance à l'oxydation conduit à l'utilisation du métal dans la production de pièces de four sous vide. Le tantale est extrêmement inerte et est donc formé dans une variété de corrosion résistants pièces, telles que des doigts de gant, corps de vanne, et les attaches de tantale. En raison de sa forte densité, charge creuse et doublures de façon explosive pénétrateurs formés ont été construits à partir de tantale. Tantale augmente considérablement les capacités de pénétration d'armure d'une charge creuse en raison de sa haute densité et point de fusion élevé. Il est aussi parfois utilisé dans précieuses montres par exemple de Audemars Piguet, Hublot, Mont Blanc, Omega, et Panerai. Le tantale est également hautement bio-inerte et est utilisé comme matériau d'implant orthopédique. L'élasticité de tantale en fait un matériau idéal pour les remplacements de la hanche à éviter le stress blindage. L'oxyde est utilisé pour fabriquer spéciale de haut l'indice de réfraction du verre pour lentilles de caméra.
Précautions
Composés contenant du tantale sont rarement rencontrés dans le laboratoire. Le métal est hautement biocompatible et est utilisé pour le corps implants et revêtements, donc une attention peuvent se concentrer sur d'autres éléments ou la nature physique du composé chimique . Une seule étude est la seule référence dans la littérature reliant tantale locale sarcomes. L'étude a été cité dans Monographie du CIRC vol. 74 qui comprend la «Note au lecteur» suivante: «L'inclusion d'un agent dans les monographies ne signifie pas que ce est un cancérogène, seulement que les données publiées ont été examinés. "

