
Protactinium
À propos de ce écoles sélection Wikipedia
SOS croit que l'éducation donne une meilleure chance dans la vie des enfants dans le monde en développement aussi. Une bonne façon d'aider d'autres enfants est de parrainer un enfant
| Protactinium | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
91 Pa | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||
lustre métallique brillant, argenté  | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | protactinium, Pa, 91 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / ˌ p r oʊ t æ k t ɪ n Je ə m / PROH -tak- TIN -ee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | actinides | ||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 7, fa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 231,03588 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Rn ] 5f 2 6d 1 7s 2 2, 8, 18, 32, 20, 9, 2 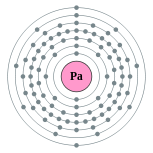 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||
| Prédiction | Dmitri Mendeleev (1869) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | William Crookes (1900) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | William Crookes (1900) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Nommé par | Otto Hahn et Lise Meitner (1917-8) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 15,37 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1841 K , 1568 ° C, 2854 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | ? 4300 K,? 4027 ° C,? 7280 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 1 2 3 4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 481 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 2, 3, 4, 5 (Faiblement oxyde de base) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,5 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 568 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 163 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 200 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | quadrilatère  | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (0 ° C) 177 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 47 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-13-3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes du protactinium | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Protactinium est un élément chimique avec le symbole Pa et de numéro atomique 91. Ce est un métal gris argenté dense qui réagit facilement avec l'oxygène , la vapeur d'eau et inorganiques acides . Il forme divers composés chimiques où protactinium est habituellement présent dans l' état d'oxydation 5, mais peut aussi prendre quatre et même deux ou trois états. Les concentrations moyennes de protactinium dans la croûte terrestre est typiquement de l'ordre de quelques parties par billion, mais peuvent atteindre jusqu'à quelques parties par million dans certains gisements de minerai uraninite. En raison de sa rareté, radioactivité élevée et de haute toxicité, il n'y a actuellement aucun utilisations pour le protactinium en dehors de la recherche scientifique, et à cet effet, le protactinium est principalement extraites de passé combustible nucléaire.
Protactinium a été identifié en 1913 par Kasimir et Fajans Oswald Helmuth Göhring et nommé Brevium raison de la courte demi-vie du spécifique isotopes étudiés, à savoir protactinium-234. Un isotope plus stable (231 Pa) de protactinium a été découvert en 1917-1918 par Otto Hahn et Lise Meitner, et ils ont choisi le nom proto-actinium, mais le UICPA nommé finalement Protactinium en 1949 et confirmé Hahn et Meitner comme découvreurs. Le nouveau nom signifie «mère de l'actinium »et reflète le fait que l'actinium est un produit de la désintégration radioactive du protactinium.
La plus longue durée de vie et le plus abondant (près de 100%) d'origine naturelle isotopique du protactinium, protactinium-231, a une demi-vie de 32760 années et est un produit de désintégration du uranium-235. Beaucoup plus faibles traces de la courte durée de vie isomère nucléaire protactinium 234m se produisent dans la chaîne de désintégration de l'uranium-238. Protactinium-233 résulte de la désintégration de thorium -233 dans le cadre de la chaîne d'événements utilisés pour produire l'uranium 233 par irradiation neutronique de thorium-232. Il repose-thorium est un produit intermédiaire désiré dans réacteurs nucléaires et est donc retirés de la zone active du réacteur pendant le processus de reproduction. L'analyse des concentrations relatives des différents uranium, le thorium et le protactinium isotopes dans l'eau et les minéraux est utilisé dans datation radiométrique des sédiments qui sont jusqu'à 175.000 ans et dans la modélisation de divers processus géologiques.
Histoire
En 1871, Dmitri Mendeleïev prédit l'existence d'un élément entre le thorium et l'uranium . Le groupe d'élément actinide ne était pas connu à l'époque. Par conséquent, l'uranium a été positionné au-dessous de tungstène , le zirconium et le thorium en dessous, en laissant l'espace vide au-dessous de tantale, et jusqu'aux années 1950 tableaux périodiques ont été publiés avec cette structure. Pendant longtemps les chimistes cherché eka-tantale comme un élément avec des propriétés chimiques similaires que le tantale, faire une découverte de protactinium presque impossible.
En 1900, William Crookes isolé protactinium comme matériau fortement radioactive de l'uranium; Toutefois, il ne pouvait pas caractériser comme un nouvel élément chimique et ainsi nommé il uranium-X. Crookes dissous nitrate d'uranium dans de l'éther , la phase aqueuse résiduelle contient plus de 234
90 e et 234
91 Pa. Sa méthode était encore utilisé dans les années 1950 pour isoler 234
90 e et 234
91 Pa à partir de composés d'uranium. Protactinium a été identifié pour la première en 1913, lorsque Kasimir Fajans et Oswald Helmuth Göhring rencontrés l'isotope 234 Pa pendant leurs études des chaînes de désintégration de l'uranium-238: 238
92 U → 234
90 Th → 234
91 Pa → 234
92 U. Ils ont appelé le nouvel élément Brevium (du mot latin, brevis, ce qui signifie brève ou court) en raison de sa courte demi-vie, 6,7 heures pour 234
91 Pa. En 1917-1918, deux groupes de scientifiques, Otto Hahn et Lise Meitner de l'Allemagne et Frederick Soddy et John Cranston de Grande-Bretagne , ont découvert indépendamment un autre isotope du protactinium, 231 Pa avoir beaucoup plus longue demi-vie d'environ 32000 années. Ainsi le nom a été changé pour Brevium protoactinium que le nouvel élément faisait partie de la chaîne de désintégration de l'uranium-235 avant l'actinium (du grec : πρῶτος = protos signifiant premier, avant). Pour faciliter la prononciation, le nom a été raccourci à protactinium par le IUPAC en 1949. La découverte de protactinium a terminé la dernière lacune dans les premières versions du tableau périodique, proposé par Mendeleev en 1869, et il a apporté à la gloire des scientifiques impliqués.
Aristide von Grosse produit deux milligrammes de Pa 2 O 5 en 1927, et en 1934 la première protactinium élémentaire isolée de 0,1 milligrammes de Pa 2 O 5. Il a utilisé deux méthodes différentes: dans la première, l'oxyde protactinium a été irradié par des électrons 35 keV dans le vide. Dans un autre procédé, appelé le van Arkel processus-de Boer, l'oxyde a été chimiquement converti en un halogénure ( chlorure, bromure ou iodure) et ensuite réduit dans un vide, un filament métallique chauffé électriquement:
- 2 PAI 5 → 2 + 5 Pa I 2
En 1961, les Britanniques Autorité de l'énergie atomique (UKAEA) a produit 125 grammes de 99,9% protactinium pur en traitant 60 tonnes de déchets dans un processus en 12 étapes, à un coût d'environ 500 000 USD. Pendant de nombreuses années, ce ne était que l'offre importante au monde de protactinium, qui a été fourni à différents laboratoires pour des études scientifiques. Oak Ridge National Laboratory aux États-Unis fournit actuellement protactinium à un coût d'environ 280 USD / gramme.
Occurrence
Protactinium est l'un des éléments les plus rares et les plus chères d'origine naturelle. Il se trouve sous la forme de deux isotopes - 231 Pa et 234 Pa, avec l'isotope 234 Pa se produisant dans deux états d'énergie différents. Presque tous protactinium naturel est protactinium-231. C'est un alpha émetteur et est formé par la désintégration de l'uranium-235, tandis que le beta rayonnant protactinium-234 est produite à la suite de la désintégration de l'uranium-238 . Presque tout l'uranium-238 (99,8%) se désintègre d'abord au 234m Pa isomère.
Protactinium se produit dans uraninite (pechblende) à des concentrations de l'ordre de 0,3 à 3 231 pièces par an et par million de parties (ppm) de minerai. Considérant que la teneur habituelle est plus proche de 0,3 ppm (par exemple dans Jáchymov, République tchèque ), certains minerais de la République démocratique du Congo ont environ 3 ppm. Protactinium est dispersé de manière homogène dans la plupart des matériaux naturels et dans l'eau, mais à des concentrations beaucoup plus faibles de l'ordre de une partie par billion, qui correspond à la radioactivité de 0,1 picocuries (PCI) / g. Il est d'environ 500 fois plus protactinium dans les particules du sol de sable que dans l'eau, même l'eau présente dans le même échantillon de sol. Des rapports beaucoup plus élevés de 2000 et ci-dessus sont mesurées en sols limoneux et argiles, comme bentonite.
Dans les réacteurs nucléaires
Deux principaux isotopes de protactinium, 231 Pa et 233 Pa, sont produits à partir de thorium dans réacteurs nucléaires; les deux sont indésirables et sont habituellement retirés, ce qui accroît la complexité de la conception et le fonctionnement du réacteur. En particulier, par l'intermédiaire de 232 Th (n, 2 n) produit des réactions 231 Th qui rapidement (demi-vie 25,5 heures) se désintègre en 231 Pa. Le dernier isotope, alors que pas un déchet transuraniens, a une longue demi-vie de 32760 années et est un contributeur majeur à long terme radiotoxicité du combustible nucléaire usé.
Protactinium-233 est formée sur la capture de neutrons par 232 Th. Il a en outre soit se désintègre à l'uranium-233 ou une autre capture neutronique et convertit dans le non-fissile de l'uranium-234. 233 Pa a une demi-vie relativement longue de 27 jours et haute section efficace de capture de neutrons (ce qu'on appelle le " poison neutronique "). Ainsi, au lieu de la décomposition rapide de l'utile 233 U, une fraction significative de 233 Pa convertit en isotopes non fissiles et consomme neutrons, dégradant l'efficacité du réacteur. Pour éviter cela, Pa 233 est extrait de la zone active de thorium réacteurs à sels fondus, pendant leur fonctionnement, de sorte qu'il se désintègre à seulement 233 U. Ceci est réalisé au moyen de plusieurs mètres de hauteur des colonnes de liquide de bismuth avec du lithium dissous. Dans un scénario simplifié, le lithium réduit sélectivement les sels d'protactinium à protactinium métallique qui est ensuite extrait du cycle de sel fondu, et le bismuth est simplement un support. Il est choisi en raison de son faible point de fusion (271 ° C), faible pression de vapeur, une bonne solubilité pour le lithium et les actinides, et non miscibilité avec fusion halogénures.
Préparation

Avant l'avènement des réacteurs nucléaires, protactinium a été séparée pour des expériences scientifiques à partir de minerais d'uranium. Aujourd'hui, il est surtout produit comme un produit intermédiaire de la fission nucléaire en thorium réacteurs à haute température:
- Les temps sont des demi-vies.
Protactinium métal peut être préparé par réduction de son fluorure avec le fluorure de calcium, de lithium ou de baryum à une température de 1300-1400 ° C.
PROPRIETES physiques et chimiques
Protactinium est un actinide , qui est positionnée dans le tableau périodique à la gauche de l'uranium et à droite de thorium , et beaucoup de ses propriétés physiques sont intermédiaires entre ces deux actinides. Ainsi, protactinium est plus dense que le thorium et rigide, mais est plus léger que l'uranium, et son point de fusion est inférieur à celui de thorium et plus élevée que celle de l'uranium. La dilatation thermique, conductivité électrique et thermique de ces trois éléments sont comparables et sont typiques des métaux "pauvres". Le estimée le module de cisaillement de protactinium est similaire à celle de titane . Protactinium est un métal avec un éclat de gris argenté qui est conservé pendant un certain temps dans l'air. Protactinium réagit facilement avec l'oxygène, la vapeur d'eau et des acides, mais pas avec des métaux alcalins.
A température ambiante, le protactinium cristallise dans centrée corps structure tétragonale qui peut être considéré comme faussé réseau cubique centré; cette structure ne change pas lors de la compression jusqu'à 53 GPa. Les changements de structure à cubique à faces centrées (cfc) lors du refroidissement des températures élevées, à environ 1200 ° C. Le coefficient de dilatation thermique de la phase quadratique entre la température ambiante et 700 ° C est de 9,9 × 10 -6 / ° C.
Protactinium est transitions paramagnétiques et aucun magnétiques sont connus pour elle à ne importe quelle température. Il devient supraconducteur à des températures inférieures de 1,4 K. Protactinium tétrachlorure est paramagnétique à température ambiante, mais tours ferromagnétique après refroidissement à 182 K.
Protactinium existe dans deux grands états d'oxydation , 4 et 5, à la fois dans les solides et solutions, et les 3 et deux États ont été observés dans certaines phases solides. Comme la configuration électronique de l'atome neutre est [Rn] 7s 6d 2 1 2 5f, l'état d'oxydation +5 correspond à la faible consommation d'énergie (et donc favorisée) 5f 0 configuration. Les deux 4 et 5 états forment facilement hydroxydes dans l'eau avec les ions prédominants étant Pa (OH) 3+, Pa (OH) 2+
2, Pa (OH) +
3 et Pa (OH) 4, tous incolore. D'autres ions protactinium connus incluent PACL 2+
2, Paso 2+
4, PAF 3+, 2+ PAF
2, PAF -
6, PAF 2-
7 et PAF 3-
8.
Les composés chimiques
| Formule | couleur | symétrie | groupe d'espace | Aucun | Symbole de Pearson | un (h) | b (h) | c (h) | Z | densité, g / cm 3 |
|---|---|---|---|---|---|---|---|---|---|---|
| Pennsylvanie | gris argenté | quadrilatère | I4 / mmm | 139 | tI2 | 392,5 | 392,5 | 323,8 | 2 | 15,37 |
| PaO | sel gemme | Fm 3 m | 225 | cf8 | 496,1 | 4 | 13,44 | |||
| PaO2 | noir | fcc | Fm 3 m | 225 | CF12 | 550,5 | 4 | 10,47 | ||
| Pa 2 O 5 | blanc | Fm 3 m | 225 | CF16 | 547,6 | 547,6 | 547,6 | 4 | 10,96 | |
| Pa 2 O 5 | blanc | orthorhombique | 692 | 402 | 418 | |||||
| Pah 3 | noir | cubique | 3 h n | 223 | CP32 | 664,8 | 664,8 | 664,8 | 8 | 10,58 |
| PAF 4 | brun-rouge | monoclinique | C2 / c | 15 | MS60 | 2 | ||||
| PACL 4 | vert-jaune | quadrilatère | I4 1 / amd | 141 | Ti20 | 837,7 | 837,7 | 748,1 | 4 | 4,72 |
| PaBr 4 | brun | quadrilatère | I4 1 / amd | 141 | Ti20 | 882,4 | 882,4 | 795,7 | ||
| PACL 5 | jaune | monoclinique | C2 / c | 15 | MS24 | 797 | 1135 | 836 | 4 | 3,74 |
| PaBr 5 | rouge | monoclinique | P2 1 / c | 14 | MP24 | 838,5 | 1120,5 | 1214,6 | 4 | 4,98 |
| PaOBr 3 | monoclinique | C2 | 1691,1 | 387,1 | 933,4 | |||||
| Pa (PO 3) 4 | orthorhombique | 696,9 | 895,9 | 1500,9 | ||||||
| Pa 2 P 2 O 7 | cubique | Pa3 | 865 | 865 | 865 | |||||
| Pa (C 8 H 8) 2 | jaune d'or | monoclinique | 709 | 875 | 1062 |
Ici, a, b et c sont des constantes réticulaires dans picomètres, n est le numéro de groupe spatial et Z est le nombre de des unités de formule par cellule unitaire; FCC désigne le face-centrée symétrie cubique. La densité a été mesurée directement, mais pas calculé à partir des paramètres de maille.
Des oxydes et des sels contenant de l'oxygène
Oxydes Protactinium sont connus pour les états d'oxydation de métal 2, 4 et 5. Le plus stable est le pentoxyde de blanc Pa 2 O 5, qui peut être produit par l'allumage protactinium (V) de l'hydroxyde à l'air à une température de 500 ° C. Sa structure cristalline est cubique, et la composition chimique est souvent non stoechiométrique, comme décrit PaO 2,25. Une autre phase de cet oxyde avec une symétrie orthorhombique a également été rapportée. Le dioxyde noir PaO 2 est obtenu à partir du pentoxyde en le réduisant à 1550 ° C avec de l'hydrogène. Il ne est pas non plus aisément solubles dans dilué ou concentré nitrique , chlorhydrique ou l'acide sulfurique , mais facilement dissout dans l'acide fluorhydrique. Le dioxyde peut être reconverti en chauffant du pentoxyde dans une atmosphère contenant de l'oxygène à 1100 ° C. Le monoxyde PaO n'a été observé comme un revêtement mince sur protactinium métal, mais pas sous une forme en vrac isolé.
formes de protactinium oxydes binaires mélangés avec divers métaux. Avec des métaux alcalins A, les cristaux ont une formule chimique 3 APAO et structure de perovskite, ou A 3 PaO 4 et la structure de sel gemme déformée, ou A 7 PaO 6 où les atomes d'oxygène pour une hexagonale compacte treillis. Dans tous ces matériaux, les ions sont protactinium octaédriquement coordonnés. Le pentoxyde de Pa 2 O 5 se combine avec des terres rares oxydes métalliques R 2 O 3 pour former divers oxydes mixtes non stoechiométriques, également de structure de perovskite.
Oxydes sont Protactinium de base; ils convertissent facilement en hydroxydes et peuvent former divers sels tels que des sulfates , phosphates, nitrates , etc. Le nitrate est habituellement blanc, mais peuvent être brun en raison de décomposition radiolytique. Le chauffage du nitrate dans l'air à 400 ° C, il se convertit en le protactinium pentoxyde blanc. Le polytrioxophosphate Pa (PO 3) 4 peut être produit en faisant réagir du sulfate de difluorure de PAF 2 SO 4 avec de l'acide phosphorique (H 3 PO 4) sous une atmosphère de gaz inerte. Chauffer le produit à environ 900 ° C permet d'éliminer la réaction des sous-produits tels que l'acide fluorhydrique, le trioxyde de soufre et de l'anhydride phosphorique. Le chauffage à des températures plus élevées dans une atmosphère inerte décompose Pa (PO 3) 4 dans le diphosphate PaP 2 O 7, qui est analogue à diphosphates d'autres actinides. Dans le diphosphate, les groupes PO 3 forment des pyramides de symétrie C 2v. Chauffage PaP 2 O 7 dans l'air à 1400 ° C se décompose en des pentoxydes de phosphore et protactinium.
Halogénures
Protactinium (V) Les formes de fluorure de cristaux blancs où les ions protactinium sont disposées en bipyramides pentagonales et coordonné par sept autres ions. La coordination est la même dans le protactinium (V) de chlorure, mais la couleur est jaune. Les changements de coordination octaédrique à l'bromure protactinium brun (V) et ne est pas connue pour protactinium (V) d'iodure. La coordination de protactinium dans tous ses tétrahalogénures est 8, mais l'arrangement est antiprismatique carré dans protactinium (IV) fluorure et dodécaédrique dans le chlorure et le bromure. Protactinium de couleur brune (III) d'iodure a été rapporté où les ions sont protactinium 8 coordonnés dans un arrangement trigonale prismatique bicouronné.
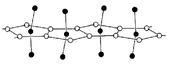
Protactinium (V) et le fluorure protactinium (V) de chlorure ont une structure polymère d'une symétrie monoclinique. Il, dans une chaîne polymérique, tous les atomes d'halogénure se situent dans un plan de graphite en forme de pentagones planes et forment autour des ions protactinium. La coordination des 7 protactinium provient des cinq atomes halogénures et deux liaisons à des atomes de protactinium appartenant à des chaînes voisines. Ces composés hydrolysent facilement dans l'eau. Le pentachlorure de fond à 300 ° C et se sublime à des températures encore plus basses.
Protactinium (V) le fluorure peut être préparé par réaction d'oxyde de protactinium avec soit pentafluorure de brome ou le trifluorure de brome à environ 600 ° C, et protactinium (IV) fluorure est obtenu à partir de l'oxyde et un mélange d'hydrogène et fluorure d'hydrogène à 600 ° C; un grand excès d'hydrogène est nécessaire pour éliminer des fuites dans l'atmosphère d'oxygène dans la réaction.
Protactinium (V) du chlorure est préparé par réaction de l'oxyde de protactinium avec le tétrachlorure de carbone à une température de 200 à 300 ° C. Les sous-produits (tels que PaOCl 3) sont éliminés par sublimation fractionnée. Réduction de protactinium (V) de chlorure avec de l'hydrogène à environ 800 ° C donne protactinium (IV) de chlorure - un solide jaune-vert qui se sublime sous vide à 400 ° C; il peut également être obtenu directement à partir de dioxyde de protactinium par traitement avec du tétrachlorure de carbone à 400 ° C.
Bromures protactinium sont produits par l'action de le bromure d'aluminium, le bromure d'hydrogène, tétrabromure de carbone ou un mélange de bromure d'hydrogène et bromure de thionyle d'oxyde de protactinium. Une réaction alternative est entre protactinium et le pentachlorure de bromure d'hydrogène ou du bromure de thionyle. Protactinium (V) de bromure a deux formes monocliniques similaires, on obtient une par sublimation à 400 à 410 ° C et l'autre par sublimation à une température légèrement inférieure de 390 à 400 ° C.
Iodures protactinium résultent des oxydes et l'iodure d'aluminium ou l'iodure d'ammonium chauffé à 600 ° C. Protactinium (III) d'iodure a été obtenu par chauffage protactinium (V) de l'iodure dans le vide. Comme avec des oxydes, des formes de protactinium mélangés halogénures avec les métaux alcalins. Parmi ceux-ci, le plus remarquable est Na 3 PAF 8 où protactinium ion est symétriquement entouré par 8 F - ions qui forment un cube presque parfait.
Fluorures de protactinium plus complexes sont également connus tels que Pa 2 F 9 et fluorures ternaires du type MPAF 6 (M = Li, Na, K, Rb, Cs ou NH 4), M 2 PAF 7 (M = K, Rb, Cs ou NH 4) 3 et M PAF 8 (M = Li, Na, Rb, Cs), tous étant des solides cristallins blancs. La formule MPAF 6 peut être représenté comme une combinaison de MF et 5 PAF. Ces composés peuvent être obtenus par évaporation d'une solution d'acide fluorhydrique contenant ces complexes les deux. Pour les petits cations alcalins tels que Na, la structure cristalline tétragonale est, alors qu'il diminue à orthorphombic pour de plus grands cations K +, Rb +, Cs + ou NH 4 +. Une variation similaire a été observée pour les deux M PAF 7 fluorures, à savoir la symétrie du cristal était dépendante du cation et différait pour Cs 2 PAF 7 et M 2 PAF 7 (M = K, Rb ou NH 4).
D'autres composés inorganiques
Oxyhalogénures et sulfoxydes de protactinium sont connus. PaOBr 3 a une structure monoclinique composé d'unités à double chaîne où protactinium a la coordination 7 et est organisé en bipyramides pentagonales. Les chaînes sont reliées entre elles par l'intermédiaire d'oxygène et de brome, et chaque atome d'oxygène est lié à trois atomes Pa. PAO est un solide non volatile jaune clair avec un réseau cristallin cubique isostructural à celle des autres oxysulfures actinides. Il est obtenu en faisant réagir protactinium (V) avec un mélange chlorure de le sulfure d'hydrogène et le disulfure de carbone à 900 ° C.
Dans hydrures et nitrures, protactinium a un état d'oxydation faible d'environ 3. L'hydrure est obtenu par l'action directe de l'hydrogène sur le métal à 250 ° C, et le nitrure est un produit d'ammoniac et de tétrachlorure ou le pentachlorure de protactinium. Ce solide jaune vif est stable au chauffage à 800 ° C sous vide. Protactinium PaC carbure est formée par réduction de protactinium tétrafluorure de baryum dans un creuset de carbone à une température d'environ 1400 ° C. formes de Protactinium borohydrures qui comprennent Pa (BH 4) 4. Il a une structure polymère avec des chaînes hélicoïdales inhabituel où l'atome d'protactinium a un nombre de coordination égal à 12 et est entouré par six BH 4 - ions.

Composés organométalliques
Protactinium (IV) forme un complexe de tétrakis (cyclopentadiényl) protactinium tétraédrique (IV) (Pa ou (C 5 H 5) 4) avec quatre des noyaux cyclopentadiényle, qui peuvent être synthétisés en faisant réagir le protactinium (IV) avec du chlorure fondu Be (C 5 H 5) 2. Un cycle peut être substitué par un atome d'halogénure. Un autre complexe organométallique est le bis jaune d'or (π-cyclooctatétraène) protactinium, Pa (C 8 H 8) 2, qui est analogue par sa structure à Uranocène. Là, l'atome de métal est prise en sandwich entre deux ligands cyclooctatétraène. Similaires à Uranocène, il peut être préparé par réaction avec du tétrachlorure de dipotassium protactinium cyclooctatetraenide, K 2 C 8 H 8, dans tétrahydrofurane.
Isotopes
Vingt-neuf des radio-isotopes de protactinium ont été découvertes, le plus stable étant 231 Pa avec une demi-vie de 32760 années, 233 Pa avec une demi-vie de 27 jours et 230 Pa avec une demi-vie de 17,4 jours. Tous les isotopes restants ont des demi-vies plus courtes que 1,6 jours, et la majorité d'entre eux ont des demi-vies de moins de 1,8 secondes. Protactinium dispose également de deux isomères nucléaires, 217m Pa (demi-vie de 1,2 millisecondes) et 234m Pa (demi-vie 1,17 minutes).
Le primaire mode de désintégration des isotopes de protactinium plus léger que (et y compris) l'isotope le plus stable 231 Pa (ce est à dire, 212 Pa à 231 Pa) est désintégration alpha et le mode principal pour les isotopes plus lourds (par exemple, 232 Pa à 240 Pa) est désintégration bêta. Le primaire produits de désintégration des isotopes de protactinium plus léger que (et y compris) 231 Pa sont actinium isotopes et les produits de désintégration primaires pour les isotopes plus lourds de protactinium sont uranium isotopes.
Applications
Bien que le protactinium est situé dans le tableau périodique entre l'uranium et du thorium, qui ont tous deux de nombreuses applications, en raison de sa rareté, radioactivité élevée et de haute toxicité, il n'y a actuellement aucun utilisations pour le protactinium en dehors de la recherche scientifique.
Protactinium-231 provient de la désintégration de l'uranium-235 formé dans les réacteurs nucléaires, et par la réaction 232 Th + n → 231 Th + 2n et après désintégration bêta. Elle peut soutenir une réaction en chaîne nucléaire, qui pourrait en principe être utilisé pour construire des armes nucléaires . Le physicien Walter Seifritz estimé une fois que l'associé masse critique que 750 ± 180 kg, mais cette possibilité (d'une réaction en chaîne) a été écartée par d'autres physiciens nucléaires depuis lors.
Avec l'avènement des très sensibles spectromètres de masse , une application de 231 Pa comme traceur en géologie et en paléocéanographie est devenu possible. Ainsi, le rapport entre le protactinium-231 de thorium-230 est utilisé pour datation radiométrique de sédiments qui sont jusqu'à 175.000 ans et dans la modélisation de la formation de minéraux. En particulier, son évaluation dans les sédiments océaniques a permis de reconstituer les mouvements de l'Atlantique du Nord plans d'eau au cours de la dernière fusion de L'âge de glace des glaciers . Certains des rencontres liées protactinium-variations se appuient sur l'analyse des concentrations relatives pour plusieurs membres de longue vie de la chaîne de désintégration de l'uranium - l'uranium, le thorium et le protactinium, par exemple. Ces éléments ont 6, 5 et 4 f-électrons dans l'enveloppe extérieure et donc favorisent 6, 5 et 4 états d'oxydation, respectivement, et montrent des propriétés physiques et chimiques. Donc, le thorium et le protactinium, mais pas de composés d'uranium sont peu solubles dans des solutions aqueuses, et précipiter dans les sédiments; le taux de précipitation est plus rapide pour le thorium que pour protactinium. En outre, l'analyse de la concentration à la fois pour le protactinium-231 (demi-vie 32750 années) et le thorium-230 (demi-vie 75380 années) permet d'améliorer la précision par rapport à lorsque seule une isotope est mesurée; cette méthode à double isotope est également faiblement sensible à des inhomogénéités dans la distribution spatiale des isotopes et à des variations de leur taux de précipitation.
Précautions
Protactinium est à la fois toxique et hautement radioactif et donc avec elle toutes les manipulations sont effectuées dans un scellée boîte à gants. Son isotope majeure 231 Pa a une activité spécifique de 0,048 Ci / gramme et émet principalement des particules alpha de l'énergie 5 MeV, qui peut être arrêté par une mince couche d'un quelconque matériau. Cependant, il se désintègre lentement, avec une demi-vie de 32760 années, en 227 Ac, qui présente une activité spécifique de 74 Ci / gramme, émet à la fois un rayonnement alpha et bêta, et a une demi-vie beaucoup plus courte de 22 ans. 227 Ac, à son tour, se désintègre en isotopes les plus légers avec encore plus courtes demi-vies et beaucoup plus des activités spécifiques (SA), tel que résumé dans le tableau ci-dessous.
| Isotope | 231 Pa | 227 Ac | 227 Th | 223 Ra | Rn 219 | 215 Po | 211 Pb | 211 Bi | 207 Tl |
|---|---|---|---|---|---|---|---|---|---|
| SA ( Ci / g) | 0,048 | 73 | 3,1 × 10 4 | 5,2 × 10 4 | 1,3 × 10 10 | 3 x 10 13 | 2,5 × 10 7 | 4,2 × 10 8 | 1,9 × 10 8 |
| Pourriture | α | α, β | α | α | α | α | β | α, β | β |
| Demi-vie | 33 ka | 22 un | 19 jours | 11 jours | 4 s | 1,8 ms | 36 min | 2,1 min | 4,8 min |
Comme protactinium est présente en petites quantités dans la plupart des produits et matériaux naturels, il est ingéré avec de la nourriture ou de l'eau et de l'air inhalé. Seulement environ 0,05% des protactinium ingéré est absorbé dans le sang et le reste est excrété. Du sang, environ 40% des dépôts de protactinium dans les os, environ 15% va vers le foie, 2% pour les reins, et le reste quitte le corps. La demi-vie biologique de protactinium est d'environ 50 ans dans les os, alors que dans d'autres organes de la cinétique a une composante rapide et lente. Ainsi, dans le foie de 70% protactinium ont une demi-vie de 10 jours et 30% rester pendant 60 jours. Les valeurs correspondantes pour les reins sont de 20% (10 jours) et 80% (60 jours). Dans tous ces organes, protactinium favorise le cancer via sa radioactivité. La dose maximale de sécurité de Pa dans le corps humain est de 0,03 uCi qui correspond à 0,5 microgrammes de 231 Pa. Cet isotope est de 2,5 × 10 8 fois plus toxique que l'acide cyanhydrique . Les concentrations maximales autorisées de 231 Pa dans l'air est de 3 × 10 -4 Bq / m 3.

![\ Mathrm {^ {232} _ {\ 90} Th \ + \ ^ _ {1} {0} n \ \ longrightarrow \ ^ {233} _ {\ 90} Th \ \ xrightarrow [22,3 \ min] {\ beta ^ -} \ ^ {233} _ {\ 91 Pa} \ \ xrightarrow [26,967 \ d] {\ beta ^ -} \ ^ {233} _ {\ 92} U}](../../images/2279/227997.png)
