
Américium
À propos de ce écoles sélection Wikipedia
Cette sélection se fait pour les écoles par la charité pour enfants en savoir plus . Parrainer un enfant de faire une réelle différence.
| Américium | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
95 Am | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||
blanc argenté  | |||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | américium, Am, 95 | ||||||||||||||||||||||||||||||||||||
| Prononciation | / ˌ æ m ə r ɪ s Je ə m / AM -ə- RIS -ee-əm | ||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | actinides | ||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 7, fa | ||||||||||||||||||||||||||||||||||||
| Poids atomique standard | (243) | ||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Rn ] 5f 7 7s 2 2, 8, 18, 32, 25, 8, 2 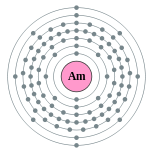 | ||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||
| Découverte | Glenn T. Seaborg, Ralph A. James, Leon O. Morgan, Albert Ghiorso (1944) | ||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 12 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Point de fusion | 1449 K , 1176 ° C, 2149 ° F | ||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 2880 K, 2607 ° C, 4725 ° F | ||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 14,39 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 62,7 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||
| États d'oxydation | 7, 6, 5, 4, 3, 2 ( l'oxyde amphotère) | ||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,3 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 578 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Rayon atomique | 173 h | ||||||||||||||||||||||||||||||||||||
| Rayon covalente | 180 ± 18 heures | ||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal  | ||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||||||||
| Résistivité électrique | 0,69 μΩ · m | ||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 10 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-35-9 | ||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de l'américium | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Américium (pron .: / ˌ æ m ə r ɪ s Je ə m / RIS -ee-əm de AM) est une transuraniens radioactifs élément chimique qui a le Am de symbole et de numéro atomique 95. Cette élément transuranien de l' actinide série se trouve dans le tableau périodique dessous du lanthanide élément europium , et donc par analogie été nommé d'après un autre continent, Amérique.
Américium a été produit en 1944 par le groupe de Glenn T. Seaborg au Université de Californie, Berkeley. Même si ce est le troisième élément de la transuranien série, on a découvert quatrième, après le plus lourd curium . La découverte a été gardé secret et ne rendu public en Novembre 1945. La plupart américium est obtenu en bombardant de l'uranium ou du plutonium avec des neutrons dans - une réacteurs nucléaires tonne de passé combustible nucléaire contient environ 100 grammes d'américium. Il est largement utilisé dans le domaine commercial Chambre d'ionisation des détecteurs de fumée, ainsi que dans sources de neutrons et jauges industrielles. Plusieurs applications inhabituelles, comme une batterie nucléaire ou carburant pour vaisseaux spatiaux à propulsion nucléaire, ont été proposés pour l' isotope Am de 242m, mais ils sont encore entravé par la rareté et le prix élevé de cette isomère nucléaire.
Américium est un relativement souple métal radioactif avec une apparence argentée. Ses isotopes les plus courants sont 241 Am et 243 Am. Dans les composés chimiques, ils supposent généralement le degré d'oxydation 3, en particulier dans des solutions. Plusieurs autres états d'oxydation sont connus, qui vont 2-7 et peuvent être identifiés par leurs caractéristiques Les spectres d'absorption optique. Le réseau cristallin de l'américium et ses composés solides contenant des défauts intrinsèques, qui sont induite par l'auto-irradiation avec des particules alpha et accumuler avec le temps; il en résulte une dérive de certaines propriétés du matériau.
Histoire

Bien que l'américium a probablement été produite dans des expériences nucléaires précédents, il était premier intentionnellement synthétisé, isolé et identifié à la fin de l'automne 1944, à la Université de Californie, Berkeley par Glenn T. Seaborg, Leon O. Morgan, Ralph A. James, et Albert Ghiorso. Ils ont utilisé un 60 pouces cyclotron à l'Université de Californie, Berkeley. L'élément a été chimiquement identifié au laboratoire métallurgique (maintenant Argonne National Laboratory) de la Université de Chicago. Après le briquet neptunium , le plutonium , et plus lourd curium , américium était le quatrième élément transuranien à découvrir. À l'époque, le tableau périodique avait été restructuré par Seaborg à son tracé actuel, contenant la ligne des actinides en dessous de la lanthanides une. Cela a conduit à l'américium étant situé juste en dessous de son jumeau lanthanide europium; ce est ainsi par analogie nommé d'après un autre continent, Amérique: "Le nom américium (après les Amériques) et le symbole Am sont proposées pour l'élément sur la base de sa position en tant que sixième membre de la série de terre rare actinides, analogue à l'europium, Eu, de la série des lanthanides."
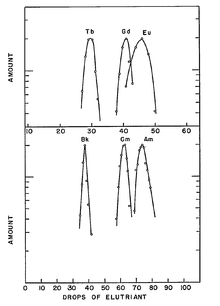
L'élément nouveau a été isolé à partir de son oxydes dans un processus complexe en plusieurs étapes. Première plutonium -239 nitrate (239 Puño 3) solution a été appliquée sur une platine feuille d'environ 0,5 cm 2, la solution a été évaporée et le résidu a été converti en dioxyde de plutonium (PuO 2) par recuit. Après irradiation par cyclotron, le revêtement a été dissous avec de l'acide nitrique , puis précipité sous forme d'hydroxyde en utilisant aqueuse concentrée une solution d'ammoniaque. Le résidu a été dissous dans l'acide perchlorique. En outre la séparation a été effectuée par échange d'ions, ce qui donne un certain isotope du curium. La séparation de l'américium et le curium était si laborieux que ces éléments ont été initialement convoquées par le groupe de Berkeley que pandémonium (du grec pour tous les démons ou l'enfer) et délire (du latin pour la folie).
Les premières expériences ont donné quatre isotopes de l'américium 241: Am, Am 242, 239 et 238 Am Am. Américium 241 a été obtenu directement à partir du plutonium lors de l'absorption d'un neutron. Il se désintègre par émission d'un α-particule de 237 Np; la demi-vie de cette décroissance a été déterminée comme 510 ± 20 ans, mais ensuite corrigé à 432,2 années.
- Les temps sont des demi-vies
Le second isotope 242 Am a été produit lors du bombardement neutronique déjà créé 241 Am. Sur rapide β-carie, 242 Am convertit en l'isotope du curium 242 cm (qui avait été découvert auparavant). La demi-vie de cette décroissance a été initialement déterminé à 17 heures, ce qui était proche de la valeur actuellement acceptée de 16.02 h.
La découverte de l'américium et le curium en 1944 a été étroitement liée à la Projet Manhattan; les résultats sont confidentiels et ne déclassifiés en 1945. Seaborg divulgué la synthèse des éléments 95 et 96 sur l'émission de radio des États-Unis pour les enfants, les Quiz enfants, cinq jours avant la présentation officielle à un Réunion de l'American Chemical Society, le 11 Novembre 1945, lorsque l'un des auditeurs a demandé si aucun élément nouveau transuranien à côté du plutonium et du neptunium avait été découvert pendant la guerre. Après la découverte de l'américium isotopes 241 et 242 Am Am, leur production et les composés ont été brevetées liste ne Seaborg comme l'inventeur. Les échantillons d'américium initiales pesés quelques microgrammes; ils étaient à peine visibles et ont été identifiés par leur radioactivité. Les premières quantités substantielles de l'américium métallique pesant de 40 à 200 microgrammes ne ont pas été préparés jusqu'en 1951 par la réduction de américium (III) avec du fluorure de baryum métallique sous un vide poussé à 1100 ° C.
Occurrence

Les isotopes les plus durables et les plus courantes de l'américium 241, Am et 243 Am, ont des demi-vies de 432,2 et 7370 années, respectivement. Par conséquent, toute américium primordiale (de l'américium qui était présent sur Terre lors de sa formation) aurait pourri maintenant.
Américium existante est concentrée dans les zones utilisées pour l'atmosphère essais d'armes nucléaires menées entre 1945 et 1980, ainsi que sur les sites des incidents nucléaires, comme la catastrophe de Tchernobyl . Par exemple, l'analyse des débris sur le site de test de la première US bombe à hydrogène, Ivy Mike, (1 Novembre 1952, Enewetak Atoll), a révélé des concentrations élevées de divers actinides y compris américium; en raison du secret militaire, ce résultat a été publié seulement en 1956. Trinitite, le résidu vitreux à gauche sur le sol du désert près de Alamogordo, Nouveau-Mexique, après la plutonium à base de Trinity essai nucléaire le 16 Juillet 1945, contient des traces de l'américium-241. Des niveaux élevés de l'américium ont également été détectés à la site du crash d'un US bombardier B-52, qui transportait quatre bombes à hydrogène, en 1968 à Groenland .
Dans d'autres régions, la radioactivité moyenne de la surface du sol en raison de l'américium résiduelle est seulement d'environ 0,01 picocuries / g (0,37 mBq / g). Composés d'américium atmosphériques sont peu solubles dans des solvants communs et la plupart adhèrent aux particules du sol. L'analyse du sol a révélé à propos de 1900 une concentration plus élevée de l'américium à l'intérieur des particules de sol sableux que dans l'eau présente dans les pores du sol; un rapport encore plus élevée a été mesurée dans les sols limoneux.
Américium est produit artificiellement principalement en petites quantités, à des fins de recherche. Une tonne de combustible nucléaire usé contient environ 100 grammes de différents isotopes de l'américium 241, principalement Am et 243 Am. Leur radioactivité prolongée ne est pas souhaitable pour l'élimination, l'américium et donc, avec d'autres actinides à vie longue, doivent être neutralisés. La procédure associée peut impliquer plusieurs étapes, où l'américium est d'abord séparé puis converti par bombardement de neutrons dans les réacteurs spéciaux pour nucléides de courte durée. Cette procédure est bien connue comme transmutation nucléaire, mais il est encore en cours d'élaboration pour l'américium.
Quelques atomes d'américium peuvent être produits par réactions de capture de neutrons et désintégration bêta en très fortement concentrées uranium dépôts -bearing.
Synthèse et extraction
nucleosyntheses isotopiques
Américium a été produit en petites quantités dans réacteurs nucléaires depuis des décennies, et de ses 241 kg et 243 Am Am isotopes ont été accumulées par l'entreprise. Néanmoins, depuis qu'il a été mis en vente en 1962, son prix, environ 1500 USD par gramme de 241 Am, est restée quasiment inchangée en raison de la procédure de séparation très complexe. Le plus lourd isotope 243 Am est produit en quantités beaucoup plus faibles; il est donc plus difficile de séparer, ce qui entraîne un coût plus élevé de l'ordre de 100 à 160 USD / mg.
Américium ne est pas synthétisée directement à partir de l'uranium - le matériau de réacteur le plus commun - mais de l'isotope du plutonium 239 Pu. Ce dernier doit être produite en premier lieu, selon le procédé nucléaire à la suite:
La capture des neutrons par deux 239 Pu (que l'on appelle (n, γ) réaction), suivie d'une β-carie, conduit à 241 Am:
Le plutonium dans le combustible nucléaire usé contient environ 12% des 241 Pu. Parce qu'il se transforme spontanément à 241 Am, Pu 241 peut être extrait et peut être utilisée pour générer plus de 241 Am. Cependant, ce processus est assez lent: la moitié de la quantité initiale de 241 Pu se désintègre en 241 Am, après environ 15 ans, et le montant de 241 Am atteint un maximum après 70 ans.
Le 241 Am obtenu peut être utilisé pour générer des isotopes plus lourds d'américium en outre par capture de neutrons à l'intérieur d'un réacteur nucléaire. Dans un réacteur à eau légère (LWR), 79% des 241 Am convertit à 242 Am et 10% à son isomère 242m nucléaire Am:
- 79%:
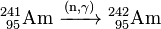
- 10%:
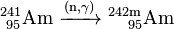
Américium-242 a une demi-vie de seulement 16 heures, ce qui rend sa plus up-conversion à 243 Am, extrêmement inefficace. Ce dernier isotope est produite à la place dans un processus où 239 Pu capte quatre neutrons sous haute flux de neutrons:
génération en métal
La plupart des routines de synthèse donnent un mélange de différents isotopes d'actinides sous formes d'oxydes, à partir de laquelle les isotopes de l'américium doivent être séparés. Dans une procédure typique, le combustible usé du réacteur (par exemple, Le combustible MOX) est dissous dans de l'acide nitrique , et la majeure partie de l'uranium et du plutonium est éliminé en utilisant un PUREX de type extraction (P lutonium - UR anium traction EX) avec le phosphate de tributyle dans un hydrocarbure. Les lanthanides et les actinides restants sont ensuite séparées du résidu aqueux ( raffinât) par un sur la base de diamide-extraction, pour donner, après le décapage, un mélange des actinides et lanthanides trivalents. composés d'américium sont ensuite extraites en utilisant de façon sélective à plusieurs étapes chromatographiques et des techniques de centrifugation avec un réactif approprié. Une grande quantité de travail a été fait sur la extraction par solvant de l'américium. Par exemple, une récente UE projet financé par le nom de code "EUROPART" étudiée triazines et d'autres composés comme agents d'extraction potentiels. Bis -triazinyl complexe bipyridine a récemment été proposé en tant que tel comme réactif hautement sélectif pour l'américium (et curium). La séparation de l'américium à partir du curium très similaire peut être obtenu par traitement d'une suspension de leurs hydroxydes dans une solution aqueuse du bicarbonate de sodium avec de l'ozone , à des températures élevées. Tant Am et Cm sont surtout présents dans les solutions à l'état de valence 3; tandis que le curium reste inchangé, l'américium se oxyde à la forme soluble Am (IV) complexes qui peuvent être emportés.
Américium métallique est obtenu par réduction de ses composés. Américium (III) le fluorure d'abord été utilisé à cette fin. La réaction a été effectuée à l'aide élémentaire baryum en tant qu'agent réducteur dans un environnement d'eau et dépourvu d'oxygène à l'intérieur d'un appareil réalisé en tantale et le tungstène .
Une autre possibilité est la réduction du Dioxyde de l'américium par métallique lanthane ou du thorium :
Propriétés physiques
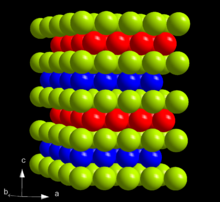
Dans le tableau périodique , de l'américium se trouve à droite du plutonium, à la gauche de curium, et en dessous du lanthanide europium , avec lequel il partage de nombreuses similitudes dans les propriétés physiques et chimiques. Américium est un élément hautement radioactif. Lorsque fraîchement préparé, elle a un lustre métallique gris-blanc, mais ternit lentement à l'air. Avec une densité de 12 g / cm 3, de l'américium est plus léger que les deux curium (13,52 g / cm 3) et de plutonium (19,8 g / cm 3); mais il est plus lourd que l'europium (5,264 g / cm 3) en raison de sa -surtout de masse atomique élevée. Américium est relativement mou et facilement déformable et a une significativement plus faible module de masse que les actinides devant elle: Th, Pa, U, Np et Pu. Son point de 1173 ° C de fusion est significativement plus élevée que celle du plutonium (639 ° C) et l'europium (826 ° C), mais plus faible que pour le curium (1340 ° C).
A conditions ambiantes, l'américium est présent sous sa forme la plus stable α qui a un symétrie cristalline hexagonale, et un groupe spatial P6 3 / mmc avec des paramètres de maille a = 346,8 h et c = 1 124 h, et de quatre atomes par cellule unitaire. Le cristal est constitué d'un double hexagonal emballage avec la succession de couches et donc ABAC est isotypique avec α-lanthane et plusieurs actinides tels que le α-curium. La structure cristalline de l'américium change avec la pression et la température. Quand comprimé à la température ambiante à 5 GPa, α-Am transforme la modification de β, qui a un cubique à faces centrées (cfc) symétrie, groupe d'espace Fm 3 m et constante de réseau a = 489 h. Cette structure fcc est équivalent à l'emballage le plus proche avec la séquence ABC. Après une nouvelle compression à 23 GPa, de l'américium se transforme en un la structure orthorhombique γ-Am similaire à celle de α-uranium. Il n'y a pas d'autres transitions observées jusqu'à 52 GPa, à l'exception d'une apparition d'une phase monoclinique à des pressions entre 10 et 15 GPa. Il n'y a pas de cohérence sur le statut de cette phase dans la littérature, qui énumère aussi parfois les α, β et γ phases I, II et III. La transition β-γ se accompagne d'une diminution de 6% en volume de cristaux; Bien que la théorie prévoit également un changement de volume considérable pour la transition α-β, il ne est pas observé expérimentalement. La pression de la transition α-β diminue lorsque la température augmente, et lorsque α-américium est chauffé à la pression ambiante, à 770 ° C, il se transforme en une phase cubique à faces centrées qui est différent de β-Am, et à 1075 ° C, il se convertit en une corps-centré structure cubique. Le diagramme de phase de l'américium à la pression de la température est donc assez semblables à ceux de lanthane, le praséodyme et le néodyme .
Comme beaucoup d'autres actinides, l'auto-endommagement du réseau cristallin due à l'irradiation de particules alpha est intrinsèque à l'américium. Il est particulièrement remarquable à basse température, où la mobilité du produit défauts réseau est relativement faible, par élargissement du Des rayons X des pics de diffraction. Cet effet rend quelque peu incertaine la température de l'américium et certaines de ses propriétés, tels que l'électricité résistivité. Donc, pour l'américium 241, la résistivité à 4,2 K augmente avec le temps d'environ 2 μOhm · cm à 10 cm μOhm · après 40 heures, et sature à environ 16 μOhm · cm après 140 heures. Cet effet est moins prononcé à la température ambiante, en raison de l'annihilation de défauts de rayonnement; chauffage également à la température ambiante l'échantillon qui a été maintenu pendant des heures à basse température restaure sa résistivité. Dans des échantillons frais, la résistivité augmente progressivement avec la température d'environ 2 cm à μOhm · l'hélium liquide à 69 μOhm · cm à la température ambiante; Ce comportement est similaire à celui du neptunium, l'uranium, le thorium et le protactinium , mais est différent du plutonium et du curium qui correspond à une augmentation rapide jusqu'à 60 K, suivie par la saturation. La valeur de la température ambiante pour l'américium est inférieure à celle du neptunium, du plutonium et du curium, mais plus élevé que pour l'uranium, le thorium et le protactinium.
Américium est paramagnétique dans une large plage de températures, de celle de l'hélium liquide, à la température ambiante, et au-dessus. Ce comportement est nettement différente de celle de son voisin le curium qui présentent transition antiferromagnétique à 52 K. Le coefficient de dilatation thermique de l'américium est légèrement anisotrope et se élève à (7,5 ± 0,2) x 10 -6 / ° C le long de la plus courte et un axe (6,2 ± 0,4) x 10 -6 / ° C pour l'axe c hexagonal plus. Le enthalpie de dissolution de l'américium métal dans l'acide chlorhydrique dans des conditions standard est -620,6 ± 1,3 kJ / mol, à partir de laquelle la changement norme enthalpie de formation (Δ f H °) de l'ion aqueuse Am est -621,2 ± 2,0 kJ / mol -1. Le Am de potentiel standard 3+ / Am 0 est 2,08 ± 0,01 V.
Propriétés chimiques
Américium réagit facilement avec l'oxygène et se dissout bien dans les acides . Le plus commun état d'oxydation pour l'américium est 3, dans lequel les composés d'américium sont plutôt stables à l'oxydation et de réduction. En ce sens, l'américium est chimiquement similaire à la plupart des lanthanides. Les formes d'américium trivalent insolubles fluorure, oxalate, iodate, hydroxyde , phosphate et d'autres sels. Autres états d'oxydation ont été observées entre 2 et 7, qui est la gamme la plus large parmi les actinides. Leur couleur dans des solutions aqueuses varie comme suit: Am 3+ (incolore à jaune-rougeâtre), Am 4+ (jaune-rouge), Am V O +
2; (Jaune), Am VI O 2+
2 (marron) et Am VII O 5-
6 (vert foncé). Tous les états d'oxydation ont leur spectre d'absorption optique caractéristique, avec quelques pics aigus dans les régions visible et infrarouge moyen, et la position et l'intensité de ces pics peuvent être convertis en les concentrations des états d'oxydation correspondants. Par exemple, Am (III) présente deux pics acérés à 504 et 811 nm, Am (V) à 514 et 715 nm, et Am (VI) à 666 et 992 nm.
composés d'américium à l'état d'oxydation +4 et plus sont des agents oxydants puissants, comparable en force à la ion permanganate (MnO -
4) dans des solutions acides. Tandis que les ions Am 4+ sont instables dans des solutions et facilement convertir à Am 3+, l'état d'oxydation +4 se passe bien dans les solides, tels que dioxyde de américium (OMA 2) et de l'américium (IV) fluorure (AMF 4).
Tous pentavalents et hexavalents composés d'américium sont des sels complexes tels que Kamo 2 F 2, Li 3 AmO 4 et 6 Li AmO 6, Ba 3 AmO 6, AmO 2 F 2. Ces haute oxydation déclare Am (IV), Am (V) et Am (VI) peut être préparé à partir Am (III) par oxydation avec persulfate d'ammonium dans de l'acide nitrique dilué, avec argent (I) en oxyde l'acide perchlorique, ou avec de l'ozone ou le persulfate de sodium dans des solutions de carbonate de sodium. L'état de l'américium d'oxydation pentavalent a été observé pour la première en 1951. Il est présent en solution aqueuse sous la forme de l'AMO +
Deux ions (acide) ou AMO -
3 ions (alcaline) qui sont cependant instable et soumis à plusieurs rapide réactions dismutation:
Les composés chimiques
Composés oxygénés
Deux oxydes américium sont connus, avec les états d'oxydation 3 (Am 2 O 3) et 4 (2) AmO. Américium (III) oxyde est un solide rouge-brun avec un point de 2205 ° C de fusion. Américium (IV) oxyde est la principale forme d'américium solide qui est utilisé dans presque tous ses applications. Comme la plupart des autres dioxydes d'actinides, ce est un solide noir avec un cube ( fluorite) structure cristalline.
L'oxalate d'américium (III), on le sèche à température ambiante sous vide, a la formule chimique Am 2 (C 2 O 4) 3 · 7H 2 O. Lors du chauffage dans le vide, il perd de l'eau à 240 ° C et commence à se décomposer en deux AmO à 300 ° C, la décomposition se termine à environ 470 ° C. L'oxalate initial se dissout dans l'acide nitrique à la solubilité maximale de 0,25 g / L.
Halogénures
Halogénures d'américium sont connus pour les états d'oxydation 2, 3 et 4, où le trois est le plus stable, surtout dans les solutions.
| état d'oxydation | Fa | Cl | Br | Je |
|---|---|---|---|---|
| 4 | Américium (IV) fluorure AmF 4 rose pâle | |||
| 3 | Américium (III) fluorure AmF 3 rose | Américium (III) chlorure AMCL 3 rose | Américium (III) du bromure AmBr 3 jaune clair | Américium (III) d'iodure AmI 3 jaune clair |
| 2 | Américium (II) chlorure AMCL 2 noir | Américium bromure (II) AmBr 2 noir | Américium (II) iodure AmI 2 noir |
Réduction de Am (III) composés avec du sodium l'amalgame donne Am (II) sels - les halogénures noirs AMCL 2, AmBr 2 et Ami 2. Ils sont très sensibles à l'oxygène et oxydent dans l'eau, libérant l'hydrogène et la conversion à l'état Am (III). Constantes de réseau spécifiques sont:
- Orthorhombique AMCL 2: a = 896,3 ± 12h08, b = 757,3 ± 12h08 et c = 453,2 ± 12h06
- Quadratique AmBr 2: a = 1159,2 ± 0,4 et c = 712,1 ± 12h03.
Ils peuvent également être préparés en faisant réagir l'américium métallique avec un halogénure de mercure appropriée HgX 2, où X = Cl, Br ou I:
Américium (III) fluorure (AMF 3) est peu soluble et précipite lors de la réaction d'Am 3+ et d'ions fluorure dans des solutions acides faibles:
Le tétravalent américium (IV) fluorure (AMF 4) est obtenu par réaction solide américium (III) avec du fluorure moléculaire fluor :
Une autre forme connue de chlorure solide tétravalent américium est KAmF 5. Américium tétravalent a également été observé dans la phase aqueuse. À cette fin, noir Am (OH) 4 a été dissous dans 15 M NH 3 F avec la concentration en américium de 0,01 M. La solution rougeâtre résultante a un spectre d'absorption caractéristique optique qui est similaire à celle de AmF 4 mais diffère d'autres états d'oxydation de l'américium. Le chauffage de la solution Am (IV) à 90 ° C n'a pas abouti à la disproportionation ou la réduction, cependant une réduction lente a été observée à Am (III) et affecté à l'autonomie de l'américium irradiation par particules alpha.
La plupart américium (III) halogénures forment des cristaux hexagonaux avec une légère variation de la couleur et de la structure exacte entre les halogènes. Ainsi, le chlorure (AMCL 3) est rouge et présente une structure isotypique de uranium (III) chlorure (groupe spatial P6 3 / m) et le point de 715 ° C de fusion. Le fluorure est isotypique LaF 3 (groupe spatial P6 3 / mmc) et l'iodure d'BiI 3 (espace groupe R 3). Le bromure est une exception avec le pUBR 3 structure de type et de l'espace groupe orthorhombique Cmcm. Cristaux d'américium hexahydraté (AMCL 3 · 6H 2 O) peuvent être préparés par dissolution de dioxyde de américium dans l'acide chlorhydrique et l'évaporation du liquide. Ces cristaux sont hygroscopiques et ont couleur jaune-rougeâtre et un structure cristalline monoclinique.
Oxyhalogénures de l'américium dans la forme Am VI O 2 X 2, Am V O 2 X, Am IV OX 2 et Am III OX peuvent être obtenus en faisant réagir l'halogénure d'américium correspondant avec de l'oxygène ou de Sb 2 O 3, et AmOCl peuvent également être produits en phase vapeur, hydrolyse:
Chalcogenides et pnictures
Le connue chalcogénures d'américium comprennent la AmS de sulfure 2, séléniures AMSE 2 et Am 3 Se 4, et tellurures Am 2 Te 3 et 2 AMTE. Le pnictures d'américium (Am 243) du type AmX sont connus pour les éléments phosphore , arsenic , antimoine et bismuth . Ils cristallisent dans le treillis sel gemme.
Siliciures et borures
Américium monosiliciure (AMSI) et "disiliciure" (nominalement AMSI x avec: 1,87 <x <2,0) ont été obtenus par réduction de l'américium (III) avec du fluorure élémentaire silicium sous vide à 1050 ° C (AMSI) et de 1150 à 1200 ° C (AMSI x). AMSI est un solide noir isomorphe Lasi, il a une symétrie cristalline orthorhombique. AMSI x possède un éclat argenté brillant et un réseau cristallin quadratique (groupe d'espace I 4 1 / amd), il est isomorphe avec PUSI 2 et thsi 2. Borures d'américium comprennent AmB 4 et 6 AmB. Le tétraborure peut être obtenue en chauffant un oxyde ou halogénure d'américium avec diborure de magnésium sous vide ou sous atmosphère inerte.
Composés Organoamericium
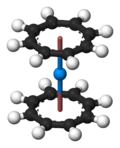
De manière analogue à Uranocène, américium forme un composé organométallique avec deux ligands cyclooctatétraène, ce est (η 8 -C 8 H 8) deux heures. Il rend également trigonale (η 5 -C 5 H 5) 3 complexes suis avec trois des noyaux cyclopentadiényle.
La formation des complexes de l'Am de type (nC 3 H 7 -BTP) 3, où BTP représente 2,6-di (1,2,4-triazine-3-yl) pyridine, dans des solutions contenant nC 3 H 7 - Les ions de BTP et AM a été confirmée par EXAFS. Certains de ces complexes de type BTP interagissent sélectivement avec l'américium et sont donc utiles dans la séparation sélective de lanthanides et les actinides autre.
Aspects biologiques
Américium est un élément artificiel, et donc une fonction biologique impliquant l'élément, comme tous les éléments plus lourds que le tungstène , serait impossible. Il a été proposé d'utiliser des bactéries pour l'enlèvement de l'américium et d'autres métaux lourds dans les rivières et les ruisseaux. Ainsi, Du genre Enterobacteriaceae Citrobacter précipiter les ions de l'américium à partir de solutions aqueuses, de les lier en un complexe métal-phosphate au niveau de leurs parois cellulaires. Plusieurs études ont été signalés sur la biosorption et bioaccumulation de l'américium par des bactéries et des champignons.
Fission
Le Am isotope de 242m1 (demi-vie 141 années) possède les plus grandes sections transversales pour l'absorption des neutrons thermiques (5700 granges), qui se traduit par un petit masse critique pour un soutenue réaction nucléaire en chaîne. La masse critique pour un nu sphère 242m1 de Am est d'environ 9-14 kg (les résultats de l'incertitude de la connaissance insuffisante de ses propriétés matérielles). Il peut être abaissé à 5/3 kg d'un réflecteur métallique et devrait devenir encore plus petit d'un réflecteur de l'eau. Cette petite masse critique est favorable pour portables armes nucléaires , mais celles basées sur 242m1 Am sont pas encore connus, probablement en raison de sa rareté et le prix élevé. Les masses critiques de deux autres isotopes facilement disponibles, 241 Am et 243 Am, sont relativement élevés - de 57,6 à 75,6 kg pour 241 Am et 209 kg pour 243 Am. La rareté et le prix élevé encore obstacle à l'application de l'américium comme combustible nucléaire les réacteurs nucléaires.
Il ya des propositions de très compacts 10 kW réacteurs à haut flux en utilisant aussi peu que 20 grammes de 242m1 Am. Ces réacteurs de faible puissance serait relativement sûr à utiliser que les sources de neutrons pour la radiothérapie dans les hôpitaux.
Isotopes
Environ 19 isotopes et 8 isomères nucléaires sont connus pour l'américium. Il ya deux émetteurs alpha à long terme, 241 AM et 243 Am avec des demi-vies de 432,2 et 7370 années, respectivement, et l'isomère de 242m1 nucléaire Am a une longue demi-vie de 141 ans. Les demi-vies des autres isotopes et les isomères varient de 0,64 microsecondes pour 245m1 Am à 50,8 heures pour 240 Am. Comme avec la plupart des autres actinides, les isotopes de l'américium avec nombre impair de neutrons ont un taux relativement élevé de la fission nucléaire et de faible masse critique.
Américium 241 se désintègre en émettant des particules 237 Np alpha de cinq énergies différentes, principalement à 5,486 MeV (85,2%) et 5,443 MeV (12,8%). Parce que beaucoup des états résultants sont métastable, ils émettent aussi rayons gamma avec les énergies discrètes entre 26,3 et 158,5 keV.
Américium-242 est un isotope de courte durée avec une demi-vie de 16,02 h. Il la plupart (82,7%) convertit par β-carie à 242 cm, mais aussi par capture d'électrons à 242 Pu (17,3%). Les deux 242 cm et 242 Pu transformer par presque la même chaîne de désintégration par 238 Pu jusqu'à 234 U.
Presque tous (99,541%) de 242m1 Am désintègre par conversion interne à 242 Am et 0,459% restants par α-carie à 238 Np. Ces derniers se décompose en 238 Pu puis à 234 U.
Américium 243 transformations par α-émission dans 239 Np, qui convertit par β-carie à 239 Pu et le 239 Pu se transforme en 235 U en émettant un α-particules.
Applications
Détecteurs à ionisation
Américium est le seul élément de synthèse d'avoir trouvé son chemin dans la maison, où un type courant de détecteur de fumée utilise 241 Am dans la forme de dioxyde de américium comme source de rayonnement ionisant. Cet isotope est préféré contre 226 Ra car il émet cinq fois plus de particules alpha et relativement peu de γ-radiations nocives. Le montant de l'américium dans un nouveau détecteur de fumée typique est une microcurie (37 kBq) ou 0,28 microgramme. Ce montant diminue lentement que l'américium se désintègre en neptunium -237, un élément transuraniens différente avec une demi-vie beaucoup plus longue (environ 2.140.000 années). Grâce à sa demi-vie de 432,2 années, l'américium dans un détecteur de fumée comprend environ 3% neptunium après 19 ans, et environ 5% après 32 ans. Le rayonnement passe à travers un chambre d'ionisation, un espace rempli d'air entre les deux électrodes, et permis une petite constants courant entre les électrodes. Toute la fumée qui pénètre dans la chambre absorbe les particules alpha, ce qui réduit l'ionisation et affecte ce courant, déclenchant l'alarme. Par rapport au détecteur de fumée optique variante, le détecteur de fumée à ionisation est moins cher et permet de détecter des particules qui sont trop petites pour produire importante dispersion de la lumière; cependant, il est plus enclin à fausses alarmes.
Radionucléide
Comme Am 241 a une demi-vie nettement plus longue que 238 Pu (432,2 années par rapport aux 87 années), il a été proposé comme un élément actif de générateurs thermoélectriques radio-isotopes, par exemple dans les vaisseaux spatiaux. Bien que l'américium produit moins de chaleur et d'électricité - le rendement de puissance est 114,7 mW / g pour 241 Am et 6,31 mW / g pour 243 Am (cf. 390 mW / g pour 238 Pu) - et son rayonnement pose plus de menace pour les humains en raison de neutrons l'émission, l' Agence spatiale européenne prévoit d'utiliser l'américium pour ses sondes spatiales.
Une autre application liée à l'espace proposé de l'américium est un carburant pour les vaisseaux spatiaux à propulsion nucléaire. Elle se appuie sur le taux très élevé de la fission nucléaire de 242m Am, qui peut être maintenue même dans une feuille de micromètre d'épaisseur. Faible épaisseur évite le problème de l'auto-absorption du rayonnement émis. Ce problème est pertinent de barres d'uranium ou de plutonium, dans lequel seules les couches de surface fournissent des particules alpha. Les produits de fission de 242m Am peuvent soit directement propulser le vaisseau spatial ou ils peuvent chauffer un gaz de poussée; ils peuvent également transférer leur énergie à un fluide et produire de l'électricité à travers un générateur magnétohydrodynamique.
Une autre proposition qui utilise le taux de fission nucléaire élevé de 242m Am est une batterie nucléaire. Sa conception se appuie non pas sur l'énergie de la émis par les particules alpha américium, mais leur charge, ce est les actes d'américium que le "cathodique" auto-entretenue. Un seul 3,2 kg 242m Am charge de cette batterie peut fournir environ 140 kW de puissance sur une période de 80 jours. Avec tous les avantages potentiels, les applications actuelles de 242m Am sont encore entravées par la rareté et le prix élevé de cette isomère nucléaire.
La production d'autres éléments
Américium est un matériau de départ pour la production d'autres éléments transuraniens et transactinides - par exemple, 82,7% des 242 Am se désintègre en 242 cm et de 17,3% à 242 Pu. Dans le réacteur nucléaire, 242 Am est également mis converti par capture de neutrons à 243 Am et 244 Am, qui transforme par β-carie à 244 Cm:
Irradiation de 241 Am par 12 C ou 22 ions Ne donne les isotopes 247 Es ( einsteinium ) ou 260 Db ( dubnium ), respectivement. En outre, l'élément berkelium ( 243 Bk isotope) avait d'abord été produits intentionnellement et identifié en bombardant 241 Am avec des particules alpha, en 1949, par le même groupe de Berkeley, en utilisant le même cyclotron de 60 pouces. De même, nobélium a été produite à l' Institut unifié de recherches nucléaires, Dubna, en Russie, en 1965 dans plusieurs réactions, dont un inclus irradiation de 243 Am avec 15 des ions N. D'ailleurs, l'une des réactions de synthèse pour lawrencium , découverts par des scientifiques de Berkeley et Dubna, inclus bombardement de 243 Am avec 18 O.
Spectromètre
Américium-241 a été utilisé comme une source portable de deux rayons gamma et des particules alpha pour un certain nombre d'utilisations médicales et industrielles. Les émissions de 60 keV rayons gamma de 241 Am dans ces sources peuvent être utilisées pour l'analyse indirecte des matériaux à la radiographie et la spectroscopie de fluorescence X-ray, ainsi que pour le contrôle de la qualité dans fixes jauges de densité nucléaire et densometers nucléaires. Par exemple, l'élément a été utilisé pour évaluer verre épaisseur pour aider à créer le verre plat. Américium 241 est également approprié pour l'étalonnage des spectromètres gamma dans la gamme basse énergie, car son spectre se compose de près d'un pic unique et continuum Compton négligeable (au moins trois ordres de grandeur plus faible intensité). Rayons gamma américium-241 ont également été utilisés pour fournir un diagnostic passive de la fonction thyroïdienne. Cette application médicale est cependant obsolète.
Les questions de santé
Comme un élément hautement radioactif, l'américium et ses composés doivent être traitées que dans un laboratoire approprié selon des modalités particulières. Bien que la plupart des isotopes de l'américium émettent principalement des particules alpha qui peuvent être bloqués par des couches minces de matériaux ordinaires, bon nombre des produits de filiation émettent des rayons gamma et des neutrons qui ont une profondeur de pénétration de long.
En cas de consommation, l'américium est excrété dans les quelques jours seulement 0,05% et est absorbé dans le sang. A partir de là, à peu près 45% de celui-ci va au foie et 45% pour les os, et les 10% restants est éliminée. L'absorption dans le foie dépend de l'individu et augmente avec l'âge. Dans les os, l'américium est d'abord déposée sur corticales et surfaces trabéculaire et redistribue sur l'os avec le temps lentement. La demi-vie biologique de 241 Am est de 50 ans dans les os et 20 ans dans le foie, alors que dans les gonades (testicules et ovaires) reste en permanence; dans tous ces organes, l'américium favorise la formation de cellules cancéreuses en raison de sa radioactivité.
Américium entre souvent décharges de rebut des détecteurs de fumée. Les règles associées à la disposition des détecteurs de fumée sont détendus dans la plupart des juridictions. Aux États-Unis, la "Radioactive Boy Scout" David Hahn était capable de se concentrer américium de détecteurs de fumée après avoir réussi à acheter une centaine d'entre eux à des prix de reste et de voler aussi quelques-uns. Il ya eu des cas humains étant contaminés par l'américium, le pire des cas étant celui de Harold McCluskey, qui, à l'âge de 64 ans a été exposé à 500 fois la norme professionnelle pour l'américium-241 à la suite d'une explosion dans son laboratoire. McCluskey est mort à l'âge de 75 ans, non pas en raison de l'exposition, mais d'une maladie cardiaque dont il avait avant l'accident.

![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {(n, \ gamma)} \ ^ {240} _ {\ 94} Pu \ \ xrightarrow {(n, \ gamma)} \ ^ {241 } _ {\ 94} Pu \ \ xrightarrow [14,35 \ an] {\ beta ^ -} \ ^ {241} _ {\ 95} Am \ \ left (\ \ xrightarrow [432,2 \ an] {\ alpha} \ ^ {237} _ {\ 93} Np \ right)}](../../images/1281/128125.png)
![\ Mathrm {^ {241} _ {\ 95} Am \ \ xrightarrow {(n, \ gamma)} \ ^ {242} _ {\ 95} Am \ \ left (\ \ xrightarrow [16,02 \ h] {\ beta ^ -} \ ^ {242} _ {\ 96 cm} \ right)}](../../images/1281/128126.png)
![\ Mathrm {^ {238} _ {\ 92} U \ \ xrightarrow {(n, \ gamma)} \ ^ {239} _ {\ 92} U \ \ xrightarrow [23,5 \ min] {\ beta ^ -} \ ^ {239} _ {\ 93} Np \ \ xrightarrow [2,3565 \ d] {\ beta ^ -} \ ^ {239} _ {\ 94}} Pu](../../images/1281/128135.png)
![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {2 (n, \ gamma)} \ ^ {241} _ {\ 94} Pu \ \ xrightarrow [14,35 \ an] {\ beta ^ -} \ ^ {241} _ {\ 95}} Am](../../images/1281/128136.png)
![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {4 (n, \ gamma)} \ ^ {243} _ {\ 94} Pu \ \ xrightarrow [4,956 \ h] {\ beta ^ -} \ ^ {243} _ {\ 95}} Am](../../images/1281/128139.png)
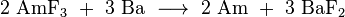
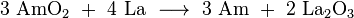

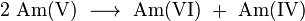
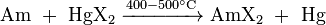
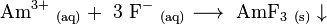
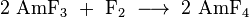



![\mathrm{^{243}_{\ 95}Am\ \xrightarrow {(n,\gamma)} \ ^{244}_{\ 95}Am\ \xrightarrow [10.1 \ h]{\beta^-} \ ^{244}_{\ 96}Cm}](../../images/1281/128167.png)
