
Bore
Saviez-vous ...
Les articles de cette sélection écoles ont été organisés par sujet du programme d'études grâce aux bénévoles d'enfants SOS. Cliquez ici pour en savoir plus sur le parrainage d'enfants.
| Bore | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
5 B | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||
brun-noir  | |||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||
| Nom, symbole, nombre | bore, B, 5 | ||||||||||||||||||||||||
| Prononciation | / b ɔər ɒ n / | ||||||||||||||||||||||||
| Catégorie Metallic | métalloïde | ||||||||||||||||||||||||
| Groupe, période, bloc | 13, 2, p | ||||||||||||||||||||||||
| Poids atomique standard | 10,81 (1) | ||||||||||||||||||||||||
| Configuration électronique | [Il] 2s 2 2p 1 2, 3  | ||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||
| Découverte | Louis Joseph Gay-Lussac et Louis Jacques Thénard (30 Juin 1808) | ||||||||||||||||||||||||
| Premier isolement | Humphry Davy (9 Juillet 1808) | ||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||
| Liquid densité au mp | 2,08 g · cm -3 | ||||||||||||||||||||||||
| Point de fusion | 2349 K , 2076 ° C, 3769 ° F | ||||||||||||||||||||||||
| Point d'ébullition | 4200 K, 3927 ° C, 7101 ° F | ||||||||||||||||||||||||
| La chaleur de fusion | 50,2 kJ · mol -1 | ||||||||||||||||||||||||
| Chaleur de vaporisation | 480 kJ · mol -1 | ||||||||||||||||||||||||
| Capacité thermique molaire | 11,087 J · mol -1 .K -1 | ||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||
| États d'oxydation | 3, 2, 1 (Légèrement acide oxyde) | ||||||||||||||||||||||||
| Électronégativité | 2,04 (échelle de Pauling) | ||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 800,6 kJ · mol -1 | ||||||||||||||||||||||||
| 2ème: 2427,1 kJ · mol -1 | |||||||||||||||||||||||||
| 3ème: 3659,7 kJ · mol -1 | |||||||||||||||||||||||||
| Rayon atomique | 90 h | ||||||||||||||||||||||||
| Rayon covalente | 84 ± 15 heures | ||||||||||||||||||||||||
| Rayon de Van der Waals | 192 h | ||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||
| Crystal structure | rhomboédrique 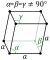 | ||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | ||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) ~ 10 6 Ω · m | ||||||||||||||||||||||||
| Conductivité thermique | 27,4 W · m -1 · K -1 | ||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) (forme β) 5-7 um · m -1 K -1 | ||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 16 200 m · s -1 | ||||||||||||||||||||||||
| Dureté Mohs | ~ 9,5 | ||||||||||||||||||||||||
| Numéro de registre CAS | 7440-42-8 | ||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||
| Article détaillé: Isotopes de bore | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Le bore est un élément chimique avec le symbole chimique B et numéro atomique 5. Parce que le bore est produit entièrement par cosmique spallation de rayons et non par nucléosynthèse stellaire, ce est un élément faible abondance tant dans le système solaire et la croûte de la Terre. Le bore est concentrée sur la Terre par l'hydrosolubilité des composés naturels les plus courants, la minéraux borate. Ceux-ci sont exploités industriellement comme évaporites, comme borax et kernite.
Chimiquement bore non combiné, qui est classé comme un métalloïde, ne est pas présent naturellement sur Terre. Industriellement, le bore très pur est produit avec difficulté, car le bore a tendance à former des matériaux réfractaires contenant de petites quantités de carbone ou d'autres éléments. Plusieurs allotropes de bore existent: bore amorphe est une poudre brune et le bore cristallin est noir, très dur (environ 9,5 sur l' échelle de Mohs ), et un mauvais conducteur à la température ambiante. Bore élémentaire est utilisé comme dopant dans la industrie des semiconducteurs.
Les principales utilisations à l'échelle industrielle de composés du bore sont en les agents de blanchiment de perborate de sodium et le borax composant d'isolation en fibre de verre. polymères de bore et céramiques jouent des rôles spécialisés comme matériaux de structure et réfractaires légers à haute résistance. Les composés du bore sont utilisés dans des verres et des céramiques à base de silice de leur donner la résistance à choc thermique. Contenant du bore réactifs sont utilisés comme intermédiaires dans de la la synthèse de produits chimiques fins organiques. Quelques produits pharmaceutiques organiques contenant du bore sont utilisés ou sont en étude. Bore naturel est composé de deux isotopes stables, dont l'une ( bore-10) a un certain nombre d'utilisations comme agent de capture de neutrons.
En biologie, les borates ont une faible toxicité chez les mammifères (semblables au sel de table), mais sont plus toxiques pour les arthropodes et sont utilisés comme insecticides. L'acide borique est légèrement antimicrobien, et un antibiotique naturel contenant du bore organique est connu. Le bore est essentiel à la vie. De petites quantités de composés du bore jouent un rôle de renforcement dans les parois des cellules de toutes les plantes, ce qui rend nécessaire de bore dans les sols. Les expériences indiquent un rôle de bore en tant que élément ultratrace chez les animaux, mais son rôle dans la physiologie de l'animal est inconnu.
Histoire et étymologie
Le nom de bore provient de l' arabe mot بورق buraq ou Mot persan بوره Burah; qui sont des noms pour le minéral borax.

Les composés de bore sont connus il ya des milliers d'années. Borax a été connu par les déserts de l'ouest du Tibet, où il a reçu le nom de tinkal, dérivé du sanscrit . émaux de Borax ont été utilisés en Chine à partir AD300, et certains ont même atteint tinkal l'Ouest, où l'alchimiste persan Jabir Ibn Hayyan semble mentionner dans 700. Marco Polo a apporté des émaux de retour en Italie au 13ème siècle. Agricola, autour de 1600, rapporte l'utilisation de borax comme un flux dans la métallurgie . En 1777, l'acide borique a été reconnu dans les sources chaudes ( soffioni) près Florence, Italie, et est devenu connu comme sedativum sal, avec des utilisations principalement médicaux. Le minerai rare est appelé sassolite, qui se trouve à Sasso, en Italie. Sasso était la principale source de borax européenne 1827-1872, date à laquelle des sources américaines ont remplacé. Les composés du bore ont été relativement peu utilisés produits chimiques jusqu'à la fin des années 1800 lorsque Francis Marion Smith Pacific Coast Borax Société abord popularisé ces composés et les a faites en volume et donc pas cher.
Boron était pas reconnu comme un élément jusqu'à ce qu'il a été isolé par Sir Humphry Davy et en Louis Joseph Gay-Lussac et Louis Jacques Thénard. En 1808, Davy observe que le courant électrique envoyé à travers une solution de borate a produit un précipité brun sur l'une des électrodes. Dans ses expériences ultérieures il a utilisé potassium pour réduire l'acide borique au lieu de l'électrolyse . Il a produit assez de bore pour confirmer un nouvel élément et nommé l'élément boracium. Gay-Lussac et Thénard utilisés fer pour réduire l'acide borique à des températures élevées. Ils ont montré par oxydation de bore avec de l'air que l'acide borique est un produit d'oxydation du bore. Jöns Jakob Berzelius identifié bore comme un élément en 1824. Pur bore a été sans doute la première produite par le chimiste américain Ezekiel Weintraub en 1909.
Caractéristiques
Allotropes

Le bore est proche de carbone dans sa capacité à former stable lié de façon covalente réseaux moléculaires. Même nominalement désordonnée ( amorphe) bore contient du bore régulière icosaèdres qui sont, cependant, lié au hasard à l'autre sans ordre à longue portée. Bore cristallin est un très dur, matière noire avec un point de fusion élevé de plus de 2000 ° C. Il existe dans quatre grands polymorphes: α, β, γ et T. considérant que α, β et T phases sont basées sur B 12 icosaèdres, le γ-phase peuvent être décrits comme un sel gemme arrangement de type de l'icosaèdre et B deux paires atomiques. Il peut être produit par compression d'autres phases de bore de 12 à 20 GPa et de chauffage à 1500-1800 ° C; il reste stable après avoir relâché la pression et la température. La phase de T est produit à des pressions similaires, mais des températures plus élevées de 1800-2200 ° C. En ce qui concerne les α et β phases, ils peuvent coexister à la fois conditions ambiantes avec la phase β étant plus stable. La compression de bore supérieure à 160 GPa produit une phase de bore avec une structure encore inconnue, et cette phase est un supraconducteur à des températures 6-12 K.
| La phase de bore | α | β | γ | T |
|---|---|---|---|---|
| Symétrie | Rhomboédrique | Rhomboédrique | Orthorhombique | Quadrilatère |
| Atomes / cellule unitaire | 12 | ~ 105 | 28 | |
| Densité (g / cm 3) | 2,46 | 2,35 | 2,52 | 2,36 |
| Dureté Vickers (GPa) | 42 | 45 | 50-58 | |
| Module vrac (GPa) | 185 | 224 | 227 | |
| Bandgap (eV) | 2 | 1.6 | 2.1 |
Composition chimique de l'élément
Bore élémentaire est rare et peu étudié parce que la matière est extrêmement difficile à préparer. La plupart des études sur "bore" impliquent échantillons qui contiennent de petites quantités de carbone. Chimiquement, le bore se comporte plus de façon similaire à du silicium que de l'aluminium . Bore cristallin est chimiquement inerte et résistant à l'attaque par ebullition fluorhydrique ou l'acide chlorhydrique . Lorsque finement divisée, il est attaqué lentement concentrée chaude peroxyde d'hydrogène , concentrée chaude de l'acide nitrique , chaud l'acide sulfurique ou d'un mélange d'acide sulfurique et chaude acides chromique.
La vitesse d'oxydation de bore dépend de la cristallinité, la taille des particules, la pureté et la température. Boron ne réagit pas avec l'air à température ambiante, mais à des températures plus élevées, il brûle pour former le trioxyde de bore:
- 4 B + 3 O 2 → 2 B 2 O 3
Le bore est soumis à une halogénation pour donner des trihalogénures, par exemple,
- 2 B + 3 Br 2 → 2 BBr3
Le trichlorure dans la pratique est habituellement fabriqué à partir de l'oxyde.
Les composés chimiques
Dans ses composés les plus familiers, le bore est à l'état d'oxydation formel III. Ceux-ci comprennent des oxydes, des sulfures, des nitrures, et des halogénures.
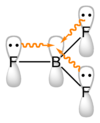
Les trihalogénures adoptent une structure trigonale plane. Ces composés sont Des acides de Lewis en ce qu'ils forment facilement adduits avec les donateurs paires d'électrons, qui sont appelés Les bases de Lewis. Par exemple, le fluorure (F -) et le trifluorure de bore (BF 3) combinés pour donner le anion tétrafluoroborate, BF 4 -. Le trifluorure de bore est utilisé dans l'industrie pétrochimique comme catalyseur. Les halogénures réagissent avec l'eau pour former acide borique.
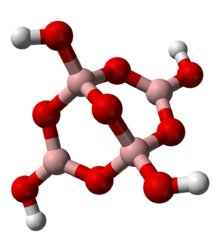
Le bore est présent dans la nature entièrement sur la Terre que divers oxydes de B (III), souvent associées à d'autres éléments. Plus d'une centaine borates tout le dispositif de bore dans l'état d'oxydation +3. Ces silicates minéraux ressemblent à certains égards, bien que le bore se trouve souvent non seulement dans une coordination tétraédrique avec l'oxygène, mais également dans une configuration plane trigonal. Contrairement silicates, les minéraux de bore ne disposent de bore avec le nombre de coordination supérieur à quatre. Un motif typique est illustrée par les anions tétraborate de la matière minérale commun borax, illustré à gauche. La charge négative formelle des centres de borate tétraédriques est équilibrée par des cations métalliques dans les sels minéraux, tels que le sodium (Na +) dans le borax.
Le nitrures de bore sont remarquables pour la variété des structures qu'ils adoptent. Ils adoptent des structures analogues à divers allotropes de carbone , y compris le graphite, le diamant, et des nanotubes. Dans le nitrure de bore cubique de type diamant structure appelée (nom commercial Borazon), des atomes de bore existe dans la structure tétraédrique des atomes de carbone dans le diamant, mais dans tous les quatre BN obligations peut être considéré comme un liaison covalente coordonnée, dans lequel deux électrons sont donnés par l'atome d'azote qui agit comme le Base de Lewis à une liaison à la Lewis bore acide (III) centre. Le nitrure de bore cubique, entre autres applications, est utilisé comme abrasif, tel qu'il a une dureté comparable avec le diamant (les deux substances sont capables de produire des rayures sur l'autre). Dans le composé analogue BN de graphite, le nitrure de bore hexagonal (h-BN), le bore chargé positivement et des atomes d'azote chargés négativement dans chaque plan se trouvent adjacent à l'atome de charge opposée dans le plan suivant. Par conséquent graphite et h-BN ont des propriétés très différentes, bien que les deux sont des lubrifiants, que ces plans glissent devant l'autre facilement. Cependant, h-BN est un conducteur électrique et thermique relativement faible dans les directions planaires.
Organoboron chimie
Un grand nombre de composés organiques de bore sont connus et sont utiles dans de nombreux synthèse organique. Organoboron composés (III) sont généralement plane tétraédrique ou trigone, par exemple, le tétraphénylborate (B (C 6 H 5) 4 -) vs triphénylborane (B (C 6 H 5) 3). Beaucoup sont produites à partir de hydroboration, qui emploie diborane (B 2 H 6).
Les composés de B (I) et B (II)
Bien que ceux-ci sont introuvables naturellement sur Terre, le bore forme une variété de composés stables avec l'état d'oxydation formel inférieur à trois. Comme pour de nombreux composés covalentes, états d'oxydation formels sont souvent de peu de sens dans des hydrures de bore et des borures métalliques. Les halogénures forment également des dérivés de B (I) et B (ii). BF, isoélectronique avec N 2, ne est pas isolable sous forme condensée, mais B 2 F 4 et B 4 Cl 4 sont bien caractérisés.

Composés binaires métal-bore, les borures métalliques, fonction de bore dans l'état d'oxydation inférieur à III. Exemplative diborure de magnésium (MgB 2). Chaque atome de bore a une formelle -1 charge et magnésium est attribué une accusation formelle de 2+. Dans ce matériau, les centres de bore rhomboédrique sont planes, avec une double liaison supplémentaire pour chaque bore, avec les atomes de bore formant des feuilles semblables à du carbone dans graphite. Toutefois, contrairement au cas de nitrure de bore hexagonal qui manque par rapport électrons dans le plan des atomes covalentes, les électrons délocalisés dans le plan du diborure de magnésium permettent de conduire l'électricité semblable à graphite isoélectronique. De plus, en 2001, ce matériau se est révélé être une haute température supraconducteur .
Certains autres borures métalliques trouver des applications spécialisées comme les matériaux durs pour les outils de coupe.
Du point de vue structurel, les composés chimiques les plus distinctifs de bore sont les hydrures. Inclus dans cette série sont les composés en grappe dodécaborate (B 12 H 12 2-), décaborane (B 10 H 14), et le carboranes tels que C 2 B 10 H 12. Caractéristique de tels composés disposent de bore avec des nombres de coordination supérieur à quatre.
Isotopes
Le bore a deux naturels stables et les isotopes , B 11 (80,1%) et 10 B (19,9%). Les résultats de différence de masse dans un large éventail de δ 11 B valeurs, qui sont définis comme une différence entre la fraction 11 B et 10 B et traditionnellement exprimée en parties par mille, dans les eaux naturelles allant de -16 à 59. Il ya 13 isotopes connus de bore, l'isotope le plus éphémère est 7 B qui se désintègre par protons et émissions désintégration alpha. Il a une demi-vie de 3,5 × 10 -22 s. Fractionnement isotopique du bore est contrôlée par les réactions d'échange de l'espèce de bore B ( O H ) et 3 [B (OH) 4] -. Isotopes de bore sont également fractionnés pendant la cristallisation minérale, au cours de H 2 O à des changements de phase systèmes hydrothermaux, et pendant altération hydrothermale des roches . Ces derniers résultats de l'effet de suppression préférentielle de la 10 B (OH) 4 d'ions sur les argiles. Il en résulte des solutions enrichies en 11 B (OH) 3 et donc peut être responsable de la grande enrichissement 11 B dans l'eau de mer par rapport à la fois océanique et la croûte continentale croûte; cette différence peut agir comme un signature isotopique. L'exotique 17 B présente une halogéno nucléaire, ce est à dire son rayon est sensiblement plus grand que celui prédit par le modèle de goutte de liquide.
L'isotope 10 B est bonne à saisir neutrons thermiques. Bore naturel est d'environ 20% 10 et 80% B 11 B. L' industrie nucléaire enrichit de bore naturel de presque pur 10 B. Le moins sous-produit précieux, le bore appauvri, est presque pur 11 B.
Enrichissement isotopique commerciale
En raison de sa grande section transversale neutrons, du bore-10 est souvent utilisée pour contrôler la fission dans des réacteurs nucléaires, comme substance de capture de neutrons. Plusieurs procédés d'enrichissement à l'échelle industrielle ont été mis au point, mais uniquement la distillation fractionnée sous vide de la produit d'addition de l'éther diméthylique de le trifluorure de bore (BF 3-DME) et Chromatographie sur une colonne de borates sont utilisés.
Bore enrichi (bore-10)

Bore enrichi ou 10 B est utilisé à la fois protection contre les rayonnements et est le nucléide primaire utilisée dans la thérapie par capture de neutrons du cancer. Dans ce dernier («thérapie par capture de neutrons du bore" ou BNCT), un composé contenant 10 B est incorporé dans un produit pharmaceutique qui est sélectivement absorbée par une tumeur maligne et les tissus près de lui. Le patient est ensuite traité avec un faisceau de neutrons soit thermique ou d'autre neutrons de faible énergie, à une dose relativement faible de rayonnement neutronique. Les neutrons, cependant, déclenchent énergique et courte portée secondaire particule alpha et lithium-sept rayonnement d'ions lourds qui sont des produits de bore + neutrons réaction nucléaire, et ce rayonnement d'ions bombarde en outre la tumeur, en particulier à partir de l'intérieur des cellules tumorales.
Dans les réacteurs nucléaires, 10 B est utilisé pour le contrôle de réactivité et en systèmes d'arrêt d'urgence. Il peut servir deux fonctions sous la forme de borosilicate barres de contrôle ou que acide borique. En réacteurs à eau pressurisée, l'acide borique est ajouté au liquide de refroidissement du réacteur lorsque l'installation est à l'arrêt pour ravitaillement en carburant. Il est ensuite lentement filtré sur de nombreux mois que matières fissiles est utilisé et le carburant devient moins réactif.
A l'avenir sondes interplanétaires habités, 10 B a un rôle théorique matériau de structure (comme les fibres de bore ou BN matériau nanotube) qui servirait également un rôle particulier dans la protection contre les radiations. Une des difficultés dans le traitement des les rayons cosmiques, qui sont essentiellement des protons d'énergie élevés, ce est que certains rayonnement secondaire de l'interaction des rayons cosmiques et des matériaux de l'engin spatial est haute énergie neutrons de spallation. Ces neutrons peuvent être modérés par des matériaux riches en éléments légers tels que polyéthylène, mais les neutrons modérés continuent d'être un danger d'irradiation absorbée moins activement dans le blindage. Parmi les éléments légers qui absorbent les neutrons thermiques, 6 Li et 10 B apparaissent engins spatiaux structurelle matériaux potentiels qui servent à la fois pour le renforcement mécanique et de la radioprotection.
Bore appauvri (bore-11)
Le rayonnement cosmique se produire des neutrons secondaires si elle frappe structures d'engins spatiaux. Ces neutrons sont capturés en 10 B, se il est présent dans l'engin spatial des semi-conducteurs , la production d'un rayons gamma, un particule alpha, et un lithium ion. Ces produits de désintégration résultantes peuvent ensuite irradier semi-conducteurs structures à proximité de 'puces', causant la perte de données (bit retournement, ou seul événement bouleversé). En rayonnement durci conceptions de semi-conducteurs, une contre-mesure est d'utiliser le bore appauvri qui est fortement enrichi en 11 B et ne contient presque pas 10 B. 11 B est en grande partie à l'abri de dégâts d'irradiation. Bore appauvri est un sous-produit de l' industrie nucléaire .
11 B est également un candidat comme combustible pour aneutronique fusion. Lorsque vous êtes touché par un proton avec une énergie d'environ 500 k eV, il produit trois particules alpha et 8,7 MeV d'énergie. La plupart des autres réactions de fusion impliquant hydrogène et d'hélium produisent pénétrer rayonnement de neutrons, ce qui affaiblit les structures de réacteurs et induit à long terme de la radioactivité mettant ainsi en danger le personnel d'exploitation. Considérant que, le des particules alpha à partir de 11 fusion B peuvent être transformés directement en énergie électrique, et tous les rayons se arrête dès que le réacteur est mis hors tension.
Spectroscopie RMN
Les deux 10 B et 11 B possèdent spin nucléaire. Le spin nucléaire du 10 B est 3 et celle du 11 B est de 3/2. Ces isotopes sont donc utiles dans spectroscopie de résonance magnétique nucléaire; spectromètres et spécialement adaptés à la détection du bore-11 noyaux sont disponibles dans le commerce. Les 10 B et 11 B noyaux provoquent également dans la division résonances des noyaux attachés.
Occurrence


Le bore est un élément relativement rare dans la croûte de la Terre, ne représente que 0,001%. Les dépôts commerciaux à travers le monde de borate sont estimés à 10 millions de tonnes. Turquie et des États-Unis sont les plus grands producteurs mondiaux de bore. La Turquie a 63% des réserves de bore du monde. Boron ne apparaît pas sur la Terre sous forme élémentaire, mais se retrouve combinés dans borax, acide borique, colemanite, kernite, ulexite et borates. L'acide borique est parfois présent dans volcaniques eaux de source.
Ulexite est l'un des plus d'une centaine minéraux borate; ce est un cristal fibreuse où les fibres individuelles peuvent guider la lumière comme des fibres optiques .
Économiquement importantes sources de bore sont rasorite ( kernite) et tinkal (minerai de borax). Ils sont tous deux trouvés dans le Désert de Mojave de Californie où le Tinto Borax mine Rio (aussi connu comme la mine Boron Borax US) 35 ° 2'34.447 "N 117 ° 40'45.412" W proximité Boron, CA est la Californie la plus grande mine à ciel ouvert de l 'et la plus grande mine de borax dans le monde, produisant près de la moitié du monde de borates de ce site unique. Cependant, les plus grands gisements de borax connus, beaucoup sont encore inexploitées, sont en Europe centrale et de l'Ouest la Turquie , y compris les provinces de Eskişehir, Kütahya et Balıkesir.
Production
La production de composés de bore ne implique pas de formation de bore élémentaire, mais exploite la disponibilité facile de borates.
Les premières routes à bore élémentaire impliqués réduction de oxyde borique avec des métaux tels que le magnésium ou l'aluminium . Toutefois, le produit est presque toujours contaminé avec du métal borures. Bore pur peut être préparé par réduction d'halogénures de bore volatils avec de l'hydrogène à des températures élevées. Ultrapure bore, pour l'utilisation dans l'industrie du semi-conducteur, est produit par la décomposition de diborane à des températures élevées et ensuite davantage purifié avec le fusion de zone ou les processus de Czochralski.
La tendance du marché
La consommation mondiale estimée du bore a augmenté à un niveau record de 1,8 millions de tonnes de B 2 O 3 en 2005, après une période de forte croissance de la demande en provenance d'Asie, en Europe et en Amérique du Nord. Boron capacités d'extraction et de raffinage sont jugées adéquates pour atteindre les niveaux attendus de croissance par le biais de la prochaine décennie.
La forme sous laquelle le bore est consommée a changé ces dernières années. L'utilisation de minerais comme colemanite a diminué à la suite des préoccupations plus arsenic contenu. Les consommateurs ont évolué vers l'utilisation de borates raffinés et de l'acide borique qui ont une plus faible teneur en polluants. Le coût moyen de bore cristallin est de 5 $ / g.
La demande croissante de l'acide borique a conduit un certain nombre de producteurs à investir dans des capacités supplémentaires. Eti Mine Société de la Turquie a ouvert une nouvelle usine d'acide borique avec la capacité de production de 100 000 tonnes par an au Emet en 2003. Rio Tinto a augmenté la capacité de son usine de bore à partir de 260 000 tonnes par an en 2003 à 310 000 tonnes par an d'ici à mai 2005, avec des plans pour développer cela à 366 000 tonnes par an en 2006. Les producteurs de bore chinois ne ont pas pu répondre à la demande croissante pour les borates de haute qualité. Cela a conduit à des importations de tétraborate de sodium ( borax) de plus en plus par un centuple entre 2000 et 2005 et les importations d'acide borique en hausse de 28% par an sur la même période.
La hausse de la demande mondiale a été stimulée par des taux de croissance élevés dans fibre de verre et production de borosilicate. Une augmentation rapide de la fabrication de la fibre de verre renfort de qualité en Asie avec une augmentation conséquente de la demande de borates a compensé le développement de la fibre de verre de renforcement de qualité sans bore en Europe et aux Etats-Unis. Les hausses récentes des prix de l'énergie peuvent conduire à une plus grande utilisation de la fibre de verre d'isolation de qualité, avec une croissance conséquente de la consommation de bore. Roskill Consulting Group prévoit que la demande mondiale pour le bore devrait croître de 3,4% par an pour atteindre 21 millions de tonnes d'ici 2010. On prévoit que la plus forte croissance de la demande pour être en Asie, où la demande pourrait augmenter en moyenne de 5,7% par an.
Applications
Presque tout le minerai de bore extrait de la Terre est destinée pour le raffinement dans l'acide borique et tétraborate de sodium pentahydraté. Aux États-Unis, 70% du bore est utilisé pour la production de verre et de la céramique.
Le verre et la céramique

Verre de borosilicate, qui est typiquement de 12 à 15% de B 2 O 3, SiO 2 80%, et 2% de Al 2 O 3, a une faible coefficient de dilatation thermique lui conférant une bonne résistance aux chocs thermiques. Duran et Pyrex sont deux grands noms de marque pour ce verre, utilisés dans les deux verrerie de laboratoire et consommateurs ustensiles de cuisson, principalement pour cette résistance.
Filaments de bore sont à haute résistance, des matériaux légers qui sont utilisés principalement pour avancée structures aérospatiales comme une composante de matériaux composites, ainsi que des biens de consommation de la production et sportives telles que limitées les clubs de golf et des cannes à pêche. Les fibres peuvent être produites par dépôt chimique en phase vapeur de bore sur un tungstène filament.
fibres de bore et de taille ressorts de bore cristallin submillimétriques sont produits par laser Assistée dépôt chimique en phase vapeur. Traduction du faisceau laser focalisé permet de produire des structures hélicoïdales, même complexes. De telles structures présentent de bonnes propriétés mécaniques ( module d'élasticité de 450 GPa, déformation à la rupture de 3,7%, une fracture de stress 17 GPa) et peut être appliqué comme matière de renforcement en céramique ou en systèmes micromécaniques.
des formulations de détergents et des agents de blanchiment
Borax est utilisé dans divers produits textiles ménagers et de nettoyage, y compris le bien-connu " 20 Mule Team Borax "booster de blanchisserie et" Boraxo "savon en poudre. Il est également présent dans certains formules de blanchiment des dents.
Le perborate de sodium est une source d' oxygène actif dans de nombreuses des détergents, détergents à lessive, produits de nettoyage et de lessive agents de blanchiment. Cependant, malgré son nom, "Borateem" eau de javel ne contient plus de composés du bore, en utilisant percarbonate de sodium à la place comme un agent de blanchiment.
Insecticides
L'acide borique est utilisé comme insecticide, notamment contre les fourmis, les puces, les blattes et les.
Semi-conducteurs
Le bore est un outil utile dopant pour semi-conducteurs tels que le silicium , le germanium , et carbure de silicium. Avoir un de moins électron de valence de l'atome d'hôte, il fait don d'un résultant en trou de type p de conductivité. Méthode traditionnelle de l'introduction de bore dans les semi-conducteurs se effectue par son diffusion atomique à des températures élevées. Ce procédé utilise soit solides, (B 2 O 3), liquide (BBr 3), ou à des sources gazeuses de bore (B 2 H 6 ou BF 3). Cependant, après 1970, il a été remplacé par la plupart implantation d'ions, qui repose principalement sur BF 3 en tant que source de bore. Gaz de trichlorure de bore est également un produit chimique important dans l'industrie des semi-conducteurs, mais pas pour le dopage mais plutôt pour gravure par plasma de métaux et de leurs oxydes. Triéthylborane est également injecté dans réacteurs de dépôt en phase vapeur en tant que source de bore. Des exemples sont le dépôt par plasma de couches de carbone dur contenant du bore, nitrure de films de nitrure de silicium-bore, et pour le dopage de diamant avec du bore pellicule.
Aimants
Le bore est un élément de aimants au néodyme (Nd 2 Fe 14 B), qui sont le type le plus fort de l'aimant permanent. Ils se trouvent dans une variété de dispositifs électromécaniques et électroniques domestiques et professionnels, tels que imagerie par résonance magnétique (IRM), et divers moteurs actionneurs, disques durs d'ordinateurs, lecteurs CD et DVD, téléphones mobiles, interrupteurs horaires, haut-parleurs, et ainsi de suite.
Haute dureté et composés abrasifs
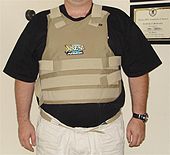
Plusieurs composés de bore sont connus pour leur extrême dureté et la ténacité.
Le carbure de bore et les poudres de nitrure de bore cubique sont largement utilisés comme abrasifs. Métal borures sont utilisés pour des outils de revêtement par dépôt chimique en phase vapeur ou dépôt en phase vapeur physique. Implantation du bore ions dans les métaux et alliages, à travers implantation d'ions ou dépôt par faisceau d'ions, se traduit par une augmentation spectaculaire de la résistance de surface et de la microdureté. Laser alliage a également été utilisé avec succès pour le même but. Ces borures sont une alternative aux outils revêtus de diamant, et leurs surfaces (traitées) ont des propriétés similaires à celles du borure vrac.
Le carbure de bore
Le carbure de bore est un matériau céramique qui est obtenu par décomposition de B 2 O 3 avec du charbon dans le four électrique:
- 2 B 2 O 3 + 7 C → B 4 C + 6 CO
La structure de carbure de bore est d'environ seulement B 4 C, et il montre une diminution nette de carbone se trouve sur cette suggéré rapport stoechiométrique. Cela est dû à sa structure très complexe. La substance peut être vu avec formule empirique B 12 C 3 (ce est à dire, avec B 12 dodécaèdres étant un motif), mais avec moins de carbone que les suggérées C 3 unités sont remplacés par les chaînes de la Colombie-Britannique, et il ya plus petit (B 6) octaèdres présente ainsi. (Voir l'article pour l'analyse structurelle).
La structure de carbure de bore polymère plus semi-cristallin répéter lui confère une grande résistance structurelle par poids. Il est utilisé dans réservoir armure, gilets pare-balles, et de nombreuses autres applications structurelles.
La capacité de carbure de bore à absorber les neutrons sans former de longue durée radionucléides (en particulier lorsque dopé avec du bore supplémentaire 10) rend le matériau attrayant comme absorbant pour le rayonnement neutronique provenant de centrales nucléaires. Les applications nucléaires de carbure de bore comprennent blindage, barres de contrôle et granulés arrêt. De barres de commande, du carbure de bore sous forme de poudre est souvent, pour augmenter son aire de surface.
| Matériel | Diamant | cube-BC 2 N | cube-BC 5 | cube-BN | B 4 C | ReB 2 |
|---|---|---|---|---|---|---|
| Dureté Vickers (GPa) | 115 | 76 | 71 | 62 | 38 | 22 |
| Ténacité (MPa m 1/2) | 5.3 | 4.5 | 9,5 | 6,8 | 3,5 |
D'autres composés du bore superdures
- Heterodiamond (également appelé BCN);
- Nitrure de bore. Ce matériau est isoélectronique de carbone . Similaire à carbone, il a à la fois hexagonale (c-BN, disques diamantés) comme formes (mous de graphite comme h-BN) et cubique. h-BN est utilisé comme un composant à haute température et lubrifiant. c-BN, également connu sous le nom commercial borazon, est un abrasif supérieure. Sa dureté est seulement légèrement plus petite, mais la stabilité chimique supérieure à celle du diamant.
- Diborure de rhénium peut être produit à des pressions ambiantes, mais est plutôt coûteux en raison du rhénium. La dureté de Reb deux expositions considérables anisotropie en raison de sa structure en couches hexagonale. Sa valeur est comparable à celle de le carbure de tungstène, le carbure de silicium, diborure de titane ou diborure de zirconium.
- AlMgB 14 + TiB 2 composites possèdent une dureté élevée et résistance à l'usure et sont utilisés soit sous forme vrac ou comme revêtements pour les composants exposés à des températures élevées et des charges portent.
Blindage dans les réacteurs nucléaires
Le bore blindage est utilisé comme contrôle pour réacteurs nucléaires, profitant de sa section haute pour la capture de neutrons.
Autres usages non médicinaux
- En raison de sa flamme verte distinctive, bore amorphe est utilisé dans fusées pyrotechniques.
- L'amidon et colles à base de caséine contient du tétraborate de sodium décahydraté (Na 2 B 4 O 7 • 10 H 2 O)
- Certains systèmes anti-corrosion contiennent borax.
- les borates de sodium sont utilisés en tant que flux pour soudage argent et d'or et le chlorure d'ammonium pour souder les métaux ferreux. Ils sont également ignifuges additifs pour matières plastiques et articles en caoutchouc.
- L'acide borique (également connu comme l'acide orthoborique) de H 3 BO 3 est utilisé dans la production de fibres de verre textiles et écrans plats et dans de nombreux PVAc et Adhésifs à base de PVOH.
- Triéthylborane est une substance qui se enflamme le JP-7 du combustible Pratt & Whitney J58 turboréacteur / statoréacteurs alimenter les Lockheed SR-71 Blackbird . Il a également été utilisé pour allumer le F-1 moteurs sur le Saturn V Rocket utilisé par la NASA s ' Apollon et Skylab programmes à partir de 1967 jusqu'en 1973. Triéthylborane convient pour cette raison de son propriétés pyrophoriques, en particulier du fait qu'il brûle à une température très élevée. Triéthylborane est un industriel dans initiateur réactions radicalaires, où il est efficace même à basses températures.
Pharmaceutique et les applications biologiques
L'acide borique a antiseptique, antifongique, et des propriétés antivirales et pour ces raisons est appliqué comme un clarificateur d'eau dans le traitement de l'eau de piscine. Solutions légères d'acide borique ont été utilisés comme antiseptiques oculaires.
Bortezomib (Velcade). Boron apparaît comme un élément actif dans sa première approuvé pharamaceutical organique dans le roman bortézomib pharmaceutique, une nouvelle classe de médicaments appelés les inhibiteurs de protéasome, qui sont actifs dans le myélome et une forme de lymphome (il est en cours d'essais expérimentaux contre d'autres types de lymphome). L'atome de bore dans le bortézomib se lie au site catalytique de la Protéasome 26S avec une haute affinité et spécificité.
- Un certain nombre de produits pharmaceutiques contenant du bore potentiels en utilisant bore-10, ont été préparés pour une utilisation dans bore thérapie par capture de neutrons (BNCT).
- Certains composés du bore sont prometteurs dans le traitement l'arthrite, mais aucun n'a encore été généralement approuvée à cette fin.
Les domaines de recherche
Diborure de magnésium est un important matériau supraconducteur à la température de transition de 39 K. MGB deux fils sont produits avec le poudre-dans-tube et procédé appliqué dans des aimants supraconducteurs.
Bore amorphe est utilisé comme un point de fusion dépresseur dans les alliages de brasure nickel-chrome.
Hexagonal de nitrure de bore atomique formes de couches minces, qui ont été utilisés pour améliorer la mobilité d'électrons dans dispositifs de graphène. Il forme également des structures de nanotubulaires ( BNNTs), qui ont une grande résistance, une stabilité chimique élevée et de haute conductivité thermique, dans sa liste de propriétés souhaitables.
Rôle biologique naturel
Il est un produit naturel contenant du bore antibiotiques , boromycin, isolé à partir de Streptomyces. Le bore est un essentiel pour les plantes des éléments nutritifs , surtout nécessaires pour maintenir l'intégrité des parois cellulaires. Inversement, les concentrations élevées de sol> 1.0 ppm peut provoquer une nécrose marginale et pointe en feuilles ainsi que la performance de la croissance globale pauvres. Niveaux aussi bas que 0,8 ppm peuvent causer ces mêmes symptômes apparaissent dans les plantes particulièrement sensibles au bore dans le sol. Presque toutes les plantes, même ceux peu tolérante de bore dans le sol, se montrent au moins certains des symptômes de toxicité de bore lorsque la teneur en bore dans le sol est supérieure à 1,8 ppm. Lorsque cette teneur dépasse 2,0 ppm, quelques plantes seront performants et certains ne peuvent pas survivre. Lorsque les niveaux de bore dans le tissu végétal dépassent 200 ppm symptômes de toxicité de bore sont susceptibles d'apparaître.
Comme ultratrace élément, le bore est nécessaire pour la santé optimale des rats, mais il est nécessaire dans de telles petites quantités que ultrapurifiée aliments et filtration des poussières de l'air est nécessaire pour induire une carence en bore, qui manifestent manteau ou les cheveux de mauvaise qualité. Vraisemblablement, le bore est nécessaire à d'autres mammifères. Aucune syndrome de déficience chez l'homme a été décrite. De petites quantités de bore se produisent couramment dans l'alimentation, et les quantités nécessaires dans le régime alimentaire seraient, par analogie avec les études sur les rongeurs, être très faible. Le rôle physiologique exact de bore dans le règne animal est mal comprise.
Boron se produit dans tous les aliments produits à partir de plantes. Depuis 1989, sa valeur nutritive a été soutenu. On pense que le bore joue plusieurs rôles biochimiques chez les animaux, y compris les humains. Le département américain de l'agriculture a mené une expérience dans laquelle les femmes ménopausées ont pris 3 mg de bore par jour. Les résultats ont montré que le bore supplémentaire réduit l'excrétion du calcium par 44%, et activés oestrogène et de la vitamine D , ce qui suggère un rôle possible dans la suppression de la l'ostéoporose. Toutefois, si ces effets étaient classiquement nutritionnel ou médicinal, n'a pu être déterminée. Les É.U Instituts nationaux de la santé stipule que «l'apport total quotidien de bore dans normales alimentation humaine varie de 2,1 à 4,3 mg de bore / jour. "
Congénitale de type endothélial de la dystrophie 2, une forme rare dedystrophie de la cornée, est liée à des mutations dansle gène qui code SLC4A11 un transporteur aurait régulation de la concentration intracellulaire de bore.
Quantification analytique
Pour la détermination de la teneur en bore dans les aliments ou les matériaux le procédé de la curcumine colorimétrique est utilisé. Le bore doit être transféré à l'acide borique ou des borates et de réaction avec la curcumine dans une solution acide, une couleur rouge bore complexe chélate, rosocyanine, est formé.
Les questions de santé et de la toxicité
Bore élémentaire, l'oxyde de bore, l'acide borique, des borates, et de nombreux des composés organiques de bore sont non toxiques pour les humains et les animaux (approximativement équivalente au sel de table). Le LD 50 (dose à laquelle il n'y a 50% de mortalité) pour les animaux est d'environ 6 g par kg de poids corporel. Substances avec LD 50 -dessus de 2 g sont considérés comme non-toxique. La dose létale minimale pour les humains n'a pas été établie. Un apport de 4 g / jour d'acide borique a été signalé sans incidents, mais plus que cela est considéré comme toxique pour plus de quelques doses. Prises de plus de 0,5 grammes par jour pour 50 jours provoquent digestifs mineurs et d'autres problèmes de toxicité suggestive. Des doses uniques de 20 médicaux g d'acide borique pour une thérapie par capture de neutrons ont été utilisés sans toxicité excessive. Les poissons ont survécu pendant 30 min dans une solution saturée d'acide borique et peuvent survivre plus longtemps dans des solutions de borax forts. L'acide borique est plus toxique pour les insectes que pour les mammifères, et est couramment utilisé comme insecticide.
Le boranes (composés de bore d'hydrogène) et des composés gazeux semblables sont très toxiques. Comme d'habitude, il est un élément qui est intrinsèquement toxiques, mais la toxicité dépend de la structure.
Les boranes sont toxiques ainsi que très inflammable et nécessitent des soins spéciaux lors de la manipulation. borohydrure de sodium présente un risque d'incendie en raison de son caractère réducteur, et la libération de l'hydrogène au contact avec de l'acide. Halogénures de bore sont corrosifs.

