
Holmium
À propos de ce écoles sélection Wikipedia
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. Voulez-vous savoir sur le parrainage? Voir www.sponsorachild.org.uk
| Holmium | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
67 Ho | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||
blanc argenté  | |||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | holmium, Ho, 67 | ||||||||||||||||||||||||||||||||||||
| Prononciation | / h oʊ l m Je ə m / HOHL -mee-əm | ||||||||||||||||||||||||||||||||||||
| Élément Catégorie | lanthanides | ||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 6, fa | ||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 164,93032 | ||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 11 6s 2 2, 8, 18, 29, 8, 2 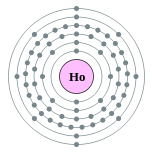 | ||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||
| Découverte | Marc Delafontaine (1878) | ||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 8,79 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 8,34 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Point de fusion | 1734 K , 1461 ° C, 2662 ° F | ||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 2993 K, 2720 ° C, 4928 ° F | ||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 17,0 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 265 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 27,15 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||
| États d'oxydation | 3, 2, 1 ( oxyde de base) | ||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,23 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 581,0 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| 2ème: 1140 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| 3ème: 2204 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Rayon atomique | 176 h | ||||||||||||||||||||||||||||||||||||
| Rayon covalente | 192 ± 19 heures | ||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | ||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||||||||
| Résistivité électrique | ( rt) (poly) 814 nΩ · m | ||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 16,2 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (poly) 11,2 um / (m · K) | ||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 2,760 m · s -1 | ||||||||||||||||||||||||||||||||||||
| Le module d'Young | 64,8 GPa | ||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 26,3 GPa | ||||||||||||||||||||||||||||||||||||
| Module Bulk | 40,2 GPa | ||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,231 | ||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 481 MPa | ||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 746 MPa | ||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-60-0 | ||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||
| Article détaillé: Les isotopes d'holmium | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Holmium est un élément chimique avec le symbole Ho et de numéro atomique 67. Une partie de la série des lanthanides , l'holmium est un élément des terres rares. Holmium a été découvert par le chimiste suédois Per Theodor Cleve. Son oxyde a été isolé à partir de minerais de terres rares en 1878 et l'élément a été nommé d'après la ville de Stockholm.
Holmium élémentaire est un blanc argenté relativement mou et malléable métal . Il est trop réactif se trouve non combinée dans la nature, mais lorsqu'il est isolé, est relativement stable dans l'air sec à température ambiante. Cependant, il réagit avec l'eau et les rouilles facilement, et sera également brûler à l'air lorsqu'il est chauffé.
Holmium se trouve dans les minerais monazite et gadolinite, et est habituellement extrait de la monazite dans le commerce en utilisant des techniques d'échange d'ions. Les composés dans la nature, et en quasi-totalité de sa chimie de laboratoire, sont oxydés trivalente, contenant des ions Ho (III). Ions trivalents holmium ont des propriétés fluorescentes similaires à de nombreux autres ions de terres rares (en cédant leur propre jeu de lignes lumineuses d'émission uniques), et des ions d'holmium sont donc utilisés de la même manière que d'autres terres rares dans certaines applications laser et le colorant de verre.
Holmium a le plus haut la force magnétique d'un élément et par conséquent est utilisé pour la pièces polaires des plus fortes statiques aimants . Parce holmium absorbe fortement les neutrons, il est également utilisé dans barres de commande nucléaires.
Caractéristiques
Propriétés physiques

Holmium est un élément relativement mou et malléable qui est assez corrosion , résistante et stable dans l'air sec à température et pression normales. Dans l'air humide et à la hausse des températures , cependant, il est rapidement oxyde, formant un oxyde jaunâtre. Dans sa forme pure, holmium possède un métallique, l'éclat argenté clair.
Holmium oxyde a des changements de couleur assez spectaculaires en fonction des conditions d'éclairage. Dans la lumière du jour, ce est une couleur jaune brunâtre. Sous trichrome lumière, il est d'un rouge orange feu, presque indiscernables de l'apparition de l'oxyde d'erbium dans les mêmes conditions d'éclairage. Le changement est lié aux bandes d'émission tranchants des ions trivalents de ces éléments, agissant en tant que substances luminescentes.
Holmium a le plus haut moment magnétique (10,6 μ
B) de tout élément naturel et possède d'autres propriétés magnétiques inhabituelles. Lorsqu'il est combiné avec l'yttrium , il forme hautement magnétiques composés. Holmium est paramagnétique dans les conditions ambiantes, mais est ferromagnétique à des températures inférieures à 19 K .
Propriétés chimiques
Métal Holmium ternit lentement à l'air et brûle facilement pour former holmium (III) oxyde:
- 4 Ho + 3 O 2 → 2 Ho 2 O 3
Holmium est assez électropositive et est généralement trivalent. Il réagit lentement avec l'eau froide et assez rapidement avec de l'eau chaude pour former de l'hydroxyde holmium:
- Ho 2 (s) + 6 H 2 O (l) 2 → Ho (OH) 3 (aq) + 3 H 2 (g)
Holmium métal réagit avec tous les halogènes:
- 2 Ho (s) + 3 F 2 (g) → 2 Hof 3 (s) [rose]
- 2 Ho (s) + 3 Cl 2 (g) → 2 HOCL 3 (s) [jaune]
- 2 Ho (s) + 3 Br 2 (g) → 2 HOBr 3 (s) [jaune]
- 2 Ho (s) + 3 I 2 (g) → 2 HoI 3 (s) [jaune]
Holmium dilué se dissout facilement dans l'acide sulfurique pour former des solutions contenant les Ho (III) des ions jaunes, qui existent en tant que [OH HO (2) 9] 3+ complexes:
- 2 Ho (s) + 3 H 2 SO 4 (aq) → 2 Ho 3+ (aq) + 3 SO 2-
4 (aq) + 3 H 2 (g)
État d'oxydation le plus commun de Holmium est trois. Holmium dans la solution est dans la forme de Ho 3+ entouré de neuf molécules d'eau. Holmium dissout dans les acides.
Isotopes
Natural holmium une contient stable isotope , holmium-165. Certains isotopes radioactifs synthétiques sont connus; la plus stable est holmium-163, avec une demi-vie de 4570 années. Tous les autres radio-isotopes avoir la moitié de l'état fondamental ne vit pas plus de 1,117 jours, et la plupart ont des demi-vies de moins de 3 heures. Cependant, la métastable 166 m1 Ho a une demi-vie d'environ 1200 années en raison de sa haute essorage. Ce fait, combiné avec une grande énergie d'excitation résultant dans un particulièrement riche spectre de décroissance rayons gamma produites lorsque l'état métastable désexcite, rend cet isotope utile dans physique nucléaire expériences comme un moyen pour calibrer les réponses de l'énergie et de l'efficacité intrinsèques de spectromètres gamma ray.
Histoire
Holmium (Holmia, latine nom pour Stockholm ) était découverte par Marc Delafontaine et Jacques-Louis Soret en 1878 qui a remarqué l'aberrante spectrographique bandes d'absorption de l'élément alors inconnu (ils l'appelaient "Element X"). Plus tard en 1878, Par Teodor Cleve découvert indépendamment l'élément alors qu'il travaillait sur erbia terre ( l'oxyde d'erbium).
En utilisant la méthode développée par Carl Gustaf Mosander, Cleve abord retiré tous les contaminants connus de erbia. Le résultat de cet effort était deux nouveaux matériaux, une brune et une verte. Il a nommé l'Holmia de substance brune (après le nom latin de la ville natale de Cleve, Stockholm) et le vert une Thulia. Holmia a été révélé plus tard être le l'oxyde d'holmium et était Thulia l'oxyde de thulium. En papier classique de Henry Moseley sur les numéros atomiques, holmium a été affecté un numéro atomique de 66. Évidemment, la préparation holmium lui avait donné pour enquêter avait été grossièrement impur, dominé par voisin (et unplotted) dysprosium. Il aurait vu des raies d'émission de rayons X pour les deux éléments, mais supposé que les dominants appartenaient à holmium, au lieu de l'impureté de dysprosium.
Présence et la production

Comme toutes les autres terres rares, holmium ne est pas naturellement présent comme un élément libre. Il ne se produit combiné avec d'autres éléments gadolinite, monazite et autres minéraux de terres rares. Les principales zones minières sont la Chine , États-Unis , le Brésil , l'Inde , le Sri Lanka et l'Australie avec des réserves de holmium estimés 400 000 tonnes.
Holmium représente 1,4 parties par million de la croûte terrestre en poids. Cela en fait le 56e élément le plus abondant dans la croûte de la terre. Holmium constitue une partie par million des sols , 400 parties par quadrillion de l'eau de mer , et presque aucun de l'atmosphère terrestre . Holmium est rare pour un lanthanides. Il représente 500 parties par billion de l' univers en poids.
Il est extrait via le commerce d'échange d'ions dans le sable monazite (0,05% de holmium), mais est encore difficile de séparer des autres terres rares. L'élément a été isolé par la réduction de son anhydre chlorure ou avec le fluorure métallique calcium . Son abondance estimée dans la terre croûte est de 1,3 mg / kg. Obéit à la Holmium Oddo-Harkins règle: comme un élément impair, il est moins abondant que son immédiate numéro pair voisins, le dysprosium et d'erbium . Cependant, il est le plus abondant des lourds impaires lanthanides . La principale source de courant sont quelques-uns des argiles ions adsorption du sud de la Chine. Certaines d'entre elles ont une composition de terres rares similaire à celle trouvée dans . xénotime ou gadolinite yttrium représente environ les deux tiers du total en poids; holmium est d'environ 1,5%. Les minerais originaux eux-mêmes sont très maigre, peut-être seulement 0,1% lanthanides totale, mais sont facilement extraits. Holmium est relativement peu coûteux pour un métal de terre rare avec le prix environ US $ 1000 par kg.
Applications

Holmium a la force magnétique le plus élevé de tout élément, et par conséquent est utilisé pour créer le plus fort généré artificiellement les champs magnétiques, lorsqu'il est placé à l'intérieur des aimants à haute résistance comme une pièce polaire magnétique (également appelé concentrateur de flux magnétique). Comme il peut absorber les neutrons de fission de race nucléaires, il est également utilisé dans les barres de commande nucléaires.
Holmium est utilisé dans yttrium fer - grenat (YIG) - yttrium et le lanthane -fluoride (YLF) lasers à semi-conducteurs trouvés dans équipement de micro-ondes (qui sont à leur tour trouvé dans une variété de paramètres médicaux et dentaires). Lasers Holmium émettent à 2,08 micromètres, et donc sont sans danger pour les yeux. Ils sont utilisés dans des applications médicales, dentaires, et des fibres optiques.
Holmium est l'un des colorants utilisés pour zircone cubique et verre , offrant coloration jaune ou rouge. Verre contenant des solutions d'oxyde d'holmium et d'oxyde d'holmium (généralement en l'acide perchlorique) ont pics acérés d'absorption optique dans la gamme spectrale de 200 à 900 nm. Ils sont donc utilisés en tant que standard de calibrage pour spectrophotomètres optiques, et sont disponibles dans le commerce.
Les radioactifs mais à vie longue Ho-166 m1 (voir «isotopes» ci-dessus) est utilisé dans l'étalonnage des spectromètres de rayons gamma.
Rôle biologique
Holmium ne joue aucun rôle biologique dans les humains , mais les sels sont capables de stimuler métabolisme. Les humains consomment environ un milligramme de holmium un an. Les plantes ne prennent pas facilement jusqu'à holmium du sol. Certains légumes ont vu leur teneur en holmium mesurée, et il se élève à 100 parties par billion.
Toxicité
De grandes quantités de holmiium sels peuvent causer des dommages graves si inhalé, consommée par voie orale, ou injecté. Les effets biologiques de l'holmium sur une longue période de temps ne sont pas connus. Holmium a un niveau de toxicité aiguë bas.

