
Cérium
Saviez-vous ...
Cette sélection se fait pour les écoles par la charité pour enfants lire la suite . Cliquez ici pour en savoir plus sur le parrainage d'enfants.
| Cérium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
58 Ce | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
blanc argenté  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | cérium, Ce, 58 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / s ɪər Je ə m / | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | lanthanides | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 6, fa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 140,116 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 1 5d 1 6s 2 2, 8, 18, 19, 9, 2  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Martin Heinrich Klaproth, Jöns Jakob Berzelius, Wilhelm Hisinger (1803) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Carl Gustaf Mosander (1839) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 6,770 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 6,55 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1068 K , 795 ° C, 1463 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 3716 K, 3443 ° C, 6229 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 5,46 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 398 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 26,94 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 4, 3, 2, 1 (Légèrement oxyde de base) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,12 (échelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 534,4 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1050 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 1949 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 181,8 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 204 ± 21 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | ( rt) (β, poly) 828 nΩ · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 11,3 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (γ, poly) 6,3 um / (m · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 2,100 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | (Forme γ) 33,6 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | (Forme γ) 13,5 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | (Forme γ) 21,5 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | (Forme γ) 0,24 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 2,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 270 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 412 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-45-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de cérium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le cérium est un élément chimique avec le symbole de Ce et de numéro atomique 58. Ce est un, argenté, métal ductile douce qui se oxyde facilement dans l'air. Cérium a été nommé d'après le planète naine Cérès (lui-même nommé pour le Déesse romaine de l'agriculture). Le cérium est le plus abondant de la éléments des terres rares, soit environ 0,0046% de la croûte terrestre en poids. Il se trouve dans un certain nombre de minéraux, l'être le plus important monazite et bastnasite. Les applications commerciales de cérium sont nombreux. Ils comprennent des catalyseurs, des additifs pour carburant pour réduire émissions et au verre et émaux pour changer leur couleur. L'oxyde de cérium est une composante importante de poudres luminophores et utilisées dans les écrans et les lampes fluorescentes verre polissage. Il est également utilisé dans le "flint" (en fait, ferrocerium) de briquets.
Caractéristiques
Propriétés physiques
Le cérium est un métal argenté, appartenant au lanthanide groupe. Il ressemble fer en couleur et le lustre, mais est doux, et les deux malléable et ductile. Cérium a le troisième plus long liquide gamme de tout élément: 2648 ° C (795 ° C à 3443 ° C) ou 4766 F ° (1463 ° F à 6229 ° F). (Seulement le neptunium et le thorium ont des gammes plus liquides.)
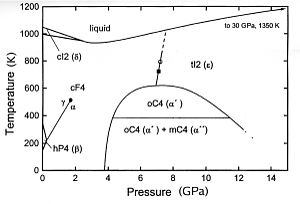
Cérium a une structure électronique variable. L'énergie du niveau 4f interne est à peu près la même que celle des électrons de valence ou externes, et seulement petite énergie est nécessaire pour modifier le taux d'occupation relative de ces niveaux électroniques. Cela donne lieu à des états de valence double. Par exemple, un changement de volume de l'ordre de 10% se produit lorsque le cérium est soumis à des pressions élevées ou très basses. Il semble que la valence change d'environ 3 à 4 quand il est refroidi ou comprimé. Le comportement à basse température de cérium est complexe. Quatre modifications allotropiques sont considérés exister: cérium à la température ambiante et à pression atmosphérique est connu comme γ-cérium. Après refroidissement à -16 ° C, les variations de γ-β-cérium de cérium. Les départs γ-cérium restants pour changer de α-cérium lorsqu'il est refroidi à -172 ° C, et la transformation est complète à 269 ° C. α-cérium a une densité de 8,16; δ-cérium existe au-dessus de 726 ° C. A la pression atmosphérique, le cérium liquide est plus dense que sa forme solide au point de fusion.
Le cérium métal est très pyrophore, ce qui signifie que quand il est constant ou rayé, les copeaux résultant prennent feu.
Propriétés chimiques
Cérium métallique ternit lentement à l'air et brûle facilement à 150 ° C pour former le cérium (IV) oxyde:
- Ce + O 2 → CeO 2
Le cérium est assez électropositive et réagit lentement avec l'eau froide et assez rapidement avec de l'eau chaude pour former l'hydroxyde de cérium:
- 2 Ce (s) + 6 H 2 O (l) → 2 Ce (OH) 3 (aq) + 3 H 2 (g)
Cérium métal réagit avec tous les halogènes:
- 2 Ce (s) + 3 F 2 (g) → 2 CeF3 (s) [blanc]
- 2 Ce (s) + 3 Cl 2 (g) → 2 CeCl3 (s) [blanc]
- 2 Ce (s) + 3 Br 2 (g) → 2 CeBr3 (s) [blanc]
- 2 Ce (s) + 3 I 2 (g) → 2 Cel3 (s) [jaune]
Le cérium diluée se dissout facilement dans l'acide sulfurique pour former des solutions contenant de l'incolore Ce (III), des ions qui existent en tant que [Ce (OH 2)] 9 3+ complexes:
- 2 Ce (s) + 3 H 2 SO 4 (aq) → 2 Ce 3+ (aq) + 3 SO 2-
4 (aq) + 3 H 2 (g)
Composés

Le cérium (IV) (cériques) les sels sont de couleur orange ou rouge jaunâtre, tandis que le cérium (III) les sels (céreux) sont habituellement blanc ou incolore. Les deux états d'oxydation absorbent la lumière ultraviolette fortement. Le cérium (III) peut être utilisé pour fabriquer des verres qui sont incolores, mais absorber la lumière ultraviolette presque complètement. Le cérium peut être facilement détectée dans des mélanges de terres rares par un test qualitatif très sensible: l'addition de l'ammoniac et du peroxyde d'hydrogène à une solution aqueuse de lanthanides produit une couleur brun foncé caractéristique si le cérium est présent.
Cérium présente trois états d'oxydation , 2, 3 et 4. L'état 2 est rare et se observe dans CeH 2, CEI 2 et EC. Le composé le plus commun de cérium est le cérium (IV) oxyde (CeO 2), qui est utilisé comme " Le rouge "Bijouterie ainsi que dans les murs de certains auto-nettoyage des fours. Deux commune agents oxydants utilisés dans titrages sont ammonium cérium (IV) (sulfate cérique d'ammonium, (NH 4) 2 Ce (SO 4 3)) et du sulfate d'ammonium cérium (IV) de nitrate (nitrate d'ammonium cérique ou CAN, (NH 4) 2 Ce (NO 3 6)). Le cérium forme également un chlorure, CeCl 3 ou le cérium (III) chlorure, utilisé pour faciliter la réaction à des groupes carbonyle dans la chimie organique . D'autres composés comprennent le cérium (III) carbonate (Ce 2 (CO 3) 3), le cérium (III) fluorure (CeF 3), le cérium (III) oxyde (Ce 2 O 3), ainsi que le cérium (IV) sulfate (sulfate cérique, Ce (SO 4) 2) et le cérium (III) triflate (Ce (OSO 2 CF 3) 3).
Les deux états d'oxydation de cérium diffèrent énormément dans la basicité: cérium (III) est une base forte, comparable aux autres lanthanides trivalents, mais le cérium (IV) est faible. Cette différence a toujours permis de cérium pour être de loin le contraire un groupe notoirement difficiles plus facilement isolé et purifié de tous les lanthanides, des éléments à séparer. Une large gamme de procédures ont été conçus dans les années à exploiter la différence. Ceux-ci comprennent:
- Lessivage des hydroxydes mixtes avec l'acide nitrique dilué: les lanthanides trivalents se dissolvent dans un état libre de cérium et du cérium tétravalent reste dans le résidu insoluble sous forme de concentré à une purification supplémentaire par d'autres moyens. Une variante de cette utilise de l'acide chlorhydrique et les oxydes calcinés de bastnasite, mais la séparation est moins forte.
- Précipitation du cérium à partir d'une solution de nitrate ou de chlorure en utilisant le permanganate de potassium et le carbonate de sodium dans un rapport de 1: 4 molaire.
- Point d'ébullition des solutions de nitrate de terres rares avec du bromate de potassium et d'éclats de marbre.
Anciennement utilisé commercialement est un procédé par lequel une solution de cérium (IV) dans de l'acide nitrique serait ajoutée à l'acide sulfurique dilué. Cela a provoqué cérium (IV) pour faire précipiter essentiellement en un sel de base, en laissant lanthanide trivalent en solution. Toutefois, le précipité finement divisé est difficile à filtrer du milieu très corrosif. En utilisant les méthodes classiques de séparation des terres rares, il y avait un avantage considérable à une stratégie d'élimination de cérium du mélange au début. Le cérium comprend habituellement 45% de la cerite ou les terres rares monazite, et en le retirant début considérablement réduit l'essentiel de ce qui devait être traitées ultérieurement (ou le coût des réactifs d'être associé à un tel traitement). Cependant, toutes les méthodes de purification de cérium invoqués basicité. Du nitrate d'ammonium cérique [hexanitratocerate ammonium (IV)] à partir de la cristallisation de l'acide nitrique est une méthode de purification. Cérium (IV) nitrate (acide hexanitratoceric) était plus facilement extractible dans certains solvants (par exemple de phosphate de tri-n-butyle) que les lanthanides trivalents. Cependant, la pratique moderne en Chine semble être de faire la purification de cérium par contre-courant extraction par solvant, dans sa forme trivalent, tout comme les autres lanthanides.
Le cérium (IV) est un oxydant fort dans des conditions acides, mais stable dans des conditions alcalines, quand il est le cérium (III) qui est un agent réducteur solide, facilement oxydé par l'oxygène atmosphérique (O 2). Cette facilité d'oxydation en milieu alcalin conduit à la séparation géochimique occasionnelle des moyens entre le cérium et la lumière de moins de lanthanides trivalents supergène intempéries conditions, leader diversement à la "négative cérium anomalie »ou à la formation de la cerianite minérale. Air-oxydation alcaline de cérium (III) est le moyen le plus économique pour obtenir de cérium (IV), qui peut ensuite être traité dans une solution acide.
Isotopes
Il ya quatre isotopes de cérium qui se produisent naturellement. Ce sont 140 Ce, qui représente 88,5% de cérium sur la terre; 142 Ce, qui constitue 11% de cérium sur la terre; 138 Ce, qui représente 0,3% de cérium sur la terre; et 136 Ce, qui constitue 0,2% de cérium sur la Terre. Cependant, seulement 140 Ce est stable. Ce 142, 138 Ce, et 136 Ce ont des demi-vies de 5 x 10 16 années, 1,5 × 10 15 années, et 70000000000000 années respectivement. En outre, certains isotopes de cérium sont présents naturellement dans l'état de traces comme le résultat de la fission de l'uranium.
39 isotopes de cérium ont été découverts tout à fait. Elles vont de 119 à 157 Ce This.
Histoire
Cérium a été découvert en Bastnäs en Suède par Jöns Jakob Berzelius et Wilhelm Hisinger, et indépendamment de l'Allemagne par Martin Heinrich Klaproth, à la fois en 1803. Le cérium a été nommé par Berzelius après la planète naine Cérès , découvert deux ans plus tôt (1801). Comme isolé à l'origine, le cérium était dans la forme de son oxyde, et a été nommé l'oxyde de cérium, un terme qui est encore utilisé. Le métal lui-même est trop électropositif être isolés par la technologie de la fusion puis à courant continu, une caractéristique de métaux des terres rares en général. Après le développement de électrochimie par Humphry Davy cinq ans plus tard, les terres ont donné dès les métaux qu'ils contiennent. Ceria, comme isolé en 1803, contenait tous les lanthanides présents dans le minerai de cerite Bastnäs, la Suède, et donc ne contenait environ 45% de ce qui est maintenant connu pour être l'oxyde de cérium pur. Ce ne est que Carl Gustaf Mosander réussi à éliminer l'oxyde de lanthane et "didymia" à la fin des années 1830, que l'oxyde de cérium a été obtenu pur. Wilhelm Hisinger était un riche propriétaire de la mine et scientifique amateur, et sponsor de Berzelius. Il détenu ou contrôlé la mine au Bastnäs, et avait essayé pendant des années pour savoir la composition de l'abondante gangue Heavy Rock (le «Tungsten des Bastnäs"), maintenant connu comme cerite, qu'il avait dans sa mine. Mosander et sa famille vivaient depuis de nombreuses années dans la même maison que Berzelius et Mosander a sans doute été persuadés par Berzelius pour enquêter sur l'oxyde de cérium plus loin.
Lorsque les terres rares ont été découverts, car ils étaient les bases fortes comme les oxydes de calcium ou de magnésium, ils ont été pensés pour être bivalent. Ainsi, "cérique" cérium a été pensé pour être trivalent et le rapport de l'état d'oxydation a donc été pensé pour être 1,5. Berzelius a été ennuyé de continuer à obtenir le bon ratio de 1,33.
À la fin des années 1950, la division chimique de Potash américaine Lindsay and Chemical Corporation du West Chicago, Illinois, le plus grand producteur de terres rares dans le monde, offrait composés de cérium dans deux gammes de pureté, "commercial" à 94-97% de pureté, et "purifié", à une pureté rapporté 99,9% de +. Dans leur 1 Octobre, liste de 1958 des prix, les quantités d'une livre d'oxydes ont été au prix de $ 3,30 $ 8,10 respectivement pour les deux puretés; le prix par livre pour des quantités de 50 livres étaient respectivement de $ 1,95 ou 4,95 $ pour les deux catégories. sels de cérium étaient proportionnellement moins cher, reflétant leur contenu net inférieur d'oxyde.
Occurrence

Le cérium est le plus abondant de la éléments de terres rares, soit environ 0,0046% de la croûte terrestre en poids. Il se trouve dans un certain nombre de minéraux, y compris allanite (également connu sous le nom orthite) - (Ca, Ce, La, Y) 2 (Al, Fe) 3 (SiO 4) 3 (OH), monazite (Ce, La, Th, Nd, Y) PO 4, bastnasite (Ce, La, Y) CO 3 F, hydroxylbastnasite (Ce, La, Nd) CO 3 (OH, F), rhabdophane (Ce, La, Nd) PO 4 -H 2 O, zircon (ZrSiO 4), et synchysite Ca (Ce, La, Nd, Y) (CO 3) 2 F. Monazite et bastnasite sont actuellement les deux plus importantes sources de cérium. D'importants gisements de monazite, allanite et bastnasite fourniront le cérium, le thorium et d'autres métaux des terres rares pendant de nombreuses années à venir.
la teneur en cérium dans le sol varie entre 2 et 150 parties par million (ppm), avec une moyenne de 50 ppm. L'eau de mer contient 1,5 parties par billion de cérium. Il n'y a presque pas de cérium dans l'atmosphère.
Production
Les mélanges minéraux sont écrasés, broyés et traités avec concentré chaud de l'acide sulfurique pour produire des sulfates de terres rares solubles dans l'eau. Les filtrats acides sont partiellement neutralisés avec de l'hydroxyde de sodium à pH 4.3. thorium précipite dans la solution sous forme d'hydroxyde et est enlevée. Après que la solution est traitée avec oxalate d'ammonium pour convertir les terres rares pour leur insoluble oxalates. Les oxalates sont convertis en oxydes par recuit. Les oxydes sont dissous dans de l'acide nitrique qui exclut l'un des composants principaux, le cérium, dont les sels sont insolubles dans HNO 3. Cérium métallique est préparé par des techniques de réduction métallo, comme en réduisant le fluorure de cérium ou le chlorure de calcium , ou par électrolyse du chlorure céreux fondu ou d'autres halogénures céreux. La technique métallothermique est utilisé pour produire de haute pureté cérium.
Applications
Une application technologique majeur pour le cérium (III) est un oxyde Convertisseur catalytique pour la réduction des émissions de CO dans les gaz d'échappement des véhicules à moteur. En particulier, l'oxyde de cérium est ajouté dans les carburants diesel. Une autre utilisation importante de l'oxyde de cérium est un hydrocarbure catalyseur dans fours auto-nettoyants, incorporés dans les parois du four et comme un catalyseur dans le craquage du pétrole raffinage du pétrole.
Oxyde de cérium (IV) est considéré comme l'un des agents les plus efficaces pour polissage de précision de composants optiques. Composés de cérium sont également utilisés dans la fabrication de verre , en tant que composant et en tant que décolorant. Par exemple, le cérium (IV) oxyde en combinaison avec titane (IV) oxyde donne une couleur jaune d'or au verre; il permet également à l'absorption sélective de lumière ultraviolette dans le verre. L'oxyde de cérium a une haute indice de réfraction et est ajouté à l'émail pour la rendre plus opaque.
Oxyde de cérium (IV) est utilisé dans les manchons à incandescence, comme le Welsbach manteau, où il a été combiné avec le thorium, le lanthane , magnésium ou yttrium oxydes. Dopé avec d'autres oxydes de terres rares, il a été étudié en tant qu'électrolyte solide dans l'oxyde solide à température intermédiaire les piles à combustible: Les le cérium (IV) oxyde de cérium (III) ou le cycle de l'oxyde CeO 2 / Ce cycle 2 O 3 est en deux étapes procédé thermochimique à base de cérium (IV) l'oxyde de cérium et (III) oxyde pour la production d'hydrogène.
La photostabilité des pigments peut être améliorée par addition de cérium. Il fournit des pigments avec résistance à la lumière et empêche polymères claires de noircir au soleil. des plaques de verre de télévision sont soumis à un bombardement électronique, qui tend à les obscurcir par création de Centres de couleur F-centre. Cet effet est supprimée par addition d'oxyde de cérium. Le cérium est aussi une composante essentielle de luminophores utilisés dans les écrans de télévision et les lampes fluorescentes. Sulfure de cérium forme un pigment rouge qui reste stable à 350 ° C. Le pigment est une alternative non toxique pour des pigments de sulfure de cadmium.
Une utilisation traditionnelle de cérium était dans le pyrophore alliage mischmetal utilisé pour silex lumière. En raison de la forte affinité de cérium de soufre et d'oxygène, il est utilisé dans différents alliages d'aluminium et des alliages de fer. Dans les aciers , degasifies de cérium et peut aider à réduire les sulfures et oxydes, et ce est un agent de durcissement par précipitation dans acier inoxydable. Ajout de cérium fontes oppose graphitisation et produit un fer malléable. L'addition de 3 à 4% de cérium de magnésium des alliages, ainsi que 0,2 à 0,6% de zirconium , contribue affiner le grain et de donner son moulage de formes complexes. Il ajoute également résistance à la chaleur à des moulages de magnésium. Cérium métal est parfois ajouté à l'aluminium pour améliorer la résistance à la corrosion de l'aluminium.
alliages de cérium sont utilisées dans les aimants permanents et tungstène pour électrodes Soudage TIG . Le cérium est utilisé dans éclairage, en particulier dans l'arc de carbone cinématographique industrie. Le cérium est un oxalate médicament anti-émétique. Le cérium (IV) sulfate est largement utilisé comme volumétrique agent oxydant dans l'analyse quantitative. Du nitrate d'ammonium cérique est un oxydant utile à un électron de la chimie organique, utilisé pour graver par oxydation des composants électroniques, et comme un étalon primaire pour l'analyse quantitative.
Rôle biologique
Cérium peut agir semblable à du calcium dans les organismes, afin accumule dans os en petites quantités. Le cérium est également présent en petites quantités dans des plants de tabac, de l'orge , et le bois de hêtres . Cependant, très peu de cérium se accumule dans le chaîne alimentaire. Human sang contient 0,001 ppm, ossements humains contiennent 3 ppm, et humain tissu contient 0,3 ppm de cérium. Il ya un total de 40 milligrammes de cérium dans un cadre typique de 70 kg humaine. Les humains consomment généralement moins d'un milligrammes par jour de cérium. Cérium sert aucune fonction biologique connue, mais des sels de cérium peut stimuler le métabolisme.
Précautions
Cérium, comme tous les métaux des terres rares, est de faible à une toxicité modérée. Le cérium est un réducteur fort et se enflamme spontanément à l'air à 65 à 80 ° C. Les fumées des feux de cérium sont toxiques. Eau ne doit pas être utilisé pour arrêter les feux de cérium, en cérium réagit avec l'eau pour produire du gaz d'hydrogène. Les travailleurs exposés à de cérium ont connu des démangeaisons, sensibilité à la chaleur, et des lésions de la peau. Cérium ne est pas toxique lorsqu'il est consommé par voie orale, mais les animaux injectés avec de fortes doses de cérium sont morts en raison de collapsus cardio-vasculaire. Le cérium est plus dangereuse pour les organismes aquatiques, en raison d'être dommageable pour les membranes cellulaires. Oxyde de cérium (IV) est un agent oxydant puissant à des températures élevées et va réagir avec les matières organiques combustibles. Alors que le cérium ne est pas radioactif, la qualité commerciale impure peut contenir des traces de thorium, qui est faiblement radioactifs.

