
Europium
Renseignements généraux
Enfants SOS ont produit une sélection d'articles de wikipedia pour les écoles depuis 2005. Cliquez ici pour plus d'informations sur les enfants SOS.
| Europium | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
63 Eu | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||
blanc argenté, mais rarement vu sans oxyde décoloration  | ||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | europium, Eu, 63 | |||||||||||||||||||||||||||||||||
| Prononciation | / j ʊ r oʊ p Je ə m / Ewing ROH -pee-əm | |||||||||||||||||||||||||||||||||
| Élément Catégorie | lanthanides | |||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 6, fa | |||||||||||||||||||||||||||||||||
| Poids atomique standard | 151,964 | |||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 7 6s 2 2, 8, 18, 25, 8, 2 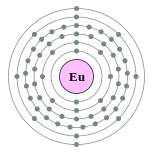 | |||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||
| Découverte | Eugène Anatole Demarçay (1896) | |||||||||||||||||||||||||||||||||
| Premier isolement | Eugène Anatole Demarçay (1901) | |||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 5,264 g · cm -3 | |||||||||||||||||||||||||||||||||
| Liquid densité au mp | 5,13 g · cm -3 | |||||||||||||||||||||||||||||||||
| Point de fusion | 1099 K , 826 ° C, 1519 ° F | |||||||||||||||||||||||||||||||||
| Point d'ébullition | 1802 K, 1529 ° C, 2784 ° F | |||||||||||||||||||||||||||||||||
| La chaleur de fusion | 9,21 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 176 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 27,66 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||
| États d'oxydation | 3, 2, 1 (Légèrement oxyde de base) | |||||||||||||||||||||||||||||||||
| Électronégativité | ? 1,2 (échelle de Pauling) | |||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 547,1 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| 2ème: 1085 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| 3ème: 2404 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| Rayon atomique | 180 h | |||||||||||||||||||||||||||||||||
| Rayon covalente | 198 ± 18 heures | |||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||
| Crystal structure | cubique centré  | |||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | |||||||||||||||||||||||||||||||||
| Résistivité électrique | ( rt) (poly) 0,900 μΩ · m | |||||||||||||||||||||||||||||||||
| Conductivité thermique | est. 13,9 W · m -1 K -1 | |||||||||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (poly) 35,0 um / (m · K) | |||||||||||||||||||||||||||||||||
| Le module d'Young | 18,2 GPa | |||||||||||||||||||||||||||||||||
| Module de cisaillement | 7,9 GPa | |||||||||||||||||||||||||||||||||
| Module Bulk | 8,3 GPa | |||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,152 | |||||||||||||||||||||||||||||||||
| Dureté Vickers | 167 MPa | |||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-53-1 | |||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de l'europium | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
Europium est un élément chimique avec le symbole Eu et de numéro atomique 63. Il est nommé d'après le continent de l'Europe . Ce est un argenté modérément dure métal qui se oxyde facilement dans l'air et l'eau . Être un membre typique de la lanthanides série, l'europium assume généralement le degré d'oxydation 3, mais l'état d'oxydation 2 est également fréquent: tous les composés d'europium avec l'état d'oxydation 2 sont légèrement réducteur. Europium n'a pas de rôle biologique important et est relativement non toxique par rapport à d'autres métaux lourds. La plupart des applications de l'europium exploitent la phosphorescence de composés d'europium.
Caractéristiques
Propriétés physiques


L'europium est un métal ductile d'une dureté similaire à celle du plomb . Il cristallise dans un corps-réseau cubique centré. Certaines propriétés de l'europium sont fortement influencées par sa demi-remplie shell électrons. Europium a le point de fusion plus bas et le deuxième plus faible densité de tous les lanthanides.
L'europium est un supraconducteur lorsqu'il est refroidi en dessous de 1,8 K et comprimé à plus de 80 GPa. Ce est parce que l'europium divalent est à l'état métallique, et est convertie en l'état trivalent par la pression appliquée. Dans l'état divalent, le fort moment magnétique local (J = 7/2) supprime la supraconductivité, qui est induite par l'élimination de ce moment local (J = 0 dans Eu 3+).
Propriétés chimiques
L'europium est le plus réactif élément des terres rares. Il se oxyde rapidement dans l'air, de sorte que l'oxydation de la masse d'un échantillon de taille centimétrique se produit en quelques jours. Sa réactivité avec l'eau est comparable à celle de calcium , et le mélange réactionnel est
- 2 Eu + 6 H 2 O → 2 Eu (OH) 3 + 3 H 2
En raison de la forte réactivité, des échantillons de l'europium solide ont rarement l'aspect brillant du métal frais, même lorsque revêtue d'une couche protectrice d'huile minérale. L'europium se enflamme à l'air à 150 à 180 ° C pour former l'europium (III) de l'oxyde:
- 4 Eu + 3 O 2 → 2 Eu 2 O 3
Europium se dissout facilement dans diluée de l'acide sulfurique pour former des solutions de roses pâles de l'UE (III) hydraté, qui existe en tant que nonahydrate:
- Eu 2 + 3 H 2 SO 4 + 18 H 2 O 2 → [Eu (H 2 O) 9] 3+ + 3 SO 2-
4 + 3 H 2
Eu (II) par rapport à Eu (III)
Bien que généralement trivalent, l'europium forme facilement des composés bivalents. Ce comportement est inhabituel pour la plupart des lanthanides , qui forment presque exclusivement composés avec un état d'oxydation de +3. L'Etat a un 2 configuration électronique 4 f 7 parce que la demi-rempli f -shell donne plus de stabilité. En termes de taille et de nombre de coordination, l'europium (II) et de baryum (II) sont similaires. Par exemple, les sulfates de baryum et deux europium (II) sont également fortement insoluble dans l'eau. L'europium divalent est un agent réducteur doux, l'oxydation dans l'air pour former des composés Eu (III). Dans anaérobie et des conditions particulièrement géothermiques, la forme bivalent est suffisamment stable qu'elle tend à être incorporé dans les minéraux de calcium et les autres terres alcalines. Ce processus d'échange d'ions est la base de la "europium anomalie négative", la faible teneur en europium dans de nombreux minéraux lanthanides tels que la monazite, par rapport à la chondritique abondance. Bastnäsite tend à montrer moins d'une anomalie de l'europium négative que ne le fait la monazite, et est la principale source de l'europium aujourd'hui donc. Le développement de méthodes faciles à séparer l'europium des autres lanthanides trivalents fait l'europium accessible, même lorsqu'il est présent en faible concentration, comme ce est généralement.
Isotopes
Naturellement l'europium survenant est composé de deux isotopes , 151 et 153 Eu Eu, avec 153 Eu étant plus abondante (52,2% du abondance naturelle). Alors que 153 Eu est stable, 151 Eu a été récemment jugée instable pour désintégration alpha avec une demi-vie de 5 11
18 × 10 -3 année, ce qui donne environ 1 désintégration alpha par deux minutes dans chaque kilogramme de l'europium naturel. Cette valeur est en accord raisonnable avec les prédictions théoriques. Outre le radio-isotope naturel 151 Eu, 35 radio-isotopes artificiels ont été caractérisés, le plus stable étant de 150 Eu avec une demi-vie de 36,9 années, 152 Eu avec une demi-vie de 13,516 années, et 154 Eu avec une demi-vie de 8,593 années. Tout le reste isotopes radioactifs ont une demi-vie de moins de 4,7612 années, et la majorité d'entre eux ont des demi-vies plus courtes que 12,2 secondes. Cet élément a également huit États méta, avec l'être le plus stable 150m Eu (T ½ = 12,8 heures), 152m1 Eu (T ½ = 9,3116 heures) et 152m2 Eu (T ½ = 96 minutes).
Le primaire mode de désintégration des isotopes plus léger que 153 Eu est capture d'électrons, et le principal mode d'isotopes plus lourds est désintégration bêta moins. Le primaire produits de désintégration avant 153 Eu sont des isotopes de samarium (Sm) et les produits primaires après sont des isotopes du gadolinium (Gd).
L'europium en tant que produit de la fission nucléaire
| Isotope | 151 Eu | 152 Eu | 153 Eu | 154 Eu | 155 Eu |
|---|---|---|---|---|---|
| Rendement | ~ 10 | faible | 1580 | > 2,5 | 330 |
| Barns | 5900 | 12800 | 312 | 1340 | 3950 |
| Prop: Unité: | t ½ une | Rendement % | Q * keV | βγ * |
|---|---|---|---|---|
| 155 Eu | 4,76 | 0,0803 | 252 | βγ |
| 85 Kr | 10,76 | 0,2180 | 687 | βγ |
| 113m Cd | 14,1 | 0,0008 | 316 | β |
| 90 Sr | 28,9 | 4,505 | 2826 | β |
| 137 Cs | 30,23 | 6,337 | 1176 | β γ |
| 121m Sn | 43,9 | 0,00005 | 390 | βγ |
| 151 Sm | 90 | 0,5314 | 77 | β |
| Hover souligné: plus d'info | ||||
Europium est produit par la fission nucléaire, mais le rendements de produits de fission d'isotopes d'europium sont faibles près du haut de la gamme des masses produits de fission.
Comme d'autres lanthanides , de nombreux isotopes, en particulier des isotopes avec des numéros impairs de masse et isotopes de neutrons pauvres comme 152 Eu, avoir une grande pour des sections transversales capture de neutrons, souvent assez haut pour être poisons neutroniques.
151 Eu est le produit de désintégration bêta de samarium-151, mais depuis cela a une longue décroissance demi-vie et peu de temps moyen à l'absorption de neutrons, plus 151 Sm se termine à la place comme 152 Sm.
152 Eu (demi-vie 13,516 années) et 154 Eu (demi-vie 8,593 années) ne peuvent pas être des produits de désintégration bêta, car 152 154 Sm et Sm sont non-radioactifs, mais 154 Eu est le seul long vécu "blindé" nucléide, à l'exception 134 Cs, d'avoir un rendement de fission de plus de 2,5 parties par million de fissions. Une plus grande quantité de 154 Eu est produit par activation des neutrons d'une partie importante de la non-radioactif 153 Eu; Cependant, une grande partie est en outre converti en 155 Eu.
155 Eu (demi-vie 4,7612 années) a un rendement de fission de 330 parties par million (ppm) pour uranium-235 et les neutrons thermiques; de plus il est transmuté de non-radioactif et non absorbant gadolinium-156 à la fin de carburant brûler.
Dans l'ensemble, l'europium est éclipsé par le césium-137 et strontium-90 comme un danger de rayonnement, et par le samarium et d'autres comme un poison de neutrons.
Occurrence

L'europium est pas trouvé dans la nature comme un élément libre. De nombreux minéraux contiennent europium, avec les sources les plus importantes étant bastnäsite, monazite, xénotime et loparite.
L'appauvrissement ou enrichissement en minéraux de l'europium par rapport aux autres éléments de terres rares est connue comme la europium anomalie. Europium est communément inclus dans les études d'oligo-éléments dans géochimie et pétrologie de comprendre les processus qui forment les roches ignées (de roches qui se sont refroidies de magma ou la lave ). La nature de l'anomalie europium trouvé aide à reconstruire les relations au sein d'une suite de roches ignées.
Europium divalent (Eu 2+) en petites quantités est l'activateur du bleu vif fluorescence de certains échantillons de la matière minérale fluorite (CaF 2). La réduction de Eu 3+ de Eu 2+ est induite par irradiation avec des particules énergétiques. Les exemples les plus remarquables de cette origine autour Weardale et les parties adjacentes du nord de l'Angleterre; ce était la fluorite trouvé ici que fluorescence a été nommé d'après, même si ce ne est que beaucoup plus tard que l'europium a été déterminée comme étant la cause.
Production
L'europium est associée à l'autre éléments de terre rare et est donc extrait avec eux. La séparation des éléments des terres rares est une étape dans le traitement ultérieur. Éléments de terres rares sont présents dans les minéraux bastnäsite, loparite, xénotime, et monazite en quantités exploitables. Les deux premiers sont des minéraux orthophosphates LnPO 4 (Ln désigne un mélange de tous les lanthanides sauf promethium ), et le troisième est un fluorocarbonate LNCO 3 F. Monazite contient également du thorium et de l'yttrium , ce qui complique la manipulation parce que le thorium et ses produits de désintégration sont radioactifs. Pour l'extraction du minerai et l'isolement des lanthanides individuelles, plusieurs méthodes ont été développées. Le choix de la méthode est basée sur la concentration et la composition du minerai et de la distribution des lanthanides individuels dans le concentré résultant. Torréfaction du minerai et la lixiviation acide et basique ultérieure est utilisé principalement pour produire un concentré de lanthanides. Si le lanthanide est le cérium dominante, puis elle est convertie à partir de cérium (III) en cérium (IV) et ensuite précipité. En outre séparation par extractions par solvant ou Chromatographie d'échange d'ions donne une fraction qui est enrichie en europium. Cette fraction est réduite avec du zinc, zinc / amalgame, l'électrolyse ou d'autres procédés de conversion de l'europium (III) en europium (II). L'europium (II) réagit d'une manière similaire à celle de métaux alcalino-terreux et par conséquent, il peut être précipité sous forme de carbonate ou est co-précipité avec du sulfate de baryum. Europium métal est disponible par l'électrolyse d'un mélange fondu de EuCl 3 et NaCl (ou CaCl 2) dans une cellule de graphite, qui sert de cathode, en utilisant du graphite comme anode. L'autre produit est le chlore gazeux.
Quelques grands dépôts produisent ou ont produit une quantité significative de la production mondiale. Le Bayan Obo gisement de minerai de fer contient des quantités importantes de bastnäsite et monazite et est, avec environ 36 millions de tonnes de rares oxydes d'éléments de la terre, le plus grand gisement connu. Les opérations minières du gisement Bayan Obo fait de la Chine le plus grand fournisseur d'éléments de terres rares dans les années 1990. Seulement 0,2% de la teneur en élément des terres rares est l'europium. La seconde source importante de métaux des terres rares entre 1965 et sa fermeture à la fin des années 1990 est la Mountain Pass mine de terres rares. Le bastnäsite extrait il est particulièrement riche en éléments des terres rares légères (La-Gd, Sc et Y) et ne contient que 0,1% de l'europium. Une autre grande source pour les éléments des terres rares est le loparite trouve sur la péninsule de Kola. Il contient plus de niobium, le tantale et le titane jusqu'à 30% des éléments de terres rares et est la plus grande source de ces éléments en Russie.
Composés

Halogénures
Europium métal réagit avec tous les atomes d'halogène:
- Eu + 3 2 2 X → 2 EuX 3 (X = F, Cl, Br, I)
Cette route donne l'europium blanc (III) fluorure (FUE 3), jaune europium (III) chlorure (EuCl 3), l'europium gris (III) du bromure (EuBr 3), et l'europium incolore (III) d'iodure (EUI 3). Europium forme également les dihalogénures correspondant: l'europium jaune-vert (II) de fluorure (FUE 2), l'europium incolore (II) chlorure (EuCl 2), l'europium incolore (II) du bromure (EuBr 2), et l'europium vert (II) d'iodure ( Eui 2).
Chalcogenides et pnictures
Europium forme des composés stables avec tous les chalcogènes, mais les chalcogènes lourds stabiliser l'état d'oxydation inférieur. Trois oxydes sont connus: l'oxyde d'europium (II) (EuO), l'europium (III) oxyde (Eu 2 O 3), et l'oxyde mixte (Eu 3 O 4). Sinon, les principales chalcogénures sont europium (II) de sulfure (EUS), l'europium (II) séléniure (euse) et l'europium (II) tellurure (EuTe): tous les trois d'entre eux sont solides noir. EuS est préparé par la sulfuration de l'oxyde à des températures suffisamment élevées pour décomposer l'Eu 2 O 3:
- Eu 2 O 3 + 3 H 2 S → 2 + 3 EuS H 2 O + S
Le principal nitrure est l'europium (III) nitrure (EUN).
Histoire
Bien que l'europium est présent dans la plupart des minéraux contenant les autres éléments rares, en raison des difficultés à séparer les éléments, il ne était pas jusqu'à la fin des années 1800 que l'élément a été isolé. William Crookes observé les spectres phosphorescente des éléments rares et observer raies spectrales tard affectés à l'europium.
Europium a été trouvée par Paul Émile Lecoq de Boisbaudran en 1890, qui a obtenu des fractions de base à partir de concentrés de samarium-gadolinium qui avaient raies spectrales non comptabilisés par le samarium ou le gadolinium . Cependant, la découverte de l'europium est généralement créditée au français chimiste Eugène Anatole Demarçay, qui soupçonnait des échantillons de l'élément samarium récemment découvert étaient contaminés par un élément inconnu en 1896 et qui a réussi à l'isoler en 1901; puis il a nommé l'europium.
Lorsque la dopé à l'europium yttrium orthovanadate phosphore rouge a été découvert au début des années 1960, et entend sur le point de provoquer une révolution dans l'industrie de la télévision couleur, il y avait une lutte pour l'offre limitée de l'europium en main parmi les processeurs de monazite, que le contenu typique d'europium dans monazite est d'environ 0,05%. Cependant, le Molycorp dépôt bastnäsite au Mine de Mountain Pass, en Californie , dont les lanthanides avait une teneur anormalement élevée d'europium de 0,1%, était sur le point de venir en ligne et de fournir l'europium suffisante pour soutenir l'industrie. Avant l'europium, la couleur TV phosphore rouge était très faible, et les autres couleurs de phosphore a dû être coupé, pour maintenir l'équilibre des couleurs. Avec le rouge brillant europium phosphore, il ne était plus nécessaire de couper les autres couleurs, et une image beaucoup plus lumineux TV couleur était le résultat. Europium a continué en usage dans l'industrie de la télévision depuis, et, bien sûr, aussi dans les écrans d'ordinateur. Bastnäsite californienne fait maintenant face à la rude concurrence des Bayan Obo, en Chine, avec un même plus «riche» teneur en europium de 0,2%.
Frank Spedding, célébré pour son développement de la technologie d'échange d'ions qui a révolutionné l'industrie de terre rare dans le milieu des années 1950 une fois raconté l'histoire de comment il enseignait sur les terres rares dans les années 1930 quand un vieux monsieur se approcha de lui avec une offre de un don de plusieurs livres d'oxyde d'europium. Ce était une quantité inouïe à l'époque, et Spedding n'a pas pris au sérieux l'homme. Cependant, un paquet dûment arrivé par la poste, contenant plusieurs kilos de véritable oxyde d'europium. Le vieux monsieur avait avéré être Herbert Newby McCoy qui avait développé une méthode célèbre de la purification de l'europium impliquant la chimie redox.
Applications

Par rapport à la plupart des autres éléments, des applications commerciales pour l'europium sont peu nombreux et assez spécialisé. Presque invariablement, ils exploitent la phosphorescence, soit à l'état oxydation +2 ou +3.
C'est un dopant dans certains types de verre dans les lasers et autres dispositifs optoélectroniques. l'oxyde d'europium (Eu 2 O 3) est largement utilisé comme un rouge phosphore dans téléviseurs et les lampes fluorescentes, et en tant qu'activateur pour yttrium -based luminophores. Couleur écrans de télévision contiennent entre 0,5 et 1 g d'europium. Considérant que l'europium trivalent donne luminophores rouges, la luminescence de l'europium divalent dépend du réseau hôte, mais a tendance à être sur le côté bleu. Les deux classes de phosphore à base de l'europium (rouge et bleu), combinées avec les jaune / vert terbium luminophores donnent lumière «blanche», la température de couleur qui peut être modifiée en modifiant la proportion ou la composition spécifique des luminophores individuels. Ce système de phosphore est généralement rencontré dans les ampoules hélicoïdaux fluorescents. En combinant les trois mêmes classes est une façon de rendre les systèmes trichromatiques dans les écrans de télévision et d'ordinateur. L'europium est également utilisé dans la fabrication du verre fluorescent. Un des luminophores persistants après-éclat plus connus en plus de cuivre dopé sulfure de zinc est dopé europium aluminate de strontium. fluorescence europium est utilisé pour interroger interactions biomoléculaires dans les écrans de découverte de médicaments. Il est également utilisé dans les luminophores anti-contrefaçon à Euro billets de banque.
Une demande qui a presque tombé en désuétude avec l'introduction de supraconducteurs abordables aimants est l'utilisation de complexes d'europium, comme Eu (fod) 3, comme réactifs de déplacement dans Spectroscopie RMN. Réactifs de déplacement chiraux, tels que Eu (hfc) 3 sont encore utilisés pour déterminer pureté énantiomérique.
Précautions
Il n'y a pas d'indications claires que l'europium est particulièrement toxique par rapport à d'autres métaux lourds. Europium nitrate de chlorure et d'oxyde ont été testés pour la toxicité: chlorure d'europium montre un intrapéritonéale DL 50 aiguë de toxicité de 550 mg / kg et la DL 50 orale toxicité aiguë est 5000 mg / kg. nitrate d'europium montre un peu plus élevé intraperitoneale toxicité DL 50 de 320 mg / kg, tandis que la toxicité orale est supérieure à 5000 mg / kg. La poussière de métal présente un risque d'incendie et d'explosion.

