
Erbium
Saviez-vous ...
SOS Enfants, qui se déroule près de 200 sos écoles dans le monde en développement, a organisé cette sélection. Parrainage d'enfants aide les enfants du monde en développement à apprendre aussi.
| Erbium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
68 Er | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
blanc argenté  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | erbium, Er, 68 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / ɜr b Je ə m / UR -bee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | lanthanides | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 6, fa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 167,259 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 12 6s 2 2, 8, 18, 30, 8, 2 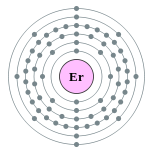 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Carl Gustaf Mosander (1842) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 9,066 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 8,86 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1802 K , 1529 ° C, 2784 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 3141 K, 2868 ° C, 5194 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 19,90 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 280 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 28,12 J · mol -1 .K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 3, 2, 1 ( oxyde de base) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,24 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 589,3 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1150 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 2194 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 176 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 189 ± 18 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique à 300 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | ( rt) (poly) 0,860 μΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 14,5 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (poly) 12,2 um / (m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 2,830 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 69,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 28,3 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 44,4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,237 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 589 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 814 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-52-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de l'erbium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'erbium est un élément chimique dans le lanthanide série, avec le symbole Er et de numéro atomique 68. Un métal solide blanc argenté lorsque isolé artificiellement, l'erbium naturel est toujours trouvé en combinaison chimique avec d'autres éléments sur la Terre. En tant que tel, ce est un un élément de terre rare qui est associé à plusieurs autres éléments rares dans le minéral gadolinite partir Ytterby en Suède .
Principales utilisations de l'erbium impliquent ses ions de couleur rose Er 3+, qui ont des propriétés fluorescentes optiques particulièrement utiles dans certaines applications laser. Des lunettes ou des cristaux dopée à l'erbium peuvent être utilisés comme milieux d'amplification optique, où les ions erbium (III) sont optiquement pompés autour de 980 nm ou 1480 nm puis rayonnent de lumière à 1530 nm en émission stimulée. Ce processus aboutit à une inhabituellement simple mécaniquement laser Amplificateur optique pour des signaux transmis par la fibre optique. La longueur d'onde 1550 nm est particulièrement important pour communications optiques parce que le mode standard unique fibres optiques ont une perte minimale à cette longueur d'onde particulière. En plus de lasers à fibres optiques, une grande variété d'applications médicales (ce est à dire la dermatologie, dentisterie) utilisent 2940 nm émission de l'ion erbium (voir Er: YAG), qui est fortement absorbée dans l'eau dans les tissus, ce qui rend son effet très superficiel. Un tel dépôt de tissu superficielle de l'énergie laser est utile pour la chirurgie au laser, et pour la production efficace de vapeur d'eau pour l'émail ablation laser dans certains types de dentisterie au laser.
Caractéristiques
Propriétés physiques

Un trivalent élément, l'erbium pur métal est malléable (ou facilement en forme), doux mais stable dans l'air et ne est pas oxyder aussi rapidement que certains autres métaux des terres rares. Son sels sont rose, et l'élément a caractéristique forte bandes de spectres d'absorption dans la lumière visible , ultraviolette , et à proximité infrarouge. Sinon, il ressemble beaucoup les autres terres rares. Son sesquioxyde est appelée erbium. Les propriétés de l'erbium sont à un degré dicté par le type et la quantité d'impuretés présentes. Erbium ne joue aucun rôle biologique connu, mais est pensé pour être en mesure de stimuler métabolisme.
Erbium est ferromagnétique inférieure à 19 K, antiferromagnétique entre 19 et 80 K et paramagnétique au-dessus de 80 K.
L'erbium peut former des agrégats atomiques en forme d'hélice Er 3 N, où la distance entre les atomes d'erbium est de 0,35 nm. Ces groupes peuvent être isolés en les encapsulant dans molécules de fullerène, comme le confirme La microscopie électronique à transmission.
Propriétés chimiques
Erbium métallique ternit lentement à l'air et brûle facilement pour former l'erbium (III) oxyde:
- 4 Er + 3 O 2 → 2 Er 2 O 3
Erbium est assez électropositive et réagit lentement avec l'eau froide et assez rapidement avec de l'eau chaude pour former de l'hydroxyde erbium:
- Er 2 (s) + 6 H 2 O (l) → Er 2 (OH) 3 (aq) + 3 H 2 (g)
Erbium métal réagit avec tous les halogènes:
- 2 Er (s) + 3 F 2 (g) → 2 ErF 3 (s) [rose]
- Er 2 (s) + 3 Cl2 (g) → 2 3 ERCL (s) [violette]
- 2 Er (s) + 3 Br 2 (g) → 2 ErBr 3 (s) [violette]
- 2 Er (s) + 3 I 2 (g) → 2 3 Eri (s) [violette]
Erbium se dissout facilement dans diluée d'acide sulfurique pour former des solutions contenant Er (III) des ions hydratés, qui existent comme jaune [Er (OH 2)] 9 3+ complexes d'hydratation:
- 2 Er (s) + 3 H 2 SO 4 (aq) → 2 Er 3+ (aq) + 3 SO 2-
4 (aq) + 3 H 2 (g)
Isotopes
Naturellement l'erbium survenant est composé de six stables isotopes , 162 Er, 164 Er, 166 Er, 167 Er, 168 ER, et 170 Er 166 Er étant le plus abondant (33,503% abondance naturelle). 29 des radio-isotopes ont été caractérisés, avec le plus stable étant 169 Er avec une demi-vie de 9,4 d, 172 Er, avec une demi-vie de 49,3 h, 160 Er, avec une demi-vie de 28,58 h, 165 Er, avec une demi-vie de 10,36 h et 171 Er avec une demi-vie de 7,516 h. Tout le reste isotopes radioactifs ont des demi-vies qui sont inférieures à 3,5 h, et la majorité d'entre eux ont des demi-vies qui sont moins de 4 minutes. Cet élément a aussi 13 États méta, avec plus stable Er l'être de 167m avec une demi-vie de 2,269 s.
Les isotopes de gamme de l'erbium dans poids atomique de 142.9663 u (143 Er) à 176,9541 U (177 Er). Le primaire mode de désintégration avant l'isotope stable le plus abondant, 166 Er, est capture d'électrons, et le mode primaire après est- désintégration bêta. Le primaire produits de désintégration avant 166 Er sont 67 éléments ( holmium ) isotopes, et les produits primaires après sont 69 éléments ( thulium ) isotopes.
Histoire
Erbium (par Ytterby, village de la Suède ) était découverte par Carl Gustaf Mosander en 1843. Mosander séparé "yttrium" du minéral gadolinite en trois fractions qu'il appelait l'oxyde d'yttrium, oxyde d'erbium, et terbia. Il a nommé le nouvel élément après le village de Ytterby où se trouvent de fortes concentrations de l'oxyde d'yttrium et l'erbium. Erbia et terbia, cependant, ont été confondus à ce moment. Après 1860, a été rebaptisé terbia erbia et après 1877 ce qui avait été connu sous le nom d'erbium a été rebaptisé terbia. Assez pur Er 2 O 3 a été isolé indépendamment en 1905 par Georges Urbain et Charles James. Raisonnablement métal pur n'a pas été produite jusqu'en 1934, lorsque Klemm et Bommer réduit le anhydre chlorure de potassium en phase vapeur. Ce ne est que dans les années 1990 que le prix de l'oxyde d'erbium chinoise dérivés est devenue suffisamment faible pour l'erbium à considérer pour une utilisation comme colorant dans l'art du verre.
Occurrence

La concentration en erbium dans la croûte terrestre est d'environ 2,8 mg / kg et dans l'eau de mer de 0,9 ng / l. Cette concentration est assez pour faire l'erbium sur les 45e l'abondance élémentaire dans la croûte terrestre.
Comme d'autres terres rares, cet élément ne est jamais trouvé comme un élément libre dans la nature, mais se trouve lié dans minerais de sable monazite. Il a toujours été très difficile et coûteux de séparer les terres rares de l'autre dans leurs minerais mais techniques de production échangeuses d'ions développés à la fin du 20e siècle ont considérablement fait baisser le coût de la production de tous les métaux de terres rares et de leurs composés chimiques .
Les principales sources commerciales de l'erbium sont des minéraux xénotime et euxénite, et, plus récemment, les argiles d'adsorption des ions de sud de la Chine; en conséquence, la Chine est devenue le principal fournisseur mondial de cet élément. Dans les versions à haute yttrium de ces concentrés de minerai, de l'yttrium est environ les deux tiers du total en poids, et oxyde d'erbium est d'environ 4-5%. Lorsque le concentré est dissous dans de l'acide, l'oxyde d'erbium libère suffisamment d'ions d'erbium pour conférer une couleur distincte et caractéristique rose à la solution. Ce comportement de couleur est semblable à ce que Mosander et les autres travailleurs au début de la lanthanides auraient vu dans leurs extraits des minéraux gadolinite de Ytterby.
Production
Minéraux broyés sont attaqués par chlorhydrique ou l' acide sulfurique qui transforme les oxydes de terres rares insolubles dans chlorures ou des sulfates solubles. Les filtrats acides sont partiellement neutralisés avec de la soude caustique (hydroxyde de sodium) à un pH de 3-4. thorium précipite dans la solution sous forme d'hydroxyde et est enlevée. Après que la solution est traitée avec oxalate d'ammonium pour convertir les terres rares dans leur insoluble oxalates. Les oxalates sont convertis en oxydes par recuit. Les oxydes sont dissous dans de l'acide nitrique qui exclut l'un des principaux composants, le cérium , dont l'oxyde est insoluble dans HNO 3. La solution est traitée avec le nitrate de magnésium pour produire un mélange cristallisé de sels doubles de métaux des terres rares. Les sels sont séparés par l'échange d'ions. Dans ce procédé, les ions de terres rares sont adsorbés sur la résine échangeuse d'ions appropriée, par échange avec de l'hydrogène, l'ammonium ou des ions cuivriques présents dans la résine. Les ions de terre rare sont ensuite lavées de façon sélective par un agent complexant approprié. Erbium métal est obtenu à partir de son oxyde ou de sels par chauffage avec du calcium à 1450 ° C sous atmosphère d'argon.
Applications

Utilisations quotidiennes de l'erbium sont variées. Il est couramment utilisé en tant que filtre photographique, et en raison de son élasticité, il est utile comme additif métallurgique. Autres utilisations:
- Utilisé dans nucléaires technologie dans absorbant les neutrons des barres de commande.
- Lorsqu'il est ajouté à du vanadium en tant que alliage, l'erbium réduit la dureté et améliore la maniabilité.
- L'oxyde d'erbium a une couleur rose, et est parfois utilisé comme colorant pour le verre , zircone cubique et porcelaine. Le verre est alors souvent utilisé dans lunettes de soleil et pas cher bijoux .
- Dopée à l'erbium fibres optiques de silice en verre sont l'élément actif dans des amplificateurs à fibre dopée à l'erbium (EDFA), qui sont largement utilisés dans les communications optiques. Les mêmes fibres peuvent être utilisées pour créer des fibres lasers . Co-dopage de la fibre optique avec Er et Yb est utilisé dans haute puissance Er / Yb lasers à fibre, qui remplacent progressivement lasers CO 2 pour le soudage des métaux et des applications de coupe. L'erbium peut également être utilisé dans amplificateurs de guide d'ondes dopée à l'erbium.
- Un erbium- nickel alliage Er 3 Ni a une capacité thermique spécifique exceptionnellement élevée à des températures de l'hélium liquide et est utilisé dans cryoréfrigérateurs; un mélange de 65% Er 3 Co et 35% de Er 0.9 Yb 0.1 Ni en volume améliore la capacité thermique spécifique encore plus.
- Une grande variété d'applications médicales (ce est à dire la dermatologie, dentisterie) utilisent 2940 nm émissions de l'erbium ions (voir Er: YAG), qui est fortement absorbée dans l'eau ( coefficient d'absorption sur 12 000 / cm). Un tel dépôt de tissu superficielle de l'énergie laser est nécessaire pour la chirurgie au laser, et la production de vapeur d'eau efficace pour émail ablation laser en dentisterie.
Rôle biologique
Erbium n'a pas de rôle biologique, mais des sels d'erbium peut stimuler métabolisme. Les humains consomment 1 milligramme de l'erbium par an en moyenne. La plus forte concentration de l'erbium est l'homme est la la os, mais il ya aussi l'erbium dans les droits de reins et foie.
Toxicité
Erbium est légèrement toxique en cas d'ingestion, mais composés d'erbium ne sont pas toxiques. Erbium métallique sous forme de poussière présente un risque d'incendie et d'explosion.
La culture populaire
Dans le roman de Carl Sagan "Contact", une machine est construite à partir d'un modèle reçu par une transmission radio extraterrestre. Un élément important (et non expliquée) de la machine sont des chevilles construit à partir de l'erbium.

