
Valence (chimie)
Saviez-vous ...
Cette sélection de wikipedia a été choisi par des bénévoles aidant les enfants SOS de Wikipedia pour cette sélection Wikipedia pour les écoles. Les enfants SOS est le plus grand organisme de bienfaisance du monde en donnant des enfants orphelins et abandonnés la chance de la vie familiale.
En chimie , valence, également connu sous le nom ou le numéro de valence valence, est une mesure du nombre de liaisons formées par un atome d'un élément donné. "Valence" peut être défini comme le nombre de les liaisons de valence d'un atome donné est formée, ou peut former avec un ou plusieurs autres atomes. Pour la plupart des éléments du nombre de liaisons peut varier. Le Définition de l'UICPA valence limite le nombre maximal d'atomes univalents qui peuvent se combiner avec l'atome, qui est le nombre maximum de liaisons de valence qui est possible pour l'élément donné.
La valence d'un élément dépend du nombre de électrons de valence qui peuvent être impliqués dans la formation de liaisons de valence. Un univalent (monovalent) atome, ion ou le groupe a une valence de l'un et peuvent donc former une une liaison covalente. Un bivalent entité moléculaire a une valence de deux et peut former deux liaisons sigma ou une liaison sigma plus un pi liaison. Les groupes alkyle et ions hydroxyles sont des exemples monovalents; sont des ligands oxo divalent.
Au cours du siècle dernier, le concept de valence a évolué dans un éventail d'approches pour décrire la liaison chimique, y compris Structures de Lewis (1916), la théorie de la valence de liaison (1927), orbitales moléculaires (1928), valence électronique shell théorie paire de répulsion (1958) et toutes les méthodes avancées de la chimie quantique .
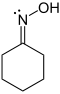 | Dans cyclohexanone oxime (image de gauche), l' azote atome a trois liaisons de valence et par la première définition, il dispose d'une valence de trois. Azote a cinq et les électrons de valence, par définition, il IUPAC a une valence de cinq, car il peut former maximales cinq liaisons de valence, comme dans de la N-méthyl-oxyde-1 phenylmethanimine . Dans cyclohexanone, l'azote a le degré d'oxydation -1 et l'oxygène -2. |
Histoire
Le étymologie du mot "valence" remonte à 1425, ce qui signifie «extrait, la préparation," de Valentia latine "force, la capacité," et le sens chimique se référant à la "puissance de combinaison d'un élément" est enregistré à partir de 1884, de l'allemand Valenz .

En 1789, William Higgins publié vues sur ce qu'il appelle des combinaisons de particules «ultimes», qui préfigure la notion de liaisons de valence. Si, par exemple, selon Higgins, la force entre la particule ultime de l'oxygène et de la particule ultime de l'azote étaient six, puis l'intensité de la force serait divisée en conséquence, et de même pour les autres combinaisons de particules ultimes (voir illustration) .
La création exacte, cependant, de la théorie des valences chimiques peut être attribuée à un document 1852 par Edward Frankland, dans lequel il a combiné les anciennes théories de les radicaux libres et «théorie de type" avec des pensées sur affinité chimique pour montrer que certains éléments ont tendance à se combiner avec d'autres éléments pour former des composés contenant de 3, ce est à dire dans les trois groupes d'atomes (par exemple, N 3, NH 3, NI 3, etc.) ou 5, ce est à dire dans les cinq groupes d'atomes (par exemple NO 5, NH 4 O, 5 PO, etc.), équivalents des éléments attachés. Ce est de cette manière, selon la Frankland, que leurs affinités sont mieux satisfait. Suite à ces exemples et de postulats, Frankland déclare comment il est évident que:
| " | Une tendance ou de droit prévaut (ici), et que, peu importe ce que les personnages des atomes de Uniting peuvent être, le pouvoir combiner de l'élément attirant, si vous me permettez le terme, est toujours satisfaits par le même nombre de ces atomes . | " |
Ce «pouvoir combiner" fut ensuite appelé quantivalence ou valence (valence et par les chimistes américains).
Covalence
Le concept de Covalence a été développé au milieu du XIXe siècle dans une tentative de rationaliser les formules des différents composés chimiques . En 1919, Irving Langmuir, emprunté le terme d'expliquer Gilbert N. Lewis modèle de l'atome cubique en déclarant que «le nombre de paires de électrons qui Any Given part d'atomes avec les atomes adjacents est appelée la covalence de cet atome. " La coopération de préfixe signifie "ensemble", de sorte que des moyens de liaison co-valente que les atomes part valence. Par conséquent, si un atome, par exemple, a une valence 1, ce qui signifie qu'il a un électron de valence au-delà de la coquille complète, et une autre une valence -1, ce qui signifie qu'il nécessite un électron pour compléter son enveloppe extérieure (manque un électron), alors une liaison entre ces deux atomes entraînerait parce qu'ils seraient compléter ou partager leur équilibre sur les tendances de valence. Par la suite, il est maintenant plus courant de parler de liaisons covalentes plutôt que "valence", qui est tombé en utilisation dans les travaux au niveau supérieur avec les progrès de la théorie de la liaison chimique, mais est encore largement utilisés dans les études élémentaires où il fournit une introduction heuristique pour le sujet.
Valences communes
Pour les éléments de la groupes principaux de la classification périodique des éléments , la valence peut varier entre un à sept, mais en général ces éléments forment un certain nombre de liaisons de valence de un à quatre. Le nombre de liaisons formées par un élément donné a été pensé pour être une propriété chimique fixe. En fait, dans la plupart des cas, cela ne est pas vrai. Par exemple, le phosphore a souvent une valence de trois, mais peut également avoir d'autres valences.
Néanmoins, de nombreux éléments ont une valence commun liées à leur position dans le tableau périodique, suite à la règle de l'octet. Éléments dans les principaux groupes 1 (métaux alcalins) et 17 (halogènes) ont généralement une valence de 1; éléments dans les groupes 2 (métaux alcalino-terreux) et (16) chalcogènes valence 2; éléments 13 groupes (groupe de bore) et 15 (groupe d'azote) de valence 3; éléments groupe 14 (groupe de carbone) de valence 4.
Valence contre l'état d'oxydation
En raison de l'ambiguïté de la valence terme, de nos jours, d'autres notations sont utilisées dans la pratique. Outre le système de nombres d'oxydation tel qu'il est utilisé dans Stock nomenclature des composés de coordination, et la notation lambda, tel qu'il est utilisé dans le Nomenclature of Inorganic Chemistry, " état d'oxydation "est une indication plus claire de l'état électronique des atomes dans une molécule.
Le " état d'oxydation "d'un atome dans une molécule donne le nombre d'électrons de valence, il a gagné ou perdu. En revanche le nombre de valence, l'état d'oxydation peut être positif (pour un atome électropositif) ou négative (pour un atome électronégatif).
Éléments dans un état d'oxydation élevé peuvent avoir une valence supérieure à quatre. Par exemple, dans perchlorates, le chlore a sept liaisons de valence et le ruthénium , dans l'état d'oxydation dans huit ruthénium (VIII) tétroxyde, a même huit liaisons de valence.
"Le nombre maximum d'obligations« définition
Le Union internationale de chimie pure et appliquée (UICPA) a fait plusieurs tentatives pour arriver à une définition sans équivoque de valence. La version actuelle, adoptée en 1994 ,:
- Le nombre maximal d'atomes univalents (à l'origine d'hydrogène ou de chlore) qui peut se combiner avec un atome de l'élément considéré, ou d'un fragment, ou pour lequel un atome de cet élément peut être substitué.
L'hydrogène et le chlore ont été initialement utilisés comme exemples d'atomes univalents, en raison de leur nature pour former une seule liaison simple. L'hydrogène a un seul électron de valence et peut former uniquement une liaison avec un atome qui possède une incomplet coque extérieure. Le chlore a sept électrons de valence et peut former uniquement une liaison avec un atome qui fait don d'un électron de valence pour compléter la coque extérieure de chlore. Cependant, le chlore peut aussi avoir des états d'oxydation de 1 à 7 et peut former plus d'une liaison par donner des électrons de valence.
Bien que l'hydrogène ne possède qu'un seul électron de valence, il peut former des liaisons avec plus d'un atome dans hypervalentes obligations. Dans le ion bifluorure ([2 HF] -), par exemple, il forme un Liaison à trois centres et quatre électrons avec deux atomes de fluor: ![[\ F \ frac {\ quad} {\ quad} H \ {} ^ - \ F \ quad \ Longleftrightarrow \ quad F ^ -! \ {} \ H \ frac {\ quad} {\ quad} F \]](../../images/1118/111899.png)
Un autre exemple est le Liaison à trois centres et deux électrons dans diborane (B 2 H 6).
Exemples
(Valences selon la définition de nombre de liaisons de valence et les états d'oxydation conforme)
| COMPOSE | FORMULE | VALENCE | L'état d'oxydation |
|---|---|---|---|
| Le chlorure d'hydrogène | HCl | H = 1 CL = 1 | H = + 1 = Cl -1 |
| Chlore | Cl 2 | Cl Cl = 1 = 1 | Cl = + 1 = Cl -1 |
| Perchlorate * | HClO 4 | H = 1 CL = 7 O = 2 | H = + 1 = Cl + O = 7 -2 |
| l'hydrure de sodium | NaH | Na = 1 H = 1 | Na = + 1 H = -1 |
| L'oxyde ferreux ** | FeO | Fe 2 O = = 2 | Fe 2 O = + = -2 |
| L'oxyde ferrique ** | Fe 2 O 3 | Fe 3 O = = 2 | Fe 3 O + = = -2 |
* L'ion perchlorate monovalent (ClO 4 -) a une valence.
** Oxyde de fer apparaît dans un structure cristalline, donc pas de molécule typique peut être identifié.
Dans l'oxyde de fer, Fe a un nombre d'oxydation II, dans de l'oxyde ferrique, nombre d'oxydation III.
Valences des éléments
Valences maximales pour la majorité des éléments sont basés sur le fluorure ou fluoroanion plus connu. Notez que la valence de l'hydrogène et du fluor sont deux. L'astate est supposé avoir une valence de sept, mais ne est pas connu pour avoir des composés présentant une valence supérieur à un.
Valences maximales des éléments | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Groupe → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| ↓ Période | ||||||||||||||||||||
| 1 | 1 H | 2 Il | ||||||||||||||||||
| 2 | 3 Li | 4 Être | 5 B | 6 C | 7 N | 8 O | 9 Fa | 10 Ne | ||||||||||||
| 3 | 11 N / A | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||||
| 4 | 19 K | 20 Californie | 21 Caroline du Sud | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Géorgie | 32 Ge | 33 Comme | 34 Se | 35 Br | 36 Kr | ||
| 5 | 37 Rb | 38 Sr | 39 Y |
40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 CD | 49 En | 50 Sn | 51 Sb | 52 Te | 53 Je | 54 Xe | ||
| 6 | 55 Cs | 56 Ba | * | 72 Hf | 73 Ta | 74 W | 75 Ré | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg |
81 Tl | 82 Pb | 83 Bi | 84 Po | 85 À | 86 Rn | ||
| 7 | 87 Fr | 88 Ra | ** | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Uut | 114 Fl | 115 Uup | 116 Lv | 117 Uus | 118 Uuo | ||
| * lanthanides | 57 La | 58 Ce | 59 Pr | 60 Dakota du Nord | 61 Pm | 62 Sm | 63 Ue | 64 Gd | 65 Tb | 66 Dy | 67 Ho |
68 Er | 69 Tm | 70 YB | 71 Lu | |||||
| ** actinides | 89 Un C | 90 Th | 91 Pennsylvanie | 92 U | 93 Np | 94 Pu | 95 Suis | 96 Cm |
97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 Aucun | 103 Lr | |||||
| Valences maximales sont basées sur la Liste des états d'oxydation des éléments | ||||||||||||||||||||
Valences maximales de éléments chimiques | |||||||||||||
|
| ||||||||||||

