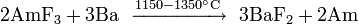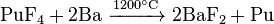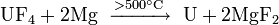Actinides
Renseignements généraux
SOS Enfants, un organisme de bienfaisance de l'éducation , a organisé cette sélection. Un lien rapide pour le parrainage d'enfants est http://www.sponsor-a-child.org.uk/
| Actinides dans le tableau périodique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

Le actinides ou actinoïde ( nomenclature IUPAC ) série englobe les 15 métalliques éléments chimiques avec des numéros atomiques de 89 à 103, l'actinium travers lawrencium .
La série des actinides tire son nom de la groupe 3 élément actinium. Tous sauf un des actinides sont f éléments de type bloc, correspondant au remplissage de la 5f shell électrons; lawrencium, un D-Block élément, est aussi généralement considéré comme un des actinides. En comparaison avec les lanthanides , aussi surtout éléments f-bloc, les actinides montrent beaucoup plus variable valence .
| 89 Un C | 90 Th | 91 Pennsylvanie | 92 U | 93 Np | 94 Pu | 95 Suis | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md |
102 Aucun | 103 Lr |
Parmi les actinides, primordial thorium et l'uranium sont naturellement présents dans des quantités importantes et de petites quantités de persistance naturel plutonium ont également été identifiés. La désintégration de l'uranium produit des quantités transitoires de l'actinium et protactinium , et les atomes de neptunium , américium , curium , berkelium et californium sont parfois produite à partir réactions de transmutation dans minerais d'uranium. Les autres actinides sont purement des éléments de synthèse. Essais d'armes nucléaires ont publié au moins six actinides plus lourd que le plutonium dans le environnement; analyse des débris à partir d'un 1952 bombe à hydrogène explosion a montré la présence de l'américium, curium, berkelium, californium, einsteinium et fermium .
Tous les actinides sont énergie radioactive et la libération sur la décroissance radioactive; naturelle de l'uranium et le thorium et le plutonium produit synthétiquement sont les actinides plus abondant sur Terre. Ils sont utilisés dans réacteurs nucléaires et les armes nucléaires . Uranium et le thorium ont aussi des utilisations actuelles ou historiques diverses, et de l'américium est utilisé dans le chambres d'ionisation de la plus moderne des détecteurs de fumée.
Dans les présentations de la table périodique , les lanthanides et les actinides sont habituellement présentés comme deux rangées supplémentaires ci-dessous le corps principal de la table, avec des emplacements ou bien un seul élément sélectionné de chaque série (soit le lanthane ou le lutétium , et soit l'actinium ou lawrencium , respectivement) présentée dans une seule cellule de la table principale, entre le baryum et le hafnium , et le radium et rutherfordium , respectivement. Cette convention est entièrement une question de l'esthétique et praticité formatage; un rarement utilisé tableau périodique grand format insère le lanthanides et des actinides à leur place, comme des parties de sixième et septième lignes du tableau (périodes).
Discovery, l'isolement et la synthèse
| Élément | Année | Méthode |
|---|---|---|
| Neptunium | 1940 | Bombardant 238 U par neutrons |
| Plutonium | 1941 | Bombardant 238 U par deutérons |
| Américium | 1944 | Bombardant 239 Pu par neutrons |
| Curium | 1944 | Bombardant 239 Pu par α-particules |
| Berkelium | 1949 | Bombardant 241 Am par α-particules |
| Californium | 1950 | Bombardant 242 cm par α-particules |
| Einsteinium | 1952 | En tant que produit de explosion nucléaire |
| Fermium | 1952 | En tant que produit d'explosion nucléaire |
| Mendelevium | 1955 | Bombardant 253 Es par α-particules |
| Nobelium | 1965 | Bombardant 243 Am par 15 N ou 238 U avec α-particules |
| Lawrencium | 1961-1971 | Bombardant 252 FC par 10 B ou 11 B et de 243 Am avec 18 O |
Comme les lanthanides , les actinides forment une famille d'éléments ayant des propriétés similaires. Dans les actinides, il ya deux groupes se chevauchent: transuraniens, qui suivent l'uranium dans le tableau périodique -et transplutoniens, qui suivent le plutonium. Par rapport aux lanthanides, qui (à l'exception de prométhium ) se trouvent dans la nature dans des quantités appréciables, la plupart des actinides sont rares. Les plus abondantes, ou faciles à synthétiser actinides sont l'uranium et du thorium, suivie par du plutonium, de l'américium, l'actinium, le protactinium et le neptunium.
L'existence d'éléments transuraniens a été suggéré par Enrico Fermi sur la base de ses expériences en 1934. Cependant, même si quatre actinides ont été connus à cette époque, il ne était pas encore compris qu'ils formaient une famille semblable à lanthanides. L'opinion dominante qui a dominé les premières recherches en transuraniens était qu'ils étaient des éléments réguliers dans la 7e période, avec le thorium, le protactinium et uranium correspondant à 6 période hafnium , le tantale et le tungstène , respectivement. Synthèse des transuraniens progressivement sapé ce point de vue. En 1944, une observation qui n'a pas réussi à présenter le curium états d'oxydation supérieure à 4 (alors que son supposé 6ème période voisin, le platine , peut atteindre état de sept d'oxydation) invité Glenn Seaborg de formuler un soi-disant «hypothèse des actinides". Études d'actinides et de découvertes d'autres éléments transuraniens connus fournis plus de données à l'appui de ce point de vue, mais l'expression «actinides hypothèse" (l'implication étant que «hypothèse» est quelque chose qui n'a pas été prouvé de façon décisive) resté dans l'utilisation active par les scientifiques à travers la fin des années 1950.
À l'heure actuelle, il existe deux grandes méthodes de production des isotopes d'éléments transplutoniens: irradiation des éléments plus légers avec soit des neutrons ou de particules chargées accélérées. La première méthode est la plus importante pour les applications, car seule l'irradiation neutronique utilisant des réacteurs nucléaires permet la production de quantités importantes d'actinides synthétiques; cependant, elle est limitée à des éléments relativement légers. L'avantage de la deuxième méthode est que les éléments plus lourds que le plutonium ainsi que les isotopes déficients en neutrons, peuvent être obtenues, qui ne sont pas formés au cours de l'irradiation neutronique.
En 1962-1966, il y avait des tentatives des États-Unis pour produire des isotopes transplutoniens utilisant une série de six explosions nucléaires souterraines. De petits échantillons de roche ont été extraits de la zone de tir immédiatement après l'essai d'étudier les produits de l'explosion, mais pas isotopes avec nombre de masse supérieure à 257 peut être détectée, malgré les prédictions que ces isotopes auraient relativement longues demi-vies de α-dentaire. Cette inobservation a été attribuée à la fission spontanée du fait de la grande vitesse des produits et à d'autres canaux de désintégration, tels que les émissions de neutrons et de fission nucléaire .
De l'actinium en neptunium

Uranium et de thorium étaient les premiers actinides découvert. Uranium a été identifié en 1789 par le chimiste allemand Martin Heinrich Klaproth dans minerai de pechblende. Il lui donna le nom de la planète Uranus , qui avait été découvert seulement huit ans plus tôt. Klaproth a pu précipiter un composé jaune (probable diuranate de sodium) par dissolution pitchblende en acide nitrique et en neutralisant la solution avec de l'hydroxyde de sodium . Il a ensuite réduit la poudre jaune obtenue avec du charbon, et extrait une substance noire qu'il prenait pour le métal. Seulement 60 ans plus tard, le scientifique français Eugène-Melchior Péligot identifié avec l'oxyde d'uranium. Il a également isolé le premier échantillon d'uranium métal en chauffant le tétrachlorure d'uranium avec du potassium . Le masse atomique de l'uranium a ensuite été calculée comme 120, mais Dmitri Mendeleev en 1872 corrigé à 240 en utilisant ses lois de périodicité. Cette valeur a été confirmée expérimentalement en 1882 par K. Zimmerman.
L'oxyde de thorium a été découvert par Friedrich Wöhler dans le minéral, qui a été trouvé en Norvège (1827). Jöns Jacob Berzelius caractérisé cette matière plus en détail en 1828. Par la réduction du tétrachlorure de thorium avec le potassium, il a isolé le métal et l'a nommé après la thorium dieu nordique du tonnerre et de la foudre Thor . La même méthode d'isolement a été utilisé plus tard par Péligot pour l'uranium.
Actinium a été découvert en 1899 par André-Louis Debierne, un assistant de Marie Curie , dans les déchets de pechblende à gauche après l'élimination du radium et le polonium. Il a décrit la substance (en 1899) comme semblable à du titane et (en 1900) comme semblable à du thorium. La découverte de l'actinium par Debierne a toutefois été remise en question en 1971 et 2000, en faisant valoir que les publications de Debierne en 1904 contredit son travail antérieur de 1899-1900. Le nom de l'actinium mot vient du grec aktis, aktinos (ακτίς, ακτίνος), ce qui signifie poutre ou rayons. Ce métal a été découvert pas par son propre rayonnement, mais par le rayonnement des produits de filiation. En raison de la similitude de l'actinium et le lanthane et de faible abondance, l'actinium pur ne peut être produit en 1950. Le terme actinides a probablement été introduit par Victor Goldschmidt en 1937.
Protactinium était peut-être isolé en 1900 par William Crookes. Il a été identifié pour la première en 1913, lorsque Kasimir Fajans et Oswald Helmuth Göhring rencontré le 234m des isotopes de courte durée Pa (demi-vie 1,17 minutes) pendant leurs études de la U décroissance 238. Ils ont appelé le nouvel élément Brevium (du latin brevis signifie brève); le nom a été changé pour protoactinium (du grec πρῶτος + ἀκτίς signifie "premier élément de faisceau") en 1918 lorsque deux groupes de scientifiques, dirigée par Otto Hahn et Lise Meitner de l'Allemagne et Frederick Soddy et John Cranston de Grande-Bretagne, indépendamment découvert 231 Pa. Le nom a été raccourci à Protactinium en 1949. Cet élément a peu caractérisée jusqu'en 1960, quand AG Maddock et ses collègues au Royaume-Uni ont produit 130 grammes de protactinium à partir de 60 tonnes de déchets laissés après extraction de l'uranium de son minerai.
Neptunium (du nom de la planète Neptune , la prochaine planète à partir Uranus, après quoi l'uranium a été nommé) a été découvert par Edwin McMillan et Philip H. Abelson en 1940 à Berkeley, en Californie. Ils ont produit l'isotope 239 Np (demi-vie 2,4 jours) en bombardant l'uranium avec des neutrons lents. Ce était la première élément transuranien produit synthétiquement.
Plutonium et au-dessus

Les éléments transuraniens ne se produisent pas en quantités importantes dans la nature et sont généralement synthétisés par réactions nucléaires menées avec des réacteurs nucléaires. Par exemple, sous irradiation avec des neutrons du réacteur, l'uranium-238 convertit partiellement plutonium 239:
De cette manière, Enrico Fermi avec des collaborateurs, en utilisant le premier réacteur nucléaire Chicago Pile-1, des quantités significatives obtenues de plutonium 239, qui ont ensuite été utilisé dans les armes nucléaires.
Actinides avec les nombres les plus élevés de masse sont synthétisés en bombardant l'uranium, le plutonium, le curium et californium avec des ions d'azote, de l'oxygène, du carbone, du néon ou du bore dans un accélérateur de particules. Donc, nobélium est obtenu en bombardant de l'uranium-238 avec néon-22
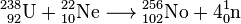 .
.
Premières isotopes d'éléments transplutoniens, américium 241 et curium-242, ont été synthétisés en 1944 par Glenn T. Seaborg, Ralph A. James et Albert Ghiorso. Curium-242 a été obtenu en bombardant le plutonium-239 avec 32 MeV α-particules
 .
.
Les américium et le curium-241 242 isotopes ont également été produits par irradiation de plutonium dans un réacteur nucléaire. Ce dernier élément a été nommé d'après Marie Curie et son mari Pierre qui sont à noter pour découvrir le radium et pour leur travail dans la radioactivité.
Bombardant curium-242 avec α-particules a abouti à un isotope de californium 245 Cf (1950), et un mode opératoire similaire cédé en 1949 berkelium-243 de l'américium-241. Les nouveaux éléments ont été nommés après Berkeley, en Californie, par analogie avec son lanthanides homologue terbium , qui a été nommé d'après le village de Ytterby en Suède.
En 1945, BB Cunningham a obtenu le premier composé chimique d'un élément essentiel de transplutoniens, à savoir l'hydroxyde américium. Au cours des trois à quatre prochaines années, les quantités de milligrammes de l'américium et le curium quantités de microgrammes ont été accumulés qui a permis la production d'isotopes de berkelium (Thomson, 1949) et californium (Thomson, 1950). Des quantités importantes de ces éléments ont été produits qu'en 1958 (Burris B. Cunningham et Stanley G. Thomson), et le premier composé de californium (0,3 ug de CfOCl) a été obtenu seulement en 1960 par BB Cunningham et JC Wallmann).
Einsteinium et fermium ont été identifiés en 1952-1953 dans les retombées de la " Ivy Mike "test nucléaire (1 Novembre 1952), le premier essai réussi d'une bombe à hydrogène. Exposition instantanée de l'uranium-238 à un grand flux de neutrons résultant de l'explosion produite isotopes lourds de l'uranium, y compris l'uranium-253 et de l'uranium-255, et leur β-decay a abouti einsteinium-253 et fermium-255. La découverte de nouveaux éléments et les nouvelles données sur la capture de neutrons ont d'abord été gardé secret sur les ordres de l'armée américaine jusqu'en 1955 en raison de la guerre froide tensions. Néanmoins, l'équipe de Berkeley étaient en mesure de préparer einsteinium et fermium par des moyens civils, à travers le bombardement de neutrons de plutonium-239, et publié ce travail en 1954 avec l'avertissement qu'il ne était pas les premières études qui ont été menées sur les éléments. Les études "Ivy Mike" ont été déclassifiés et publiés en 1955. Les premières importantes (submicrograms) quantités de einsteinium ont été produites en 1961 par Cunningham et ses collègues, mais cela n'a pas encore été fait pour fermium.
Le premier isotope de mendelevium, 256 Md (demi-vie 87 min), a été synthétisé par Albert Ghiorso, Glenn T. Seaborg, Gregory R. Choppin, Bernard G. Harvey et Stanley G. Thompson quand ils ont bombardé une cible 253 Es avec des particules alpha dans la 60 pouces de cyclotron Berkeley Radiation Laboratory; ce est le premier isotope d'un élément à synthétiser un atome à la fois.
Il ya eu plusieurs tentatives pour obtenir des isotopes de nobélium par suédoise (1957) et (1958) des groupes américains, mais les premiers résultats fiables était la synthèse de 256 Pas par le groupe russe ( Gueorgui Fliorov et al.) En 1965, reconnaît que par le IUPAC en 1992. Dans leurs expériences, Flyorov et al. Bombardé l'uranium-238 avec le néon-22.
En 1961, Ghiorso et al. A obtenu le premier isotope de californium lawrencium par irradiation (principalement californium-252) avec bore 10 et 11 ions bore. Le nombre de masse de cet isotope ne était pas clairement établi (éventuellement 258 ou 259) à l'époque. En 1965, Lr 256 ont été synthétisés par Flyorov et al. À partir de Am 243 et 18 O. Ainsi UICPA reconnu les équipes de physique nucléaire à Dubna et Berkeley que les co-découvreurs du lawrencium.
Isotopes
| Isotope | Demi-vie | Probabilité de fission spontanée en% | l'énergie d'émission, MeV (rendement en%) | L'activité spécifique de | ||
|---|---|---|---|---|---|---|
| α | γ | α, β-particules, Bq / kg | fission, Bq / kg | |||
| 241 Am | 432,2 (7) ans | 4,3 (18) x 10 -10 | 5,485 (84,8) 5,442 (13.1) 5,388 (1,66) | 0,059 (35,9) 0,026 (2,27) | 1,27 × 10 14 | 546,1 |
| 243 Am | 7,37 (4) × 10 3 années | 3,7 (2) × 10 -9 | 5,275 (87,1) 5,233 (11.2) 5,181 (1,36) | 0,074 (67.2) 0,043 (5,9) | 7,39 × 10 12 | 273,3 |
| 242 cm | 162,8 (2) jours | 6,2 (3) × 10 -6 | 6,069 (25,92) 6.112 (74,08) | 0,044 (0,04) 0,102 (4 × 10 -3) | 1,23 × 10 17 | 7,6 × 10 9 |
| 244 cm | 18,10 (2) ans | 1,37 (3) × 10 -4 | 5,762 (23,6) 5,804 (76,4) | 0,043 (0,02) 0,100 (1,5 × 10 -3) | 2,96 × 10 15 | 4,1 × 10 9 |
| 245 cm | 8,5 (1) × 10 3 années | 6,1 (9) x 10 -7 | 5,529 (0,58) 5,488 (0,83) 5,361 (93,2) | 0,175 (9,88) 0,133 (2,83) | 6,35 × 10 12 | 3,9 × 10 4 |
| 246 cm | 4,76 (4) × 10 3 années | 0,02615 (7) | 5.343 (17,8) 5,386 (82,2) | 0,045 (19) | 1,13 × 10 13 | 2,95 × 10 9 |
| 247 cm | 1,56 (5) × 10 7 années | - | 5,267 (13.8) 5,212 (5,7) 5,147 (1.2) | 0,402 (72) 0,278 (3.4) | 3,43 × 10 9 | - |
| 248 cm | 3,48 (6) × 10 5 années | 8,39 (16) | 5,034 (16,52) 5,078 (75) | - | 1,40 × 10 11 | 1,29 × 10 10 |
| 249 Bk | 330 (4) jours | 4,7 (2) × 10 -8 | 5,406 (1 × 10 -3) 5,378 (2,6 × 10 -4) | 0,32 (5,8 × 10 -5) | 5,88 × 10 16 | 2,76 × 10 7 |
| 249 Cf | 351 (2) ans | 5,0 (4) x 10 -7 | 6,193 (2,46) 6,139 (1,33) 5,946 (3,33) | 0,388 (66) 0,333 (14,6) | 1,51 × 10 14 | 7,57 × 10 5 |
| 250 Cf | 13,08 (9) ans | 0,077 (3) | 5,988 (14,99) 6,030 (84,6) | 0,043 | 4,04 × 10 15 | 3,11 × 10 12 |
| 251 Cf | 900 (40) ans | ? | 6,078 (2,6) 5,567 (0,9) 5,569 (0,9) | 0,177 (17.3) 0,227 (6,8) | 5,86 × 10 13 | - |
| 252 Cf | 2,645 (8) ans | 3,092 (8) | 6,075 (15.2) 6.118 (81,6) | 0,042 (1,4 × 10 -2) 0,100 (1,3 × 10 -2) | 1,92 × 10 16 | 6,14 × 10 14 |
| 254 Cf | 60,5 (2) jours | ≈100 | 5,834 (0,26) 5,792 (5,3 × 10 -2) | - | 9,75 × 10 14 | 3,13 × 10 17 |
| 253 Es | 20,47 (3) jours | 8,7 (3) × 10 -6 | 6,540 (0,85) 6,552 (0,71) 6,590 (6,6) | 0,387 (0,05) 0,429 (8 × 10 -3) | 9,33 × 10 17 | 8,12 × 10 10 |
| 254 Es | 275,7 (5) jours | <3 × 10 -6 | 6,347 (0,75) 6,358 (2,6) 6,415 (1,8) | 0,042 (100) 0,034 (30) | 6,9 × 10 16 | - |
| 255 Es | 39,8 (12) jours | 0,0041 (2) | 6,267 (0,78) 6,401 (7) | - | 4,38 × 10 17 (β) 3,81 × 10 16 (α) | 1,95 × 10 13 |
| 255 Fm | 20.07 (7) heures | 2,4 (10) x 10 -5 | 7,022 (93,4) 6,963 (5,04) 6,892 (0,62) | 0,00057 (19,1) 0,081 (1) | 2,27 × 10 19 | 5,44 × 10 12 |
| 256 Fm | 157,6 (13) min | 91,9 (3) | 6,872 (1.2) 6,917 (6,9) | - | 1,58 × 10 20 | 1,4 × 10 19 |
| 257 Fm | 100,5 (2) jours | 0,210 (4) | 6,752 (0,58) 6,695 (3,39) 6,622 (0,6) | 0,241 (11) 0,179 (8,7) | 1,87 × 10 17 | 3,93 × 10 14 |
| 256 Md | 77 (2) min | - | 7,142 (1,84) 7,206 (5,9) | - | 3,53 × 10 20 | - |
| 257 Md | 5,52 (5) heures | - | 7,074 (14) | 0,371 (11.7) 0,325 (2,5) | 8,17 × 10 19 | - |
| 258 Md | 51,5 (3) jours | - | 6,73 | - | 3,64 × 10 17 | - |
| 255 Non | 3.1 (2) min | - | 8,312 (1,16) 8,266 (2,6) 8.121 (27,8) | 0,187 (3.4) | 8,78 × 10 21 | - |
| 259 Non | 58 (5) min | - | 7,455 (9,8) 7,500 (29,3) 7,533 (17.3) | - | 4,63 × 10 20 | - |
| 256 Lr | 27 (3) s | <0,03 | 8,319 (5.4) 8,390 (16) 8,430 (33) | - | 5,96 × 10 22 | - |
| 257 Lr | 646 (25) ms | - | 8,796 (18) 8,861 (82) | - | 1,54 × 10 24 | - |
Trente et un isotopes de l'actinium et huit heureux États isomères de certains de ses nucléides ont été identifiés par 2010. Trois isotopes, 225 Ac, 227 Ac et 228 Ac, ont été trouvés dans la nature et les autres ont été produites dans le laboratoire; seuls les trois isotopes naturels sont utilisés dans les applications. Actinium-225 est un membre du radioactifs série neptunium; il a été découvert en 1947 en tant que produit de fission l'uranium 233, ce est une α-émetteur avec une demi-vie de 10 jours. Actinium-225 est moins disponible que l'actinium-228, mais il est plus prometteuse dans les applications de radiotraceurs. Actinium-227 (demi-vie 21,77 années) se produit dans tous les minerais d'uranium, mais en petites quantités. Un gramme d'uranium (en équilibre radioactif) ne contient que 2 × 10 -10 gramme de 227 Ac. Actinium-228 est un membre de série de thorium radioactif formé par la désintégration de 228 Ra; ce est une β - émetteur avec une demi-vie de 6,15 heures. Dans une tonne de thorium il ya 5 × 10 -8 gramme de 228 Ac. Il a été découvert par Otto Hahn en 1906.
Vingt-neuf isotopes de protactinium sont connues avec des nombres de masse de 212 à 240 ainsi que trois heureux États isomères. Seulement 231 Pa et 234 Pa ont été trouvées dans la nature. Tous les isotopes ont une courte durée de vie, sauf pour le protactinium-231 (demi-vie 32760 années). Les plus importants sont les isotopes 231 Pa et 233 Pa, qui est un produit intermédiaire dans l'obtention de l'uranium-233 et est le plus abordable parmi les isotopes artificiels de protactinium. 233 Pa a une demi-vie et d'énergie commode de γ-rayonnement, et donc a été utilisé dans la plupart des études de la chimie de protactinium. Protactinium-233 est un β-émetteur avec une demi-vie de 26,97 jours.
L'uranium a le nombre le plus élevé (25) à la fois naturel et synthétique isotopes. Ils ont des nombres de masse de 217 à 242, et trois d'entre eux, 234 U, 235 U et 238 U, sont présents en quantités appréciables dans la nature. Entre autres, le plus important est U 233, qui est un produit final de transformations de 232 Th irradié par des neutrons lents. 233 U a un rendement de fission très élevé par une faible énergie (neutrons thermiques), contre par exemple avec 235 U. La plupart des études de chimie de l'uranium ont été effectuées sur l'uranium-238 en raison de sa longue demi-vie de 4,4 × 10 9 ans.
Il ya 19 isotopes du neptunium avec des nombres de masse de 225 à 244; ils sont tous hautement radioactifs. Le plus populaire parmi les scientifiques sont de longue durée 237 Np (t ½ = 2,20 × 10 6 années) et de courte durée 239 Np, 238 Np (t ½ ~ 2 jours).
Seize isotopes de l'américium sont connues avec des nombres de masse de 232 à 248. Les plus importantes sont 241 Am et 243 Am, qui sont émetteurs alpha et aussi émettre doux, mais les rayons γ intenses; deux d'entre eux peuvent être obtenus sous une forme isotopiquement pur. Les propriétés chimiques de l'américium ont été étudiés avec 241 Am, mais plus tard, décalés à 243 Am, qui est près de 20 fois moins radioactif. L'inconvénient de 243 Am est la production de la fille de courte durée isotope 239 Np, qui doit être pris en compte dans l'analyse des données.
Parmi 19 isotopes de curium, le plus accessible sont 242 cm et 244 cm; ils sont α-émetteurs, mais à durée de vie beaucoup plus courte que les isotopes de l'américium. Ces isotopes émettent presque pas de γ-rayonnement, mais subissent fission spontanée avec l'émission de neutrons associé. Plus isotopes à long terme de curium (245-248 cm, tous les α-émetteurs) sont formés comme un mélange cours irradiation neutronique de plutonium ou l'américium. Lors d'une irradiation courte, ce mélange est dominé par le curium-246, puis le curium-248 commence à se accumuler. Ces deux isotopes, en particulier 248 cm, avoir une demi-vie plus longue (3,48 × 10 5 ans) et sont beaucoup plus pratique pour effectuer des recherches chimique de 242 cm et 244 cm, mais ils ont aussi un taux assez élevé de fission spontanée . 247 cm a la plus longue durée de vie entre les isotopes de curium (1,56 × 10 7 années), mais ne est pas formée en grande quantité en raison de la forte fission induite par des neutrons thermiques.
Quatorze isotopes de berkelium ont été identifiés avec des nombres de masse de 238 à 252. Seulement 249 Bk est disponible en grandes quantités; il a une demi-vie relativement courte de 330 jours et émet essentiellement douce β-particules, qui ne sont pas pratiques pour la détection. Son rayonnement alpha est plutôt faible (1,45 × 10 -3% par rapport au β-rayonnement), mais il est parfois utilisé pour détecter cet isotope. Bk 247 est un émetteur alpha avec une longue demi-vie de 1380 années, mais il est difficile pour obtenir en quantités appréciables; il ne est pas formée sur l'irradiation neutronique de plutonium en raison de la β-stabilité des isotopes d'isotopes du curium avec le numéro de masse au-dessous de 248.
Isotopes de californium avec des nombres de masse de 237 à 256 sont formés dans les réacteurs nucléaires; californium-253 est un β-émetteur et le reste sont des α-émetteurs. Les isotopes avec même nombre de masse (250 FC, 252 FC et 254 FC) ont un taux élevé de la fission spontanée, en particulier 254 Cf dont 99,7% se désintègre par fission spontanée. Californium-249 a une demi-vie relativement longue (352 ans), la faiblesse de la fission spontanée et solide γ-émission qui facilite son identification. Cf 249 ne est pas formée en grandes quantités dans un réacteur nucléaire en raison de la β-décroissance lente du parent isotope 249 Bk et une grande section de l'interaction avec les neutrons, mais il peut se accumuler dans la forme isotopiquement pur comme le produit β-désintégration de (présélectionné) 249 Bk. Californium produit par irradiation du réacteur est principalement constitué de plutonium 250 et 252 Cf Cf, ce dernier étant prépondérant pour les grandes fluences de neutrons, et son étude est entravée par le rayonnement neutronique solide.
| Mère isotope | t ½ | Fille isotope | t ½ | Temps d'établir équilibre radioactif |
|---|---|---|---|---|
| 243 Am | 7370 années | 239 Np | 2,35 jours | 47,3 jours |
| 245 cm | 8265 années | 241 Pu | 14 ans | 129 années |
| 247 cm | 1,64 × 10 7 années | 243 Pu | 4,95 heures | 7,2 jours |
| 254 Es | 270 jours | 250 Bk | 3,2 heures | 35,2 heures |
| 255 Es | 39,8 jours | 255 Fm | 22 heures | 5 jours |
| 257 Fm | 79 jours | 253 Cf | 17,6 jours | 49 jours |
Parmi les 16 connue isotopes de einsteinium avec des nombres de masse de 241 à 257 le plus abordable est de 253 Es. Il se agit d'une α-émetteur avec une demi-vie de 20,47 jours, une relativement faible émission γ-petit et le taux de fission spontanée par comparaison avec les isotopes de californium. Irradiation neutronique prolongée produit également un isotope de longue période (254 Es t ½ = 275,5 jours).
Dix-neuf isotopes de fermium sont connues avec des nombres de masse de 242 à 260. 254 Fm, 255 et 256 Fm Fm sont α-émetteurs avec une demi-vie courte (heures), qui peut être isolée en quantités importantes. 257 Fm (t ½ = 100 jours) peuvent se accumuler lors d'une irradiation prolongée et forte. Tous ces isotopes sont caractérisés par des taux élevés de fission spontanée.
Parmi les 15 connue mendelevium isotopes de masse (numéros 245 à 260), le plus étudié est 256 Md, qui se désintègre principalement à travers la capture d'électrons le (α-rayonnement est ≈10%) avec la demi-vie de 77 minutes. Un autre émetteur alpha, 258 Md, a une demi-vie de 53 jours. Ces deux isotopes sont produits à partir einsteinium rare (253 et 255 Es Es respectivement), qui limite leur soi leur disponibilité.
À long terme isotopes de nobélium et isotopes de lawrencium (et des éléments plus lourds) sont relativement petites demi-vie. Pour nobélium 11 isotopes sont connus avec des nombres de masse 250-260 et 262. Les propriétés chimiques de nobélium et lawrencium ont été étudiés avec 255 No (t ½ = 3 min) et 256 Lr (t ½ = 35 s). Le nobélium isotope plus longue durée 259 Non a une demi-vie de 1,5 heures.
Répartition en nature
Thorium et l'uranium sont les actinides le plus abondant dans la nature avec les concentrations massiques respectives de 1,6 × 10 -3 % et 4 x 10 -4 %. Uranium se produit surtout dans la croûte de la Terre comme un mélange de ses oxydes minéraux dans l' uraninite, qui est aussi appelé pechblende en raison de sa couleur noire. Il ya plusieurs dizaines d'autres minéraux d'uranium tels que carnotite (KUO 2 VO 4 · 3H 2 O) et autunite (Ca (UO 2 ) 2 (PO 4 ) 2 .nH 2 O). La composition isotopique de l'uranium naturel est 238 U (abondance relative 99,2742%), 235 U (0,7204%) et 234 U (0,0054%); de ces 238 U a la plus grande demi-vie de 4,51 × 10 9 ans. La production mondiale d'uranium en 2009 a atteint 50 572 tonnes, dont 27,3% a été extrait dans le Kazakhstan . Autres pays d'extraction d'uranium importantes sont le Canada (20,1%), l'Australie (15,7%), la Namibie (9,1%), la Russie (7,0%) et Niger (6,4%).
| Minerai | Emplacement | Uranium contenu,% | Rapport de masse 239Pu / minerai | Ratio 239Pu / U (x1012) |
|---|---|---|---|---|
| Uraninite | Canada | 13,5 | 9,1×10-12 | 7.1 |
| Uraninite | Congo | 38 | 4,8×10-12 | 12 |
| Uraninite | Colorado, États-Unis | 50 | 3,8×10-12 | 7,7 |
| Monazite | Brésil | 0,24 | 2,1×10-14 | 8.3 |
| Monazite | Caroline du Nord, Etats-Unis | 1,64 | 5,9×10-14 | 3.6 |
| Fergusonite | - | 0,25 | <1×10-14 | <4 |
| Carnotite | - | 10 | <4×10-14 | <0,4 |
Les plus abondants minéraux de thorium sont thorianite (THO 2 ), thorite (ThSiO 4 ) et monazite, ((Th, CA, CE) PO 4 ). La plupart des minéraux de thorium contiennent de l'uranium et vice versa; et ils ont tous fraction significative de lanthanides. De riches gisements de minéraux thorium sont situés aux États-Unis (440 000 tonnes), l'Australie et l'Inde (~ 300.000 tonnes chacun) et au Canada (~ 100 000 tonnes).
L'abondance de l'actinium dans la croûte de la Terre est seulement d'environ 5 × 10 -15 %. Actinium est surtout présent dans contenant de l'uranium, mais aussi dans d'autres minéraux, mais en quantités beaucoup plus petites. Le contenu de l'actinium dans la plupart des objets naturels correspond à l'équilibre isotopique de l'isotope parent 235 U, et il est pas affectée par la faiblesse de la migration Ac. Protactinium est plus abondante (10 -12 %) dans la croûte de la Terre que l'actinium. Il a été découvert dans le minerai d'uranium en 1913 par Fajans et Göhring. Comme actinium, la répartition des protactinium suit celle de 235 U.
La demi-vie de l'isotope plus longue durée du neptunium, 237 Np, est négligeable par rapport à l'âge de la Terre. Ainsi le neptunium est présent dans la nature dans des quantités négligeables produites comme produits de désintégration intermédiaires des autres isotopes. Des traces de plutonium dans les minéraux d'uranium ont été découverts en 1942, et les résultats plus systématiques sur 239 Pu sont résumées dans le tableau (pas d'autres isotopes de plutonium pourraient être détectés dans ces échantillons). La limite supérieure de l'abondance de l'isotope le plus long-vie de plutonium, 244 Pu, est de 3 × 10 -20 %. Plutonium n'a pas pu être détecté dans des échantillons de sol lunaire. En raison de sa rareté dans la nature, la plupart du plutonium est produit synthétiquement.
Des quantités négligeables del'américium,curium,berkeliumetcaliforniumsont produites pardes réactions de capture de neutrons etla désintégration bêta dans des dépôts d'uranium d'appui très fortement concentrés.
Extraction
En raison de la faible abondance des actinides, leur extraction est un processus à étapes multiples complexes. Les fluorures d'actinides sont généralement utilisés parce qu'ils sont insolubles dans l'eau et peuvent être facilement séparés par des réactions d'oxydoréduction. Les fluorures sont réduits par le calcium , le magnésium ou le baryum :
Parmi les actinides, le thorium et l'uranium sont les plus faciles à isoler. Le thorium est principalement extrait de la monazite: diphosphate de thorium (Th (PO 4 ) 2 ) est mis à réagir avec l'acide nitrique et le nitrate de thorium produit traité avec du phosphate de tributyle. impuretés de terres rares sont séparés en augmentant le pH dans une solution de sulfate.
Dans un autre procédé d'extraction, la monazite est décomposé avec une solution aqueuse à 45% d' hydroxyde de sodium à 140 ° C. Des hydroxydes de métaux mélangés sont extraits en premier lieu, filtré à 80 ° C, on l'a lavé avec de l'eau et concentré dissous avec de l'acide chlorhydrique . Ensuite, la solution acide est neutralisée avec des hydroxydes à pH = 5,8 qui donne lieu à la précipitation de l'hydroxyde de thorium (Th (OH) 4 ) contaminé avec ~ 3% d'hydroxydes de terres rares; le reste des hydroxydes de terres rares reste en solution. Hydroxyde de thorium est dissous dans un acide minéral et ensuite purifié à partir des éléments des terres rares. Une méthode efficace est la dissolution de l'hydroxyde de thorium dans l'acide nitrique, car la solution résultante peut être purifié par extraction avec des solvants organiques:
Th (OH)4+ 4 HNO3→ Th (NO3)4+ 4 H2O
Thorium métallique est séparée de l'oxyde anhydre, le chlorure ou le fluorure de réagir avec le calcium dans une atmosphère inerte:
ThO22 + Ca → CaO + 2 Th
Parfois, le thorium est extrait par électrolyse d'un fluorure dans un mélange de sodium et de chlorure de potassium à 700-800 ° C dans un creuset en graphite. Hautement thorium pur peut être extrait de son de l'iodure avec le processus de la barre de cristal.
L'uranium est extrait à partir de ses minerais de diverses manières. Dans un procédé, le minerai est brûlé et ensuite mis à réagir avec de l'acide nitrique à convertir l'uranium à l'état dissous. Traitement de la solution avec une solution de phosphate de tributyle (TBP) dans le kérosène transforme l'uranium en une forme organique UO 2 (NO 3 ) 2 (TBP) 2 . Les impuretés insolubles sont filtrés et la uranium est extrait par réaction avec des hydroxydes que (NH 4 ) 2 U 2 O 7 ou avec du peroxyde d'hydrogène comme UO 4 · 2H 2 O.
Lorsque le minerai d'uranium est riche en minéraux tels que la dolomite, la magnésite, etc., ces minéraux consomment beaucoup d'acide. Dans ce cas, le procédé carbonate est utilisé pour l'extraction de l'uranium. Son composant principal est une solution aqueuse de carbonate de sodium, qui convertit en un complexe uranium [UO 2 (CO 3 ) 3 ] 4- , qui est stable dans des solutions aqueuses à de faibles concentrations d'ions hydroxyde. Les avantages du procédé de carbonate de sodium sont des produits chimiques qui ont une faible corrosivité (par rapport aux nitrates) et que la plupart des métaux non-uranium précipité de la solution. L'inconvénient est que les composés d'uranium tétravalent précipitent ainsi. Par conséquent, le minerai d'uranium est traité avec du carbonate de sodium à température élevée et sous une pression d'oxygène:
- 2 UO2+ O2+ 6CO2-
3→ 2 [UO2(CO3)3]4-
Cette équation indique que le meilleur solvant pour le traitement de l'uranium de carbonate est un mélange de carbonate au bicarbonate. A un pH élevé, il en résulte la précipitation du diuranate, qui est traité avec de l'hydrogène en présence de nickel produisant une tetracarbonate d'uranium insoluble.
Un autre procédé de séparation utilise des résines polymères comme un polyélectrolyte. Procédés d'échange d'ions dans les résines conduisent à une séparation de l'uranium. L'uranium à partir de résines est lavée avec une solution de nitrate d'ammonium ou de l'acide nitrique qui produit du nitrate d'uranyle, UO 2 (NO 3 ) 2 · 6H 2 O. Lorsqu'il est chauffé, il se transforme en UO 3 , qui est transformé en UO 2 avec de l'hydrogène:
- UO3+ H2→ UO2+ H2O
Réagissant dioxyde d'uranium avecl'acide fluorhydrique il se transforme entétrafluorure d'uranium, ce qui donne de l'uranium métal par réaction avec du magnésium métallique:
- 4 HF + UO2→ UF4+ 2 H2O
Pour extraire le plutonium, l'uranium de neutrons irradiés est dissous dans de l'acide nitrique, et un agent réducteur ( FeSO 4 , ou H 2 O 2 ) est ajouté à la solution résultante. Cet ajout change l'état d'oxydation du plutonium 6-4, tandis que l'uranium reste sous la forme de nitrate d'uranyle (UO 2 (NO 3 ) 2 ). La solution est traitée avec un agent réducteur et on le neutralise avec du carbonate d'ammonium à pH = 8 qui entraîne la précipitation du Pu 4+ composés.
Dans un autre procédé, Pu4+etUO2+
2sont d'abord extraits avec du phosphate de tributyle, puis mis à réagir avecl'hydrazine de lavage sur le plutonium récupéré.
La difficulté majeure dans la séparation de l'actinium est la similitude de ses propriétés avec celles de lanthane. Ainsi, l'actinium est soit synthétisé par des réactions nucléaires parmi les isotopes du radium ou séparés en utilisant des procédures d'échange d'ions.
Propriétés
Actinides ont des propriétés similaires à lanthanides. Les 6 d et 7 s couches électroniques sont remplis dans l'actinium et du thorium et le 5 f coquille se remplit de nouvelle augmentation de nombre atomique; le 4 f réservoir est rempli dans les lanthanides. La première preuve expérimentale pour le remplissage de la 5 f coquille dans actinides a été obtenu par McMillan et Abelson en 1940. Comme dans les lanthanides (voir contraction des lanthanides), le rayon ionique des actinides diminue de façon monotone avec le nombre atomique (voir aussi principe Aufbau).
| Propriété | Un C | Th | Pennsylvanie | U | Np | Pu | Suis | Cm | Bk | Cf | Es | Fm | Md | Aucun | Lr |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| La charge de base | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
| masse atomique | [227] | 232.0381 | 231,03588 | 238,02891 | [237] | [244] | [243] | [247] | [247] | [251] | [252] | [257] | [258] | [259] | [262] |
| Nombre d'isotopes naturels | 3 | 9 | 5 | 9 | 4 | 5 | 5 | 8 | 2 | 5 | - | - | - | - | - |
| Isotopes naturels | 225, 227-228 | 226-232, 234-235 | 231, 233-236 | 232-240 | 237-240 | 238-240, 242, 244 | 241-245 | 242-249 | 249-250 | 249-253 | - | - | - | - | - |
| Isotope plus longue durée | 227 | 232 | 231 | 238 | 237 | 244 | 243 | 247 | 247 | 251 | 252 | 257 | 258 | 259 | 262 |
| La demi-viede l'isotope le plus long terme | 21,8 années | 14000000000 années | 32500 années | 4470000000 années | 2.140.000 années | 80.800.000 années | 7370 années | 15.600.000 années | 1400 années | 900 années | 1,29 années | 100,5 jours | 52 jours | 58 min | 261 min |
| Configuration électronique dans l'état du sol | 6d17s2 | 6d27s2 | 5f26d17s2ou 5f16d27s2 | 5f36d17s2 | 5f46d17s2ou 5f57s2 | 5f67s2 | 5f77s2 | 5f76d17s2 | 5f97s2ou 5f86d17s2 | 5f107s2 | 5f117s2 | 5f127s2 | 5f137s2 | 5f147s2 | 5f147s27p1 |
| état d'oxydation | 3 | 3, 4 | 3, 4, 5 | 3, 4, 5, 6 | 3, 4, 5, 6, 7 | 3, 4, 5, 6, 7 | 2, 3, 4 | 3, 4 | 3, 4 | 2, 3 | 2, 3 | 2, 3 | 2, 3 | 2, 3 | 3 |
| Rayon métallique, nm | 0,203 | 0,180 | 0,162 | 0,153 | 0,150 | 0,162 | 0,173 | 0,174 | 0,170 | 0,186 | 0,186 | - | - | - | - |
| Rayon ionique, nm: Un4+ An3+ | - 0,126 | 0,114 - | 0,104 0,118 | 0,103 0,118 | 0,101 0,116 | 0,100 0,115 | 0,099 0,114 | 0,099 0,112 | 0,097 0,110 | 0,096 0,109 | 0,085 0,098 | 0,084 0,091 | 0,084 0,090 | 0,084 0,095 | 0,083 0,088 |
| Température, ° C: fusion ébullition | 1050 3300 | 1750 4800 | 1572 4400 | 1130 3800 | 640 3900 | 640 3230 | 1176 2610 | 1340 - | 1050 - | 900 - | 860 - | 1530 - | 830 - | 830 - | 1630 - |
| Densité, g / cm3 | 10.07 | 11,78 | 15.37 | 19,06 | 20,25 | 19.84 | 11,7 | 13.51 | 14,78 | 15,1 | 8,84 | ||||
| Potentiel d'électrode standard, V: E° (Un4+/ Une0) E° (Un3+/ Une0) | - -2.13 | -1.83 - | -1.47 - | -1.38 -1.66 | -1.30 -1.79 | -1.25 -2.00 | -0.90 -2.07 | -0.75 -2.06 | -0.55 -1.96 | -0.59 -1.97 | -0.36 -1.98 | -0.29 -1.96 | - -1.74 | - -1.20 | - -2.10 |
| Couleur [M (H2O)n]4+ [M (H2O)n]3+ | - Incolore | Incolore Bleu | Jaune Bleu foncé | Vert Pourpre | Vert jaunâtre Pourpre | Brun Violet | Rouge Rose | Jaune Incolore | Beige Vert jaunâtre | Vert Vert | - Rose | - - | - - | - - | - - |
| état d'oxydation | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 |
| 3 | Un C3+ | Th3+ | Pennsylvanie3+ | U3+ | Np3+ | Pu3+ | Suis3+ | Cm3+ | Bk3+ | Cf3+ | Es3+ |
| 4 | Th4+ | Pennsylvanie4+ | U4+ | Np4+ | Pu4+ | Suis4+ | Cm4+ | Bk4+ | Cf4+ | ||
| 5 | PaO+ 2 | UO+ 2 | NpO+ 2 | PuO+ 2 | AmO+ 2 | ||||||
| 6 | UO2+ 2 | NpO2+ 2 | PuO2 + 2 | AmO2+ 2 | |||||||
| 7 | NpO3+ 2 | PuO3+ 2 | [AmO6]5- |
Propriétés physiques
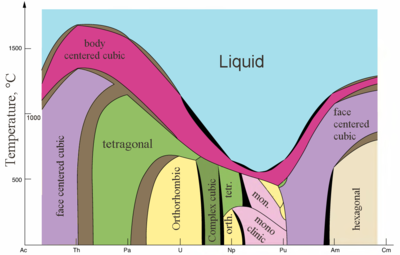 | 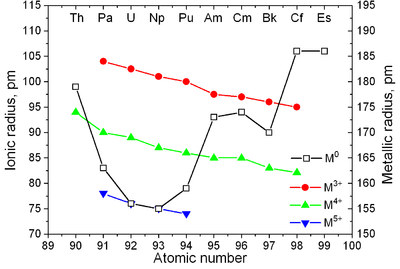 |
| Structures cristallines majeures de certains actinides fonction de la température | Métalliques etdes rayons ioniques des actinides |

Actinides typiques sont des métaux. Tout d'entre eux sont doux et ont une couleur argentée (mais ternir dans l'air), relativement élevé de densité et de la plasticité. Certains d'entre eux peuvent être coupés avec un couteau. Leur résistivité électrique varie entre 15 et 150 μOhm · cm. La dureté de thorium est similaire à celle de l'acier doux, le thorium pur afin chauffée peut être roulé dans des feuilles et tiré dans le fil. Le thorium est près de la moitié aussi dense que l'uranium et le plutonium, mais est plus difficile que l'un d'eux. Toutes les actinides sont radioactifs, paramagnétique, et, à l'exception de l'actinium, ont plusieurs phases cristallines: plutonium a sept, et l'uranium, le neptunium et le californium trois. structures de cristal protactinium, uranium, le neptunium et le plutonium ne disposent pas des analogues claires entre les lanthanides et sont plus similaires à celles des 3 d - métaux de transition .
Tous les actinides sont pyrophorique, en particulier lorsque finement divisée, à savoir, elles enflamment spontanément lors de la réaction avec de l'air. Le point de fusion des actinides n'a pas une dépendance claire sur le nombre de f électrons n. Le point de fusion inhabituellement faible du neptunium et du plutonium (~ 640 ° C) est expliqué par hybridation de 5 f et 6 d orbitales et la formation de liaisons directionnelles dans ces métaux.
| Lanthanides | Ln3+, Å | Actinides | Un3+, Å | Un4+, Å |
|---|---|---|---|---|
| Lanthane | 1.061 | Actinium | 1.11 | - |
| Cérium | 1.034 | Thorium | 1.08 | 0,99 |
| Praséodyme | 1.013 | Protactinium | 1,05 | 0,93 |
| Néodyme | 0,995 | Uranium | 1,03 | 0,93 |
| Prométhium | 0,979 | Neptunium | 1.01 | 0,92 |
| Samarium | 0,964 | Plutonium | 1,00 | 0,90 |
| Europium | 0,950 | Américium | 0,99 | 0,89 |
| Gadolinium | 0,938 | Curium | 0,98 | 0,88 |
| Terbium | 0,923 | Berkelium | - | - |
| Dysprosium | 0,908 | Californium | - | - |
| Holmium | 0,894 | Einsteinium | - | - |
| Erbium | 0,881 | Fermium | - | - |
| Thulium | 0,869 | Mendelevium | - | - |
| Ytterbium | 0,858 | Nobelium | - | - |
| Lutetium | 0,848 | Lawrencium | - | - |
Propriétés chimiques
Comme les lanthanides, tous les actinides sont très réactifs avec les halogènes et chalcogènes; cependant, les actinides réagissent plus facilement. Actinides, en particulier ceux avec un petit nombre de 5 f électrons n, sont sujettes à l'hybridation. Ceci est expliqué par la similitude des énergies d'électrons à l'extrémité 5 f , 7 s et 6 d coquilles. La plupart des actinides présentent une plus grande variété d'états de valence, et la plus stable sont +6 pour l'uranium, 5 pour le protactinium et le neptunium, +4 pour thorium et de plutonium et 3 pour l'actinium et d'autres actinides.
Chimiquement, l'actinium est similaire au lanthane, qui est expliqué par leur rayon ionique similaire et structure électronique. Comme le lanthane, l'actinium a l'oxydation de +3, mais il est moins réactif et a plus prononcées propriétés de base. Entre autres actinides trivalents Ac 3+ est moins acide, c.-à plus faible a tendance à hydrolyser dans des solutions aqueuses.
Le thorium est plutôt actif chimiquement. Faute de électrons sur 6 d et 5 f orbitales, les composés tétravalent de thorium sont incolores. A pH <3, les solutions de sels de thorium sont dominées par les cations [Th (H 2 O) 8 ] 4+ . Le Th 4+ ion est relativement grande, et en fonction du nombre de coordination peut avoir un rayon compris entre 0,95 et 1,14 Å. En conséquence, les sels de thorium présentent une faible tendance à une hydrolyse. La capacité unique de sels de thorium est leur solubilité élevée, non seulement dans l'eau, mais également dans des solvants organiques polaires.
Protactinium présente deux états de valence; le 5 est stable, et l'état +4 oxyde facilement à protactinium (V). Ainsi protactinium tétravalent en solution est obtenue par l'action d'agents réducteurs forts dans une atmosphère d'hydrogène. Protactinium tétravalent est chimiquement similaire à l'uranium (IV) et le thorium (IV). Les fluorures, les phosphates, hypophosphate, l'iodate et phenylarsonates de protactinium (IV) sont insolubles dans l'eau et les acides dilués. Protactinium forme de carbonates solubles. Les propriétés hydrolytiques de pentavalent protactinium sont proches de celles de tantale (V) et de niobium (V). Le comportement chimique complexe de protactinium est une conséquence du début du remplissage de la 5 f coquille dans cet élément.
L'uranium a une valence du 3 au 6, le dernier étant le plus stable. Dans l'état hexavalent, l'uranium est très similaire à la sixième éléments du groupe. Beaucoup de composés d'uranium (IV) et l'uranium (VI) sont stoechiométrique, soit avoir une composition variable. Par exemple, la formule chimique réelle du dioxyde d'uranium UO est 2 + x , où x varie entre -0,4 et 0,32. Uranium (VI) composés sont faibles oxydants. La plupart d'entre eux contiennent linéaire " groupe uranyle ", UO 2+
2 . Entre 4 à 6 ligands peuvent être logés dans un plan équatorial perpendiculaire au groupe uranyle. Le groupe d'uranyle agit comme un acide fort et forme des complexes forts avec des ligands oxygène donateurs qu'avec ligands azote donateurs. NpO 2+
2 et PuO 2 +
2 sont également la forme commune de Np et Pu dans l'état d'oxydation +6. Uranium (IV) composés présentent des propriétés de réduction, par exemple, ils sont facilement oxydé par l'oxygène atmosphérique. Uranium (III) est un agent réducteur très forte. Grâce à la présence de D-coque, de l'uranium (ainsi que de nombreux autres actinides) forme des composés organométalliques, tels que U III (C 5 H 5 ) 3 et U IV (C 5 H 5 ) 4 .
Neptunium a valence Etats de 3 à 7, qui peuvent être observées simultanément dans les solutions. L'état le plus stable en solution est 5, mais la valence +4 est préféré dans les composés de neptunium solides. Neptunium métal est très réactive. Les ions de neptunium sont sujettes à l'hydrolyse et la formation de composés de coordination.
Le plutonium présente également la valence comprise entre 3 et 7, et donc est chimiquement similaire à neptunium et l'uranium. Il est très réactif, et forme rapidement un film d'oxyde à l'air. Le plutonium réagit avec un atome d'hydrogène même à des températures aussi basses que 25 à 50 ° C; elle forme aussi facilement halogénures et des composés intermétalliques. Les réactions d'hydrolyse des ions de plutonium de différents états d'oxydation sont très diverses. Plutonium (V) peut entrer dans des réactions de polymérisation.
La plus grande diversité de produits chimiques parmi les actinides est observé dans l'américium, qui peut avoir valence comprise entre 2 et 6. divalent américium est obtenue seulement dans les composés secs et des solutions non aqueuses ( acétonitrile). États d'oxydation +3, +5 et +6 sont typiques pour les solutions aqueuses, mais aussi à l'état solide. Formes d'américium tétravalents composés stables solides (dioxyde, le fluorure et l'hydroxyde) ainsi que des complexes dans des solutions aqueuses. Il a été signalé que dans une solution alcaline américium peut être oxydé à l'état heptavalent, mais ces données avérée erronée. La valence la plus stable de l'américium 3 est dans les solutions aqueuses et 3 ou 4 dans des composés solides.
Valence 3 est dominant dans tous les éléments ultérieurs jusqu'à lawrencium (avec l'exception possible de nobélium). Curium tétravalent peut être en matières solides (fluorure, le dioxyde). Berkelium, avec une valence de 3, montre également la valence de 4, et plus stable que celle du curium; la valence 4 est observée dans fluorure solide et de dioxyde. La stabilité de Bk 4+ en solution aqueuse est voisin de celui de Ce 4+ . Seulement valence 3 a été observée pour californium, einsteinium et fermium. L'état bivalent est prouvé pour mendelevium et nobélium, et nobélium il est plus stable que l'état trivalent. Lawrencium montre valence 3 fois dans les solutions et les solides.
Les potentiels d'oxydo-réduction  augmente de -0,32 V à l'uranium, par le biais de 0,34 V (Np) et 1,04 V (Pu) à 1,34 V dans l'américium révélant la capacité de réduction croissante de l'une 4+ à l'américium à partir d'ions uranium. Tous les actinides forment Anh 3 hydrures de couleur noire avec des propriétés de type sel. Actinides produisent également des carbures avec la formule générale de AnC ou AnC 2 (U 2 C 3 pour l'uranium), ainsi que des sulfures Un 2 S 3 et Ans 2 .
augmente de -0,32 V à l'uranium, par le biais de 0,34 V (Np) et 1,04 V (Pu) à 1,34 V dans l'américium révélant la capacité de réduction croissante de l'une 4+ à l'américium à partir d'ions uranium. Tous les actinides forment Anh 3 hydrures de couleur noire avec des propriétés de type sel. Actinides produisent également des carbures avec la formule générale de AnC ou AnC 2 (U 2 C 3 pour l'uranium), ainsi que des sulfures Un 2 S 3 et Ans 2 .
Composés
Oxydes et hydroxydes
| Composé | Couleur | La symétrie du cristal, le type | Constantes treillis, Å | Densité, g / cm3 | Température, ° C | ||
|---|---|---|---|---|---|---|---|
| une | b | c | |||||
| Ac2O3 | Blanc | Hexagonal, La2O3 | 4.07 | - | 6.29 | 9.19 | - |
| PaO2 | - | Cubique, CaF2 | 5.505 | - | - | - | - |
| Pa2O5 | Blanc | cube, CaF2 cubique Tetragonal Hexagonal Rhomboédrique Orthorhombique | 5.446 10,891 5,429 3,817 5,425 6,92 | - - - - - 4,02 | - 10.992 5.503 13.22 - 4. 18 | - | 700 700-1100 1000 1000-1200 1240-1400 - |
| ThO2 | Incolore | Cubique | 5,59 | - | - | 9,87 | - |
| UO2 | Brun-noir | Cubique | 5,47 | - | - | 10,9 | - |
| NpO2 | Brun-verdâtre | Cubique, CaF2 | 5.424 | - | - | 11,1 | - |
| PuO | Noir | Cubique, NaCl | 4,96 | - | - | 13,9 | - |
| PuO2 | Vert olive | Cubique | 5.39 | - | - | 11.44 | - |
| Am2O3 | Rouge-brun -roux | Cubique, Mn2O3 hexagonal, La2O3 | 11,03 3.817 | - | - 5,971 | 10,57 11,7 | - |
| AmO2 | Noir | Cubique, CaF2 | 5.376 | - | - | - | - |
| Cm2O3 | Blanc - - | Cubique, Mn2O2 Hexagonal, LaCl3 Monoclinique, Sm2O3 | 11.01 3.80 14.28 | - - 3,65 | - 6 8,9 | 11,7 | - |
| OCM2 | Noir | Cubique, CaF2 | 5,37 | - | - | - | - |
| Bk2O3 | Marron clair | Cubique, Mn2O3 | 10,886 | - | - | - | - |
| BKO2 | Rouge-marron | Cubique, CaF2 | 5,33 | - | - | - | - |
| Cf2O3 | Incolore Jaunâtre - | Cubique, Mn2O3 Monoclinique, Sm2O3 hexagonal, La2O3 | 10,79 14,12 3,72 | - 3,59 - | - 8,80 5,96 | - | - |
| CFO2 | Noir | Cubique | 5.31 | - | - | - | - |
| Es2O3 | - | Cubique, Mn2O3 Monoclinique hexagonal, La2O3 | 10.07 14,1 3,7 | - 3,59 - | - 8,80 6 | - | - |
| état d'oxydation | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | Pu2O3 | Am2O3 | Cm2O3 | Bk2O3 | Cf2O3 | Es2O3 | |||||
| 4 | ThO2 | PaO2 | UO2 | NpO2 | PuO2 | AmO2 | OCM2 | BKO2 | CFO2 | ||
| 5 | Pa2O5 | U2O5 | Np2O5 | ||||||||
| 6 | U3O8 | ||||||||||
| UO3 |
| Formule chimique | ThO2 | PaO2 | UO2 | NpO2 | PuO2 | AmO2 | OCM2 | BKO2 | CFO2 |
| Numéro CAS | 1314-20-1 | 12036-03-2 | 1344-57-6 | 12035-79-9 | 12059-95-9 | 12005-67-3 | 12016-67-0 | 12010-84-3 | 12015-10-0 |
| Masse molaire | 264,04 | 263,035 | 270,03 | 269,047 | 276,063 | 275,06 | 270-284 ** | 279,069 | 283,078 |
| Point de fusion | 3390 ° C | 2865 ° C | 2547 ° C | 2400 ° C | 2175 ° C | ||||
| Crystal structure | 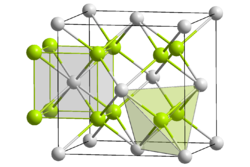 Un 4+:__/ O2-:__ | ||||||||
| Groupe d'espace | Fm3m | ||||||||
| numéro de coordination | Un, O [4] | ||||||||
- Un- actinides
** Selon les isotopes
Certains actinides pouvez existe sous plusieurs formes d'oxyde tels que Un 2 O 3 , AnO 2 , un 2 O 5 et AnO 3 . Pour tous les actinides, les oxydes AnO 3 sont amphotère et un 2 O 3 , AnO 2 et An 2 O 5 sont de base, ils réagissent facilement avec l'eau, formant bases:
- Un2O3+ 3 H22 O → Un (OH)3.
Ces bases sont peu solubles dans l'eau et par leur activité sont proches des hydroxydes de métaux des terres rares. La base est la plus forte de l'actinium. Tous les composés de l'actinium sont incolores, sauf pour le noir de sulfure d'actinium (Ac 2 S 3 ). Dioxydes d'actinides tétravalents cristallisent dans le système cubique, comme dans le fluorure de calcium.
Thorium réagir avec l'oxygène forme exclusivement du dioxyde:
Le dioxyde de thorium est un matériau réfractaire avec le point de fusion le plus élevé parmi les tout oxyde connu (3390 ° C). Ajout de 0,8-1% ThO 2 de tungstène stabilise sa structure, de sorte que les filaments dopées avoir une meilleure stabilité mécanique aux vibrations. Pour dissoudre ThO 2 dans les acides, il est chauffé à 500-600 ° C; chauffage au-dessus de 600 ° C un produit très résistant aux acides et d'autres réactifs sous forme de ThO 2 . Petit addition d'ions fluorure catalyse la dissolution du dioxyde de thorium dans les acides.
Deux oxydes de protactinium ont été obtenus: PAO 2 (noir) et Pa 2 O 5 (blanc); le premier est isomorphe avec ThO 2 et celui-ci est plus facile à obtenir. Les deux oxydes sont basiques, et Pa (OH) 5 est une base faible, peu soluble.
La décomposition de certains sels d'uranium, par exemple UO 2 (NO 3 ) · 6H 2 O dans l'air à 400 ° C, les rendements UO orange ou jaune 3 . Cet oxyde est amphotère et forme plusieurs hydroxydes, le plus stable étant UO 2 (OH) 2 . Réaction uranium (VI) oxyde avec des résultats d'hydrogène dans le dioxyde d'uranium, qui est similaire dans ses propriétés avec ThO 2 . Cet oxyde est également de base et correspondant à l'hydroxyde d'uranium (U (OH) 4 ).
Le plutonium, le neptunium et l'américium forme de deux oxydes de base: Un 2 O 3 et AnO 2 . Neptunium trioxyde est instable; Ainsi, seulement Np 3 O 8 pourrait être obtenue jusqu'ici. Cependant, les oxydes de plutonium et le neptunium avec la formule chimique AnO 2 et An 2 O 3 sont bien caractérisés.
Sels
| Formule chimique | AcCl3 | UCl3 | NPCl3 | PUCL3 | AMCL3 | CMCl3 | BkCl3 | CFCL3 |
| Numéro CAS | 22986-54-5 | 10025-93-1 | 20737-06-8 | 13569-62-5 | 13464-46-5 | 13537-20-7 | 13536-46-4 | 13536-90-8 |
| Masse molaire | 333,386 | 344,387 | 343,406 | 350,32 | 349,42 | 344-358 ** | 353,428 | 357,438 |
| Point de fusion | 837 ° C | 800 ° C | 767 ° C | 715 ° C | 695 ° C | 603 ° C | 545 ° C | |
| Point d'ébullition | 1657 ° C | 1767 ° C | 850 ° C | |||||
| Crystal structure |  Un 3+:__/ Cl-:__ | |||||||
| Groupe d'espace | P63/ m | |||||||
| numéro de coordination | Un* [9], Cl | |||||||
| Constantes Lattice | un= 762 h c= 455 pm | un= 745.2 h c= 432,8 pm | un= 739,4 pm c= 424,3 pm | un= 738,2 pm c= 421,4 pm | unh = 726 c= 414 pm | un= 738,2 h c= 412,7 pm | unh = 738 c= 409 pm | |
- *Une- actinides
** Selon les isotopes
| Composé | Couleur | La symétrie du cristal, le type | Constantes treillis, Å | Densité, g / cm3 | ||
|---|---|---|---|---|---|---|
| une | b | c | ||||
| AcF3 | Blanc | Hexagonale, LaF3 | 4,27 | - | 7.53 | 7,88 |
| PAF4 | Brun foncé | Monoclinique | 12,7 | 10,7 | 8,42 | - |
| PAF5 | Noir | Quadratique, β-UF5 | 11.53 | - | 5.19 | - |
| ThF4 | Incolore | Monoclinique | 13 | 10.99 | 8,58 | 5.71 |
| UF3 | Pourpre rougeâtre | Hexagonal | 7.18 | - | 7,34 | 8.54 |
| UF4 | Vert | Monoclinique | 11,27 | 10,75 | 8,40 | 6,72 |
| α UF-5 | Bleuâtre | Quadrilatère | 6.52 | - | 4.47 | 5,81 |
| β-UF5 | Bleuâtre | Quadrilatère | 11.47 | - | 5,20 | 6,45 |
| UF6 | Jaunâtre | Orthorhombique | 9,92 | 8.95 | 5.19 | 5.06 |
| NpF3 | Noir ou violet | Hexagonal | 7.129 | - | 7.288 | 9.12 |
| NpF4 | Vert clair | Monoclinique | 12.67 | 10.62 | 8.41 | 6,8 |
| NpF6 | Orange | Orthorhombique | 9,91 | 8,97 | 5.21 | 5 |
| PuF3 | Bleu-violet | Trigone | 7,09 | - | 7,25 | 9.32 |
| PuF4 | Brun pâle | Monoclinique | 12.59 | 10,57 | 8,28 | 6,96 |
| PuF6 | Rouge-marron | Orthorhombique | 9,95 | 9.02 | 3,26 | 4,86 |
| AmF3 | Beige rosé ou de la lumière | hexagonal, LaF3 | 7.04 | - | 7.255 | 9,53 |
| AmF4 | Orange-rouge | Monoclinique | 12,53 | 10,51 | 8.20 | - |
| CmF3 | Du brun au blanc | Hexagonal | 4.041 | - | 7.179 | 9,7 |
| CmF4 | Jaune | Monoclinique, UF4 | 12.51 | 10,51 | 8.20 | - |
| BkF3 | Vert jaunâtre | Trigonal, LaF3 Orthorhombique, YF3 | 6,97 6,7 | - 7,09 | 7.14 4,41 | 10.15 9,7 |
| BkF4 | - | Monoclinique, UF4 | 12.47 | 10,58 | 8,17 | - |
| CFF3 | - - | Trigonal, LaF3 Orthorhombique, YF3 | 6. 94 6,65 | - 7.04 | 7,10 4,39 | - |
| CFF4 | - - | Monoclinique, UF4 Monoclinique, UF4 | 1.242 1.233 | 1.047 1.040 | 8.126 8.113 | - |
Actinides réagissent facilement avec des halogènes former des sels avec les formules MX 3 et MX 4 (X = halogène ). Donc, le premier composé de berkelium, BkCl 3 , a été synthétisé en 1962 avec un montant de 3 nanogrammes. Comme les atomes d'halogène d'éléments de terres rares, actinides chlorures, bromures et iodures sont solubles dans l'eau, et les fluorures sont insolubles. Uranium donne facilement un hexafluorure incolore, qui se sublime à une température de 56,5 ° C; en raison de sa volatilité, il est utilisé dans la séparation des isotopes de l'uranium par ultracentrifugation ou par diffusion gazeuse. hexafluorures actinides ont des propriétés proches de anhydrides. Ils sont très sensibles à l'humidité et la formation d'hydrolyser AnO 2 F 2 . Le hexachloride pentachlorure et noir de l'uranium ont été synthétisés, mais ils sont à la fois instable.
Action des acides sur les actinides donne sels, et si les acides sont non-oxydante, puis l'actinide dans le sel est dans un état de faible valence:
- U + 2 H2SO4→ U (SO4)2+ 2 H2
- 2 Pu + 6 HCl → 2 PUCL3+ 3 H2
Cependant, dans ces réactions de régénération de l'hydrogène peut réagir avec le métal, formant l'hydrure correspondant. Uranium réagit avec les acides et l'eau beaucoup plus facilement que le thorium.
sels d'actinides peuvent également être obtenus par dissolution des hydroxydes correspondants dans les acides. Les nitrates, les chlorures, les sulfates et les perchlorates d'actinides sont solubles dans l'eau. Lorsque la cristallisation à partir de solutions aqueuses, ces sels formant un hydrates, tels que Th (NO 3 ) 4 · 6H 2 O, Th (SO 4 ) 2 · 9H 2 O et Pu 2 (SO 4 ) 3 · 7H 2 O. Sels d'actinides haute valence hydrolysent facilement. Donc, le sulfate incolore, chlorure, nitrate et perchlorate de thorium se transforment en sels basiques avec des formules Th (OH) 2 SO 4 et Th (OH) 3 NO 3 . La solubilité et l'insolubilité des trivalents et tétravalents actinides est comme celle de sels de lanthanides. Ainsi, les phosphates, les fluorures, les oxalates, les iodates et carbonates d'actinides sont faiblement solubles dans l'eau; ils précipitent sous forme d'hydrates, tel que le THF 4 · 3H 2 O et Th (CrO 4 ) 2 · 3H 2 O.
Actinides avec l'état d'oxydation +6, sauf pour l'ONA 2 2+ les cations de forme [AnO 4 ] 2- , [Un 2 O 7 ] 2- et d'autres anions complexes. Par exemple, l'uranium, le neptunium et forment des sels de plutonium de la Na 2 UO 4 (uranate) et (NH 4 ) 2 U 2 O 7 (diuranate) types. En comparaison avec les lanthanides, actinides plus facilement former des composés de coordination, et cette capacité augmente avec la valence des actinides. actinides trivalents ne forment pas des composés de coordination de fluorure, tandis que les formes de thorium tétravalent K 2 THF 6 , KThF 5 , et même K 5 THF 9 complexes. Thorium forme également les correspondants sulfates (par exemple Na 2 SO 4 · Th (SO 4 ) 2 · 5H 2 O), les nitrates et thiocyanates. Sels avec la formule générale Un 2 Th (NO 3 ) 6 · n H 2 O sont de coordination nature, avec le nombre de coordination de thorium égal à 12. Encore plus facile est de produire des sels complexes de pentavalents et hexavalents actinides. Les composés les plus stables de coordination des actinides - tétravalent thorium et l'uranium - sont obtenus dans les réactions avec dicétones, par exemple acétylacétone.
Applications
Alors que les actinides ont certaines applications de la vie quotidienne établis, tels que les détecteurs de fumée (américium) et manteaux de gaz (thorium), ils sont principalement utilisés dans les armes nucléaires et utiliser comme combustible dans les réacteurs nucléaires. Les deux dernières régions exploitent la propriété des actinides à libérer l'énorme énergie dans les réactions nucléaires, qui, dans certaines conditions peuvent devenir autonome réaction en chaîne.
L'isotope le plus important pour les centrales nucléaires applications est l'uranium-235. Il est utilisé dans le réacteur thermique, et sa concentration en uranium naturel ne dépasse pas 0,72%. Cet isotope absorbe fortement les neutrons thermiques de libération d'énergie. Un acte de fission de 1 gramme de 235 U convertit en environ 1 MW · jour. D'importance, est que 235 U émet plus de neutrons qu'il absorbe; après avoir atteint la masse critique, 235 U entre dans une réaction en chaîne auto-entretenue. En général, le noyau d'uranium est divisée en deux fragments avec la sortie de 2-3 neutrons, par exemple:
D'autres isotopes d'actinides prometteurs pour l'énergie nucléaire sontle thorium-232 et son produit ducycle du combustible de thorium,uranium-233.
| Réacteur nucléaire |
| Le noyau de tout réacteur nucléaire contient un ensemble de tiges métalliques creuses, généralement faite dezirconiumalliages, rempli de les cellules de combustible nucléaire - principalement l'oxyde, le carbure, le nitrure ou le monosulfure de l'uranium, du plutonium ou de thorium, ou leur mélange (que l'on appelle Combustible MOX). Le combustible le plus courant est de l'oxyde d'uranium-235. Les neutrons rapides sont ralentis par modérateurs, qui contiennent de l'eau,du carbone, deutérium, oubéryllium, comme neutrons thermiques pour augmenter l'efficacité de leur interaction avec l'uranium-235. La vitesse de réaction nucléaire est contrôlée en introduisant des tiges supplémentaires en bore ou le cadmium ou un absorbant liquide, habituellement acide borique. Réacteurs de production de plutonium sont appelés réacteur ou éleveurs éleveur; ils ont un design différent et utilisent des neutrons rapides. |
Émission de neutrons au cours de la fission de l'uranium est important non seulement pour le maintien de la réaction nucléaire en chaîne, mais aussi pour la synthèse des actinides plus lourds. Uranium-239 convertit via β-carie en plutonium-239, qui, comme l'uranium-235, est capable de fission spontanée. Premiers réacteurs nucléaires dans le monde ont été construits non pas pour l'énergie, mais pour produire du plutonium-239 pour les armes nucléaires.
Environ la moitié du thorium produit est utilisé en tant que matériau de manchons à incandescence émettant de la lumière. Le thorium est également ajoutée dans plusieurs composants des alliages de magnésium et de zinc . Ainsi, les alliages Mg-Th sont légers et résistants, mais aussi point de fusion élevé et la ductilité et sont donc largement utilisés dans l'industrie aéronautique et dans la production de missiles. Thorium a également de bonnes propriétés d'émission d'électrons, avec une longue durée de vie et une faible barrière de potentiel pour l'émission. La teneur relative des isotopes de thorium et d'uranium est largement utilisée pour estimer l'âge de divers objets, y compris les étoiles (voir la datation radiométrique).
La principale application du plutonium a été dans les armes nucléaires , où l'isotope du plutonium-239 est un élément clé en raison de sa facilité de la fission et de la disponibilité. Conceptions à base de plutonium permettent de réduire la masse critique pour environ un tiers de ce que l'uranium-235. Le " Fat Man "bombes au plutonium de -Type produites au cours de la Manhattan Project utilisé la compression explosive du plutonium à obtenir des densités nettement plus élevées que la normale, combinée avec un neutron centrale la source pour commencer la réaction et augmenter l'efficacité. Ainsi, seulement 6,2 kg de plutonium ont été nécessaires pour une puissance explosive équivalente à 20 kilotonnes de TNT. (Voir aussi conception de l'arme nucléaire.) Hypothétiquement, aussi peu que 4 kg de plutonium et peut-être même moins pourrait être utilisé pour faire une seule bombe atomique en utilisant des dessins d'assemblage très sophistiqués.
Plutonium-238 est potentiellement isotope plus efficace pour les réacteurs nucléaires, comme il l'a plus petite masse critique que l'uranium-235, mais les rejets beaucoup plus d'énergie thermique (0,56 W / g). Cependant, son application est limitée par le prix élevé (environ 1000 USD / g). Cet isotope a été utilisé dans l'eau et les thermopiles distillation de certains systèmes satellites et des stations spatiales. Ainsi Galileo et Apollo vaisseaux spatiaux (par exemple Apollo 14) avaient chauffe alimenté par des kilogrammes de plutonium-238 d'oxyde; cette chaleur est également transformée en électricité avec thermopiles. La désintégration du plutonium-238 est produite particules alpha relativement inoffensifs et ne sont pas accompagnés par irradiation gamma. Par conséquent, et cet isotope (~ 160 mg) est utilisé comme source d'énergie dans les stimulateurs cardiaques où elle dure environ cinq fois plus longtemps que les batteries conventionnelles.
Actinium-227 est utilisé comme une source de neutrons. Son énergie spécifique élevée (14,5 W / g) et la possibilité d'obtenir des quantités importantes de composés thermiquement stables sont attrayants pour une utilisation de longue durée dans des générateurs thermoélectriques pour une utilisation à distance. 228 Ac est utilisé comme un indicateur de la radioactivité dans la recherche chimique, comme il émet électrons de haute énergie (2,18 MeV) qui peuvent être facilement détectés. 228 Ac- 228 mélanges Ra sont largement utilisés comme une gamma-source intense dans l'industrie et la médecine.
Développement de matériaux d'actinides dopé auto-lumineux avec des matrices cristallines durables est un nouveau domaine de l'utilisation des actinides que l'ajout de radionucléides émetteurs alpha de quelques verres et cristaux peuvent conférer luminescence.
Toxicité

Les substances radioactives peuvent nuire à la santé humaine via (i) de la contamination de la peau locale, (ii) l'exposition interne due à l'ingestion d'isotopes radioactifs, et (iii) la surexposition externe en β-activité et γ-rayonnement. Ensemble, avec des éléments de radium et transuraniens, l'actinium est un des poisons radioactifs les plus dangereux avec spécifique élevée α-activité. La caractéristique la plus importante de l'actinium est sa capacité à accumuler et à rester dans la couche de surface de squelettes. Au stade initial de l'empoisonnement, actinium accumule dans le foie. Un autre danger de l'actinium est qu'elle subit une désintégration radioactive plus rapide que d'être excrété. L'adsorption de l'appareil digestif est beaucoup plus petit (~ 0,05%) pour actinium de radium.
Protactinium dans le corps a tendance à s'accumuler dans les reins et les os. La dose maximale de sécurité de protactinium dans le corps humain est 0,03 uCi qui correspond à 0,5 microgrammes de 231 Pa. Cet isotope, qui pourraient être présents dans l'air comme aérosol, est de 2,5 × 10 8 fois plus toxique que l'acide cyanhydrique .
Plutonium, en entrant dans le corps à travers l'air, de la nourriture ou de sang (par exemple une blessure), installe surtout dans les poumons, le foie et les os avec seulement environ 10% allant à d'autres organes, et y reste pendant des décennies. Le temps de plutonium dans le corps de résident de longue explique en partie sa faible solubilité dans l'eau. Certains isotopes de plutonium émettent ionisantes α-rayonnement, ce qui endommage les cellules environnantes. Le dose létale (DL 50 ) pendant 30 jours chez les chiens après l'injection intraveineuse de plutonium est de 0,32 milligramme par kg de masse corporelle, et donc la dose mortelle pour l'homme est d'environ 22 mg pour une personne de 70 kg; le montant de l'exposition respiratoire devrait être d'environ quatre fois plus grande. Une autre estimation suppose que le plutonium est 50 fois moins toxique que le radium , et le contenu ainsi admissible de plutonium dans le corps devrait être de 5 pg ou 0,3 pCi. Ce montant est presque invisible en vertu microscope. Après des essais sur les animaux, cette dose maximale admissible a été réduit à 0,65 pg ou 0,04 uCi. Des études sur des animaux ont également révélé que voie d'exposition de plutonium est le plus dangereux par inhalation, de 5 à 25%, après quoi de substances inhalées est retenu dans le corps. En fonction de la taille des particules et la solubilité des composés de plutonium, soit du plutonium est localisée dans les poumons ou dans le système lymphatique, ou est absorbé dans le sang et ensuite transporté vers le foie et les os. La contamination par voie alimentaire est la manière la moins probable. Dans ce cas, seulement environ 0,05% de 0,01% de composés insolubles solubles de plutonium absorbe dans le sang, et le reste est excrété. L'exposition de la peau endommagée au plutonium garderait près de 100% de celui-ci.
Utilisation actinides en combustible nucléaire, les sources radioactives scellées ou les matériaux avancés tels que des cristaux auto-lumineux a de nombreux avantages potentiels. Cependant, une grave préoccupation est extrêmement forte radiotoxicité des actinides et leur migration dans l'environnement. L'utilisation de formes chimiquement instables d'actinides en MOX et des sources radioactives scellées ne convient pas aux normes de sécurité modernes. Il ya un défi de développer des matériaux des actinides stables et durables, qui offrent un stockage sûr, l'utilisation et l'élimination finale. Un besoin essentiel est l'application de solutions solides actinides dans durables phases d'accueil cristalline.

![\ Mathrm {{} ^ {238} _ {92} U + {} ^ {1} _ {0} n \ \ xrightarrow \ \ {} ^ {239} _ {92} U \ \ xrightarrow [23,5 \ min] {\ beta ^ -} \ {} ^ {239} _ {93} Np \ \ xrightarrow [2,3 \ jour] {\ beta ^ -} \ {} ^ {239} _ {94} Pu \ \ xrightarrow [2.4 \ cdot 10 ^ 4 \ année] {\ alpha}}](../../images/1195/119579.png)