
Unúntrio
Informações de fundo
Esta seleção wikipedia foi escolhido por voluntários que ajudam Crianças SOS da Wikipedia para este Seleção Wikipedia para as escolas. SOS Children trabalha em 45 países africanos; você pode ajudar uma criança em África ?
| Unúntrio | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
113 Uut | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||
| desconhecido | |||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | unúntrio, Uut, 113 | ||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / u n u n t r Eu ə m / oon- OON -tree-əm | ||||||||||||||||||||||||||||||||||||||||||
| Categoria Metallic | desconhecido presumivelmente metais de transição pós- | ||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 13, 7, p | ||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | [286] | ||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Rn ] 5f 14 6d 10 7s 2 7P 1 (Previsto) 2, 8, 18, 32, 32, 18, 3 (Previsto) 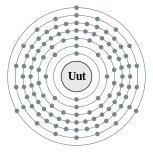 | ||||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Instituto Conjunto de Pesquisa Nuclear e Lawrence Livermore National Laboratory (2003) | ||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido (prevista) | ||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 18 (prevista) · g cm -3 | ||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 700 K , 430 ° C, 810 (prevista) ° F | ||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 1400 K, de 1100 ° C, 2000 (previsto) ° F | ||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 130 (prevista) kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 1, 2, 3, 5 (previsão) | ||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 704,9 (previsão) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 170 (previsão) pm | ||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 136 (previsão) pm | ||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 54084-70-7 | ||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de unúntrio | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
Unúntrio é o nome temporário de um elemento químico com o símbolo temporário Uut e número atômico 113. É extremamente radioativo elemento sintético (um elemento que pode ser criado num laboratório, mas não se encontra na natureza); o isótopo mais estável conhecida, unúntrio-286, tem uma meia-vida de 20 segundos. Unúntrio foi criado pela primeira vez em 2003 pelo Instituto Conjunto de Pesquisa Nuclear em Dubna, Rússia.
Na tabela periódica , que é um p-bloco elemento transactinide. Ele é um membro da 7a período e é colocado no grupo de boro, embora não há experiências químicas foram realizados para confirmar que ele se comporta como o mais pesado homólogo de tálio no grupo de boro. Unúntrio é calculado para ter algumas propriedades semelhantes ao seu homólogos mais leves, boro , alumínio , gálio , índio , tálio e, embora também deve mostrar várias diferenças importantes a partir deles. Ao contrário de todos os outros elementos do bloco p, é ainda previsto para mostrar um pouco de metal de transição caráter.
História
Colaboração Dubna-Livermore
O primeiro relatório de unúntrio foi em Agosto de 2003 quando foi identificado como um alfa produto de decaimento do elemento 115, ununpentium . Estes resultados foram publicados em 1 de fevereiro de 2004, por uma equipe composta por cientistas russos no Dubna ( Instituto Conjunto de Pesquisa Nuclear), e os cientistas americanos na Lawrence Livermore National Laboratory:
- 243
95 Am + 48
20 Ca → 288
115 UUP + 3 1
0 n → 284
113 Uut + α - 243
95 Am + 48
20 Ca → 287
115 4 1 + UUP
0 n → 283
113 Uut + α
A colaboração Dubna-Livermore tem fortalecido sua reivindicação para a descoberta de unúntrio através da realização de experiências químicas no final produto de decaimento 268 Db. Em experimentos em Junho de 2004 e Dezembro de 2005, o dubnium isótopo foi identificado com sucesso por extrair os produtos finais de decaimento, medindo fissão espontânea (SF) atividades e usando técnicas de identificação química para confirmar que eles se comportam como um grupo 5 elemento (dubnium como é conhecido por ser no grupo 5 da tabela periódica). Tanto o modo de meia-vida e decadência foram confirmados para a proposta de 268 Db que empresta apoio para a atribuição do pai e núcleos filhos para Ununpentium e unúntrio respectivamente. Outras experiências em Dubna em 2005 foram plenamente confirmados os dados de decaimento para ununpentium e unúntrio, mas em 2011, o / Partido IUPAC IUPAP de Trabalho Conjunto (JWP) não reconheceu os dois elementos como tendo sido descoberto porque a teoria atual não pode distinguir entre grupo 4 e grupo 5 elementos por suas propriedades, com confiança suficiente, ea identificação do isótopo filha dubnium foi o fator mais importante na confirmação da descoberta de ununpentium e unúntrio.
RIKEN
Em 23 de julho de 2004, uma equipe de cientistas japoneses em RIKEN bombardeado uma meta de bismuto-209 com núcleos acelerados de zinco-70 e detectado um único átomo do isótopo unúntrio-278. Eles publicaram seus resultados em 28 de setembro de 2004:
- 209
83 Bi + 70
30 Zn → 278
113 Uut + 1
0 n
Anteriormente, em 2000, uma equipe liderada por PA Wilk identificou o produto de decaimento 266 Bh como decadente com propriedades idênticas ao que havia observado a equipe japonesa, assim dando apoio para sua reivindicação. No entanto, também foi observada a filha de Bh 266, 262 Db , sofrem decaimento alfa em vez de fissão espontânea (que a equipe japonesa observado).
A equipe RIKEN produzido um átomo adicional em 02 de abril de 2005, embora os dados de decaimento foram ligeiramente diferente a partir da primeira cadeia, talvez devido quer à formação de um estado metastable ou um partícula alfa escapar do detector antes de depositar a sua energia total. Devido a estas inconsistências nos dados de decaimento, o pequeno número de átomos unúntrio produzidos, ea falta de âncoras inequívocas de isótopos conhecidos, a JWP não aceitar isso como uma descoberta conclusiva de unúntrio em 2011.
Mais recentemente, a produção e identificação de um outro núcleo 278 Uut ocorreu em RIKEN em 12 de Agosto de 2012. Neste caso, uma série de seis decaimentos alfa foi observada:
- 278
113 Uut → 274
111 Rg + α → 270
109 Mt + α → 266
107 Bh + α → 262
105 Db + α → 258
103 Lr + α → 254
101 Md + α
Esta cadeia de desintegração diferente das observações anteriores em RIKEN principalmente no modo de decaimento de dubnium, que foi previamente observada para sofrer fissão espontânea, mas neste caso em vez de alfa deteriorado. Como o decaimento alfa de dubnium-262 para lawrencium-258 é bem conhecido, isso proporciona uma prova clara de que elemento 113 é a origem da cadeia. Os cientistas nesta equipe calculou a probabilidade de acidental coincidência ser 10 -28, ou totalmente negligenciáveis.
Nomeando
Unúntrio é o elemento mais leve que ainda não recebeu um nome oficial. Uso Nomenclatura de Mendeleev para elementos não identificados e não descobertas, unúntrio deve ser conhecido como eka- tálio ou DVI- índio . Em 1979 IUPAC publicou recomendações segundo as quais o elemento era para ser chamado unúntrio (com o símbolo correspondente da Uut), um nome de elemento sistemático como um marcador de posição, até a descoberta de que o elemento é confirmado e um nome é decidida. As recomendações são amplamente ignoradas entre os cientistas, que o chamam de "elemento 113", com o símbolo da (113) ou mesmo simplesmente 113.
Declarações para a descoberta de unúntrio foram apresentadas por ambas as equipes Dubna e RIKEN. O Grupo de Trabalho Conjunto IUPAC / IUPAP (JWP) vai decidir a quem o direito de sugerir um nome será dado. Em 2011, a IUPAC avaliou as experiências RIKEN de 2004 e de 2004 e 2007 experimentos Dubna, e concluiu que eles não cumprem os critérios para a descoberta.
Os seguintes nomes foram sugeridos pelas equipes acima mencionados alegando descoberta:
| Grupo | Nome proposto | Derivação |
|---|---|---|
| RIKEN | Japonium | Japão: país de requerentes de grupo |
| Rikenium | RIKEN: instituto de requerentes de grupo | |
| Nishinanium | Yoshio Nishina, físico japonês |
Nucleosynthesis
Elementos super-pesados como unúntrio são produzidos bombardeando elementos mais leves em aceleradores de partículas que induzem reações de fusão. Considerando que a maior parte dos isótopos de unúntrio pode ser sintetizado diretamente dessa maneira, alguns mais pesados foram observados apenas como produtos de decaimento de elementos com maiores números atómicos .
Consoante as energias envolvidas, os primeiros são separados em "quente" e "frio". Em reações de fusão quente, muito leves, projéteis de alta energia são acelerados em direção a metas muito pesados ( actinídeos ), dando origem a núcleos compostos em energia de alta excitação (~ 40-50 MeV) que podem ou fissão ou evaporar várias (3-5) nêutrons. Nas reações de fusão a frio, os núcleos fundidos produzidos têm uma relativamente baixa energia de excitação (~ 10-20 MeV), o que diminui a probabilidade de que estes produtos serão submetidos a reações de fissão. Como os núcleos fundidos arrefecer para a estado fundamental, que necessitam de emissão de apenas um ou dois neutrões, e, assim, permite a geração de mais produtos ricos em neutrões. O último é um conceito distinto do de fusão nuclear, onde reivindicado para ser alcançada em condições de temperatura ambiente (ver a fusão a frio).
A fusão a frio
Antes da síntese bem-sucedida de unúntrio pela equipe RIKEN, cientistas da Instituto de Pesquisa de Íons Pesados (Gesellschaft für Schwerionenforschung) em Darmstadt, Alemanha também tentado sintetizar unúntrio bombardeando bismuto-209 com zinco-70 em 1998. Não átomos unúntrio foram identificadas em duas pistas separadas da reacção. Eles repetiram o experimento em 2003 novamente sem sucesso. No final de 2003, a equipe emergente no RIKEN usando sua garis aparelho eficiente tentou a reação e chegou a um limite de 140 fb. Em dezembro de 2003 - agosto de 2004, eles recorreram a "força bruta" e realizou a reacção por um período de oito meses. Eles foram capazes de detectar um único átomo de 278 Uut. Eles repetiram a reacção em várias corridas em 2005 e foram capazes de sintetizar um segundo átomo.
Fusão quente
Em junho de 2006, a equipe de Dubna-Livermore sintetizado unúntrio diretamente bombardeando um neptunium -237 alvo com acelerado de cálcio-48 núcleos:
- 237
93 Np + 48
20 Ca → 282
113 Uut + 1
0 n
Foram detectados dois átomos de 282 Uut.
Como produto do decaimento
| Resíduo de evaporação | Isótopo unúntrio observado |
|---|---|
| Uus 294, 290 UUP | 286 Uut |
| Uus 293, 289 UUP | 285 Uut |
| 288 UUP | 284 Uut |
| 287 UUP | 283 Uut |
Unúntrio tem sido observado como produtos de decaimento de ununpentium. Ununpentium tem atualmente quatro isótopos conhecidos; todos eles submetidos a alfa decai para se tornar núcleos unúntrio, com números de massa entre 283 e 286. núcleos Ununpentium Pais podem ser eles mesmos produtos de decaimento de Ununseptium. Até o momento, não há outros elementos têm sido conhecida a decair para unúntrio. Por exemplo, em janeiro de 2010, a equipe de Dubna ( JINR) identificou unúntrio-286 como um produto da decomposição de Ununseptium através de uma sequência de decaimento alfa:
- 294
117 Uus → 290
115 UUP + 4
2 Ele - 290
115 UUP → 286
113 Uut + 4
2 Ele
Isótopos
| Isótopo | Meia-vida | Decadência modo | Descoberta ano | Reação |
|---|---|---|---|---|
| 278 Uut | 0,24 ms | α | 2004 | 209 Bi (70 Zn, n) |
| 282 Uut | 70 | α | 2006 | 237 NP (48 Ca, 3n) |
| 283 Uut | 0,10 s | α | 2003 | 287 UUP (-, α) |
| 284 Uut | 0,48 s | α | 2003 | 288 UUP (-, α) |
| 285 Uut | 5,5 | α | 2009 | Uus 293 (-, 2α) |
| 286 Uut | 20 | α | 2009 | Uus 294 (-, 2α) |
| 287 Uut | 20? min | α, SF? | desconhecido | - |
Unúntrio não tem isótopos estáveis ou que ocorrem naturalmente. Vários isótopos radioactivos foram sintetizados no laboratório, ou pela fusão de dois átomos ou através da observação da deterioração dos elementos mais pesados. Seis isótopos diferentes de unúntrio foram relatados com massas atômicas 278 e 282-286; todos eles decaem através de decaimento alfa.
Estabilidade e meias-vidas
Todos os isótopos unúntrio são extremamente instável e radioativo; no entanto, os isótopos mais pesados unúntrio são mais estáveis do que o isqueiro. O isótopo mais estável unúntrio conhecido, 286 Uut, é também o mais pesado isótopo unúntrio conhecido; que tem uma meia-vida de 20 segundos. O isótopo 285 Uut foi reportado ter também uma meia-vida de mais de um segundo. O isótopos 284 e 283 Uut Uut tem meia-vida de 0,48 e 0,10 segundos, respectivamente. Os restantes dois isótopos têm semi-vidas entre 0,1 e 100 milissegundos: 282 Uut tem uma meia-vida de 70 milissegundos, e 278 Uut, o isótopo mais leve unúntrio conhecido, é também conhecido o isótopo de vida mais curta unúntrio, com uma semi-vida de apenas 0,24 milésimos de segundo. Prevê-se que mesmo os mais pesados não descoberto isótopos unúntrio poderia ser muito mais estável: por exemplo, 287 UEE está previsto para ter uma semi-vida de cerca de 20 minutos, perto de dois ordens de grandeza mais do que a de 286 Uut.
Estimativa teórica decaimento alfa meia-vida de isótopos de unúntrio estão em boa concordância com os dados experimentais. O isótopo não descoberto 293 Uut foi previsto para ser o mais estável no sentido decaimento beta; no entanto, nenhum isótopo unúntrio conhecido tem sido observada a sofrer decaimento beta.
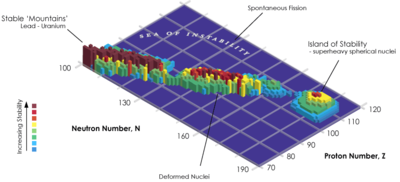
A estabilidade dos núcleos diminui grandemente com o aumento do número atómico após plutónio , o mais pesado elemento primordial, de modo que todos os isótopos com um número atômico acima de 101 deterioram radioactivamente com uma semi-vida de menos de um dia, com a excepção de dubnium -268. Não há elementos com número atômico acima de 82 (depois de chumbo ) têm isótopos estáveis. No entanto, por causa de razões ainda não muito bem compreendidos, existe um aumento ligeiro estabilidade nuclear em torno de números atómicos 110 - 114 , o que leva ao aparecimento do que é conhecido na física nuclear como o " ilha de estabilidade ". Este conceito, proposto pelo Professor da Universidade de Califórnia Glenn Seaborg, explica por que elementos superpesados durar mais tempo do que o previsto.
Propriedades previstas

Unúntrio é o primeiro membro da série de elementos e o mais pesado 7p elemento boro grupo na tabela periódica, abaixo de boro , alumínio , gálio , índio e tálio . Prevê-se para mostrar muitas diferenças a partir dos seus homólogos mais leves: um efeito em grande parte contribui é o spin-órbita (SO) interação. É especialmente forte para a elementos superpesados, porque seus elétrons se movem muito mais rápido do que em átomos mais leves, em velocidades comparáveis à velocidade da luz , que é onde as diferenças surgem de. Em relação aos átomos unúntrio, abaixa os 7s e os níveis de energia de elétrons 7P (que estabilizam os elétrons correspondentes), mas dois dos níveis de energia de elétrons 7P são estabilizadas mais do que os outros quatro. A estabilização dos electrões é chamado o 7s efeito inerte par, e o efeito de "rasgar" o 7p subcamada no mais estabilizado e as partes menos estabilizados é chamado a divisão subcamada. Químicos Computation ver a separação como uma mudança do segundo ( azimutal) número quântico l de 1 a 1/2 e 3/2 para as partes mais estabilizadas e menos estabilizadas da subshell 7p, respectivamente. Para muitos propósitos teóricos, a configuração eletrônica de valência pode ser representada para refletir o desdobramento subshell 7P como 7s 2 7P 1 1/2. Estes efeitos estabilizar os estados de oxidação mais baixos: a primeira energia de ionização de unúntrio se espera que seja 7,306 eV, o maior entre os elementos do grupo de boro. Assim, o estado de oxidação mais estável de unúntrio está previsto para ser o estado 1. Diferenças para outros níveis de elétrons também existem. Por exemplo, os níveis de elétrons 6d (também dividido em duas metades, com quatro sendo 6d 3/2 e 5/2 sendo seis 6d) estão levantadas, de modo que eles estão perto de energia para os 7s. Assim, os níveis de elétrons 6d, sendo desestabilizado, deve ser capaz de participar de reações químicas nas anteriores 7P elementos (até por volta ununpentium ), tornando-os se comportar, em alguns aspectos, como os metais de transição e permitir que os estados de oxidação mais elevados. Unúntrio deve, portanto, também ser capaz de mostrar estáveis 2, 3 e 5 estados de oxidação. No entanto, o estado 3 ainda deve ser menos estáveis do que o estado 1, a seguir tendências periódicas. Unúntrio deve ser o mais eletronegativo entre todos os elementos do grupo de boro: por exemplo, no composto Uut Uus, a carga negativa é esperado estar no átomo de unúntrio em vez do átomo de Ununseptium, o oposto do que seria esperado a partir de periodicidade simples. A afinidade eletrônica de unúntrio é calculada em cerca de 0,68 eV; em comparação, a do tálio é de 0,4 eV. A alta afinidade eletrônica e eletronegatividade de unúntrio são devidas ao facto de ser apenas um curto elétron da concha fechada configuração elétron de valência de fleróvio (7s 2 7P 1/2 2).
O composto unúntrio mais simples possível é a monohydride, Uut H . A ligação é fornecida pelo 7p 1/2 de electrões de unúntrio e o electrão 1s de hidrogénio. No entanto, a interacção faz com que o SO energia de monohydride unúntrio obrigatório de ser reduzidas em cerca de 1 eV eo comprimento de ligação unúntrio-hidrogênio para diminuir à medida que a ligação 7P 1/2 orbital é relativisticamente contratado. O monofluoretado análogo (Uut F ) também deve existir. Unúntrio também deve ser capaz de formar o tri-hidreto de (UutH 3), trifluoreto de (UutF 3), e tricloreto de (UUT Cl 3), com unúntrio no estado de oxidação +3. Uma vez que os electrões 6d estão envolvidos na ligação, em vez de os 7s, estas moléculas são previstos para ser Em forma de T e não planar trigonal. Embora o anião UutF polyfluoride -
6 deve ser estável, o que corresponde neutro UutF fluoreto 5 deve ser instáveis, decompondo-se espontaneamente no trifluoreto e flúor elementar. Unúntrio (I) é previsto para ser mais semelhante a prata (I) de tálio (I).
Unúntrio deverá ser muito mais denso do que o tálio, tendo uma densidade previsto de cerca de 18 g / cm 3, devido à estabilização relativista e contracção das suas 7s e 7p 1/2 orbitais. Isto é porque os cálculos estimam que têm um raio atómico de cerca de 170 pm, a mesma que a de tálio, embora as tendências periódicas poderia prever-se ter um raio atómico maior do que a de tálio, devido ao facto de ser um período mais abaixo na tabela periódica. Os pontos de fusão e ebulição de unúntrio não está definitivamente conhecida, mas tiver sido calculada como sendo de 430 ° C e 1100 ° C, respectivamente, excedendo os valores de gálio, indio, tálio, e seguintes tendências periódicas.
